文章编号: 1004-0609(2005)02-0300-05
LiFePO4/C锂离子电池正极材料的电化学性能
张 宝, 罗文斌, 李新海, 王志兴
(中南大学 冶金科学与工程学院, 长沙 410083)
摘 要: 以碳凝胶作为碳添加剂, 采用固相法制备了复合型LiFePO4/C锂离子电池正极材料。 研究了不同掺碳量对样品性能的影响。 利用X射线衍射仪、 扫描电镜和碳硫(质量分数)分析方法对所得样品的晶体结构、 表面形貌、 含碳量进行分析研究。 结果表明: 样品中的碳含量(质量分数)分别为0%、 5%、 10%、 22%, 所得样品均为单一的橄榄石型晶体结构, 碳的加入使LiFePO4颗粒粒径减小。 另外, 碳分散于晶体颗粒之间, 增强了颗粒之间的导电性。 合成样品的电化学性能测试结果表明, 掺碳后的LiFePO4放电比容量和循环性能都得到显著改善。 其中, 含碳量为22%的LiFePO4/C在0.1C倍率下放电, 首次放电容量达143.4mA·h/g, 充放电循环6次后电容量为142.7mA·h/g, 容量仅衰减0.7%。
关键词: 锂离子电池; 正极材料; 磷酸铁锂; 碳凝胶 中图分类号: TM912.9
文献标识码: A
Electrochemical properties of LiFePO4/C for cathode materials of lithium ion batteries
ZHANG Bao, LUO Wen-bin, LI Xin-hai, WANG Zhi-xing
(College of Metallurgy Science and Engineering,
Central South University, Changsha 410083, China)
Abstract: LiFePO4/C composite obtained with carbon gel as carbon droped were prepared by solid-state reaction. The crystalline structure, morphology of particles, carbon contents were analyzed by X-ray diffraction, scanning electromicroscopy and carbon/sulfur determinator. The resulting carbon contents in these samples are 0%, 5%, 10%, 22%, respectively . The results of X-ray diffraction show that the LiFePO4/C is pure olivine-type phase. SEM micrographs confirmed that the addition of the carbon reduces the LiFePO4 grain size.The carbon is dispersed between the grains, ensuring a good electronic contact. Electrochemical tests show that the material obtained by adding carbon gives enhanced performance in term of improved practical capacity and cycleability. The first specific discharge capacities of the LiFePO4/C coated with about 22% carbon is 143.4mA·h/g, after 6 times cycling the discharge capacities is 142.7mA·h/g. The capacity fade is about 0.7%.
Key words: Li-ion battery; cathode material; lithium iron phosphate; carbon gel
目前, 锂离子电池正极材料主要集中在钴系、 镍系和锰系。 由于铁资源丰富、 价廉, 而且无毒, 这促使电池界开展对多种含铁化合物的研究[1-14], 如α-Fe2O3 , γ-Fe2O3, Fe3O4 , LiFe5O8, FeS2, γ-FeOOH衍生物, FeOCl, FePS3 , Li3FeN2 , β-FeOOH和尖晶石型铁氧体等。 这些材料都依赖于Fe3+/Fe2+间的氧化还原反应进行锂离子的嵌入和脱出(FeS2除外), 放电电压在1~3V之间, 其中许多材料可作为正极材料。 但是, 它们都因为电化学性能欠佳而不能投入到实际应用中。
为了寻找理想的含铁正极材料, Padhi等[15, 16]对一系列聚合阴离子如(XO4)y-(X=P、 S、 As、 W、 Mo等, y=2或3)进行了研究。 研究表明, 这些化合物中, 由于O原子与S, P等形成较强的共价键, 消弱了与铁的共价键, 降低了Fe3+/Fe2+的氧化还原能级, 使开路电压提高。 聚合阴离子不仅给锂离子的迁移创造了更大的空间, 而且还使锂离子的嵌入/脱出电位保持稳定。
在这些含铁正极材料中LiFePO4具有非常好的发展前景, 它除了具有理论容量高(170mA·h/g), 放电电压平台适中(3.4V), 更具价廉、 无毒、 环境友好、 无吸湿性、 热稳定性好、 安全性高等诸多优点, 但这种材料电子导电性能极差。 国内外许多学者对提高该材料的导电性进行了广泛的研究。 Prosini等[17]在合成LiFePO4时添加高比表面的碳黑, 在80℃时以0.1C倍率放电, 比容量接近理论容量, 在室温以0.5C倍率放电, 循环230次后比容量95mA·h/g。 Dahn等[18]用蔗糖作为碳添加剂, 研究了不同掺入方式对LiFePO4的电化学性能的影响。 Fanger等[19]采用水热合成法, 以Fe3(PO4)2、 Li3PO4为前驱体, 溶入蒸馏水中, 放入通氩气的高压斧中, 在220℃、 2.4MPa条件下加热1h, 迅速降至室温, 将所得粉末过滤干燥, 加入适量碳黑后在保护性气氛下进行高温热处理, 最终合成LiFePO4/C复合材料, 但该材料的电化学性能不好。 Barker等[20]以LiH2PO4、 Fe2O3、 碳黑为原料采用炭热还原法合成出LiFePO4/C复合材料。
本文作者通过在LiFePO4制备过程中添加自制碳凝胶来提高其导电性能, 研究了不同掺碳量对LiFePO4结构以及电化学性能的影响。
1 实验
1.1 材料的制备
碳凝胶的制备采用溶胶-凝胶法, 将间苯二酚和甲醛按摩尔比1∶2混成溶液, 加入一定量的碳酸钠作为催化剂, 用稀硝酸调节溶液的pH值, 经搅拌干燥后, 用丙酮反复冲洗, 然后经过真空抽滤、 洗涤、 热处理, 即可制得碳凝胶[21]。
以Li2CO3、 FeC2O4·2H2O 和 NH4H2PO4(分析纯)为原料, 碳凝胶(自制)作碳添加剂, 采用高温固相法制备LiFePO4/C正极材料。 将Li2CO3、 FeC2O4·2H2O和NH4H2PO4以摩尔比0.5∶1∶1配比, 加入一定量的碳凝胶, 经充分混合后用玛瑙研钵磨细, 将前驱体转移至程序控温的管式炉内, 通氩气保护, 首先升温至320℃预分解一段时间, 然后升温至600℃, 保温一段时间后降至室温, 将所得样品磨细后备用。
1.2 材料的表征
本研究采用的仪器为日本Rigaku D/max2550VB+18kW转靶X射线衍射仪。 物相分析的条件为: CuKα 辐射, 40kV, 300mA, 步宽 0.02°, 扫描速度 8°/min, 扫描范围(2θ)为10°~90°; 用JEOL公司的JSM-5600LV扫描电子显微在20kV下分别以不同的放大倍数对样品的表面形貌进行观察; 合成产物的含碳量由CS800高频红外碳硫仪(德国)来测定。
1.3 实验电池组装和测试
以NMP为溶剂, 将LiFePO4/C、 乙炔黑、 粘结剂PVDF按质量比80∶10∶10混合均匀, 然后将其均匀涂在0.02mm的铝箔上, 经充分干燥得到正极片。 电解液为1mol/L LiPF6/EC-DMC(1∶1)混合溶液。 采用三电极实验电池体系对合成样品的电化学性能进行测试, 三电极实验电池体系以金属锂为对电极和参比电极, LiFePO4/C电极为工作电极, 电池组装在充满氩气的手套箱内完成。 组装的实验电池在深圳嵩和实业有限公司生产的BTS-51二次电池性能检测装置上进行充放电循环性能测试。 充放电方式: 充电以先恒流充电(充电电流为0.1C, 终止电压为4.2V), 后恒压充电(充电电压4.2V, 时间2h)方式进行; 放电以恒流方式进行, 电流为0.1C, 终止电压为2.6V。
2 结果与讨论
2.1 样品的含碳量分析
合成的LiFePO4/C样品中的碳含量采用用碳硫仪来测定。 结果表明, 所合成的LiFePO4/C样品中的碳含量分别为0%、 5%、 10%、 22%。
2.2 样品的X射线衍射分析
图1所示为600℃下合成出不同含碳量的LiFePO4/C样品的X射线衍射谱。 由图可见, 几种材料的衍射峰都比较尖锐, 并且特征峰也比较明显, 说明合成出的产物结晶良好。 尽管包覆碳的百分含量不一样, 但它们的图谱均与未进行包覆碳处理的LiFePO4的谱峰一致。 在X射线衍射谱上观察不到晶态或无定型碳的衍射峰存在, 且LiFePO4/C样品X射线衍射峰峰位均相同。 说明包覆碳不会影响LiFePO4的内部晶体结构, LiFePO4仍将保持正交晶系橄榄石型结构。
2.2 样品的扫描电镜分析
图2所示为含碳量0%和22%的LiFePO4/C复合材料的SEM像。 从图中可看出, 含碳为0%的LiFePO4样品颗粒形状不规则, 颗粒呈簇状团聚; 而含碳量为22%的LiFePO4样品基本上看不到团聚现象, 颗粒为规则的类球形, 颗粒表面比较粗糙。 由此可见, 经过包覆碳处理后的LiFePO4, 粒径减小, 比表面积增大, 粒径均匀。 这说明在制备LiFePO4过程中添加碳能有效地减少颗粒的团聚现象, 从而减小粒径, 使粒径分布较为均匀。
2.3 样品的充放电测试分析
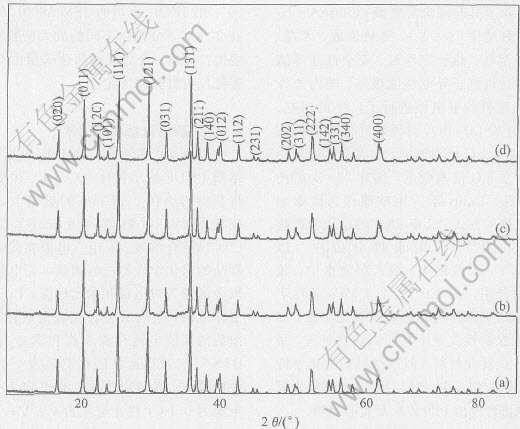
图1 不同碳含量LiFePO4/C 样品的X射线衍射谱
Fig.1 XRD patterns of LiFePO4/C samples with different carbon contents
Carbon content: (a)—0%; (b)—5%; (c)—10%; (d)—22%[TS)]
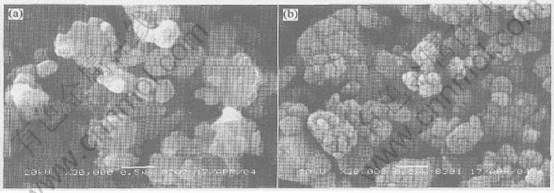
图2 不同碳含量LiFePO4/C样品的SEM像
Fig.2 SEM images of LiFePO4/C samples with different carbon contents
Carbon content: (a)—0%; (b)—22%
图3所示为600℃下不同含碳量的LiFePO4/C的首次充放电曲线。 从图中可看出, 样品的充电平台在3.5V左右, 放电电压平台在3.4V左右。 含碳量为0%、 5%、 10%、 22%的LiFePO4/C的首次放电容量分别为103.0、 117.8、 130.0、 143.4mA·h/g。 由此可见, 随着含碳量的增加, 所合成出的LiFePO4/C复合材料的放电比容量也随着增加。 这是因为纯的LiFePO4电子导电性差, 添加碳后, 碳分散于晶粒之间, 这样就大大提高了晶粒之间的导电性能。 另外, 从扫描电镜分析结果可看出, 碳的加入, 可以减少颗粒团聚, 细化颗粒, 使粒径分布均匀。
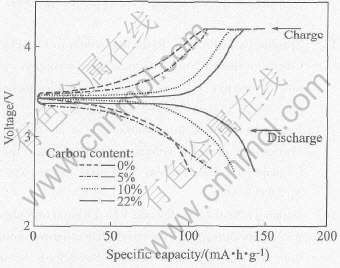
图3 不同含碳量LiFePO4/C样品于600℃的首次充放电曲线
Fig.3 First charge-discharge curves of LiFePO4/C samples with different
carborn contents at 600℃
根据Andersson等[22]提出的锂嵌入脱出模型, 锂离子脱出/嵌入是一个沿径向的扩散过程, 在锂离子的脱出过程中, LiFePO4/ FePO4界面向内移动, 当外部LiFePO4转变为FePO4时, 内部的锂离子必须通过新形成的FePO4相向外移动, 如果颗粒粒径较大, 扩散距离长, 则中心未转换的LiFePO4增多, LiFePO4的利用率降低。 因此, 减小颗粒粒径能提高LiFePO4的利用率, 从而提高其容量。
2.4 样品的循环性能测试
图4所示为不同掺碳量的LiFePO4/C样品的循环性能曲线。 从图中可看出, 含碳量为0%、 5%、 10%、 22%的LiFePO4/C样品的首次放电容量分别为103、 117.8、 130、 143.4mA·h/g, 经过6次循环后放电容量为 96.82、 115.6、 128、 142.7mA·h/g。 由此可见, 含碳量为22%的样品容量经6次循环后衰减较少, 仅为0.7%, 含碳量为0%的样品容量衰减最快, 为6.0%。 由此可见, 随着掺碳量的增加, LiFePO4样品的循环性能也逐渐提高。

图4 不同碳含量LiFePO4/C样品的循环性能曲线
Fig.4 Cycle performance curves of LiFePO4/C
samples with different carbon contents
3 结论
1) 采用自制碳凝胶作为添加剂, 采用高温固相法合成LiFePO4/C复合材料, 样品为单一的橄榄石型晶体结构, 碳的加入对晶体结构没有影响。
2) 掺碳后所得LiFePO4/C复合材料, 颗粒形貌规则, 为类球形。 颗粒小, 粒径分布均匀。
3) 随着碳掺碳量的增加, 样品的充放电容量有明显提高, 循环性能也有所改善。 其中, 含碳量22%的样品电化学性能最佳, 首次放电容量143.4mA·h/g, 经6次循环后放电容量仍达142.7mA·h/g, 容量衰减0.7%。
REFERENCES
[1]Thackeray M M, David W I F, Goodenough J B . Structural characterization of the lithium ion oxides LixFe3O4 and LixFe2O3(0〈x〈2)[J]. Mat Res Bull, 1982, 17: 785-800.
[2]Thackeray M M, David W I F, Goodenough J B. High-temperature lithiation of α-Fe2O3: a mechanistic study[J]. J Solid State Chem, 1984, 55: 280-282.
[3]Pernet M, Strobl P, Bonnet B, et al. Strctural and electrochemical study of lithium insertion into γ-Fe2O3[J]. Solid State Ionics, 1993, 64: 259-263.
[4]Islam M S, Catlow C R A. Lithium insertion into Fe3O4[J]. J Solid State Chem, 1988, 77: 180-182.
[5]de Picciotto L A, Thackeray M M. Lithium insertion into the spinel LiFe5O8[J]. Mat Res Bull, 1986, 21: 583-589.
[6]Chen C J, Greenblatt M, et al. Lithium insertion into spinel ferrites[J]. Solid State Ionics, 1986, 18-19: 838-845.
[7]Chen C J, Greenblatt M, Waszczak J V. Lithium insertion compounds of LiFe5O8, Li2FeMn3O8 and Li2ZnMn3O8[J]. J Solid State Chem, 1986, 64: 240-246.
[8]Frong R, Dahn J R, Jones C H W. Electrochemistry of pyrite-based cathodes for ambinent temperature lithium batteries[J]. J Electrochem Soc, 1989, 136: 3206-3211.
[9]Sakaebe H, Higuchi S, Kanamura K, et al. Discharge and charge characteristics of amorphous FeOOH including aniline[J]. J Electrochem Soc, 1995, 142: 360.
[10]Hikari S, Shunich H, Fujimoto K K, et al .Electrochemical properties of FeOCl derivatives prepared by the reaction of FeOCl intercalated with 2, 2-bithiophene and H2O[J]. Solid State Ionics, 2002, 79: 234-240.
[11]Hikari S, Shunich H. Preparation of a FeOCl derivative with pyrrole and its performance as a cathode material in a secondary lithium battery system[J]. J Power Sources, 1995, 56: 164-170.
[12]Amine K, Yasuda H Yamachi M. β-FeOOH, a new positive electrode material for lithium secondary batteries[J]. J Power Sources, 2001, 81-82: 221-230.
[13]Fatseas G A, Evain M. Unusual Mossbauer phenomenon in LixFePS3[J]. Phys Rev B, 1987, B35: 3082-3086.
[14]Nishijima M, Takeda Y, Imanishi N, et al. Li deintercalation and structural change in the lithium trasition metal nitride Li3FeN2[J]. J Solid state Chem, 1994, 113: 205-211.
[15]Padhi A K, Nanjundaswamy K S, Goodenough J B. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. J Electrochem Soc, 1997, 144(4): 1188-1194.
[16]Padhi A K, Nanjundaswamy K S, Goodenough J B, et al. Effect of structure on the Fe3+/Fe2+ redox couple in iron phosphates[J]. J Electrochem Soc, 1997, 144: 1609-1615.
[17]Prosini P P, Zane D, Pasquali M. Improved electrochemical performance of a LiFePO4-based composite cathode[J]. Electrochimica Acta, 2001, 46: 3517-3523.
[18]Zhaohui C, Dahn J R. Reducing carbon in LiFePO4/C comsite electrodes to maximize specific energy, volumetric energy, and tap density[J]. J Electrochem Soc, 2002, 149(9): A1184-A1189.
[19]Franger S, Cras F Le, Bourbon C, et al. LiFePO4 synthesis routes for enhanced electrochemical performance[J]. Electrochem Solid-state Letter, 2002, 5: A231-A233.
[20]Barker J, Saidi M Y, Swoyer J L. Lithium iron phospho-olivines prepared by a novel carbonthermal reduction method[J]. Electrochem Solid-State letter, 2003, 6: A53-A60.
[21]Lin C, Ritter J A. Effect of synthesis pH on the structure of carbon xerogels[J]. Carbon, 1997, 35(9): 1271-1278.
[22]Andersson A S, Thomas J O. The source of first-cycle capacity loss in LiFePO4[J]. J Power Sources, 2001, 97-98: 498-502.
基金项目: 国家自然科学基金资助项目(50302016)
收稿日期: 2004-09-21; 修订日期: 2004-11-30
作者简介: 张 宝(1971-), 男, 博士研究生.
通讯作者: 张 宝; 电话: 13808415616; E-mail: zhangbao@qgzxol.com
(编辑陈爱华)