低钴羟基氧化镍的合成、 结构表征和电化学性能
潘军青1, 万平玉2, 孙艳芝2, 王子镐1, 刘小光2
(1. 北京化工大学 化学工程学院, 北京 100029;
2. 北京化工大学 理学院, 北京 100029)
摘 要: 用高浓度KClO-KOH混合液在常温下一步氧化掺钴球形氢氧化镍, 通过洗涤和真空干燥得到高纯度羟基氧化镍。 利用扫描电镜、 X射线衍射和激光粒度仪等对样品的结构进行了表征, 结果表明: 样品为具有球形形貌、 粒径在220.1~650.9nm之间的超细羟基氧化镍晶体。 通过恒流放电实验研究了3种低钴羟基氧化镍的放电性能, 结果表明, 含钴1.5%的羟基氧化镍放电性能最为优越, 在60mA/g放电速率下具有高达280mA·h/g以上的放电容量。 恒流充放电实验和循环伏安实验表明该羟基氧化镍具有较好的电化学可逆性, 在充放电循环中比容量高达330mA·h/g。
关键词: NiOOH; 碱性锌镍电池; 放电容量; 电化学性能 中图分类号: TM911.4
文献标识码: A
Synthesis, characterization and electrochemical performance of low cobalt content NiOOH
PAN Jun-qing1, WAN Ping-yu2, SUN Yan-zhi2, WANG Zi-hao1, LIU Xiao-guang2
(1. College of Chemical Engineering, Beijing University of Chemical Technology,Beijing 100029, China;
2. Faculty of Science, Beijing University of Chemical Technology, Beijing 100029, China)
Abstract: Highly pure NiOOH was synthesized through one-step oxidizing spherical NiOOH with low cobalt content by highly concentrated mixture of KClO-KOH and followed by rinsing and vacuum desiccating. Structure characterization of the sample by means of scanning electron microscopy, X-ray diffractrometry and laser grain size tester shows that the sample is crystalline of super fine NiOOH with sizes between 220.1-650.9nm. Three low Co content NiOOH samples are galvanostatically discharged. The results show that the NiOOH containing 1.5% Co has the optimum properties. The discharge capacity is 280mA·h/g at a discharge rate of 60mA/g. The tests of charge/discharge and cyclic voltammetry of the prepared NiOOH express good electrochemical reversibility. The specific capacity during charge/discharge reaches as high as 330mA·h/g.
Key words: NiOOH; alkaline Zn/Ni battery; discharge capacity; electrochemical performance
开发高比容量的电极材料, 已经成为目前无机功能材料研究的一个热点[1-5]。 近年来由于数码电子产品的兴起而发展的碱性锌镍电池, 因其在高电流密度放电时具有高的放电电压平台(1.6V)和几倍于碱锰电池的比容量等优异的重负荷放电性能引起了国内外电化学界的高度重视[6-10]。 羟基氧化镍(NiOOH)作为碱性锌镍电池的正极活性物质, 由于其在酸性或碱性溶液中有很高的电极电位, 所以一直以来较难通过普通的化学方法制备出较为纯净的样品。 近年来, 不少学者通过以β-氢氧化镍、 纳米氢氧化镍等不同镍源为原料, 过硫酸盐为氧化剂来合成β-羟基氧化镍的研究工作, 目前获得的羟基氧化镍的纯度为60%~80%, 有效电极容量为210~230mA·h/g, 但是目前存在合成步骤多, 生长时间长和生产成本高等不足, 另外得到的样品有效电极容量与理论值(291mA·h/g)相比仍有较大的差距[7-11]。 羟基氧化镍的合成过程实质上是氢氧化镍失去一个质子和电子的过程, 因此在高浓度的碱液和强氧化剂存在下, 有利于得到高纯度的羟基氧化镍。 本文作者曾报道过利用高浓度的次氯酸钠-氢氧化钠混合液制备电池级的NiOOH, 但是该工艺因为采用粘度较大的高浓度NaOH作为反应液, 需要高速搅拌分散, 所以容易出现球形氢氧化镍因受冲击而破裂和过滤时间较长等问题[6]。
针对本文作者先前对化学氧化合成的研究[11-14], 采用粘度较低的氢氧化钾和高浓度次氯酸钾的混合液来氧化掺钴球形氢氧化镍, 一步反应得到高容量的羟基氧化镍。 并对该羟基氧化镍进行了初步的结构表征, 并研究了其作为碱性电池正极的电化学性能。
1 实验
1.1 次氯酸钾-氢氧化钾试液的制备
称取一定量的KOH溶解于100mL水中, 用冰水冷却至5~10℃。 在搅拌下通入Cl2, 使之充分吸收达到饱和, 此时有少量KCl晶体析出, 上述反应时间控制在0.5h左右。 将65g片状KOH在搅拌下逐次少量地加入上述溶液中, 控制温度在15~20℃。 将析出的氯化钾晶体经抽滤分离后, 再用抽滤法过滤得到KClO-KOH试液。
1.2 样品的制备
将球形氢氧化镍(长沙矿冶研究院)与上述试液以一定的化学计量比混合, 投入玻璃反应器, 在20℃下均匀慢速搅拌2~3h, 得到黑色沉淀, 用倾析法洗涤沉淀3~5次, 产品经离心抽滤后, 在60℃下真空干燥6h后得到产物。
1.3 合成羟基氧化镍样品的理化分析
采用日本Rigaku D/max2500VB2+/PC X射线衍射仪分析样品的物相晶体结构, 测试用Cu靶, 管电压为40kV, 电流为200mA, 扫描速度为10(°)/min扫描角度范围为10°~90°。 在英国Malvern公司3000HS型激光粒度分析仪上测试样品粒度。
1.4 样品的恒流放电实验
将一定量的羟基氧化镍样品和一定量的石墨粉以物理方式混合均匀后, 加入3滴60%(质量分数)PTFE粘合剂, 搅拌均匀。 以高纯镍丝为正极集流体, 在8MPa高压下压制成研究正极。 以自制ZnO/Zn(Hg)作参比电极, 铂片电极为辅助阳极, 40%(质量分数)KOH溶液作为电解液。 上述三电极模拟电池经静置平衡12h后, 在Land-CT2001A型电池测试仪上以60mA/g恒流放电至0.9V。
1.5 样品的恒流充放电实验
将80mg羟基氧化镍和20mg高纯膨胀石墨在玛瑙研钵里研磨20min, 充分混合均匀后, 按照实验1.3的方法制成研究电极。 60mA/g放电至1.25V, 60mA/g充电6.5h, 反复循环10次。 该项测试在Land-CT2001A型电池测试仪上进行。
1.6 样品的循环伏安实验
将70mg羟基氧化镍样品、 10mg乙炔黑和20mg高纯膨胀石墨在玛瑙研钵里研磨20min, 充分混合均匀后, 涂覆在泡沫镍上, 再经压制成研究电极。 以自制ZnO/Zn(Hg)电极为参比电极, 铂片为辅助电极, 在9mol/L KOH溶液中进行循环伏安测试。 扫描范围在0.8~1.9V之间, 扫描速率为1mV/s。 该项测试在美国EG&G公司Model273型电化学工作站上进行。
2 结果和讨论
2.1 NiOOH的制备原理
以Ni(OH)2和KClO为原料在碱性水溶液中合成制备NiOOH的反应本质上可以看成是Ni(OH)2和KClO微电极分别发生阳极氧化和阴极还原的过程, 可表示为
Ni(OH)2微阳极:
Ni(OH)2-2e+2OH-→NiO2+2H2O(1)
NiO2+Ni(OH)2→2NiOOH(2)
KClO微阴极:
KClO+2e+H2O→KCl+2OH-(3)
可见, 高浓度的OH-和高浓度的KClO有利于促进在Ni(OH)2微阳极反应。 同时, Ni(OH)2的本身的粒度和活性也是影响NiOOH合成的重要因素。 综合考虑氢氧化镍的相关文献, 本实验采用含有低钴的加锌球形氢氧化镍作为反应原料。 在同样摩尔浓度下, KOH溶液不仅具有更低的粘度, 同时由于本身具有比NaOH更高的活度, 因而在同样碱度下, KOH溶液的碱性相对更高一些。 粘度的降低和碱性的升高, 有利于NiOOH的合成反应的进行。 但是KClO本身的稳定性较NaClO差, 更易分解为KCl和KClO3。 为了降低KClO自身的歧化反应, KClO的反应温度越低, 时间越短, 都有利于得到高浓度的KClO溶液, 通常将合成KClO的反应温度控制在5~10℃, 反应时间不超过0.5h, 并且是现制现用。
2.2 样品的结构形貌表征
图1所示为样品在反应前后的扫描电镜照片。 从图中可以看出, 样品在反应前后的形貌没有发生很大改变, 仍然保持了球形, 同时有些球形NiOOH破裂成小碎片。 图1(c)所示为NiOOH在更高放大倍数下羟基氧化镍的局部照片, 从图1(c)中可以看出, 球形氢氧化镍本身是由于絮状小晶体聚集而成, 搅拌的冲击力和氧化过程的析氧副反应产生的应力导致了氢氧化镍微球的破裂。
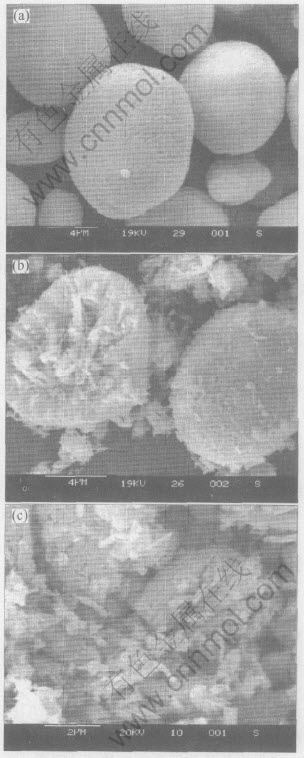
图1 Ni(OH)2(a)和NiOOH((b), (c))材料的SEM像
Fig.1 SEM photographs of Ni(OH)2(a) and NiOOH((b), (c)) samples
图2所示为氢氧化镍在反应前后的X射线衍射谱, 对照X射线衍射标准JCPDS卡, 样品在18.353°、 37.28°和66.761°均出现较强的衍射峰, 分别对应为NiOOH晶体的(001)、 (002)和(110)晶面。 因此可以判定反应产物为β-NiOOH, 且样品中基本不含Ni(OH)2。 从图可以看出, 样品的晶面衍射峰出现宽化现象, 这表明样品的粒径较反应前有所较小。 图3所示为样品的激光粒径分布图, 从图中可以看出, 反应后样品的粒径主要分布在220.1~650.9nm之间, 表明样品为超细羟基氧化镍, 这一点与前面的扫描电镜和X射线衍射测试结果吻合。 NiOOH的粒度及分布对镍正极的容量有一定影响。 近年来, 人们开始普遍使用粒径微米量级的球形Ni(OH)2作为镍氢电池的正极材料, 随着纳米Ni(OH)2的兴起, 使得现在的Ni(OH)2 产品的粒径还有进一步减小的趋势。 在通常情况下, 产品粒度越小, 越有利于产物本身的充分反应, 提高其电化学活性。 但是实验中也发现过小的粒度(〈50nm), 会大大影响产品堆积密度。 也许羟基氧化镍的粒径范围控制在0.2~1.0μm, 既可以保证产品既具有良好的电化学活性, 同时又有较高的堆积密度。
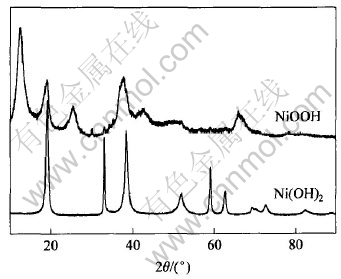
图2 Ni(OH)2和NiOOH的X射线衍射谱
Fig.2 XRD patterns of Ni(OH)2 and NiOOH samples
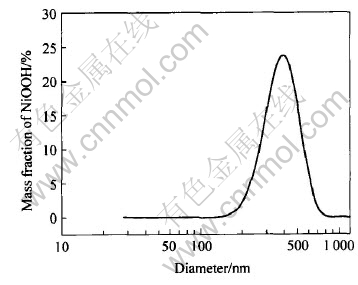
图3 NiOOH的粒径分布
Fig.3 Distribution of particle size of NiOOH sample
2.3 样品的电化学性能
目前氢氧化镍产品根据钴含量的不同主要分为3类: 样品A为含钴1.5%的球镍; 样品B为含钴3%的高钴球镍, 样品C为覆钴4.5%的球镍。 实验中将上述3种球镍在同样的条件下合成羟基氧化镍样品并制成正极, 通过恒流放电实验研究了样品的放电性能, 图4所示为在60mA/g时3种羟基氧化镍样品的恒流放电曲线。 实验表明, A种羟基氧化镍电极的放电性能在放电容量上明显优于其它2种羟基氧化镍电极。 从图中可以看出, 随着含钴量的增加, NiOOH电极的放电电压显著上升, 同时放电容量随之下降。 结合实验现象, 可以认为这是由于含钴量的增加, 大大增加了NiOOH电极的电化学活性, 降低了NiOOH电极的阴极极化, 从而提高了电极的实际放电电压。 但是, 由于钴本身良好的电催化活性, 高钴球镍在还没有充分氧化的前提下, 部分KClO由于钴的催化作用而分解, 导致了实际KClO反应浓度的降低, 从而降低了最终产品的放电容量。 对大多数用电器来说, 1.0V以上的放电电压都是有效放电, 所以本文作者认为含钴1.5%的球镍最适合于制备NiOOH, 这不仅可以得到高容量的NiOOH, 同时由于低的钴含量, 而且可以降低电极成本。 样品A在60mA/g的充放电速率和放电终止电压1.0V的情况下, 给出了280.5mA·h/g的首次放电容量和高达1.40~1.60V (vs Zn/ZnO)的放电平台。 根据样品的实际放电容量和NiOOH理论容量(291mA·h/g)推算出其主体NiOOH的质量分数≥96.4%; 化学氧化还原滴定法分析结果表明, 样品中羟基氧化镍的质量分数为97.3%, 两者基本吻合。 这主要来源于羟基氧化镍样品本身高的电极电势和电化学活性, 以及高纯度(>97%), 从而导致高的电极放电电压和放电容量, 因此它很适合作为锌镍一次电池的正极材料。
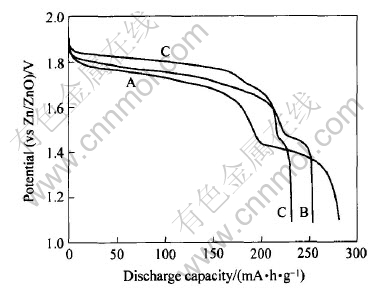
图4 3种羟基氧化镍样品在60 mA/g时的恒流放电曲线
Fig.4 Discharge curves of NiOOH cathodes recorded at current density of 60mA/g
图5所示为样品A在0.2C下经过不同周期后的充放电曲线图, 从图中可以看出, 样品具有典型的充放电平台和高达270mA·h/g以上的循环容量, 表明其具有较好的循环特性。 从图中可见, 经过第一次充电后, 电极的放电容量有所提高, 达到了330mA·h/g, 放电容量的增加, 可以认为是由于充电后的NiOOH电极残留有少量的NiO2, 从而增加了电极的放电容量。
图6所示为样品A的循环伏安实验曲线。 在三电极体系中, 通过氧化或还原峰的变化反映出镍电极的电化学性能的变化。 从图6可看出, 该NiOOH样品电极在1.886V 处出现较强的氧化峰, 在1.985V处的小峰可能对应为副反应—氧气的析出反应。 在1.505V 处出现一个很强的还原峰, 对应于NiOOH还原为Ni(OH)2的过程, 而1.051V处的小峰可能为NiOOH由于欧姆极化导致的还原峰[15, 16], 这与恒流放电过程中的两个放电平台相吻合。 根据阳极过程峰电位值φ0P与还原
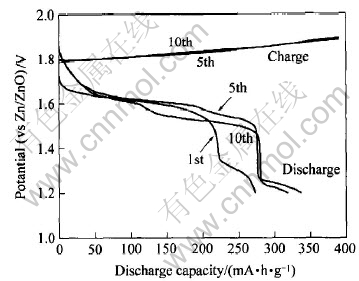
图5 NiOOH的充放电曲线
Fig.5 Discharge and charge curves of NiOOH cathodes recorded at current density of 60mA/g
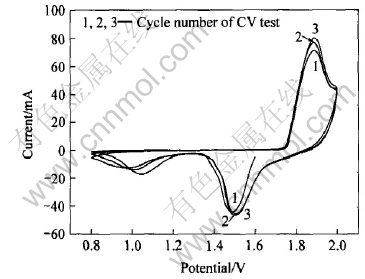
图6 NiOOH的循环伏安曲线
Fig.6 CV curves of NiOOH samples
过程峰电位值φRp的差值Δφp约为370mV, 大于59mV, 说明此NiOOH的氧化还原过程是一个准可逆过程。 从图5还可以看出, 峰电流是随着循环次数的增加没有出现明显的衰减或增加, 这表明羟基氧化镍样品已处于活化阶段, 无需经过通常氢氧化镍电极所需的活化过程, 并且从电极的峰形变化不明显可以看出, 该样品在循环过程中稳定性能较好。 如果该羟基氧化镍如果用于镍氢电池的正极材料, 可以减少镍氢电池的化成过程。
3 结论
1) 通过低温氯化高浓度的KOH溶液得到高浓度的KClO溶液, 利用新制KClO-KOH混合液在常温下氧化球形氢氧化镍, 通过洗涤真空干燥得到高纯度的羟基氧化镍样品一步制备出。
2) 借助扫描电镜、 X射线衍射和激光粒度仪等测试对样品的结构性能进行了初步研究, 表明样品为粒径在220.1~650.9nm之间的具有球形形貌的超细β-NiOOH粉体。
3) 恒流放电实验、 充放电实验和循环伏安实验表明, 该羟基氧化镍具有高达280mA·h/g的放电比容量和330mA·h/g可逆容量, 同时表现了良好的充放电性能。
REFERENCES
[1]Whittingham M S. Lithium batteries and cathode materials[J]. Chem Rev, 2004, 104(10): 4271-4302.
[2]MacFarlane D R, Junhua H, Maria F. Lithium-doped plastic crystal electrolytes exhibiting fast ion conduction for secondary batteries[J]. Nature, 1999, 402: 792-794.
[3]Nakayama M, Konishi S, Tagashira H, Ogura K. Electrochemical synthesis of layered manganese oxides intercalated with tetraalkylammonium ions[J]. Langmuir, 2005, 21: 354-359.
[4]CHEN Jun, Kuriyama N, YUAN Hua-tang, et al. Electrochemical hydrogen storage in MoS2 nanotubes[J]. J Am Chem Soc, 2001, 123: 11813-11814.
[5]李辉, 翟玉春, 田彦文. 锂离子电池正极材料LiNi1-yAlyO2 的制备及性能[J]. 中国有色金属学报, 2003, 13(3): 690-694.
LI Hui, ZHAI Yu-chun, TIAN Yan-wen. Preparation and properties of LiNi1-yAlyO2 as cathode material in lithium ion battery[J]. The Chinese Journal of Nonferrous Metals, 2003,13(3): 690-694.
[6]PAN Jun-qing, SUN Yan-zhi, WAN Ping-yu, et al. Synthesis, characterization and electrochemical performance of battery grade NiOOH[J]. Electrochem Comm, 2005, 7(8): 857-862.
[7]马淳安, 楼颖伟, 赵峰鸣, 等. 纳米MnO2的制备及电化学性能研究[J]. 中国有色金属学报, 2004, 14(10): 1736-1740.
MA Chun-an, LOU Ying-wei, ZHAO Feng-ming, et al. Synthesis and characterization of nano-size manganese dioxide[J]. The Chinese Journal of Nonferrous Metals, 2004,14(10): 1736-1740.
[8]夏熙, 潘仁. β-N iOOH 的制备及充放电性能[J]. 应用化学, 2001,18(1): 76-78.
XIA Xi, PAN Ren. Preparation of β-NiOOH and its charge/discharge performance[J]. Chinese J Applied Chemistry, 2001,18(1): 76-78.
[9]张清顺, 常海涛, 薛祥峰, 等. 羟基氧化镍的制备方法[P]. CN 03148203.1, 2003-07-01.
ZHANG Qing-shun, CHANG Hai-tao, XUE Xiang-feng, et al. The Synthesis Method of NiOOH[P]. CN 03148203.1, 2003-07-01.
[10]夏熙, 龚玉良. 纳米β-NiOOH的固相合成及其性能[J]. 电池, 2002, 31(1): 6-9.
XIA Xi, GONG Liang-yu. Synthesis and performances of nanophase β-NiOOH by solid state reaction[J]. Battery Bimonthly, 2002, 31(1): 6-9.
[11]Acharya R, Subbaiah T, Anand S, et al. Preparation, characterization and electrolytic behavior of β-nickel hydroxide[J]. J Power Sources, 2002,109(2): 494-499.
[12]潘军青, 万平玉, 孙艳芝, 等. 纳米铋酸钠的合成及其结构表征[J]. 高等学校化学学报, 2004, 25(12): 2204-2207.
PAN Jun-qing, WAN Ping-yu, SUN Yan-zhi, et al. Synthesis and structure characterization of nano-NaBiO3[J]. Chem J Chinese Universities, 2004, 25(12): 2204-2207.
[13]PAN Jun-qing, SUN Yan-zhi, WAN Ping-yu, et al. Halogen: A high capacity cathode for rechargeable alkaline batteries[J]. Chem Comm, 2005. 3340-3342.
[14]万平玉, 潘军青, 孙艳芝, 等. NaBiO3的固相合成及其对二氧化锰电化学性质的影响[J]. 电源技术, 2005, 29(1): 38-45.
WAN Ping-yu, PAN Jun-qing, SUN Yan-zhi, et al. Synthesis of NaBiO3 by solid-phase reaction and its influence on MnO2 electrodes[J]. Chinese Journal of Power Sources, 2005, 29(1): 38-45.
[15]Provazi K, Giz M J, DallAntoni L H, et al. The effect of Cd, Co, and Zn as additives on nickel hydroxide opto-electrochemical behavior[J]. J Power Sources, 2001,102(2): 224-232.
[16]Singh D. Characteristics and effects of γ-NiOOH on cell performance and a method to quantify it in nickel electrodes[J]. J Electrochem Soc, 1998, 145(1): 116-120.
(编辑龙怀中)
基金项目: 北京市自然科学基金资助项目(2002018)
收稿日期: 2005-05-12; 修订日期: 2005-06-20
作者简介: 潘军青(1980-), 男, 博士研究生.
通讯作者: 万平玉, 教授; 电话: 010-64445917; 传真: 010-64451998; E-mail: pywan@mail.buct.edu.cn