铜渣氯浸渣中有价元素分离富集工艺
孙培梅,魏岱金,李洪桂,赵中伟,霍广生,李运姣
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘要: 用Na2S浸出-SO2沉淀法对金川公司铜渣氯浸渣中有价元素的分离和富集进行了研究,分析了浸出温度、Na2S浓度,Na2S与S0的摩尔比及浸出时间对浸出过程的影响。研究结果表明,在Na2S浓度为0.5 mol/L,Na2S与S0的摩尔比为1∶4,温度为25 ℃,浸出时间为60 min的条件下,平均渣率为26.52%,贵金属平均浸出率为10.63%,浸出渣中贵金属含量为原渣的3.96倍;向浸出液中通入SO2,元素硫从浸出液中析出,元素硫的纯度可达99.08%,回收率达54.6%~74.19%。
关键词: 铜渣氯浸渣; 硫化钠; 浸出; 贵金属; 富集
中图分类号:TF111.14+5 文献标识码:A 文章编号: 1672-7207(2005)01-0038-06
Separation and Enrichment of Valuable Elements
from Copper Residue Leached by Chlorine
SUN Pei-mei, WEI Dai-jin, LI Hong-gui, ZHAO Zhong-wei, HUO Guang-sheng, LI Yun-jiao
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The separation and enrichment of valuable elements in copper residue slag leached by chlorine in Jinchuan company were studied by the method of sodium sulfide leaching and SO2 neutralization. The effect of temperature, concentration of Na2S, molar ratio of Na2S to S0 and leaching time on leaching process were researched. The experimental results show that the average residue ratio is 26.52% and the leaching ratio of noble metals is 10.63% when the temperature is 25 ℃, concentration of Na2S is 0.5 mol/L, n(Na2S)/n(S0)=1∶4 and the leaching time is 60 min. And the content of noble metals is enriched 3.96 times in the leached residue. The element sulphur deposits from solution by bubbling SO2 into solution. The quality of element sulphur may reach 99.08% and the recycle ratio of sulphur is 54.6%-74.19%.
Key words: copper residue; sodium sulfide; leaching; precious metals; enrichment
铜渣氯浸渣为镍电解车间的除铜渣经氯气浸出后产生的渣,主要含硫、铜、镍及贵金属,其中硫总含量(质量分数)为70%以上,元素硫质量占总硫质量的90%,贵金属总含量达100~200 g/t。这种渣长期以来堆放渣场不能处理,造成有价元素损失和环境污染。
通常采用热滤法、 真空蒸馏法、 化学溶剂法等治理废渣的方法回收元素硫和贵金属[1-4], 但都存在一些问题。 在此, 作者采用Na2S浸出-SO2沉淀法, 对铜渣氯浸渣中有价元素的分离和富集进行研究。 该方法的特点是在回收高质量硫的同时, 反应剂能循环使用, 从而有可能在试剂消耗和成本均较低的条件下获得高含量元素硫, 并使贵金属在渣中富集。
1 基本原理
在一定条件下,在水溶液中硫化钠可与元素硫反应生成多硫化钠,反应式为:
nS0+Na2S=Na2S(n+1)。(1)
多硫化钠在碱性溶液中可稳定存在,当溶液pH值降低时,多硫化钠离解,析出元素硫[5-7]。其反应式为:
Na2S(n+1)+SO2+H2O=
Na2S+H2SO4+nS↓(2)
由以上反应可知,若用一定浓度的Na2S对铜渣氯浸渣进行浸出,则渣中的元素S可以与溶液中的Na2S按反应式(1)进行反应,生成多硫化钠Na2S(n+1)进入溶液;然后,向该含有Na2S(n+1)的溶液中通入SO2气体,当SO2使溶液的pH值降低到一定程度后,即可按反应式(2)生成纯净的元素S。含有大量元素硫的溶液经固液分离从多硫化钠溶液中提取元素硫,而二氧化硫在整个过程中被消耗,不会对环境造成污染。
但是,在一定条件下,贵金属可溶于多硫化物溶液 [8-11]。因此,需寻找合适的工艺条件,使铜渣氯浸渣中硫的浸出率最大,贵金属的浸出率最小,从而使贵金属富集在渣中。浸出液经SO2沉淀法提取其中的硫后,再返回浸出工序。
2 试验方法
2.1 试验原料
试验原料为金川公司提供的铜渣氯浸渣,其主要化学成分如表1所示。
表 1 铜渣氯浸渣化学成分
Table 1 Composition of copper residue
w/%
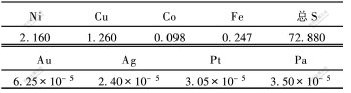
元素硫含量占总硫量的90%,每吨铜渣氯浸渣中含贵金属196.8 g。
试验所用的Na2S为化学纯。SO2为株洲化工厂生产的瓶装液态SO2。
2.2 工艺流程
Na2S浸出-SO2沉淀法处理铜渣氯浸渣工艺流程如图1所示。
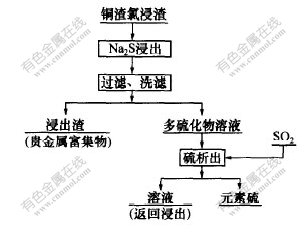
图 1 Na2S浸出-SO2沉淀法处理铜渣浸出渣工艺流程
Fig. 1 Flowchart of copper residue treated
by Na2S leaching-SO2 precipitating method
2.2.1 渣氯浸渣的水洗
将一定量铜渣氯浸渣在温度为60 ℃的水中进行搅拌洗涤,使渣中的水溶物(如CuSO4和NiSO4)进入水中,然后过滤,干燥去水。经水洗后,占原渣15%左右的可溶物可被分离。
2.2.2 水洗渣的浸出
配制一定浓度的Na2S溶液,将一定量的水洗渣和Na2S溶液放入反应烧杯中进行搅拌浸出。
2.2.3 浸出渣的过滤和干燥
浸出完毕,使用真空抽滤装置使液固分离,采用火法试金法分别分析浸出渣和溶液中贵金属含量。
试验中用渣率ηr表示元素硫的浸出程度,渣率越小,硫的浸出率越大。
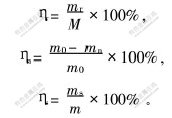
其中:mr为Na2S浸出后渣的质量,g;M为水洗渣质量,g;ηn为贵金属浸出率,%;m0原渣中贵金属质量,g;mn为浸出渣中贵金属质量,g;ηs为元素硫回收率,%;ms为溶液中硫的析出质量,g;m为原渣中硫的质量,g。
3 试验结果及讨论
3.1 Na2S浸出试验
3.1.1 温度对渣率和贵金属浸出率的影响
取水洗渣20 g,Na2S与S0的摩尔比即n(Na2S)∶n(S0)=1∶3。分别用浓度为0.5,1.0和1.5 mol/L的硫化钠溶液浸出,在不同温度下保温30 min,试验结果如图2和图3所示。
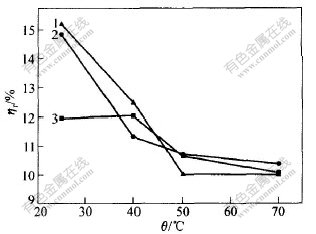
c(Na2S)/(mol·L-1):1—0.5; 2—1.0; 3—1.5
图 2 温度对渣率ηr的影响
Fig. 2 Effect of temperatures on ηr
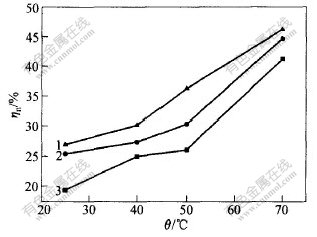
c(Na2S)/(mol·L-1):1—0.5; 2—1.0; 3—1.5
图 3 温度对贵金属浸出率ηn的影响
Fig. 3 Effect of temperatures on ηn
从图2和图3可以看出,在一定的Na2S浓度下,随着温度的升高,渣率减小,特别是在较低温度范围内(25~40 ℃)该趋势更明显,在50~70 ℃之间渣率变化不大。说明在25~50 ℃范围内,提高温度对元素硫的浸出有利。对贵金属来说,温度升高,浸出率增大,而且温度对贵金属浸出率的影响比对元素硫浸出率的影响更明显;在一定温度下,Na2S浓度越高,贵金属浸出率越大。综合考虑硫的浸出和贵金属的损失,浸出过程可以在25 ℃和Na2S浓度为0.5 mol/L时进行。
3.1.2 浸出时间对渣率和贵金属浸出率的影响
取水洗渣20 g,n(Na2S)∶n(S0)=1∶3,温度为25 ℃。分别用浓度为0.5,1.0和1.5 mol/L硫化钠溶液浸出,保温不同时间,试验结果如图4和图5所示。
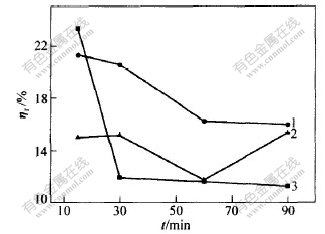
c(Na2S)/(mol·L-1): 1—0.5; 2—1.0; 3—1.5
图 4 浸出时间对渣率ηr的影响
Fig. 4 Effect of time on ηr
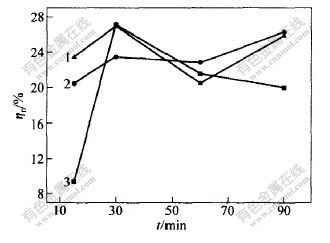
c(Na2S)/(mol·L-1): 1—0.5; 2—1.0; 3—1.5
图 5 浸出时间对贵金属浸出率ηn的影响
Fig. 5 Effect of leaching time on ηn
从图4和图5可看出,在一定的Na2S浓度下,渣率随浸出时间延长略有减少,贵金属浸出率随浸出时间的增加而增加,但规律不是很明显,这可能是检测误差较大造成的。
总之,浸出时间对于硫的浸出和贵金属浸出率影响都不大。
3.1.3 浸出时间不同时Na2S浓度对渣率和贵金属浸出率的影响
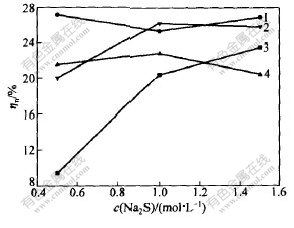
取水洗渣20 g,n(Na2S)∶n(S0)=1∶3,温度为25 ℃。浸出时间分别为15,30,60和90 min时,Na2S浓度对渣率和贵金属浸出率的影响如图6和图7所示。
从图6和图7可看出,当浸出时间为15 min时,随着Na2S浓度的升高,渣率降低,贵金属浸出率增大;但浸出时间增加到30 min后,渣率随Na2S浓度的增大先增大后减小,贵金属浸出率变化不大。
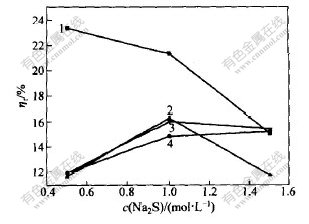
t/min: 1—15; 2—30; 3—60; 4—90
图 6 浸出时间不同时Na2S浓度对渣率ηr的影响
Fig. 6 Effect of content of Na2S on ηr at
different time
t/min: 1—15; 2—30; 3—60; 4—90
图 7 浸出时间不同时Na2S浓度对贵金属
浸出率ηn的影响
Fig. 7 Effect of content of Na2S on ηn
at different time
3.1.4 不同温度下Na2S浓度对渣率和贵金属浸出率的影响
取水洗渣20 g,n(Na2S)∶n(S0)=1∶3,时间为30 min。温度分别为25,40,50和70 ℃时,Na2S浓度对浸出的影响如图8和图9所示。
从图8和图9可看出,在温度较低(25℃)时,Na2S浓度对渣率的影响较大,但对贵金属浸出率影响不大;在温度高于40 ℃时, Na2S浓度对渣率的影响不大,但Na2S浓度对贵金属浸出率的影响较明显;随着Na2S浓度的增加,贵金属浸出率逐渐增加,温度越高,对贵金属富集到渣中越不利。
3.1.5 正交试验
为了确定浸出温度、Na2S浓度和浸出时间等影响因素的主次关系和最佳工艺条件,又进行了4因素3水平的正交试验,试验中均选用水洗渣20 g,试验结果如表2所示。
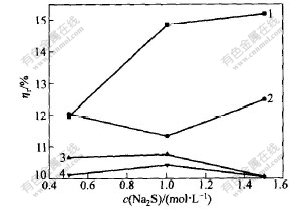
θ/℃:1—25; 2—40; 3—50; 4—70
图 8 不同温度下Na2S浓度下对渣率ηr的影响
Fig. 8 Effect of content of Na2S on ηr
at different temperatures
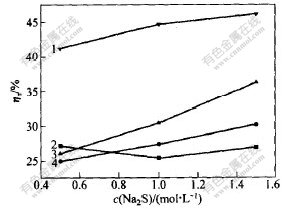
θ/℃:1—25; 2—40; 3—50; 4—70
图 9 不同温度下Na2S浓度对贵金属浸出率ηn的影响
Fig. 9 Effect of content of Na2S on ηn
at different temperatures
根据极差,4个因素对浸出过程的影响从大到小顺序为:温度,浓度,时间,n(Na2S)/n(S0)。较好的试验条件是:浸出温度为25 ℃,Na2S浓度为0.5 mol/L,硫化钠与元素硫的摩尔比取1∶4,浸出时间为60 min。按照上述试验条件,对正交实验得出结果进行综合验证,结果如表3所示。
从表3可知,在上述试验条件下,渣率平均为26.52%。按照原渣中元素硫含量,假设元素硫能全部浸出,则渣率应为22.93%,表示在Na2S浸出过程中,渣中的元素硫几乎能被全部浸出。贵金属浸出率平均为10.63%,每吨浸出渣中贵金属质量平均为779 g,与原渣中的贵金属含量相比,浸出渣中贵金属富集3.96倍。
3.2 元素硫析出试验
用Na2S溶液浸出铜渣氯浸渣后,元素硫以多硫化钠的形态进入浸出液中,因此,必须从浸出液中回收元素硫。采用往浸出液中通入气态SO2的方法,使溶液的pH值逐步降低,多硫化物发生解离,使元素硫从溶液中析出。试验在室温下进行,结果如表4所示。
表 2 正交试验结果
Table 2 Results of orthogonal test
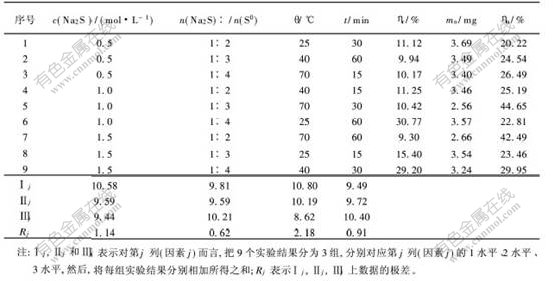
表 3 综合试验结果
Table 3 Results of synthesise test
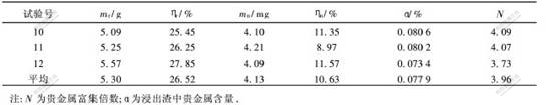
表 4 元素硫析出试验结果
Table 4 Results of depositing sulphur from solution
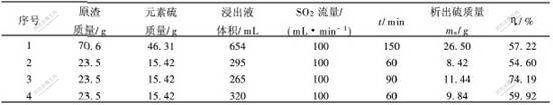
经分析,析出的元素硫中含S 99.08%,硫的回收率平均为54.60%~74.19%。金川公司镍精矿闪速熔炼的烟气中含有SO2,因此,可考虑将来工业化时用烟气中SO2代替瓶装SO2,这样可以大大降低生产成本。
4 结 论
a. 在Na2S浓度为0.5 mol/L,Na2S与S0摩尔比为1∶4,温度为25 ℃,浸出时间为60 min的条件下,平均渣率为26.52%,平均贵金属浸出率为10.63%。表明原渣中的元素硫几乎全部被浸出,浸出渣中贵金属含量为原渣的3.96倍。
b. 向溶液中通入SO2的方法可从浸出液中析出元素硫,元素硫的纯度可达到99.08%,回收率达54.6%~74.19%。
参考文献:
[1]周勤俭.湿法冶金渣中元素硫的回收方法[J].湿法冶金,1997,(3):50-54.
ZHUO Qin-jian. Method of Reclaim Element Sulfur from Hydrometallurgical Slag[J]. Hydrometallurgy, 1997,(3):50-54.
[2]杨天足, 赵天从. 用二甲苯从湿法冶金残渣中提取元素硫[J].中南矿冶学院学报,1990,21(4):171-176.
YANG Tian-zu, ZHAO Tian-cong. Reclaim Element Sulfur from Hydrometallurgical Slag with Dimethylbenzene[J]. Journal of Central South Institute of Mining and Metallurgy,1990, 21(4):171-176.
[3]邓日章,赵天从,钟竹前. 从含硫浸出渣中回收元素硫的研究[J].中南矿冶学院学报,1992,23(6):287-291.
DENG Ri-zhang, ZHAO Tian-cong, ZHONG Zhu-qian. Study of Reclaim Element Sulfur from Leaching Slag Obtained Sulfur[J]. Journal of Central South Institute of Mining and Metallurgy, 1992,23(6):287-291.
[4]董建勋,李振中.石灰石炉内高温煅烧脱硫及产物活性的实验[J].动力工程,2004, 24(5):711-715.
DONG Jian-xun,LI Zhen-zhong. Experimental Research on Desulfurization of Limestones and Activity of Calcination Products in Furnace[J]. Power Engineering,2004,24(5):711-715.
[5]朱继民.元素硫在(NH4)2S+NH3溶液中溶解的研究[J].有色金属(冶炼部分),1989,(2):61-63.
ZHU Ji-ming. Study of Element Sulfur Dissolving in the Solution of (NH4)2S and NH3[J]. Nonferrous metal(Extractive Metallurgy), 1989,(2):61-63.
[6]童仁唐,沈士德.从硫化钠脱硫残液中直接回收硫的研究[J].武汉冶金科技大学学报(自然科学版),1999,(6):131-133.
TANG Ren-tang,SHENG Shi-de. Study of Reclaim Element Sulfur from Desulfurized Liquid by Na2S[J]. Journal of Wuhan University of Metallurgy Technology, 1999, (6):131-133.
[7]易清风.石墨电极上硫化钠的阳极氧化机理探索[J]. 物理化学学报,2000,16(3)263-268.
YI Qing-feng. Investigation of Anodic Oxidation Mechanism of Na2S Solution on Graphite Electrode[J]. Acta Physico-chimica Sinica, 2000,16(3): 263-268.
[8]杨天足,陈希鸿,宾万达,等.多硫化钠浸金研究[J].中南矿冶学院学报,1992,23(6):687-692.
YANG Tian-zu,CHEN Xi-hong, BIN Wan-da, et al. Study of Leaching Gold by Polysulfide[J]. Journal of Central South Institute of Mining and Metallurgy.1992,23(6):687-692.
[9]龙炳清,陈希鸿,宾万达,等.多硫化物浸金研究[J].黄金,1987,1(3):33-37.
LONG Bing-qing, CHEN Xi-hong, BIN Wan-da, et al. Study of Leaching Gold by Polysulfide[J].Gold, 1987, 1(3): 33-37.
[10]朱国才,方兆珩,陈家墉.多硫化物浸取含金硫化矿的研究.贵金属[J].1994,15(2):26-31.
ZHU Guo-cai,FANG Zhao-heng,CHEN Jia-yong. Study of Leaching Sulfuration Mine with Gold by Polysulfide[J]. Precious Metal, 1994,15(2);26-31.
[11]WERNER F G. Equilibria Involving Polysulfide Ions in Aqueous Sulfide Solutions up to 240 ℃[J]. Inorg Chem, 1974,13(7):1724-1730.
收稿日期:2004-07-21
作者简介:孙培梅(1945-),女,山西长子人,教授,博士生导师,从事有色金属冶金研究
论文联系人: 孙培梅,女,教授,博士生导师;电话:0731-8830477(O);E-mail:hgli@mail.csu.edu.cn