网络首发时间: 2017-03-02 14:22
稀有金属 2018,42(03),278-284 DOI:10.13373/j.cnki.cjrm.XY16100040
螯合剂与氧化剂协同降低CMP中Co/Cu电偶腐蚀
李祥州 潘国峰 王辰伟 郭学海 何平 李月
天津市电子材料与器件重点实验室
河北工业大学电子信息工程学院
河北工业大学计算机科学与软件学院
摘 要:
钴 (Co) 作为10 nm及以下技术节点的铜互连极大规模集成电路 (GLSI) 的新型阻挡层材料, 在阻挡层化学机械抛光 (CMP) 中易与铜 (Cu) 发生电偶腐蚀。本文采用电化学、CMP、静态腐蚀实验以及扫描电镜 (SEM) 表征方法, 研究了弱碱性抛光液中螯合剂和氧化剂在Co/Cu电偶腐蚀中的协同作用。研究表明:抛光液中的氧化作用, 使得Co和Cu表面生成一层由氧化物及氢氧化物组成的钝化膜, 抑制了Co和Cu的静态腐蚀;多羟多胺螯合剂浓度增加, 抛光液pH升高, Co和Cu表面钝化膜的生成加快;CMP过程中, Co和Cu腐蚀电位均有明显降低, 去除速率均加快。抛光液组分为1.5 ml·L-1H2O2、0.1%FA/O螯合剂、30%AEO-9、5%硅溶胶 (质量分数) 时, Co的腐蚀电位低于Cu的腐蚀电位;研磨状态下, Co/Cu腐蚀电位差降到-6 m V, 电偶腐蚀电流很小, 极大地减弱Co/Cu电偶腐蚀。同时, Co的去除速率为130 nm·min-1, Cu的去除速率为76.5 nm·min-1, Co与Cu的静态腐蚀均不明显, 可以很好地满足阻挡层CMP要求。
关键词:
钴;螯合剂;电偶腐蚀;碱性抛光液;化学机械抛光;
中图分类号: TG172.8
作者简介:李祥州 (1990-) , 男, 四川彭州人, 硕士, 研究方向:表面超精密加工;E-mail:toxzlee@163.com;;潘国峰, 教授;电话:022-60201634;E-mail:pgf@hebut.edu.cn;
收稿日期:2013-12-25
基金:国家科技重大专项子课题 (2016ZX02301003-004-007);河北省高等学校自然科学重点项目 (ZD2016123);河北省自然科学基金青年基金项目 (F2015202267);河北工业大学优秀青年科技创新基金项目 (2015007);天津市电子材料与器件重点实验室资助;
Reduction of Galvanic Corrosion between Cobalt and Copper in CMP by Chelation and Oxidation
Li Xiangzhou Pan Guofeng Wang Chenwei Guo Xuehai He Ping Li Yue
Tianjin Key Laboratory of Electronic Materials and Devices
School of Electronic Information Engineering, Hebei University of Technology
School of Computer Science &Engineering, Hebei University of Technology
Abstract:
Cobalt as the copper-interconnects barrier in the 10 nm Node (or next techniques node) great-large scale integrated circuit (GLSI) , was prone to have galvanic corrosion during chemical-mechanical polishing (CMP) with copper. The synergistic reaction of chelating agent and hydrogen peroxide on Co/Cu galvanic corrosion in weak alkaline slurry were investigated. The results of electrochemical experiments, polishing experiments and static corrosion experiments indicated that the passive film was composed of oxide and hydroxide on the surface of cobalt and cooper could inhibit the corrosion due to the enhanced oxidation by increasing hydrogen peroxide concentration. The formation of passive film became faster as a result of the pH rise because of the increasing multi hydroxyl polyamine chelating agent concentration; during the CMP process, both the corrosion potential of cobalt and copper decreased and the removal rate of cobalt and copper were increased. When the slurry was composed by 1. 5 ml·L-1 hydrogen peroxide, 0. 1% FA/O, 30% AEO-9, 5% silica (mass fraction) , copper had higher corrosion potential than cobalt and the galvanic corrosion could be reduced effectively when the difference of open circuit potential between them decreased to-6 m V. Meanwhile, the removal rate of Co was 130 nm·min-1, the removal rate of Cu was 76. 5 nm·min-1, and the static corrosion of Co/Cu was very weak which could be very good for meeting the requirements of barrier CMP.
Keyword:
cobalt; chelator; galvanic corrosion; alkaline polishing slurry; CMP;
Received: 2013-12-25
随着集成电路 (integrated circuit, IC) 特征尺寸的进一步缩小, 传统Ta/Ta N双层铜互连阻挡层结构无法满足微电子技术发展的要求[1], 寻求新型超薄阻挡层材料迫在眉睫。近年来, Os, Ru, Co, Mo等金属都被作为铜互连扩散阻挡层[2,3,4,5,6,7]研究。由于Co具有电阻率低, 台阶覆盖性、化学惰性及热稳定性好以及与Cu粘附性良好等性能, 因此Co成为10 nm及以下技术节点极大规模集成电路 (GLSI) 铜互连阻挡层材料[8,9,10]。但由于金属Co/Cu标准电极电位差较大, Co/Cu接触时极易产生电偶腐蚀, Co作为阴极溶解而产生“空洞”, Cu离子向介质层扩散而导致器件失效。Lu等[11,12]采用2-巯基噻唑啉 (2-MT) 和苯并三唑 (BTA) 为抑制剂在Co表面成膜钝化理论, 降低了在酸性条件下Co的腐蚀和减少了Co与Cu之间的自腐蚀电位差 (△Ecorr) , 能够减缓Cu/Co电偶腐蚀, 得到了较好的Cu/Co速率选择性。Peethala等[13]研究了p H, H2O2, 精氨酸和苯并三唑 (BTA) 对Co抛光的影响并提出了相应的去除机制。
本文采用电化学分析方法研究了FA/O螯合剂和H2O2对化学机械抛光 (CMP) 过程中Co/Cu电偶腐蚀的协同作用。并采用静态腐蚀和CMP的方法研究了FA/O螯合剂和H2O2在Co和Cu静态腐蚀以及CMP中的作用。
1 实验
1.1 电化学实验
本实验采用上海辰华-CHI660E三电极电化学工作站, 采用饱和甘汞电极作参比电极, 铂 (Pt) 电极作对电极, 分别测得工作电极在静止状态和研磨状态下的开路电位-时间 (OCP-t) 曲线和动电位极化曲线 (Tafel曲线) 。其中, 开路电位-时间曲线扫描范围为-1~1 V, 扫描时间为600 s;Tafel曲线扫描范围为开路电压±300 m V, 扫描速率10 m V·s-1。实验装置如图1所示, 工作电极为Co (99.99%, 高4 mm, 半径5 mm) 和Cu (99.99%, 高4 mm, 半径5 mm) 旋转圆盘电极 (rotating disk electrode, RDE) , 抛光垫为politex regularly。动态工作压力27.56 k Pa;RDE转速500 r·min-1。
1.2 抛光实验
抛光实验均在法国Alpsitec-E460E型抛光机上进行, 抛光垫为politex regularly型抛光垫, 样品为 (3英寸) Co (99.99%) 和Cu (99.99%) 基片。抛光液由硅溶胶 (粒径70~90 nm) 、FA/O螯合剂、非离子表面活性剂 (AEO-9) 、双氧水 (H2O2, 30%, 质量分数, 电子纯) 和去离子水组成。抛光工艺:工作压力6.89 k Pa, 抛头/抛盘转速87/93 r·min-1, 抛光液流量300 ml·min-1。每组试验重复3次取平均值得实验结果。
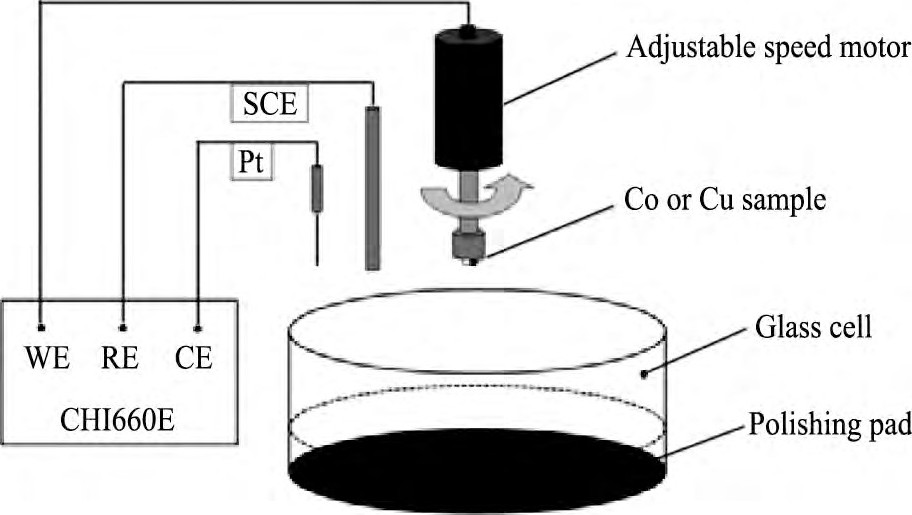
图1 电化学抛光系统示意图Fig.1 Schematic setup of electrochemical polishing system
1.3 静态腐蚀实验
实验样品为Co靶 (99.99%, 10 mm×20 mm×1.5 mm) 和Cu靶 (99.99%, 10.0 mm×20.0 mm×0.5 mm) 。实验前样品均在抛光实验相同抛光工艺条件下抛光120 s, 用乙醇 (化学纯) 清洗, 去离子水冲洗, 高纯氮气吹干, 以避免表面氧化物和杂质等带来的干扰。实验时, 将经过处理的样品在盛有100 ml抛光液的烧杯中浸泡120 min后取出, 用乙醇 (化学纯) 清洗, 去离子水冲洗, 高纯氮气吹干。进行后续腐蚀速率测量和表面状态的观测实验。每组试验重复3次取平均值得实验结果。
1.4 去除速率和静态腐蚀速率测量及表面状态表征
Co和Cu去除速率 (removal rate, RR) 和静态腐蚀速率 (static etching rate, SER) 均采用称重法 (Mettler Toledo ML503, 精度0.1 mg) 计算得出。由 (Δm为抛光前后基片的质量差;ρ为基片的密度;t为抛光时间;S为基片的面积) 计算出RR和SER。每组试验重复3次取平均值得实验结果。
(Δm为抛光前后基片的质量差;ρ为基片的密度;t为抛光时间;S为基片的面积) 计算出RR和SER。每组试验重复3次取平均值得实验结果。
本文采用ZEISS-Sigma-500扫描电镜 (SEM) 观测Co在静态腐蚀后的表面状态, 加速电压为5.00k V, 放大倍数为5.0×104倍。
2 结果与讨论
实验所用抛光液均由5% (质量分数, 下同) 硅溶胶, 30%活性剂和不同浓度的FA/O螯合剂与H2O2 (30%, 电子纯) 组成。本文所使用FA/O螯合剂为河北工业大学自主研发, 是一种多羟基的胺碱, 室温下为淡黄色稠状液体, 对Cu离子有很强螯合作用[14,15]。FA/O螯合剂分子式如图2。
2.1 H2O2对Co, Cu电偶腐蚀的影响
不同H2O2浓度下, Co, Cu在静止状态和研磨状态下的Tafel曲线如图3所示。由Tafel曲线外推法计可算出:Co的腐蚀电位 (VCo, corr) 、腐蚀电流密度 (ICo, corr) , 以及Cu的腐蚀电位 (VCu, corr) 、腐蚀电流密度 (ICu, corr) ;图3中, 由Co阴极曲线与Cu阳极曲线 (或者Co的阳极曲线与Cu的阴极曲线) 的交点对应的电流可得Co/Cu电偶腐蚀电流密度 (Igc) [16]。
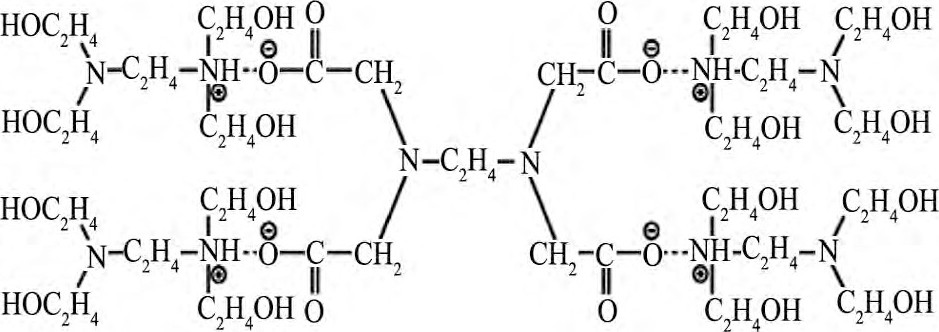
图2 FA/O螯合剂分子式Fig.2 Formula of an FA/O chelating agent
图3中所示溶液均含0.1%FA/O螯合剂、30%活性剂, 不含磨料。其中, 图3 (a~d) 中H2O2浓度分别为:0, 0.5, 1.5, 2.0 ml·L-1。
在静止状态下, 在Co电化学实验中, VCo, corr由120 m V升高到158 m V, ICo, corr由15.68μA·cm-2降低到10.22μA·cm-2;而VCu, corr由49 m V升高到111 m V, ICu, corr由0.55μA·cm-2升高到1.12μA·cm-2。
Co作为阳极时, 表面发生电极反应 (1) , (2) [17];同理, Cu作为阳极时, 表面发生电极反应 (5~7) [18];在上述两组实验中均采用Pt作阴极, 其阴极反应如 (3) , (4) 所示。此外, 在Cu的实验中, Cu表面还发生电离反应 (8) , (9) , 由反应方程可看出, Cu OH, Cu (OH) 2的电离速率与p H密切相关。
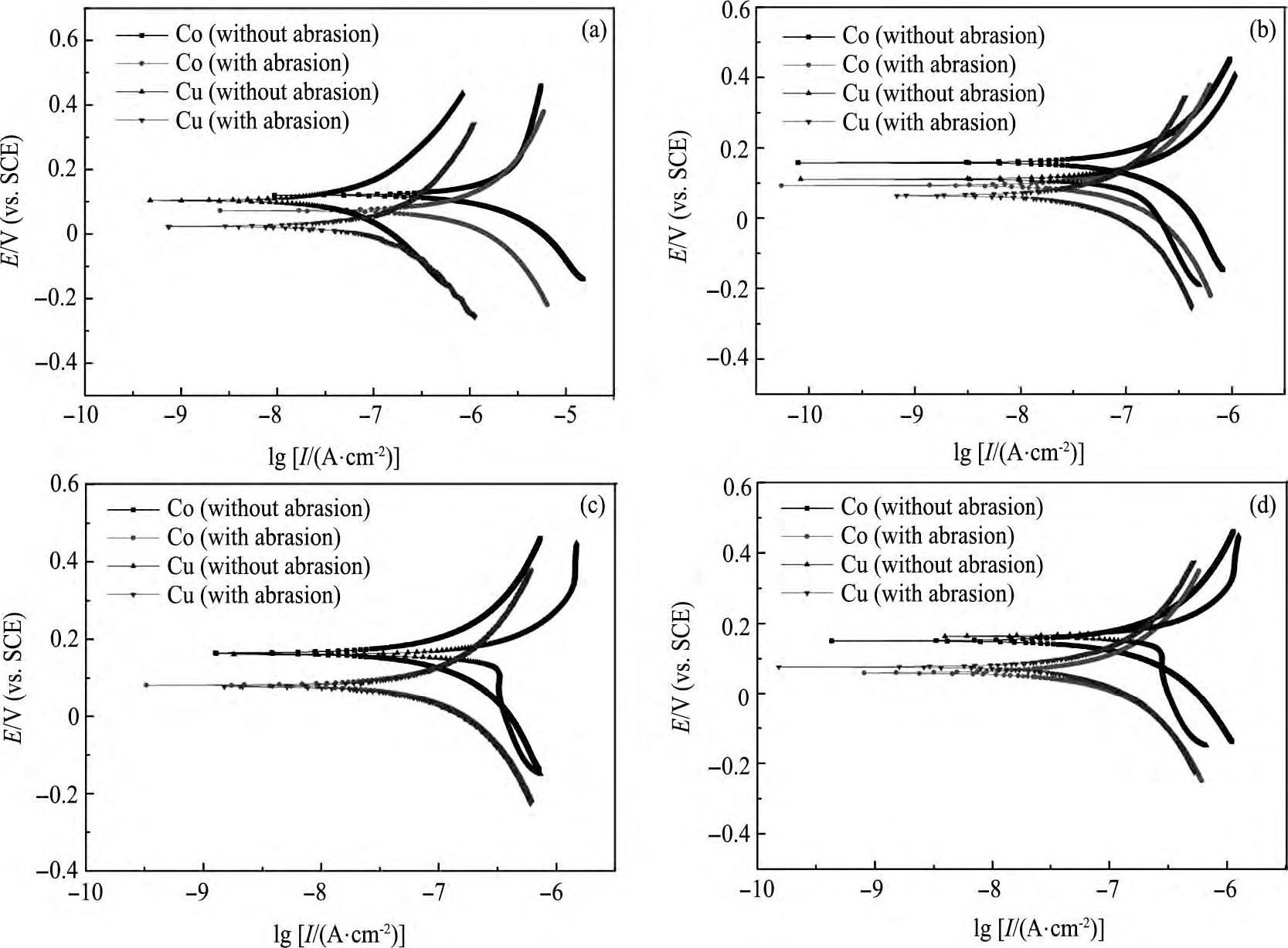
图3 不同H2O2浓度下Co/Cu分别在研磨和非研磨状态下的Tafel曲线图Fig.3 Potentiodynamic polarization plots for Co and Cu in solution with different concentrations of H2O2with or without abrasion
(a) With 0 ml·L-1H2O2and 0.1%FA/O; (b) With 0.5 ml·L-1H2O2and 0.1%FA/O; (c) With 1.5 ml·L-1H2O2and 0.1%FA/O; (d) With 2.0 ml·L-1H2O2and 0.1%FA/O
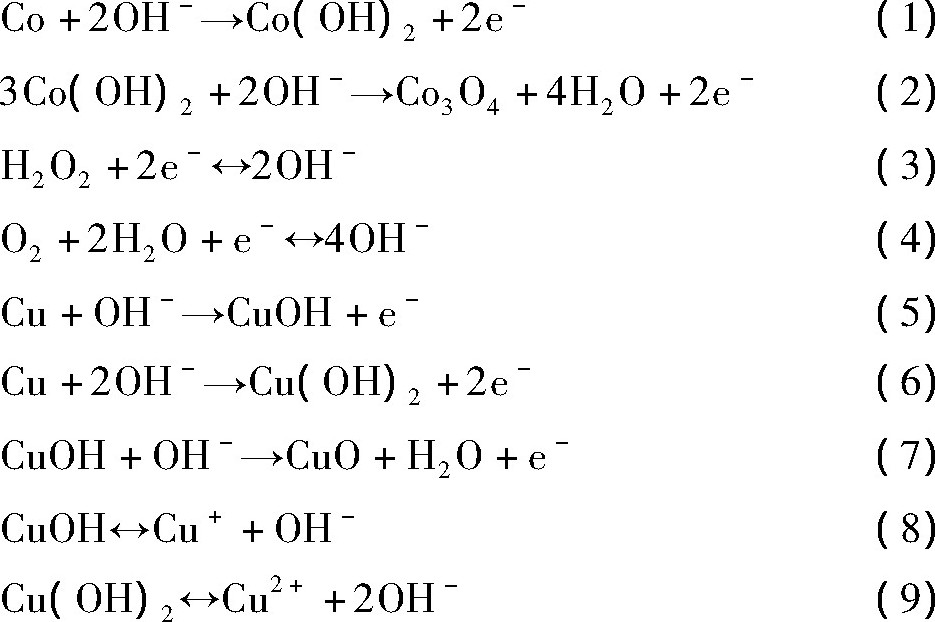
由上述反应可知, Co表面覆盖一层难溶Co3O4, Co (OH) 2 (图4 (a) ) , 导致VCo, corr升高;同理, Cu作阳极时, 生成物Cu O, Cu (OH) 2覆盖在Cu表面 (图4 (b) ) , 也会致使VCu, corr升高。由图3 (a, b) 可以发现, 溶液中加入H2O2时, Co/Cu腐蚀电位差 (VCo, corr-VCu, corr, ΔVcorr) 由71 m V降到47 m V, Igc由0.03μA·cm-2升高到0.08μA·cm-2。
在研磨状态下, VCo, corr由90 m V降低到85 m V, ICo, corr由5.50μA·cm-2降低到5.34μA·cm-2, VCu, corr由23 m V升高到64 m V, ICu, corr由1.26μA·cm-2升高到3.85μA·cm-2。这是由于在机械作用力下, Co表面Co3O4, Co (OH) 2被去除, 机械去除与化学反应达动态平衡时, VCo, corr降低。相反, Cu CMP中, 平衡时, VCu, corr升高。由图3 (a, b) 可以发现, 随着H2O2的加入, Co/Cu腐蚀电位差由67 m V降到21 m V, Igc由0.03μA·cm-2降低到0.02μA·cm-2。
由上述静止、研磨状态的电化学实验可知, H2O2作氧化剂可以降低Co/Cu腐蚀电位差, 明显减弱Co/Cu电偶腐蚀。
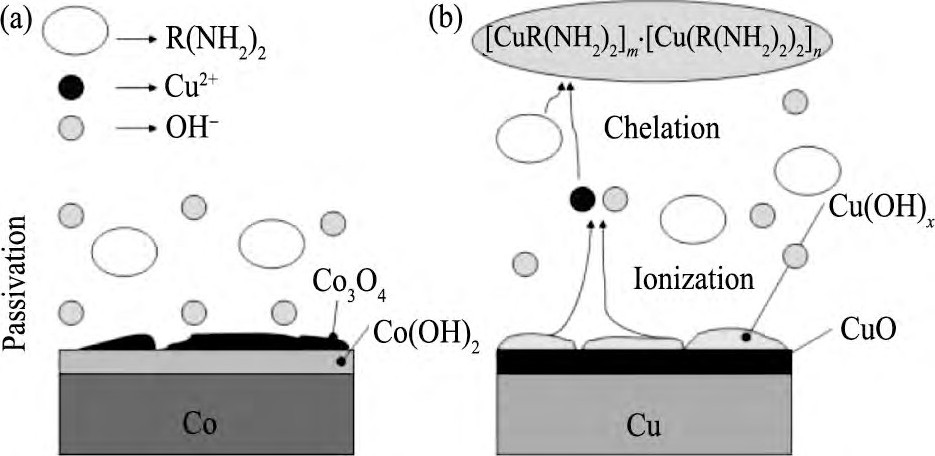
图4 Co和Cu在抛光液中的反应机理示意图Fig.4 Reaction mechanism of cobalt (a) and copper (b) in polishing slurries
2.2 不同浓度H2O2对Co, Cu电偶腐蚀的影响
在图3 (b~d) 中, H2O2的浓度是逐渐增大的。
静止状态下, 在Co的电化学实验中, 阴极反应 (3) 加快, Pt电极周围局部p H值上升, OH-浓度升高, OH-逐渐向阳极扩散, 阳极反应 (1) , (2) 加快, Co表面Co3O4, Co (OH) 2积累, 形成致密钝化膜, 避免Co进一步被腐蚀, 反应逐渐减弱, 达动态平衡时, VCo, corr升高, ICo, corr降低;同理, 在Cu电化学实验中, Cu表面反应 (5) ~ (7) 加快, 但是由于Cu OH, Cu (OH) 2的电离 (式 (8) , (9) ) , VCu, corr和ICu, corr均升高。
研磨状态下, Co表面Co3O4, Co (OH) 2被去除, 机械作用与化学作用达动态平衡时, VCo, corr降低;相反, Cu CMP中, VCu, corr升高。当H2O2浓度为1.5 ml·L-1时, VCo, corr低于VCu, corr, 在Co/Cu电偶腐蚀系统中, Cu将作阴极被保护, Co作阳极被腐蚀, 满足阻挡层CMP要求 (保护铜互连线) 。在H2O2浓度为1.5 ml·L-1时, Co/Cu腐蚀电位差降到最低-6 m V, 腐蚀电流Igc极小;H2O2浓度继续升高, Co/Cu腐蚀电位差和Igc均升高。
因此, 存在0.1%FA/O螯合剂的环境下, H2O2作氧化剂有助于抑制Co和Cu的腐蚀。在H2O2浓度为1.5 ml·L-1时, Co/Cu腐蚀电位差降到-6 m V, Igc很小, 极大地降低了Co/Cu腐蚀电位差, 减弱Co/Cu电偶腐蚀。
2.3 FA/O螯合剂对Co/Cu电偶腐蚀的影响
保持H2O2浓度为1.5 ml·L-1不变, 研究了螯合剂浓度对Co/Cu电偶腐蚀的影响。在不同FA/O螯合剂浓度下, Co, Cu在静止状态和研磨状态下的Tafel曲线如图5所示。VCo, corr, ICo, corr, VCu, corr, ICu, corr以及Igc的计算同图3。图5 (a~c) 中分别加入0%, 0.05%, 0.2%FA/O螯合剂。螯合剂作p H调节剂, 溶液p H逐渐升高。
静止状态下, 在Co的电化学实验中, 溶液p H升高, 溶液中OH-浓度升高, Co表面反应 (2) 加快, Pt电极上反应 (3) , (4) 被抑制, Co表面Co (OH) 2转化为Co3O4 (图4 (a) ) , VCo, corr由-88 m V升高到117 m V, ICo, corr由0.37μA·cm-2升高到4.07μA·cm-2。在Cu的实验中, FA/O螯合剂对Cu有较强螯合作用, 但当加入的量较小时 (0.1%) , 螯合剂p H调节剂的作用大于螯合作用, Cu表面氧化反应 (5) ~ (7) 得以加强, Cu表面Cu O, Cu OH, Cu (OH) 2钝化膜增厚, 但是由于溶液中螯合反应 (10) ~ (12) 的发生, Cu OH和Cu (OH) 2电离增强 (图4 (b) ) , 腐蚀速率增大, VCu, corr由-142m V升高到103 m V, ICu, corr由3.89μA·cm-2降低到0.56μA·cm-2。
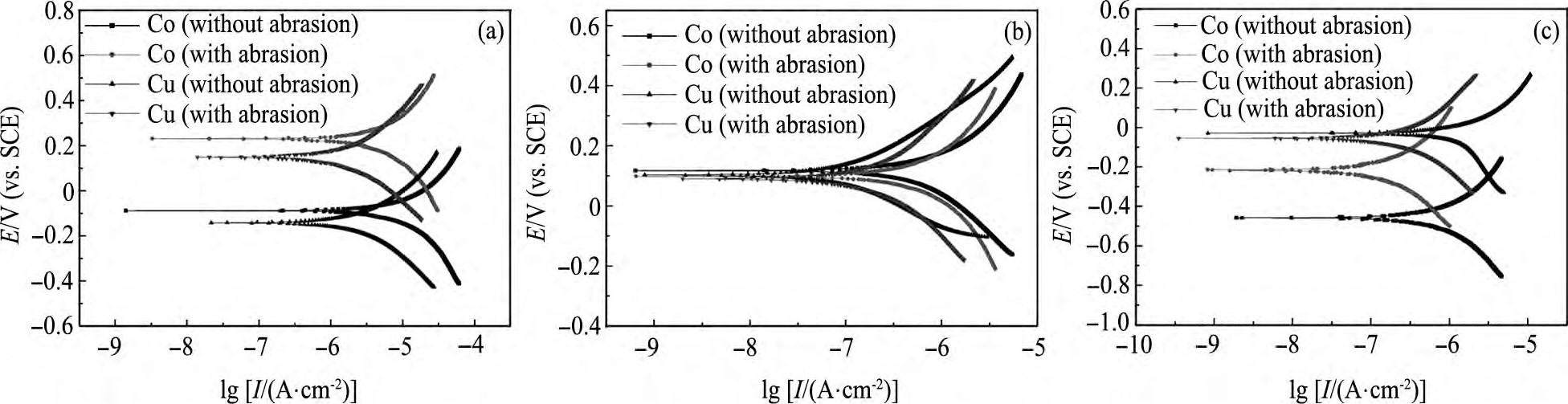
图5 不同FA/O浓度下Co/Cu分别在研磨和非研磨状态下的Tafel曲线图Fig.5 Potentiodynamic polarization plots for Co and Cu in solution with different concentrations of FA/O with or without abrasion
研磨状态下, 在Co的实验中, 抛光液p H升高, 反应 (1) , (2) 加快, 但在机械作用下, Co表面生成的Co3O4, Co (OH) 2被部分去除, 平衡时, VCo, corr由232 m V降低到98 m V, ICo, corr由1.89μA·cm-2升高到3.44μA·cm-2;Cu的实验中, 加入FA/O, Cu表面Cu O, Cu OH, Cu (OH) 2一部分被机械去除, 离开Cu表面进入溶液环境, 一部分由于电离 (式 (8) , (9) ) 加快而溶解, 以Cu+和Cu2+离子进入溶液, 溶液中发生螯合剂与Cu+和Cu2+离子的反应 (10) ~ (12) , 生成紫色可溶大分子螯合物 (胺盐) , 动态平衡时, VCu, corr由149 m V降低到90 m V, ICu, corr由0.47μA·cm-2升高到1.17μA·cm-2。同时发现, 加入0.1%FA/O, Co/Cu腐蚀电位差由83 m V降到8 m V, Igc由1.02μA·cm-2降低到0.06μA·cm-2。所以FA/O螯合剂可以降低Co/Cu腐蚀电位差, 减弱Co/Cu电偶腐蚀。
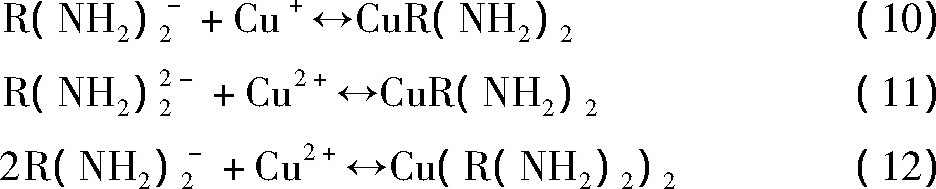
2.4 FA/O螯合剂浓度对Co/Cu电偶腐蚀的影响
在图3 (c) , 图5 (b, c) 中, FA/O螯合剂浓度逐渐增大。
静止状态时, Co实验中, 随着溶液p H值逐渐升高, 导致VCo, corr升高, ICo, corr降低;同理, Cu实验中, Cu表面反应 (5) ~ (7) 加快, 但由于螯合剂浓度增大, 螯合剂与Cu+和Cu2+离子反应加快, 促进Cu OH, Cu (OH) 2的电离, 致使VCu, corr升高, ICu, corr升高。
但在研磨状态时, Co实验中, 随着螯合剂浓度增大, 抛光液p H升高, VCo, corr降低, ICo, corr升高;Cu实验中, 随螯合剂浓度增大, VCu, corr降低, ICu, corr升高。比较在各FA/O螯合剂浓度条件下, 在加入0.1%螯合剂时, Co/Cu腐蚀电位差降到-6 m V, Igc极小, 极大地降低了Co/Cu腐蚀电位差, 减弱Co/Cu电偶腐蚀。表1为研磨状态下Co和Cu的腐蚀电位 (Vcorr) , 腐蚀电流 (Icorr) 以及Co/Cu电偶腐蚀电流 (Igc) 。
综上所述, FA/O螯合剂在Co抛光中主要作p H调节剂作用, 而对Cu抛光来讲, FA/O的螯合作用发挥主要作用, FA/O螯合剂有助于降低Co/Cu腐蚀电位差, 减弱Co/Cu电偶腐蚀。
表1 研磨状态下Co和Cu的腐蚀电位 (Vcorr) , 腐蚀电流密度 (Icorr) 以及Co/Cu电偶腐蚀电流 (Igc) Table 1 Icorr (corrosion current density) , Vcorr (corrosion potential) and Igc (gavalnic corrosion current density) with abrasion 下载原图

表1 研磨状态下Co和Cu的腐蚀电位 (Vcorr) , 腐蚀电流密度 (Icorr) 以及Co/Cu电偶腐蚀电流 (Igc) Table 1 Icorr (corrosion current density) , Vcorr (corrosion potential) and Igc (gavalnic corrosion current density) with abrasion
2.5 H2O2和FA/O螯合剂对Co, Cu静态腐蚀和CMP的影响
H2O2和FA/O螯合剂对Co, Cu抛光速率和静态腐蚀的影响, 如图6。其中抛光液分别按 (1) 0ml·L-1H2O2, 0%FA/O; (2) 0.5 ml·L-1H2O2, 0%FA/O; (3) 0 ml·L-1H2O2, 0.1%FA/O; (4) 1.5 ml·L-1H2O2, 0.1%FA/O配制。Co分别在上述四组抛光液中静态腐蚀后的SEM图如图7。
由图7 (a, b) 可知, 在Co的静态腐蚀实验中, 抛光液中加入H2O2, 抛光具有氧化性, Co表面生成由Co3O4, Co (OH) 2组成的钝化膜, 表面变的疏松多孔。由图7 (a, c) 可得, Co实验中, 随抛光液中加入FA/O螯合剂, 抛光液p H升高, Co表面Co3O4的生成反应速率加快。Co在含有1.5 ml·L-1H2O2, 0.1%FA/O抛光液中静态腐蚀后的表面状态如图7 (d) , 表面比只加入H2O2或FA/O螯合剂时都致密, 能更有效地抑制Co腐蚀。
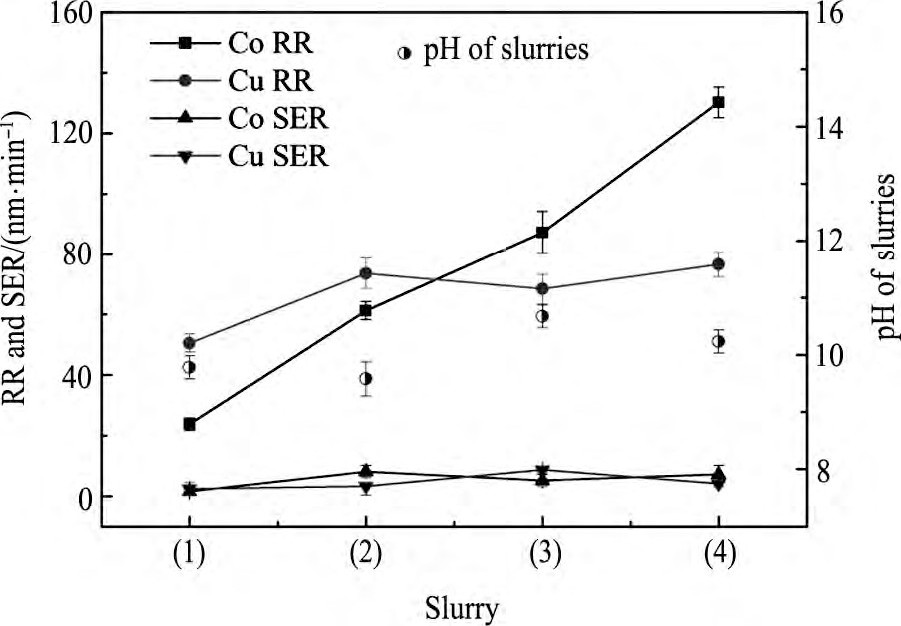
图6 Co和Cu在不同抛光液中的抛光速率和静态腐蚀速率Fig.6 RR and SER of Co and Cu and p H of slurries in differ-ent slurries

图7 Co分别在不同抛光液中静态腐蚀后的SEM图Fig.7SEM images of surface of cobalt after static corrosion experiments in different slurries
(a) 0 ml·L-1H2O2, 0%FA/O; (b) 0.5 ml·L-1H2O2, 0%FA/O; (c) 0 ml·L-1H2O2, 0.1%FA/O; (d) 1.5 ml·L-1H2O2, 0.1%FA/O
在Cu的静态腐蚀实验中, 由反应方程式 (5) ~ (7) 可推测出:Cu表面生成由Cu O, Cu OH, Cu (OH) 2组成的钝化膜, 表面状态也应该是疏松多孔的结构。不同的是, 由反应式 (10) ~ (12) 可推测出, 由于在Cu的实验中, 随着抛光液的螯合作用增强, 在Cu表面, 不仅Cu O, Cu OH, Cu (OH) 2生成加快, Cu+和Cu2+离子被螯合的速率也加快, Cu OH, Cu (OH) 2的电离加快, Cu表面比Co表面更疏松。在含有不同浓度的H2O2和FA/O螯合剂的抛光液中, Co和Cu的静态腐蚀速率均较低, 表明该浓度下Co和Cu的静态腐蚀都得到了有效抑制。
在Co的CMP实验中, 由于抛光液中H2O2和FA/O螯合剂的协同作用, Co表面先生成疏松多孔的钝化膜, 由于钝化膜硬度小于Co金属单质, 更易被机械去除[12], 所以Co抛光速率加快;同理, Cu抛光速率也加快。在抛光液组分为1.5 ml·L-1H2O2, 0.1%FA/O螯合剂, 30%AEO-9, 5%硅溶胶时, Co的去除速率为130 nm·min-1, Cu的去除速率为76.5 nm·min-1, Co的静态腐蚀速率为7nm·min-1, Cu的静态腐蚀速率为4 nm·min-1。FA/O螯合剂对Co是否有螯合作用还不明了, 有待进一步研究。
3 结论
研究了弱碱性抛光液中螯合剂和氧化剂在Co/Cu电偶腐蚀中的协同作用。研究得出, 抛光液中同时存在螯合剂与氧化剂时, 随H2O2浓度增加, 抛光液氧化性增强, 有助于抑制Co和Cu的静态腐蚀。随多羟多胺螯合剂浓度增加, 抛光液螯合作用增强, Co和Cu的静态腐蚀被抑制。CMP过程中, Co和Cu的抛光速率均提高。抛光液组分为1.5 ml·L-1H2O2, 0.1%FA/O螯合剂, 30%AEO-9以及5%硅溶胶时, Co的腐蚀电位低于Cu的腐蚀电位, Co/Cu腐蚀电位差降到-6 m V, Igc很小, 极大地降低了Co/Cu腐蚀电位差, 减弱Co/Cu电偶腐蚀。同时, Co的去除速率为130 nm·min-1, Cu的去除速率为76.5 nm·min-1, Co/Cu的静态腐蚀均不明显, 可以很好地满足阻挡层CMP要求。
参考文献
[1] Roule A, Amuntencei M, Deronzier E, Haumesser P H, Silva S Da, Avale X, Pollet O, Baskaran R, Passenmard G.Seed layer enhancement by electrochemical deposition:the copper seed solution for beyond 45 nm[J].Microelectronic Engineering, 2007, 84 (11) :2610.
[2] Shimizu H, Sakoda K, Shimogaki Y.CVD of cobalttungsten alloy film as a novel copper diffusion barrier[J].Microelectronic Engineering, 2011, 106 (6) :91.
[3] Jiang L, He Y Y, Li Y Z, Luo J B.Effect of ionic strength on ruthenium CMP in H2O2-based slurries[J].Applied Surface Science, 2014, 317 (317) :332.
[4] Cheng J, Wang T, Mei H, Zhou W, Lu X.Synergetic effect of potassium molybdate and benzotriazole on the CMP of ruthenium and copper in KIO4-based slurry[J].Applied Surface Science, 2014, 320 (320) :531.
[5] Cook B A, Bonino C A, Trainham J A.Solid-state processing of oxidation-resistant molybdenum borosilicide composites for ultra-high-temperature applications[J].Journal of Materials Science, 2014, 49 (22) :7750.
[6] Josell D, Witt C, Moffat T P.Osmium barriers for direct copper electrodeposition in damascene processing[J].Electrochemical and Solid-State Letters, 2006, 9 (2) :48.
[7] Zhong M, Venkataraman S S, Lan Y, Li Y, Shipp D A.Role of 1, 2, 4-triazole as a passivating agent for cobalt during post-chemical mechanical planarization cleaning[J].Journal of the Electrochemical Society, 2014, 161 (3) :138.
[8] Tanwar K, Canaperi D, Lofaro M, Tseng Wei-tsu, Patlolla R, Penny C.BEOL Cu CMP process evaluation for advanced technology nodes[J].Journal of the Electrochemical Society, 2013, 160 (12) :3247.
[9] Nakano H, Itabashi T, Akahoshi H.Electroless deposited cobalt-tungsten-boron capping barrier metal on damascene copper interconnection[J].Electrochem.Soc., 2015, 152 (3) :163.
[10] Huang Q, Baker-O'Neal B C, Jr Cabral C, Simonyi E, Deline V R, Hopstaken M.Enhanced grain growth of electroplated copper on cobalt-containing seed layer[J].Electrochem.Soc., 2013, 160 (12) :3045.
[11] Lu H S, Wang J X, Zeng X, Chen F, Zhang X M, Zhang W J, Qu X P.The effect of H2O2and 2-MT on the chemical mechanical polishing of cobalt adhesion layer in acid slurry[J].Electrochemical and Solid-State Letters, 2012, 15 (4) :97.
[12] Lu H S, Zeng X, Wang J X, Chen F, Qu X P.The effect of glycine and benzotriazole on corrosion and polishing properties of cobalt in acid slurry[J].Journal of the Electrochemical Society, 2012, 159 (9) :383.
[13] Peethala B C, Amanapu H P, Lagudu U R K, Babu S V.Cobalt polishing with reduced galvanic corrosion at copper/cobalt interface using hydrogen peroxide as an oxidizer in colloidal silica-based slurries[J].Journal of the Electrochemical Society, 2012, 159 (6) :582.
[14] Gu Z B, Niu X H, Liu Y L, Gao B H, Wang C W, Deng H W.Removal of residual metal oxide after CuCMP in ultra-precision machining[J].Chinese Journal of Rare Metals, 2017, 41 (2) :146. (顾张冰, 牛新环, 刘玉岭, 高宝红, 王辰伟, 邓海文.超精密加工中铜表面CMP后残余金属氧化物的去除[J].稀有金属, 2017, 41 (2) :146.)
[15] Wang C W, Liu Y L, Tian J Y, Gao B H, Niu X H.A study on the comparison of CMP performance between a novel alkaline slurry and a commercial slurry for barrier removal[J].Microelectronic Engineering, 2012, 98 (5) :29.
[16] Turk M C, Shi X, Gonyer D A J, Roy D.Chemical and mechanical aspects of a Co-Cu planarization scheme based on an alkaline slurry formulation[J].Journal of Solid State Science and Technology, 2016, 5 (2) :88.
[17] Jiang L, He Y Y, Li Y, Luo J B.Synergetic effect of H2O2and glycine on cobalt CMP in weakly alkaline slurry[J].Microelectronic Engineering, 2014, 122 (7) :82.
[18] Zhang B G, Liu Y L, Wang C W.BTA free alkaline slurries developed for copper and barrier CMP[J].Journal of Solid State Science and Technology, 2015, 4 (11) :5112.