DOI:10.19476/j.ysxb.1004.0609.2018.12.21
多金属结核与低品位硫化镍矿共提取中Acidithiobacillus ferrooxidans增速作用
康金星1,冯雅丽1,李浩然2,杜竹玮2,邓祥意1,王洪君1
(1. 北京科技大学 土木与资源工程学院,北京 100083;
2. 中国科学院 过程工程研究所 生化工程重点实验室,北京 100190)
摘 要:为利用多金属结核与低品位硫化镍矿,提出嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans,At. f 菌)共浸出镍、钴、铜、锰工艺,考察有无Fe(Ⅲ)和At. f菌体系中S/Mn矿石质量比、矿浆浓度、搅拌速度、温度、接菌量和pH值对主金属元素浸出的影响,通过循环伏安、电化学极化、计时电流、XRD和SEM等分析手段揭示多金属共浸出过程中At. f菌的增速作用机理。结果表明:At. f菌可提高主金属元素浸出速度和回收率;At. f菌存在时,多金属结核阴极-低品位镍矿阳极电极间电位差增大,Fe3+/Fe2+和S0/S2-氧化还原加快,从而加速腐蚀反应。At. f菌促进多金属结核溶解过程电子转移和物质交换,引起低品位硫化镍矿氧化还原电位负移并释放吸附矿石表面S0电子。有菌浸取时的镍、锰、铜和钴浸出率分别达95.34%、97.34%、92.24%和97.75%,比无菌浸取时的分别提高8.78%、4.78%、10.34%和5.46%。
关键词:生物共浸出;电位差;电化学极化;电子转移;氧化还原
文章编号:1004-0609(2018)-12-2580-10 中图分类号:TF843.1 文献标志码:A
从低品位复杂矿石中提取有价金属,是缓解矿产资源枯竭与需求之间矛盾的重要途径。大洋多金属结核为复杂低品位氧化矿资源,富含镍、钴、铜、锰等有价金属,其选冶关键是破坏高价锰铁矿物包裹结构[1]。火法还原多金属结核因工序多、能耗高、环境危害大逐步被湿法取代;湿法提取多金属结核中的有价金属需要还原剂[2]。低品位硫化镍矿是重要的镍资源,常伴生有铜、钴等金属矿物,目前主要采用浮选富集-火法熔炼工艺处理[3],但矿石中金属矿物以微细粒赋存为特征,使得选矿富集资源利用率不高,同时,后续火法处理会造成环境破坏。
微生物冶金是将有机界与无机界融合的新兴矿 物提取技术[4],具有环境危害小和资源利用率高的特点,在环保要求严苛的今天正倍受关注。自WYCISZKIEWICZ等从酸性矿坑水中分离出Acidithiobacillus ferrooxidans (At. f菌)[5],用At. f菌提取镍[6]、铜[7]、金[8]、锰[9]等矿物的生物技术快速发展,并已实现一些矿石的工业应用。然而,低品位复杂多金属矿生物提取速度慢、浸出率低,仍然是低品位资源开发的难题。生物浸出过程中,多以硫化矿氧化为阳极和以氧还原为阴极来完成电子转移,从而氧化溶解有用硫化矿物,氧供应不足常制约着硫化矿物浸出;Mn(Ⅳ)氧化物直接酸碱溶解困难,为具高电位的氧化态物质,可代替氧为阴极电子受体被还原溶解,即Mn(Ⅳ)氧化矿物还原转变为可溶性Mn(Ⅱ)而溶解;因而,同一体系协同硫化矿物与氧化锰矿物的生物浸出,是实现两类矿石中加速有用矿物氧化还原溶解与有价金属元素共提取的有效方式。
本文作者采用At .f菌溶浸体系,以低品位多金属硫化镍矿为电子供体和多金属结核为电子受体,提出低品位多金属氧化锰矿与硫化镍矿的微生物共提取工艺,同时提取氧化性与还原性矿石中的锰、镍、铜、钴等,研究有菌和无菌溶浸体系对有价金属共提取的影响,考察微生物共浸出的工艺条件,阐述了At .f菌的增速作用,以期为低品位复杂多金属矿石资源的综合开发与利用提供新的途径和理论参考。
1 实验
1.1 菌种和培养基
菌种:所用的原始菌株为实验室保存的嗜酸氧化亚铁硫杆菌(At. f菌),浸矿细菌为低品位硫化镍矿驯化培养后的实验菌株。培养基:9K培养基(g/L),(NH4)2SO4 0.15; MgSO4·7H2O 0.05; K2HPO4 0.05; Ca(NO3)2 0.05。用20%硫酸调节pH。At. f菌生长培养时加入FeSO4·7H2O 44.5 g/L,驯化细菌生长至对数期后期得到At. f母菌液,其细菌数量为(3±0.2)×108/ mL,Fe2+浓度< 0.01 g/L,Fe3+浓度约9 g/L。试验浸液为At. f菌+Fe(At. f+Fe)、铁(Fe)、At. f菌(At. f)、空白9K(Control)培养基;其中,空白9K培养基为不引入铁离子的无菌9K基础培养基溶液;At. f菌+Fe培养基为用空白9K培养基稀释去除沉淀物母菌液的电解液;将细菌均匀悬浮在无铁9K培养基配置At. f菌培养基,细菌由去除沉淀物菌液再经12000 r/min离心得到;铁培养基是分离细菌后的营养液,经超声、紫外杀菌20 min得到无菌溶液,再用无菌无铁9K基础培养基溶液稀释的溶液。
1.2 试验材料和仪器
多金属锰结核采自中国太平洋开辟区,结核中锰以高价锰氧化矿物形式存在,镍、铜、钴以离子态充填在锰铁矿物晶格间隙,脉石矿物主要为石英、钙长石;低品位硫化镍矿为甘肃金川的低品位硫化镍矿,其主要金属矿物为紫硫镍矿、镍黄铁矿、黄铜矿、磁黄铁矿等,脉石矿物有镁绿泥石和辉石等。表1所列为所用矿石的主要化学成分,XRD衍射分析见图1。
主要试验设备及仪器有:恒温摇床(NHWY-211B);三辊四筒棒磨机(XRM-70);紫外分光光度计(UV-1750);电子天平(AR1140);电热恒温鼓风干燥箱(DHG-9140A);电化学工作站(CHI160D);X射线衍射仪(D/max 2550VB+);扫描电镜与能谱分析仪(JSM-7001F+INCA X-MAX)。
1.3 试验方法
先将多金属结核与硫化镍矿磨至<0.038 mm占80%,按比例称取试样于四组250 mL锥形瓶中,每组平行做四个试验;分别以At. f菌+Fe、铁、At. f菌、空白9 K培养基与试样按比例配制为150 mL矿浆,再将锥形瓶置于恒温摇床中,用20%硫酸每3 h调节pH控温浸出,一定时间取少量浸出液分析,浸出截止时抽滤得浸出渣,浸出渣烘干后留样分析。分别采用高碘酸钾、丁二酮肟、铜试剂、1-亚硝基-2-萘酚、邻菲罗啉光度法测定浸出液中锰、镍、铜、钴、铁(Fe3+/Fe2+)含量,以浸出液中金属含量推算浸出率。采用XRD、SEM等方法分析原料及浸出渣矿物组成;采用三电极体系分析不同培养基下矿石的电化学特征,其中,试样为工作电极,铂电极为辅助电极,饱和甘汞电极做参比电极。电化学测试所用培养基的配制方法与1.1节相同,其中以Fe(III)离子浓度和At. f菌数量浓度来区分At. f菌、Fe、At. f+Fe培养基性质。
表1 多金属结核与低品位硫化镍矿主要化学成分
Table 1 Chemical compositions of polymetallic nodule and low-grade nickel sulfide ore


图1 多金属结核与低品位硫化镍矿的XRD谱
Fig. 1 XRD patterns of polymetallic nodule(a) and low-grade nickel sulfide ore(b)
2 结果与讨论
2.1 初始浸出体系对主金属元素浸出的影响
基于有无Fe和At. f菌参与,考察不同初始浸出体系对多金属结核与低品位镍矿的镍、铜、钴、锰元素浸出的影响,部分结果如图2所示。At. f菌能提高金属的浸出率和浸出速率,较单一化学提取效率改善明显。结合矿石性质,硫化镍矿中钴和锰含量远低于多金属结核,且后者钴、镍、铜常随锰矿物腐蚀溶解而溶出,钴与锰主要从多金属结核中溶出;而铜与镍赋存状态类似,以硫化物存在于硫化镍矿或以离子态充填锰铁晶格,铜镍可从多金属结核与硫化镍矿中同时溶出。钴与锰、镍与铜分别表现出相似的溶出特性,故后续论述着重讨论镍和锰的提取特性。
2.2 浸出条件对镍锰元素浸出的影响
多金属结核与低品位硫化镍矿微生物共浸出,是微生物催化矿物的电化学腐蚀过程,浸出条件对镍、锰浸出的影响如图3所示。随硫化镍矿用量增大,锰浸出率增大且溶出速率变快,镍浸出量与浸出速率先增大后减小,这是由于锰矿物得电子后溶出锰及镍,硫化物被氧化释放低价硫中电子并溶出镍,电子受体或供体不足,均会导致原电池腐蚀效应及反应推动力的减弱(见图3(a));又硫化物欠缺时,会制约微生物繁殖而影响浸出。图3(b)所示结果表明,低矿浆浓度不利于锰矿物与硫化矿物接触而影响浸出,而且矿浆浓度与浸出液离子浓度相关性大;矿浆浓度高时,金属离子浓度过高会限制At.f菌生长而影响浸出[10-11]。

图2 初始浸出体系对主金属元素浸出的影响
Fig. 2 Effect of initial leaching system on major elements leaching

图3 浸出条件对镍、锰元素浸出的影响
Fig. 3 Effect of initial leaching system on Ni and Mn leaching
搅拌速度、温度、酸度高或低不利于锰镍浸出;一定范围内,微生物活性成为影响镍锰共浸出的主要因素,如图3(c)、(d)、(e)所示。多金属氧化还原共浸出主要通过碰撞实现,低摇速减少矿石相互接触机会,摇速大于160 r/min能增加矿石间碰撞,但对细菌在矿物表面吸附及细菌生长不利;温度升高能加快矿物溶解速率,但细菌生长易被高温限制而使镍浸出率降低,40 ℃浸出96 h仅为91.54%,比30 ℃和35 ℃时低4%;H+参与锰还原和硫氧化过程,At. f菌对镍溶出的影响较对锰大,酸度增大多金属结核与硫化镍矿原电池反应推动力增强,但At. f菌活性相对变差,使得pH为1.6时镍锰浸出速率比1.8时低,而增大pH≥2.0生物浸出易生成黄钾铁矾覆盖矿物表面而影响有价金属的提取[12-16]。
接菌5%的At. f培养基反应96 h后,与At. f+Fe组镍、锰浸出率相当,比无菌含铁浸出组镍、锰分别提高4%和8%,浸出率提高归因于微生物氧化硫化物释放更多电子,生物体系释放电子能力较无机体系强;接菌超过10%后,接菌量对镍锰浸出影响较小,说明At. f菌影响体系铁循环而促进反应[17]。At. f菌活性体系,与相对应的无菌体系相比,浸出速度明显加快,锰镍溶出率提高,说明At. f菌从微细粒供体或低价硫产物中释放了更多电子,且催化加速氧化物与还原物间电子交换。
在S/Mn质量比为2.0、矿浆浓度为8%、摇动速度为140 r/min、温度为30 ℃、接菌量为15%、pH为1.8的最佳条件下浸出96 h,获得镍、锰、铜和钴浸出率分别为95.34%、97.34%、92.24%和97.75%,同条件下较铁培养基浸出镍、锰、铜和钴浸出率所得分别提高8.78%、4.78%、10.34%和5.46%,48 h内平均主金属元素浸出速率都提高10%以上。
2.3 微生物共浸出多金属电化学特征

图4 不同体系下矿石的循环伏安曲线
Fig. 4 Cyclic voltammetry curves of ores at different leaching solutions
图4所示为不同培养基下获得的多金属结核与低品位硫化镍矿循环伏安曲线。浸出培养基无铁时,低品位硫化镍矿电极在0.3~0.5 V和-0.1~0.2 V (vs SCE)的氧化还原峰分别为Fe3+/Fe2+和S0/S2-电对相互转 化,引入At. f菌比空白9K电对间电位差分别缩小0.033 V和0.032 V,且还原峰电流增大,说明At. f菌催化Fe3+/Fe2+和S0/S2-电对循环;多金属硫化物Me(Ni,Cu,Co)S的氧化电位低于 电位,在生物浸出过程易被高价铁腐蚀溶解。当浸出溶液含Fe(Ⅲ)时,低品位硫化镍矿腐蚀变快,电子交换速率加快;At. f+Fe电解液的还原峰较铁培养基位于0.36 V的还原峰向负方向移至0.21 V,且0.1~0.6 V间Fe3+/Fe2+电对在有菌体系的氧化还原峰电流比值较在无菌体系的更接近于1,说明At. f菌增强了硫化镍矿的氧化还原活性;在含At. f菌及Fe(Ⅲ)电解液,-0.12 V的解吸峰和0.09 V的产物吸附峰,说明是硫化矿电极氧化,S2-产生的S0强吸附在矿石表面,而后被At. f菌氧化利用;-0.26 V的还原峰为由
电位,在生物浸出过程易被高价铁腐蚀溶解。当浸出溶液含Fe(Ⅲ)时,低品位硫化镍矿腐蚀变快,电子交换速率加快;At. f+Fe电解液的还原峰较铁培养基位于0.36 V的还原峰向负方向移至0.21 V,且0.1~0.6 V间Fe3+/Fe2+电对在有菌体系的氧化还原峰电流比值较在无菌体系的更接近于1,说明At. f菌增强了硫化镍矿的氧化还原活性;在含At. f菌及Fe(Ⅲ)电解液,-0.12 V的解吸峰和0.09 V的产物吸附峰,说明是硫化矿电极氧化,S2-产生的S0强吸附在矿石表面,而后被At. f菌氧化利用;-0.26 V的还原峰为由 转化为
转化为 引起。低品位硫化镍矿氧化电极反应可表示为(vs SCE):
引起。低品位硫化镍矿氧化电极反应可表示为(vs SCE):
Ni2++S0+2e=NiS(γ), 0.14 V (1)
0.14 V (1)
3Ni2++2S0+6e=Ni3S2, -0.14 V (2)
-0.14 V (2)
S0+2e=S2-, -0.75 V (3)
-0.75 V (3)
H2SO3+4H++4e=S+3H2O, 0.21 V (4)
0.21 V (4)
Fe3++e=Fe2+, 0.54 V (5)
0.54 V (5)
Cu2++S0+2e=CuS, 0.35 V (6)
0.35 V (6)
Co2++S0+2e=CoS, -0.09 V (7)
-0.09 V (7)
式中: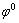 为电极反应的标准电极电位。当培养基无铁时,At. f培养基较空白组0.1 V与1.16 V处Mn(Ⅳ)氧化电位正移0.1 V,氧化电流增大45%;用At. f+Fe电解液腐蚀Mn(Ⅳ)矿物的速率是Fe电解液的两倍,且电位向正方向移动0.1V,说明At. f菌增强了多金属结核中Mn(Ⅳ)氧化活性,且加快电子转移或物质扩散;At. f+Fe体系中,Fe3+还原电位负向移动0.08 V且电流变小,使得
为电极反应的标准电极电位。当培养基无铁时,At. f培养基较空白组0.1 V与1.16 V处Mn(Ⅳ)氧化电位正移0.1 V,氧化电流增大45%;用At. f+Fe电解液腐蚀Mn(Ⅳ)矿物的速率是Fe电解液的两倍,且电位向正方向移动0.1V,说明At. f菌增强了多金属结核中Mn(Ⅳ)氧化活性,且加快电子转移或物质扩散;At. f+Fe体系中,Fe3+还原电位负向移动0.08 V且电流变小,使得 电极反应较铁体系变困难,这是由于多金属结核浸出引入At. f菌时,较Fe(Ⅲ)以Mn(Ⅳ)作为电子受体反应更加迅速。多金属结核溶出的电极反应为(vs SCE):
电极反应较铁体系变困难,这是由于多金属结核浸出引入At. f菌时,较Fe(Ⅲ)以Mn(Ⅳ)作为电子受体反应更加迅速。多金属结核溶出的电极反应为(vs SCE):
MnO2+4H++2e=Mn2++2H2O, 0.99 V (8)
0.99 V (8)
MnO2+H2O+2e=Mn(OH)2+2OH-, 0.19 V (9)
0.19 V (9)
Fe3++e=Fe2+, 0.54 V (10)
0.54 V (10)
图5所示为不同电解液中矿石的极化曲线。存在Fe3+时,硫化镍矿自腐蚀电流比无铁培养基体系大得多,说明高价铁能加速反应;At. f+Fe体系比有铁体系腐蚀电位高0.012 V的正极化,但还原电流与交换电流明显增大,说明Fe3+与微生物同时存在时,硫化物能更快地被腐蚀;无铁浸出体系中,多金属硫化矿在-0.8~0 V、0~0.2,0.2~0.6 V(vs SCE)电位间三个Tafel区,分别对应的电极反应为(vs SCE):
S0+2H++2e=H2S, -0.10 V (11)
-0.10 V (11)
2H2SO3+4H++4e=3H2O+ ,
, 0.16 V (12)
0.16 V (12)
H2SO3+4H++4e=3H2O+S0, 0.16 V (13)
0.16 V (13)

图5 不同体系下矿石的极化曲线
Fig. 5 Polarization curves of ores at different leaching solutions
At. f培养基较空白组电极反应(11)、(13)向正方向移动且交换电流变小,反应(12)负向移动同时交换电流增大,说明有At. f菌时,电子在S元素中转移具有更快的速度,使得S0生成反应速度减缓或S0被氧化为可溶性硫酸盐速率增大。
多金属结核在无铁有At. f菌电解液时,腐蚀电位相对于空白降低0.12 V左右,且氧化电流增大;有铁电解液中,At. f+Fe体系的还原极限电流密度最大,电位在0.45~0.6 V时,其还原电流密度远大于无菌体系的;At. f菌增强多金属结核的氧化活性并降低其被还原难度,从而加速多金属结核腐蚀溶解。图6所示为不同条件下矿石的计时电流曲线,存在At. f菌,电极达到平衡所需时间缩短,进一步证实At. f菌加速电子转移和物质交换。
2.4 微生物共浸出多金属浸渣特性
图7所示为不同体系下生物浸出多金属结核与低品位硫化镍矿96 h浸渣XRD谱。浸渣主要物相为石英、绿泥石、铁氧化物和铁矾、硫酸钙、硫单质等。相对于无机反应体系,有At. f菌参与的浸出过程未生成新的矿物相,但硫单质相减少,说明微生物能促进硫单质氧化为高价可溶性硫化合物;9K空白组中仍有少量镍硫化物和氧化矿物残留,其他试验组镍锰基本被溶出。图8为初始有铁条件下,有机与无机体系浸出96 h 浸渣SEM像。有At. f菌时,微细粒矿石更多地被溶解,且吸附在大颗粒表面较少,这是由于At. f菌能吸附于微细粒表面继而腐蚀溶解矿物,或起中介作用链接两矿粒间的电子传递,从而实现矿石腐蚀溶解,提高微细粒矿物的利用率[18]。

图6 不同体系下矿石的计时电流曲线
Fig. 6 Chronoamperometric plots of ores at different leaching solutions

图7 不同体系下浸渣的XRD谱
Fig. 7 XRD patterns of residue at different leaching solutions
2.5 微生物共浸出多金属过程分析
热力学上,Me(Mn, Ni, Cu, Co, Fe)-S-H2O系中电势-pH可见图9。控制生物浸出条件位于,A区域,能选择性腐蚀溶解镍、铜、钴金属矿物,但无法还原Mn(Ⅳ)氧化物,即难以提取多金属结核中有价金属;B区域,能溶出锰、镍、铜、钴而铁留在固相中,且At. f菌活性较好;C1/C2区为Fe2+/Fe3+、Mn2+、Ni2+、Cu2+、Co2+的热力学稳定区,但浸出选择性差。控制pH和电位位于(a)区时,既可快速还原破坏高价锰矿物包裹结构,又能氧化腐蚀硫化矿物,且使铁留在渣相,继而选择性从多金属矿石共浸出镍、铜、钴、锰。

图8 不同条件下浸渣的SEM像
Fig. 8 SEM images of residue at different leaching solutions

图9 25 ℃离子活度为0.01时Me(Mn, Ni, Cu, Co, Fe)- S-H2O的φ-pH图
Fig. 9 φ-pH diagrams for Me(Mn, Ni, Cu, Co, Fe)-S-H2O systems at 25 ℃ and unit activity of 0.01
图10所示为浸出过程Me(Ni, Cu, Co, Fe)S/MnO2 (At. f菌)相互作用模型。无铁无At. f菌(见图10(a))条件下,硫化物与氧化锰矿相互接触组成固相原电池,经接触碰撞而腐蚀溶解,溶解反应可表示如下:
MeS→Me2+(aq)+S(s)+2e (14)
MnO2+4H++2e→Mn2+(aq)+2H2O (15)
有铁无At.f菌(见图10(b))浸出过程可归纳如下:
MeS+2Fe3+→Me2+(aq)+Fe2++S(s) (16)
MnO2+2Fe2++4H+→Mn2+(aq)+2Fe3++2H2O (17)
无铁有At. f菌(见图10(c))存在时,还包括反应:
MeS Me2+(aq)+S(s)+2e (18)
Me2+(aq)+S(s)+2e (18)
S(s)+2MnO2
 (aq)+Mn2+(aq) (19)
(aq)+Mn2+(aq) (19)
Fe2+(aq) Fe3+(aq)+e (20)
Fe3+(aq)+e (20)
多金属结核MnO2与低品位硫化镍矿MeS(Ni, Cu, Co, Fe)生物共提取总反应为
MeS+2MnO2+2H+ Me2+(aq)+2Mn2+(aq)+H2SO4 (21)
Me2+(aq)+2Mn2+(aq)+H2SO4 (21)
At. f菌引起硫化矿电极负极化和多金属结核正极化,增大电极间氧化还原电位差,增强电化学推动力;At. f菌促进多金属结核物质间电子交换与转移,加速硫化矿中Fe3+/Fe2+及S0/S2-电对循环转化,Fe3+腐蚀硫化镍矿中金属硫化物,产出Fe2+还原多金属结核高价锰矿物;At. f菌氧化释放低价含硫物质中电子,促进锰的还原,从而使生物浸出体系中有价金属共提取增速。

图10 MnO2/Me(Ni, Cu, Co, Fe)S (At. f)的浸出过程
Fig. 10 Bioleaching model of MnO2/Me(Ni, Cu, Co, Fe)S using At. f
3 结论
1) At. f菌增大多金属结核与硫化镍矿电极电位差,增大电极反应推动力。At. f菌引起多金属结核中Mn(Ⅳ)氧化电位正极化,并加速电子和物质交换;At. f菌引起Fe2+还原电流增大并使低品位硫化镍矿还原电位负移,且催化氧化强吸附在矿石表面的S0,从中释放更多电子,继而增加还原锰量。
2) 低品位多金属矿微生物共浸出时,At. f菌催化Fe3+/Fe2+及S0/S2-电对间转化,Fe3+推动硫化矿氧化进程,Fe2+提高氧化锰矿还原速率,同时加速低价硫氧化为高价硫,使有价金属共腐蚀溶解增速进行。
3) At. f菌体系下,当多金属结核与低品位硫化镍矿矿石粒度为<0.038 mm占80%、S/Mn质量比2.0、矿浆浓度8%、摇动速度140 r/min、温度30 ℃、接菌量15%、pH为1.8浸出96 h时,镍、锰、铜、钴浸出率分别达95.34%、97.34%、92.24%、97.75%,比无菌Fe溶浸体系浸出率分别提高8.78%、4.78%、10.34%、5.46%。
REFERENCES
[1] 赵 鹏, 曹英志, 谭 论. 促进我国大洋矿产资源商业化开发的思考[J]. 国土资源情报, 2015, 170(2): 27-30.
ZHAO Peng, CAO Ying-zhi, TAN Lun. Thinking about promotion of China’s commercial exploitation of ocean mineral resources[J]. Land and Resources Information, 2015, 170(2): 27-30.
[2] 赵 峰, 蒋训雄. 含硫物质对大洋多金属结核金属化还原的影响[J]. 有色金属(冶炼部分), 2014(1): 15-18.
ZHAO Feng, JIANG Xun-xiong. Effect of sulfur-bearing substance on metallic reduction of oceanic polymetallic nodules[J]. Nonferrous Metals(Extractive Metallurgy), 2014(1): 15-18.
[3] 崔富晖, 牟文宁, 顾兴利, 许 茜, 翟玉春. 铜镍氧硫混合矿焙烧-浸出过程铜、镍、铁的转化[J]. 中国有色金属学报, 2017, 27(7): 1471-1478.
CUI Fu-hui, MU Wen-ning, GU Xing-li, XU Qian, ZHAI Yu-chun. Transformation of cooper, nickel and iron of oxide-sulfide mixed copper-nickel ore during roasting-leaching process[J]. The Chinese Journal of Nonferrous Metals, 2017, 27(7): 1471-1478.
[4] DUNBAR W S. Biotechnology and the mine of tomorrow[J]. Trends in Biotechnology, 2017, 35(1): 80-89.
[5] WYCISZKIEWICZ M, SAEID A, MALINOWSKI P, CHOJNACKA K. Valorization of phosphorus secondary raw materials by Acidithiobacillus ferrooxidans[J]. Molecules, 2017, 22(3): 473.
[6] LI Hong-xu, LI Chao, ZHANG Zhi-qian. Decomposition mechanism of pentlandite during electrochemical bio-oxidation process[J]. Transaction of Nonferrous Metals Society of China, 2012, 22 (3): 731-739.
[7] LIU Hong-chang, XIA Jin-lan, NIE Zhen-yuan. Relatedness of Cu and Fe speciation to chalcopyrite bioleaching by Acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 2015, 156: 40-46.
[8] FANG Fang, ZHONG Hong, JIANG Fang-ming, LI Chao-hui, CHEN Yong-fa, ZHAN Xue-hui. Influence of surfactants on bioleaching of arsenic-containing gold concentrate[J]. Journal of Central South University, 2014, 21 (10): 3963-3969.
[9] XIAO Li, FANG Zheng, QIU Guan-zhou, WANG Shao-fen, WANG Chun-xiong. Mechanism of elecro-generative-leaching of chalcopyrite-MnO2 in presence of Acidithiobacillus ferrooxidans[J]. Transaction of Nonferrous Metals Society of China, 2010, 20 (S1): s15-s20.
[10] 叶茂友, 严苹方, 孙水裕, 韩大建, 庄圣炜, 郑 莉, 黄绍松. 铜离子浓度对嗜酸性氧化亚铁硫杆菌生长特性和生长动力学的影响[J]. 中国有色金属学报, 2016, 26(10): 2238-2245.
YE Mao-you, YAN Ping-fang, SUN Shui-yu, HAN Da-jian, ZHUANG Sheng-yi, ZHENG Li, HUANG Shao-song. Effect of copper ion concentration on growth activity and kinetics of Acidithiobacillus ferrooxidans[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(10): 2238-2245.
[11] 腾 青, 冯雅丽, 李浩然, 张 旭. 锰离子浓度对氧化亚铁硫杆菌生长动力学的影响[J]. 中国有色金属学报, 2016, 26(7): 1547-1551.
TENG Qing, FENG Ya-li, LI Hao-ran, ZHANG Xu. Effect of manganese ion concentration on growth kinetics of Acidithiobacillus ferrooxidans[J]. The Chinese Journal of Nonferrous Metals,2016, 26(7): 1547-1551.
[12] YU Zhao-jing, YU Run-lan, LIU A-juan, ZENG Wei-min, LIU Xue-duan, QIU Guan-zhou. Effect of pH values on extracellular protein and polysaccharide secretions of Acidithiobacillus ferrooxidans during chalcopyrite bioleaching[J]. Transaction of Nonferrous Metals Society of China, 2017, 27 (2): 406-412.
[13] NAZARI B,JORJANI E,HANI H, MANAFI Z, RIAHI A. Formation of jarosite and its effect on important ions for Acidithiobacillus ferrooxidans bacteria[J]. Transaction of Nonferrous Metals Society of China, 2017, 27 (4): 406-412.
[14] 赖绍师, 覃文庆, 杨聪仁, 王 军, 张雁生, 张 博, 常自勇, 匡浩华. 低品位硫化铜矿的细菌浸出[J]. 中国有色金属学报, 2011, 21(6): 1473-1478.
LAI Shao-shi, QIN Wen-qing, YANG Cong-ren, WANG Jun, ZHANG Yan-sheng, ZHANG Bo, CHANG Zi-yong, KUANG Hao-hua. Bioleaching of low grade copper sulfide ore[J]. The Chinese Journal of Nonferrous Metals,2011, 21(6): 1473-1478.
[15] LIU Hong-chang, XIA Jin-lan, NIE Zhen-yuan, ZHENG Lei, MA Chen-yan, ZHAO Yi-dong. Differential ultilization and speciation transformation of orthorhombic α-S8 and amorphous μ-S by substrate-acclimated mesopholic Acidithiobacillus ferrooxidans and its mechanism analysis[J]. Transaction of Nonferrous Metals Society of China, 2015, 25 (9): 3096-3102.
[16] NOEI S B, SHEIBANI S, RASHCHI F, MIRAZIMI S M J. Kinetic modeling of copper bioleaching from low-grade ore from the Shahrbabak Copper Complex[J]. International Journal of Minerals, Metallurgy and Materials,2017, 24(6): 611-620.
[17] MA Li-yuan, WANG Xing-jie, TAO Jie-meng, LIU Xue-duan, QIN Wen-qing. Differential fluoride tolerance between sulfur-and ferrous iron-grown Acidithiobacillus ferrooxidans and its mechanism analysis[J]. Biochemical Engineering Journal, 2017, 119: 59-66.
[18] 张瑞洋, 魏德洲, 刘文刚, 卢 涛, 沈岩柏, 崔宝玉. 聚乙二醇对氧化亚铁硫杆菌浸出黄铜矿的影响[J]. 中国有色金属学报, 2015, 25(7): 2015-2021.
ZHANG Rui-yang, WEI De-zhou,LIU Wen-gang, LU Tao, SHEN Yan-bai, CUI Bao-yu. Effect of polyethylene glycol on chalcopyrite bioleaching with Acidithiobacillus ferrooxidans[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(7): 2015-2021.
Enhancement of Acidithiobacillus ferrooxidans on polymetallic nodule and low-grade nickel sulfide ore simultaneous bioleaching
KANG Jin-xing1, FENG Ya-li1, LI Hao-ran2, DU Zhu-wei2, DENG Xiang-yi1, WANG Hong-jun1
(1. School of Civil and Resource Engineering, University of Science and Technology, Beijing 100083, China;
2. Key State Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China)
Abstract: For the extraction of Ni, Cu, Co, and Mn from polymetallic nodule and low-grade nickel sulfide ore, a simultaneous bioleaching was investigated by using Acidithiobacillus ferrooxidans(At. f). The extraction regularity was measured by effect of mass ratio of S/Mn, pulp density, agitation speed, temperature, inoculation amount of bacteria and pH on the leaching of major metal elements. The feature and mechanism of the acceleration of At. f was determined by cyclic voltammetry, electrochemical polarization-curve, chronoamperometry, XRD and SEM analysis. The results show that the leaching rate and recovery of major metal elements increase with admixing At. f. Acidithiobacillus ferrooxidans prospers the corrosion, by accelerating the mutual transformation of Fe3+/Fe2+ and S0/S2- electron couples and by increasing the potential difference between the anode of low-grade nickel sulfide ore and the cathode of polymetallic nodule. Acidithiobacillus ferrooxidans can also improve the electron transfer and substance exchange in the dissolution of polymetallic nodules, cause a negative movement of the corrosion potential of nickel ore, and increase in the electron release of the adherent S0. With the presence of At. f, the extraction ratios of Ni, Mn, Cu and Co during bioleaching are 95.34%, 97.34%, 92.24% and 97.75%, respectively, and more than those during inorganic leaching by 8.78%, 4.78%, 10.34% and 5.46%.
Key words: simultaneous bioleaching; potential difference; electrochemical polarization-curve; electron transfer; oxidation-reduction
Foundation item: Project(DY135-B2-15) supported by Deep Sea Bacterial Resources Development Program of China; Project(2015ZX07205-003) supported by Major Science and Technology Program of China for Water Pollution Control and Treatment, China; Projects(21176026, 21176242) supported by the National Natural Science Foundation of China
Received date: 2018-02-28; Accepted date: 2018-07-19
Corresponding author: FENG Ya-li; Tel: +86-10-82627063; E-mail: ylfeng126@126.com
(编辑 何学锋)
基金项目:深海生物资源计划资助项目(DY135-B2-15);水体污染与治理科技重大专项资助项目(2015ZX07205-003);国家自然科学基金资助项目(21176026,21176242)
收稿日期:2018-02-28;修订日期:2018-07-19
通信作者:冯雅丽,教授,博士;电话:010-82627063;E-mail: ylfeng126@126.com