文章编号:1004-0609(2016)-05-1129-07
铁酸钠对含铁矿物碳热还原过程铁粒形成的影响
李小斌1, 2,王一霖1, 2,周秋生1, 2,彭志宏1, 2,刘桂华1, 2,齐天贵1, 2
(1. 中南大学 冶金与环境学院,长沙 410083;
2. 中南大学 难冶有色金属资源高效利用国家工程实验室,长沙 410083)
摘 要:通过热力学计算、动力学试验以及还原产物微观形貌扫描电镜分析,研究Na2O·Fe2O3在Fe2O3/MgFe2O4-Na2CO3-C还原体系中的作用。结果表明:在该体系中,Na2CO3与Fe2O3或MgFe2O4快速反应生成更易被碳还原的Na2O·Fe2O3,从而降低还原反应的起始温度,并加速反应的进行;Na2O·Fe2O3还能促进含铁矿物碳热还原过程中铁晶粒的长大,有利于后续铁矿物的磁选分离。
关键词:冶金废渣;碳酸钠;还原焙烧;铁酸钠
中图分类号:TF09 文献标志码:A
还原焙烧-磁选法[1]是一种常用的处理含铁冶炼废渣回收其中铁矿物的方法,即将这些铁矿物如赤铁矿、针铁矿、铁橄榄石以及各种铁尖晶石等还原为单质铁或磁铁矿,进而通过磁选分离回收铁。该方法具有对物料适应性强、工艺成熟的优点,在处理高铁赤泥[2]、无钙焙烧铬渣[3]、锌浸出渣[4]和铜冶炼渣[5]等含铁废渣和尾矿中均有应用,但同时存在诸如还原温度高、能耗大和部分矿物因组分细粒嵌布而分离困难的缺点。因此,研究强化还原焙烧过程具有重要意义。
国内外学者对冶金废渣的还原焙烧进行了广泛的研究,众多研究表明:Na2CO3作为添加剂可以强化铁矿物的还原,但是对其过程机理尚未形成一致意见。郭培民等[6]在研究炭还原氧化铁过程时认为,碳酸钠的加入加速了碳的气化,促进了氧化铁还原过程中的直接还原和间接还原反应的进行,从而加速氧化铁的还原。黄柱成等[7]、梅贤恭等[8-9]在研究赤泥煤基还原时提出,强碱性氧化物可从铁橄榄石中置换出FeO,从而提高FeO活度,优化反应传质和传热条件,促进铁晶粒的长大及铁矿物的还原。姜涛等[10-11]在研究高铝褐铁矿和红土镍矿处理新工艺时认为,加入碳酸钠可以与脉石成分氧化铝和氧化硅反应,破坏矿石结构,进而加速铁矿石的还原过程。以上研究对碳酸钠促进铁矿物还原的机理从不同方面进行了解释,但Na2CO3与铁矿物反应生成Na2O·Fe2O3的作用并未被关注。此外,对于含铁尖晶石类矿物(如无钙焙烧铬渣)的还原也研究较少,相关工艺缺乏理论基础。因此,本文作者研究Na2O·Fe2O3对冶炼废渣中典型含铁化合物(赤铁矿和含铁尖晶石)碳热还原过程的影响及机理,以期为进一步优化该还原过程提供理论依据。
1 热力学计算
1.1 含铁矿物碳热还原过程中的主要反应
采用还原焙烧法处理含铁冶炼废渣过程中,其铁矿物(如赤铁矿和铁镁尖晶石)碳热还原的主要反应 如下:
Fe2O3+1.5C=2Fe+1.5CO2(g) (1)
MgO·Fe2O3+1.5C=2Fe+MgO+1.5CO2(g) (2)
在有碳酸钠情况下,还能发生如下反应:
Fe2O3+Na2CO3=Na2O·Fe2O3+CO2(g) (3)
MgO·Fe2O3+Na2CO3=Na2O·Fe2O3+MgO+CO2(g) (4)
Na2O·Fe2O3+1.5C=2Fe+Na2CO3+0.5CO2(g) (5)
1.2 热力学分析
根据热力学计算方法[12],计算得到含铁矿物碳热还原和Na2CO3与其反应生成Na2O·Fe2O3的反应吉布斯自由能与温度之间的关系,其结果如图1所示。
由图1可见,还原体系中铁矿物的碳热还原以及与纯碱形成二元钠盐化合物的反应吉布斯自由能都随着温度的升高而逐渐降低,当温度大于1200 K时,上述反应的吉布斯自由能均为负值,说明在此温度以上,还原反应及含铁矿物与碳酸钠反应生成Na2O·Fe2O3的过程均可以发生。同时注意到,Na2O·Fe2O3被碳还原的初始温度较其他铁矿物(如赤铁矿,铁镁尖晶石)被碳还原的初始温度低,即反应可在更低温度条件下发生。
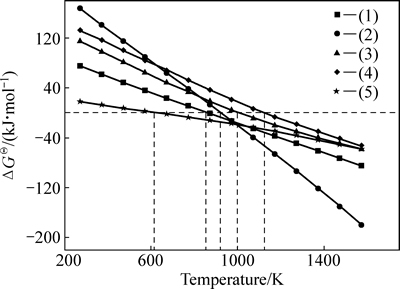
图1 反应(1)~(5)吉布斯自由能与温度的关系
Fig. 1 Relationship between Gibbs free energy and temperature of reactions (1)-(5)
2 实验
2.1 原料与设备
为了排除杂质矿物的影响,所用含铁化合物如赤铁矿(Fe2O3)、铁酸钠(Na2O·Fe2O3)、铁镁尖晶石(MgO·Fe2O3)、铁铬镁尖晶石(MgO(Cr2O3)0.5(Fe2O3)0.5)均为分析纯或实验室合成。还原剂为焦煤,其固定碳含量为79.82%,挥发份为9.62%,灰分为8.34%。试验用含铁化合物合成条件如表1所列,合成矿物物相分析结果如图2所示。
差热-热重实验采用SDTQ600型热分析仪(美国TA公司生产),样品的微观形貌和物相组成则分别借助JSM-6360LV型高低真空扫描电镜(日本株式会社生产)和Rigaku-TTRⅢ型X射线衍射仪(日本株式会社生产,铜靶)进行分析。实验室含铁化合物的制备与还原实验在RHTH120-300型管式气氛炉(德国Nabertherm公司生产)中进行,还原物料的磁选分离在SSC型磁选管(唐山宏达机械厂生产)中进行。
表1 含铁化合物合成条件
Table 1 Synthesis conditions of Iron-containing compounds
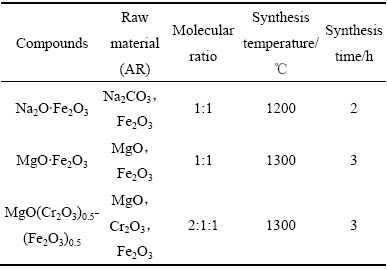
图2 制备含铁化合物物相分析
Fig. 2 XRD patterns of synthesized iron-containing compounds
2.2 实验方法
1) 差热-热重实验
将反应物料按相应配比在混料机上混合均匀,然后加入SDTQ600型热分析仪,采用程序升温控制方式(升温速率为10 ℃/min),从室温缓慢升温至1000 ℃,以流量为100 mL/min的高纯度氩气作为载气。根据热分析仪记录的热重(TG)曲线得到升温过程各物相反应和温度之间的关系。比较混合物料的理论质量损失率和实际质量损失率即可换算得到其反应率。
2) 含铁化合物还原实验
将含铁化合物(氧化铁和含铁尖晶石)、还原剂以及碳酸钠按设定配比在混矿机上混匀,称取一定质量的混合物料放入刚玉坩埚,置于设定好温度的高温管式气氛炉中进行还原焙烧,一定时间后取出坩埚,水淬冷却,物料细磨分析金属化率。称取一定质量经磨细的物料放入磁选管中进行磁选分离,将磁性物质与非磁性物质分别抽滤烘干得到精矿和尾矿,用于成分分析和物相分析。
3 结果与讨论
3.1 Na2O·Fe2O3在赤铁矿物还原过程中的作用
拜耳法高铁赤泥的含铁化合物主要以赤铁矿形态存在,堆存量巨大[13],其铁含量高达30%(质量分数)以上,同时含有6%~8%(质量分数)的Na2O,采用还原焙烧法回收其中的Fe2O3、Al2O3和Na2O是其高效综合利用的重要途径,因而深入研究Na2O·Fe2O3对于此类含铁冶炼废渣的还原影响及机理具有重要的意义。为此,将不同配比的氧化铁(铁酸钠)、碳酸钠和还原剂混合物料进行热重分析,其物料配比和质量变化曲线如图3所示。
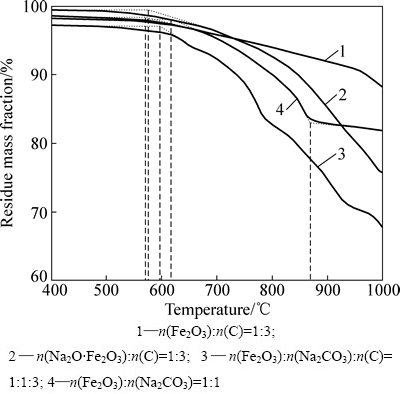
图3 温度对Fe2O3-Na2CO3-C体系还原过程热重曲线的影响(10 ℃/min)
Fig. 3 Effect of temperature on mass loss of Fe2O3-Na2CO3-C system during reduction (10 ℃/min)
由图3可知,在热重分析过程中,Fe2O3和Na2O·Fe2O3碳热还原反应的开始温度分别约为576和573 ℃,如图中曲线1和2所示,另外从质量损失率可以看出,Na2O·Fe2O3比Fe2O3更容易被碳还原。曲线3表明,有Na2CO3存在情况下,碳还原Fe2O3反应开始温度约为598 ℃。Fe2O3与Na2CO3生成Na2O·Fe2O3的反应从620 ℃开始剧烈发生,升温至870 ℃时,反应已基本结束,即Na2O·Fe2O3较易生成(见图3中曲线4)。也就是说在Fe2O3-Na2CO3-C三组分混合体系中,当温度高于620 ℃时,Na2O·Fe2O3的形成、Fe2O3和Na2O·Fe2O3的碳热还原反应将同时进行。
热重分析为非等温条件动力学研究,为了进一步研究中间产物Na2O·Fe2O3对赤铁矿还原过程的影响,在900 ℃条件下,分别将混合物料进行还原焙烧一定时间,取出水淬冷却后测定其还原产物中铁矿物的金属化率,其结果如图4所示。
从图4可以看出,在900 ℃时赤铁矿还原金属化率受反应时间和混合物料组成影响较大。在反应前10 min内,Fe2O3-Na2CO3-C体系与Fe2O3-C体系中铁矿物的金属化率均只在0.25%~2%之间,低于Na2O·Fe2O3-C体系金属化率。在反应10~30 min内,Fe2O3-Na2CO3-C体系反应较快,金属化率从2%迅速达到85%左右,与Na2O·Fe2O3-C体系金属化率接近,而Fe2O3-C体系依旧反应缓慢。结合前文热重分析可认为,在反应初期,当Na2CO3与Fe2O3没来得及反应时,其对Fe2O3-C体系还原过程影响不大,Na2O·Fe2O3较Fe2O3更容易被碳还原;而经一段反应时间后,Fe2O3-Na2CO3-C体系中Na2O·Fe2O3大量生成,使得混合物料中的赤铁矿物得以快速还原。Fe2O3-Na2CO3-C体系和Na2O·Fe2O3-C体系金属化率在反应40 min后较为接近,达到85%~87%左右,而没有添加碳酸钠的Fe2O3-C体系在反应40 min后,金属化率仅为17.7%,铁矿物的还原度远小于Fe2O3-Na2CO3-C体系和Na2O·Fe2O3-C体系中铁矿物还原度。同时,比较图4中曲线2和4可以看出,Na2CO3含量越大,Fe2O3还原反应率越高。
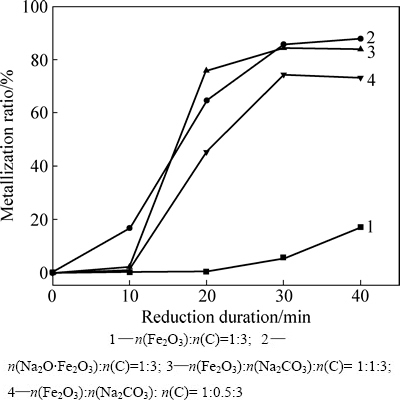
图4 900 ℃时Fe2O3-Na2CO3-C体系还原反应铁矿物的金属化率与还原时间的关系
Fig. 4 Relationship between metallization rate and reduction duration of Fe2O3 at 900 ℃
3.2 Na2O·Fe2O3在含铁尖晶石矿物还原过程中的作用
湿法炼锌厂锌浸出渣和铬盐生产所排放出的铬渣等,铁含量高达25%以上,主要赋存于含铁尖晶石如铁酸锌尖晶石、铁酸镁尖晶石和铁铬酸镁尖晶石中。相关热力学研究表明[14-15],这些含铁尖晶石性质稳定,通常需较高温度才能分解。因此,研究降低此类含铁化合物的还原温度的方法和原理是有意义的。为此,将MgO·Fe2O3和MgO(Cr2O3)0.5(Fe2O3)0.5配入不同比例的碳酸钠及还原剂,进行热重分析,其物料配比和质量变化曲线如图5所示。
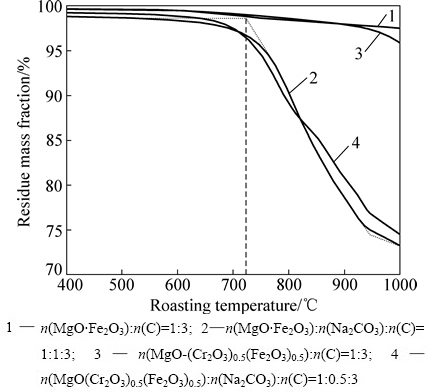
图5 MgO·Fe2O3(MgO(Cr2O3)0.5(Fe2O3)0.5)-Na2CO3-C体系还原过程热重曲线(10 ℃/min)
Fig. 5 Mass loss of MgO·Fe2O3(MgO(Cr2O3)0.5(Fe2O3)0.5)- Na2CO3-C system during reducting (10 ℃/min): 1—n(MgO·Fe2O3)
从图5可知,在无碳酸钠情况下(见图5中曲线1和3),MgO·Fe2O3和MgO(Cr2O3)0.5(Fe2O3)0.5的碳热还原反应过程中物料质量降低缓慢且幅度较小,即此条件下,铁镁尖晶石与铁铬镁尖晶石皆比较稳定,很难被碳还原。而配入碳酸钠组分之后(见图5中曲线2,4),相同实验条件下,当温度达到1000 ℃左右时,MgO·Fe2O3和MgO(Cr2O3)0.5(Fe2O3)0.5对应混合物料质量损失率均增加至25%左右,表明还原反应进行快速。相关研究表明[3],Na2CO3和铁镁尖晶石反应生成Na2O·Fe2O3和MgO的反应起始温度约为726 ℃,当升温至945 ℃左右时已经反应完全,验证了实验体系中,Na2O·Fe2O3的生成与尖晶石的还原将同步发生。根据前文热力学及热重分析可知,反应生成的铁酸钠与混合物料中原有的含铁尖晶石相比,起始还原温度更低且还原速率更快,因此加快了含铁尖晶石的碳热还原反应。
为了进一步研究Na2CO3对于含铁尖晶石类化合物碳热还原过程影响,将图5中不同配比的混合物料于950 ℃进行还原焙烧一定时间后,取出水淬冷却后测定其还原产物中铁矿物的金属化率,其结果如图6所示。
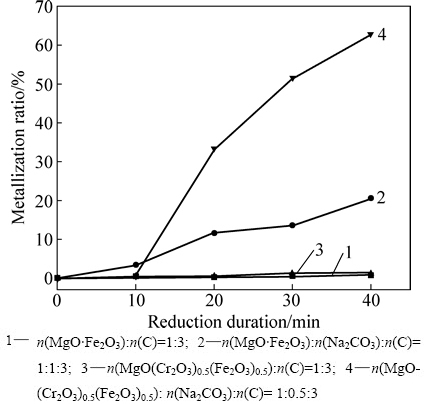
图6 还原时间对含铁尖晶石-碳酸钠-炭反应体系铁矿物的金属化率的影响
Fig. 6 Effect of reduction duration on metallization ratio of MgO·Fe2O3(MgO(Cr2O3)0.5(Fe2O3)0.5)-Na2CO3-C system
由图6可知,含铁尖晶石化合物还原反应铁矿物的金属化率同样受原料组成和反应时间影响。在不添加Na2CO3的反应物料中,铁镁尖晶石、铁铬镁尖晶石基本不与还原剂发生反应,反应40 min后,其金属化率仅为1%左右。而添加Na2CO3后,含铁尖晶石碳热还原的金属化率显著提高,反应40 min后,铁镁尖晶石和铁铬镁尖晶石反应铁矿物的金属化率分别达到20%和62%左右,说明Na2CO3对于降低含铁尖晶石的碳热还原起始温度和加快反应速度具有较大的推动作用。与Na2CO3对赤铁矿碳热还原反应影响类似,在反应开始前10 min,Na2CO3尚未来得及与含铁尖晶石反应,因此对反应金属化率影响不大,10 min后,反应生成的Na2O·Fe2O3一定程度上促进了反应的发生。
3.3 Na2O·Fe2O3对含铁化合物还原产物的影响
虽然上述研究证明了Na2CO3对冶金废渣中典型含铁化合物碳热还原的促进作用缘于Na2O·Fe2O3的形成,但大部分的冶金废渣含铁组分粒度较细,还原产物难以实现有效的矿物分离,因此,有必要进一步研究Na2O·Fe2O3对物料还原产物颗粒形貌的影响。为此以铁酸镁为实验原料,配入一定比例的Na2CO3和煤粉,在1000 ℃下还原焙烧60 min,对其还原所得物料进行背散射扫描电镜分析,其结果如图7所示。

图7 1000 ℃时不同碳酸钠配比条件下铁酸镁还原产物的SEM像
Fig. 7 SEM images of reduction product of MgO·Fe2O3 with different sodium carbonate ratio at 1000 ℃
结合微区成分分析,图7中亮度较高的白色颗粒主要成分为铁,灰黑色小颗粒主要成分为氧化镁。当不添加Na2CO3时,还原物中铁矿物与杂质组分界限不明显,铁组分与杂质组分解离度低,此条件下还原产物难以通过磁选实现含铁组分与杂质元素的分离。随n(Na2CO3)/n(Fe2O3)从0.33提高到0.66,还原产物微观结构发生较明显的变化,金属铁颗粒粒径由2~3 μm长大至15 μm左右,铁晶粒的长大有利于磨矿过程中矿物单体解离度的提高和磁选分离,从而提高精矿品位和回收率。继续提高Na2CO3的加入量,还原产物微观形貌变化不明显,因此,适量的Na2CO3加入反应,有利于铁镁尖晶石的碳热还原,能够促进铁晶粒的长大。另有研究表明[16],在添加其他钠盐如Na2SO4对于高铁赤泥还原焙烧产物中的铁晶粒长大亦有促进作用,其机理同样可能是由于Na2O·Fe2O3的生成,促进了还原反应的进行,进而使铁晶粒更为粗大。
为了研究不同碳酸钠配比对还原产物磁选性能的影响,对上述实验条件下得到的还原物料于弱磁场强度下进行分离,其铁品位和回收率如图8所示。
从图8中可以看出,随着物料中碳酸钠配比从0增加到0.66,磁选精矿中铁品位显著提高,同时尾矿中铁含量下降,铁回收率从74.39%提高到98.47%,即在实验条件下,碳酸钠配比的增加有利于含铁组分和杂质矿物的分离。当碳酸钠配比从0.66继续提高到1时,精矿产率增加,但其中铁品位略有下降,尾矿中铁含量增多,回收率变化不大。这可能是由于随碳酸钠配比的提高,导致物料熔点降低,液相量增加,还原产物收缩度加大,各组分嵌布更加紧密。在相同磨矿条件下,磁性物质与非磁性物质解离度降低,进而影响铁和杂质元素的分离效果,同时,高碱配比可能使精矿中的含量升高,对后续高炉冶炼造成危害。在还原温度为1000 ℃、时间为60 min条件下,碳酸钠配比n(Na2CO3)/n(Fe2O3)=0.66为宜,此时精矿中全铁品位为94.7%,全铁回收率为98.47%。
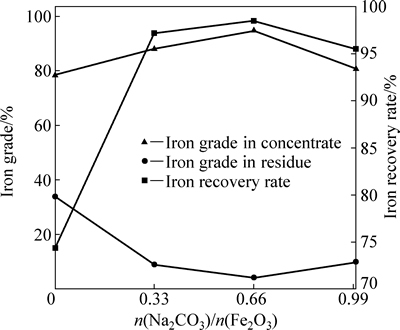
图8 碳酸钠配比对铁酸镁还原产物磁选分离的影响
Fig. 8 Effect of sodium carbonate ratio on iron recovery rate and iron grade
4 结论
1) 在Fe2O3-Na2CO3-C还原体系中,Fe2O3易与Na2CO3反应生成Na2O·Fe2O3,Na2O·Fe2O3相对于Fe2O3更容易被碳还原,从而加速还原反应的进行。
2) MgO·Fe2O3和MgO(Cr2O3)0.5(Fe2O3)0.5性质稳定且不易被碳还原,配入Na2CO3可以与含铁尖晶石类化合物反应生成Na2O·Fe2O3,降低含铁尖晶石类矿物的C还原温度,加快反应速度。
3) Na2O·Fe2O3可以强化含铁矿物还原,促进还原物料中铁晶粒的长大,有利于铁矿物的磁选分离回收。
REFERENCES
[1] 黄希祜. 钢铁冶金原理[M]. 北京: 冶金工业出版社, 2004: 282-308.
HUANG Xi-hu. Iron and steel metallurgy principles[M]. Beijing: Metallurgical Industry Press, 2004: 282-308.
[2] LI Xiao-bin, XIAO Wei, LIU Wei, LIU Gui-hua, PENG Zhi-hong, ZHOU Qiu-sheng. Recovery of alumina and ferric oxide from Bayer red mud rich in iron by reduction sintering[J]. Transactions of Nonferrous Metals Society of China, 2009, 19(5): 1342-1347.
[3] 齐天贵. 铬铁矿强氧化焙烧理论与技术研究[D]. 长沙: 中南大学, 2011: 121-136.
QI Tian-gui. Theory and technology for intensified oxidative roasting of chromite ore[D]. Changsha: Central South University, 2011: 121-136.
[4] 王纪明, 彭 兵, 柴立元, 李 密, 彭 宁. 锌浸渣还原焙烧-磁选回收铁[J]. 中国有色金属学报, 2012, 22(5): 1455-1461.
WANG Ji-ming, PENG Bing, CHAI Li-yuan, LI Mi, PENG Ning. Recovery iron from zinc leaching residues by reduction roasting and magnetic separation process[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(5): 1455-1461.
[5] 杨慧芳, 景丽丽, 常春阁. 铜渣中铁组分的直接还原与磁选回收[J]. 中国有色金属学报, 2011, 21(5): 1165-1170.
YANG Hui-fang, JING Li-li, CHANG Chun-ge. Iron recovery from copper-slag with lignite-based direct reduction followed by magnetic separation[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(5): 1165-1170.
[6] 郭培民, 赵 沛, 张殿伟. 低温下碳还原氧化铁的催化机理研究[J]. 钢铁钒钛, 2006, 27(4): 1-5.
GUO Pei-min, ZHAO Pei, ZHANG Dian-wei. Study on catalytic mechanism of reducing hematite by carbon at low temperature[J]. Iron Steel Vanadium Titanium, 2006, 27(4): 1-5.
[7] 黄柱成, 蔡凌波, 张元波, 杨永斌, 姜 涛. Na2CO3和CaF2强化赤泥铁氧化物还原研究[J]. 中南大学学报:自然科学版, 2010, 41(3): 838-844.
HUANG Zhu-cheng, CAI Ling-bo, ZHANG Yuan-bo, YANG Yong-bin, JIANG Tao. Reduction of iron oxides of red mud reinforced by Na2CO3 and CaF2[J]. Journal of Central South University: Science and Technology, 2010, 41(3): 838-844.
[8] 梅贤功, 袁明亮, 左文亮. 高铁赤泥煤基直接还原中铁晶粒成核及晶核长大特性[J]. 中南工业大学学报:自然科学版, 1994, 25(6): 696-700.
MEI Xian-gong, YUAN Ming-liang, ZUO Wen-liang. Studies on the nucleation and grain growth characteristics of metallic phase in direct reduction of high-iron red mud with coal base[J]. Journal of Central South University of Technology: Natural Science, 1994, 25(6): 696-670.
[9] 梅贤功, 袁明亮, 陈 苕. 论残钠在高铁赤泥煤基直接还原过程中之作用[J]. 轻金属, 1995(4): 20-22.
MEI Xian-gong, YUAN Ming-liang, CHEN Shao. Influence of remainder natrium in direct reduction of high-iron content with coal based[J]. Light Metals, 1995(4): 20-22.
[10] 姜 涛, 刘牡丹, 李光辉, 孙 娜, 曾精华, 邱冠周. 钠化还原法处理高铝高铝褐铁矿新工艺[J]. 中国有色金属学报, 2010, 20(3): 565-571.
JIANG Tao, LIU Mu-dan, LI Guang-hui, SUN Na, ZENG Jing-hua, QIU Guan-zhou. Novel process for treatment of high-aluminum limonite ore by reduction roasting with addition of sodium salts[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(3): 565-571.
[11] 李光辉, 饶明军, 姜 涛, 史唐明, 黄晴晴. 红土镍矿钠盐还原焙烧-磁选的机理[J]. 中国有色金属学报, 2012, 22(1): 274-280.
LI Guang-hui, RAO Ming-jun, JIANG Tao, SHI Tang-ming, HUANG Qing-qing. Reduction roasting magnetic separation mechanisms of nickelferous laterite ore in presence of sodium salts[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(1): 274-280.
[12] VAN WYLEN G J, SONNTAG R E, WYLEN G J. Fundamentals of classical thermodynamics[M]. New York: John Wiley and Sons Incorporation, 1973: 561-617.
[13] POWER G, GR FE M, KLAUBER C. Bauxite residue issues: I. Current management, disposal and storage practices[J]. Hydrometallurgy, 2011, 108(1): 33-45.
FE M, KLAUBER C. Bauxite residue issues: I. Current management, disposal and storage practices[J]. Hydrometallurgy, 2011, 108(1): 33-45.
[14] ANTONY M P, JHA A, TATHAVADKAR V. Alkali roasting of Indian chromite ores: thermodynamic and kinetic considerations[J]. Mineral Processing and Extractive Metallurgy, 2006, 115(2): 71-79.
[15] TATHAVAKAR V D, ANTONY M P, JHA A. The physical chemistry of thermal decomposition of South African chromite minerals[J]. Metallurgical and Materials Transactions B, 2005, 36(1): 75-84.
[16] 庄锦强. 高铁氧化铝赤泥中铁的回收技术研究[D]. 长沙: 中南大学, 2012: 33-43.
ZHUANG Jin-qiang. Study on the technology of iron recovery from high iron content alumina red mud[D]. Changsha: Central South University, 2012: 33-43.
Effect of sodium ferrite (Ⅲ) on iron grain formation in carbothermal reduction of iron minerals
LI Xiao-bin1, 2, WANG Yi-lin1, 2, ZHOU Qiu-sheng1, 2, PENG Zhi-hong1, 2, LIU Gui-hua1, 2, QI Tian-gui1, 2
(1. School of Metallurgy and Environment, Central South University, Changsha 410083, China;
2. National Engineering Laboratory for Efficient Utilization of Refractory Non-ferrous Metals Resources,
Central South University, Changsha 410083, China)
Abstract: The effects of Na2O·Fe2O3 in the Fe2O3/MgFe2O4-Na2CO3-C were identified by thermodynamic calculation, kinetic research and microscopic morphology analyses of reduction products. The results show that Na2O·Fe2O3 readily reduced by carbon is rapidly formed by the reaction of Fe2O3 (or MgFe2O4) and Na2CO3, resulting in the decrease of the initial reduction reaction temperature of Fe2O3/MgFe2O4-Na2CO3-C system and the acceleration of the reduction reaction. Na2O·Fe2O3 can also promotes the growth of iron grains during the reduction process, and thus is in favor of the magnetic separation of the reduction products.
Key words: metallurgical residues; sodium carbonate; reduction roasting; sodium ferrite (Ⅲ)
Foundation item: Project (51374239) supported by the National Natural Science Foundation of China; Project (2015CX001) supported by the Innovation-driven Plan of Central South University, China
Received date: 2015-05-19; Accepted date: 2015-09-18
Corresponding author: QI Tian-gui; Tel: +86-731-88830453; E-mail: qitiangui@csu.edu.cn
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(51374239);中南大学“创新驱动计划”(2015CX001)
收稿日期:2015-05-19;修订日期:2015-09-18
通信作者:齐天贵,讲师,博士;电话:0731-88877830;E-mail:qitiangui@csu.edu.cn