稀有金属 2013,37(02),295-301+8
硫酸介质中载金黄铁矿的氧化动力学
衷水平 吴智 黄中省 阮仁满
低品位难处理黄金资源综合利用国家重点实验室紫金矿业集团股份有限公司
中国科学院过程工程研究所
摘 要:
利用自制反应器研究了黄铁矿的化学氧化溶解动力学过程,对氧化产物进行分析。结果显示:在温度为45~90℃内,黄铁矿的活化能为37.00 kJ·mol-1,结合黄铁矿的浸出率不受搅拌速度影响,认为黄铁矿的浸出过程受化学控制;溶液中Fe3+浓度与酸度影响黄铁矿的浸出;S物相分析与EDS图谱结果显示黄铁矿中的硫经过一系列中间形态,最终氧化成SO24-,并且有部分单质硫生成。由于S2O23-为中间关键的转化步骤,结合XPS图谱分析,认为S2O23-为中间过程的氧化机制。
关键词:
黄铁矿;氧化动力学;活化能;反应机制;
中图分类号: O643.1
作者简介:衷水平(1977-),男,江西赣州人,博士,高级工程师;研究方向:湿法冶金,生物冶金及电极材料;吴智(E-mail:mikewuzhi@163.com);
收稿日期:2012-11-14
基金:国家科技部重点基础研究发展计划项目(2010(B)735501);福建省杰出青年基金项目(2011J0628)资助;
Oxidation Kinetics Reaction of Gold-Bearing Pyrite in Sulphuric Acid
Abstract:
Oxidation of pyrite in ferric sulfate solutions was studied using short-term batch experiments.The studies included analyses of sulfite,thiosulfate,polythionates and sulfate.The results of pyrite oxidation showed that the leaching rate of pyrite linearly increased with temperature increase,an apparent activation energy for pyrite oxidation was 37.00 kJ·mol-1(45-90 ℃).The magnitude of the activation energy and the speed with no effect suggested that the process of pyrite dissolution was controlled by reaction,and not by diffusion;leaching rates was dependent on initial concentration of ferric iron and the acidity;from analyses of phase,EDS and XPS,it was proposed that the formation of S2 O2-3 in the intermediate stage was a crucial step for sulphide oxidation to eventually oxidize to sulphate and elemental sulphur during the oxidation process.
Keyword:
pyrite;oxidation kinetics;activation energy;reaction mechanism;
Received: 2012-11-14
黄铁矿是自然界最常见的硫化矿物之一,几乎与所有的金属硫化矿伴生。同时,它又是许多稀贵金属如金、银、铂族金属的载体矿物[1,2,3]。随着经济的发展,对矿产资源的开发利用越来越多,资源日趋贫乏,易选冶的金矿资源日趋减少,难处理矿石已经成为黄金工业的主要资源。由于金被毒砂或黄铁矿等伴生矿物包裹从而不能用传统工艺直接提取,人们不得不考虑采用新方法开发低品位、难处理矿产资源。
细菌氧化是从预处理的精矿中进行金浸出的有效方法,使金暴露在下一步的浸出中[4]。难处理金矿的微生物浸出由于其成本低、污染小、工艺流程短、资源利用广等优点,越来越受到研究者的关注。研究黄铁矿微生物浸出过程的溶解对低品位矿石中有价金属的回收及难处理复杂硫化矿的生物预氧化有重要意义[5,6,7]。根据最新研究报道,细菌浸出过程中,通过Fe3+和(或)质子在晶格表面的作用实现黄铁矿的氧化,而Fe3+通过细菌分泌物EPS再生循环,在这一过程中,Fe3+是黄铁矿分解唯一的氧化剂[8]。
国内外有关黄铁矿浸出的报道很多,对微生物浸出黄铁矿的动力学、浸出机制等进行了一些有益的探索。有关黄铁矿浸出的研究主要侧重点在环境保护和微生物浸出中细菌的多样性。而对细菌浸出黄铁矿过程中的化学浸出动力学的研究甚少,尤其是针对载金黄铁矿的浸出。本文开展了硫酸铁溶液中载金黄铁矿的浸出动力学与机制研究,找出影响黄铁矿氧化的主要影响因素及控制环节,从本质上找到特定环境因素下提高黄铁矿氧化能力的途径。
1 实验
1.1 实验原料
实验所用高纯黄铁矿由贵州水银洞矿区金精矿经过重选及后续处理得到,工艺流程如图1所示。
将上述工艺流程得到的高纯黄铁矿密封保存。选取(150~250μm)粒级黄铁矿进行实验。
1.2 实验方法
实验在自制的反应器中进行,用1000 ml三口烧瓶作为浸出容器,并在烧瓶中放置搅拌桨,温度波动范围±0.5℃。数显电动搅拌机控制搅拌速度。实验开始时将配好的硫酸铁溶液加入到烧瓶并搅拌,待温度达到预定值后再加入黄铁矿,到反应结束时进行固液分离,滤渣低温干燥后密封保存,为保证过程中反应物活度近似不变,将所有实验的液固质量比定为100∶1。
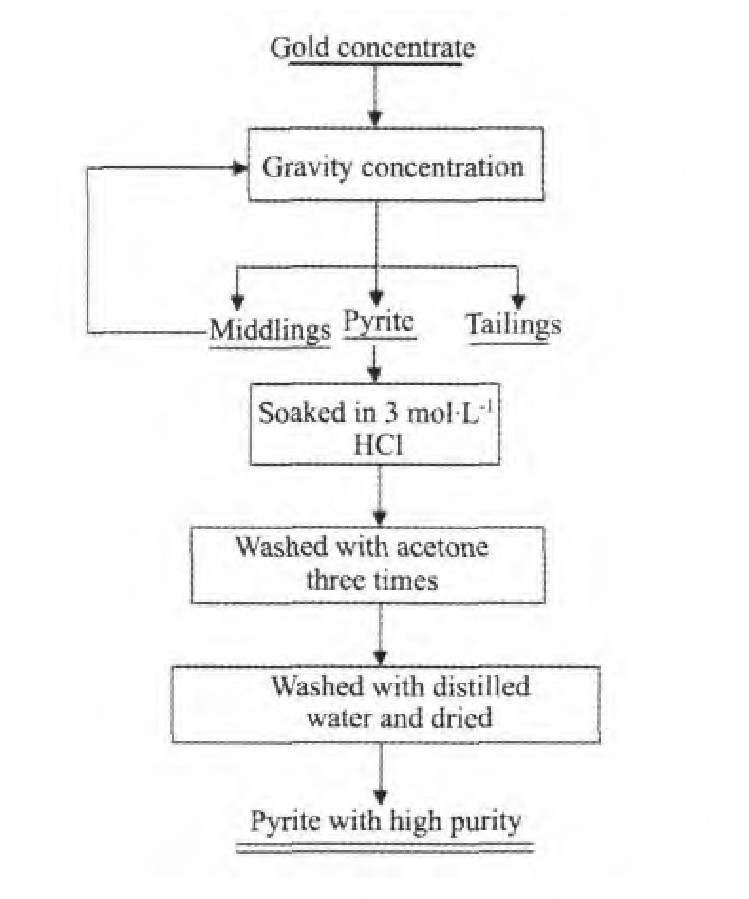
图1 黄铁矿提纯工艺流程图Fig.1 Process flow for preparing pyrite
2 结果与讨论
2.1 黄铁矿样的物相与形貌分析
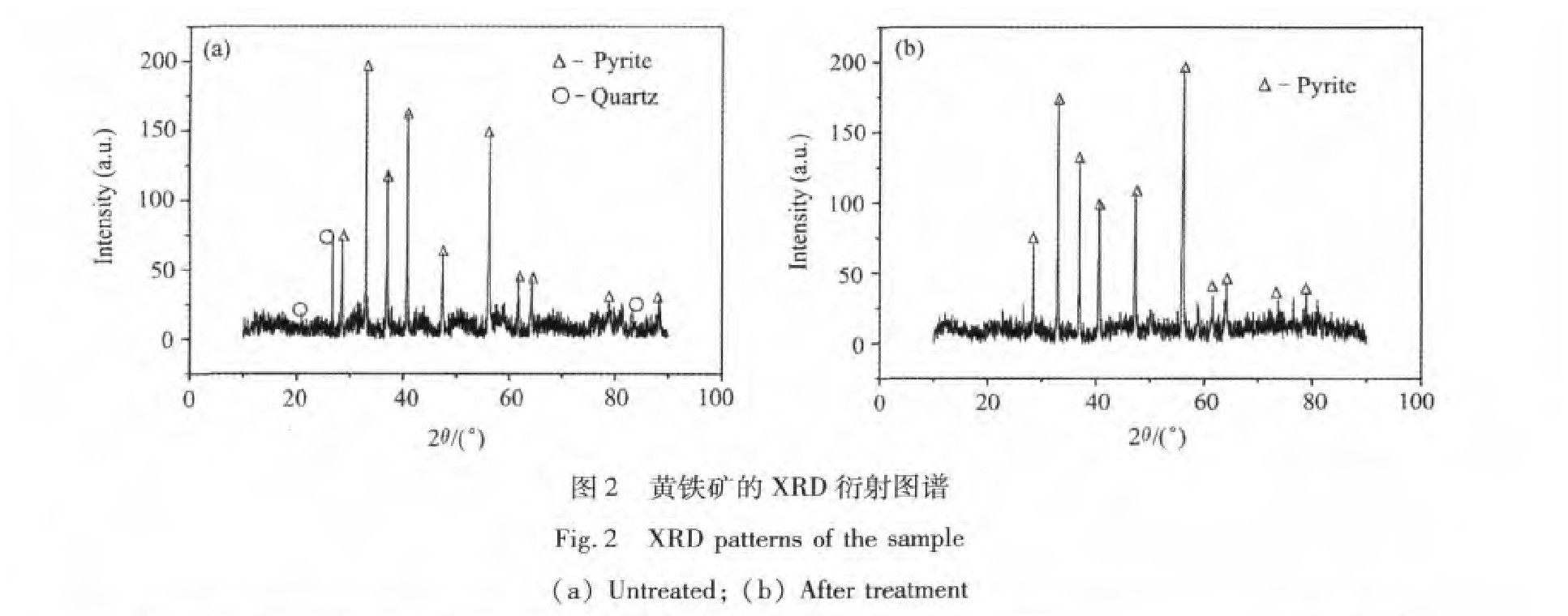
采用D/max-ⅢA全自动X射线粉末分析仪(辐射条件为Cu靶,Kα射线,扫描范围(2θ)10°~90°,扫描速度为8(°)·min-1,扫描步长为0.004°)对处理前后的黄铁矿样品的物相成分进行分析,其X射线衍射图如图2所示。由图可知,相对处理前的样品,经过一系列处理后的黄铁矿检测不到石英峰。
图3为处理前后的SEM图,对比可知经过处理的黄铁矿形状规整,粒度分布均匀,黄铁矿表面基本上不存在细小的微粒。
2.2 活化能计算
活化能是表征某一反应历程速率特征的重要参量,其大小在某种程度上体现了反应速率的控制机制。可将温度以外的其他参数保持为常数,在仅改变温度的情况下,由Arrhenius公式求得,即:

A为频率因子;k为反应速率常数;E为表观活化能;T为反应温度。

对公式(1)两边取对数则有,

活化能求解是将不同温度下矿物浸出分数曲线中数据按1-(1-R)1/3对t进行拟合作图(R为矿物的浸出分数)。由于这些不同研究条件下的实验点都成直线关系,而且这些线都通过原点,符合表面化学控制方程式,各直线的斜率就是相应条件下的综合速率常数k'。根据公式(2),将不同温度下的综合速率常数k'的自然对数对温度的倒数作图可以得到浸出反应的Arrhenius图。Arrhenius图的斜率即-E/R,经过计算可以得到浸出反应的活化能E[9]。
图4为黄铁矿在30 g·L-1Fe3+溶液下不同温度时的浸出率图,图中可知,温度对黄铁矿的浸出率影响较大,温度越高浸出速率越快,且这一趋势在45~90℃反映很明显。将黄铁矿的浸出率图按照上述方法处理得到黄铁矿溶解的Arrhenius曲线图,图中直线斜率为-E/R,从而计算出黄铁矿在45~90℃范围浸出的活化能为37.00 k J·mol-1。图5显示在大于400 r·min-1的情况下,搅拌速度对黄铁矿的浸出几乎无影响。Long等[10]的研究结果也证实这一点,搅拌速度超过800 r·min-1时,对黄铁矿的浸出几乎没有影响。
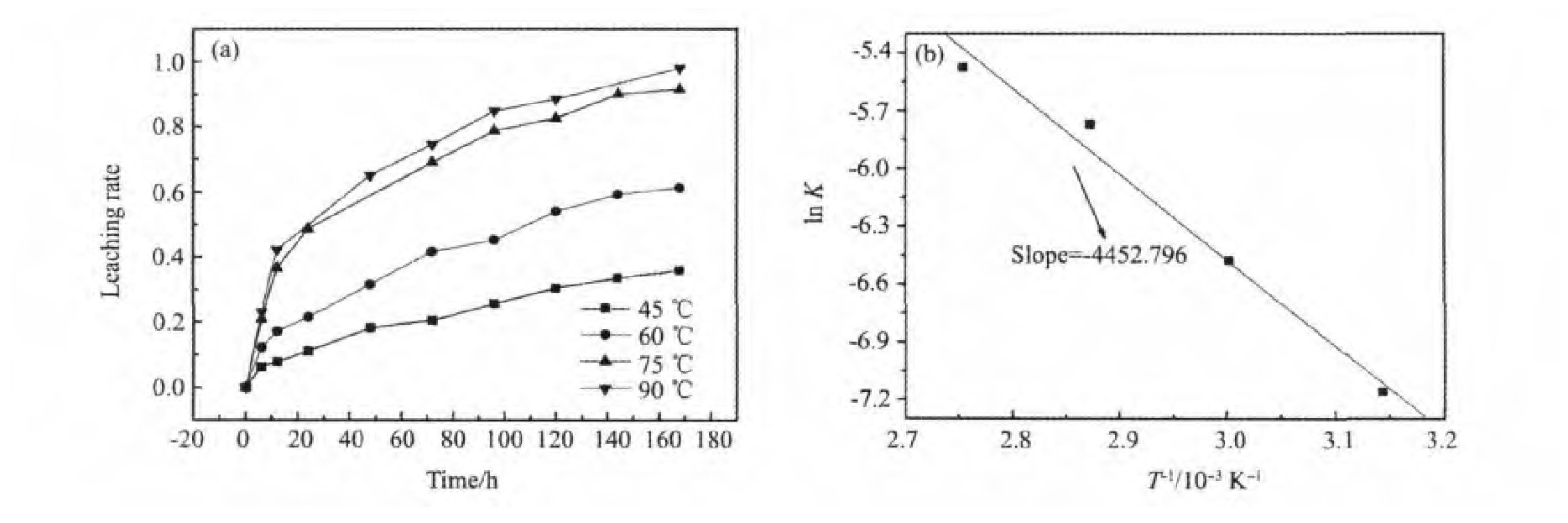
图4 温度对黄铁矿浸出率的影响(a)及黄铁矿溶解的Arrhenius曲线图(b)Fig.4 Leaching rate(a)and the-E/R(b)of pyrite(Eh=725 m V,p H=1.0,S=400 r·min-1)
前人的研究较多使用Fe3+作为氧化剂开展黄铁矿浸出实验,通过计算黄铁矿的活化能(33~92k J·mol-1)[11,12,13]展开对黄铁矿的溶解机制控制讨论。Nicholson等[12]在中性条件下获得了88k J·mol-1的活化能,认为过程是化学控制而不是物理吸附控制。Antonijevic等[13]用电化学技术研究了总反应的动力学过程,通过测量在不同情况下黄铁矿的腐蚀电位,证实了产物硫酸根中的氧来自水,以上结论都是电化学控制机制的直接证据。化学反应机制和电化学反应机制有着本质的不同。对于化学反应来说,反应物碰撞直接生成产物,而在电化学反应中,反应物不直接碰撞而是通过电子传导,例如在矿物的表面。在化学反应中反应物直接碰撞生成产物并且伴随着热量的产生,而在电化学反应中没有能量交换。然而Bockris等[14]认为,在固液反应界面,电化学反应伴随着化学反应的发生,例如在溶液浸出中。多相反应(化学和电化学)上涉及到一个催化(电化学反应中的电化学催化)界面,从反应物运输吸附到界面上,吸附物质之间的反应(对电化学来说是电荷转移),最后是产物的生成。
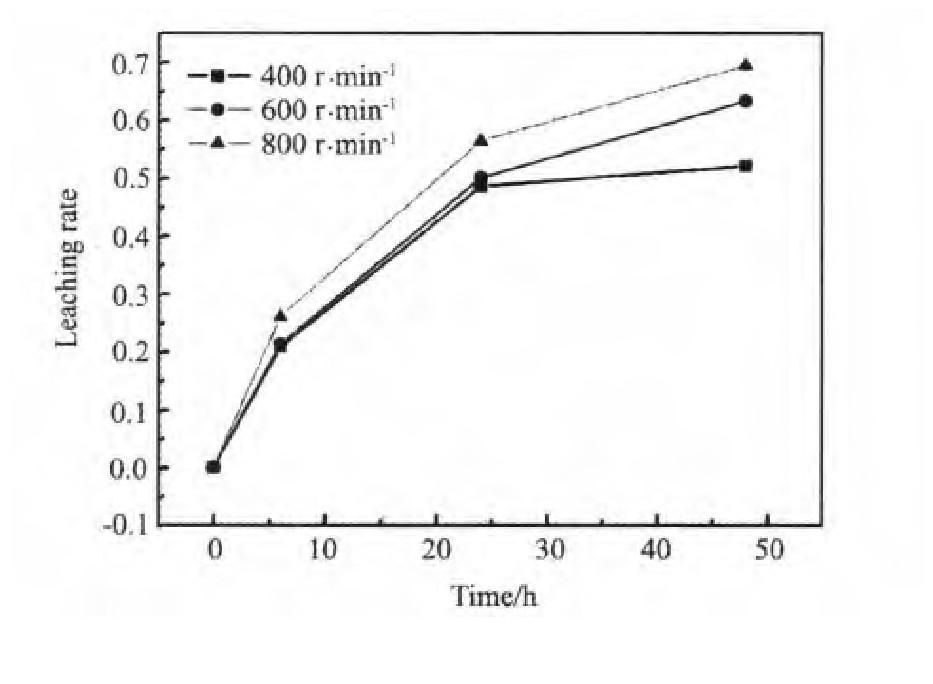
图5 搅拌速度对黄铁矿浸出率的影响Fig.5 Leaching rate of pyrite(T=75℃,Eh=725 m V,p H=1.0)
在本实验研究中,Fe3+浸出黄铁矿的活化能为37.00 k J·mol-1,加上搅拌速度对浸出无影响,因此溶液中黄铁矿的浸出由化学反应控制,而不是吸附。对于相应的电化学反应机制,有待于电化学实验的进一步开展而深入。
2.3 氧化剂的影响
在矿物的浸出体系中,溶液氧化还原电位(Eh值)、p H值、氧化剂的种类与浓度、矿物粒径与比表面积、温度、压力都是浸出的影响因素。Eh值是其中关键的因素。图6为黄铁矿在不同Fe3+溶液下的浸出图,由图6可知,Fe3+浓度对黄铁矿的浸出率影响较为明显,在8.0~39.62 g·L-1之间的反应级数为0.35699,当Fe3+浓度进一步提高,其反应级数为2.2185(39.62~46.4 g·L-1),表明高浓度Fe3+对黄铁矿的浸出影响更为明显,这与图6(a)是一致的。
从图7可看出溶液酸度对黄铁矿的浸出几乎没有影响。这一点与Garrels等(p H=0~2)[15]的研究结果相一致。溶液中的Eh值是通过Fe3+在溶液浸出黄铁矿中起关键的作用,这在一个侧面反应出了电化学反应的机制。Eh与溶液中Fe3+与Fe2+通过能斯特方程相关联,
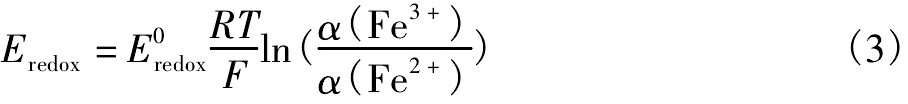
其中α(Fe3+)为Fe3+离子活度,α(Fe2+)为Fe2+离子活度。
更早的研究对黄铁矿浸出的过程控制存在着争议,Garrels等[15]认为,浸出速率由黄铁矿表面的Fe3+与Fe2+所决定,而Singer等[16]认为在一个循环过程中,浸出速率由Fe2+氧化成Fe3+的速率所决定,这两种认识代表了现阶段研究人员的观点,Garrels等在硫酸铁溶液中(T=33℃)下开展实验,Fe3+浓度通过高锰酸钾滴定,Fe2+与Fe3+有如下关系
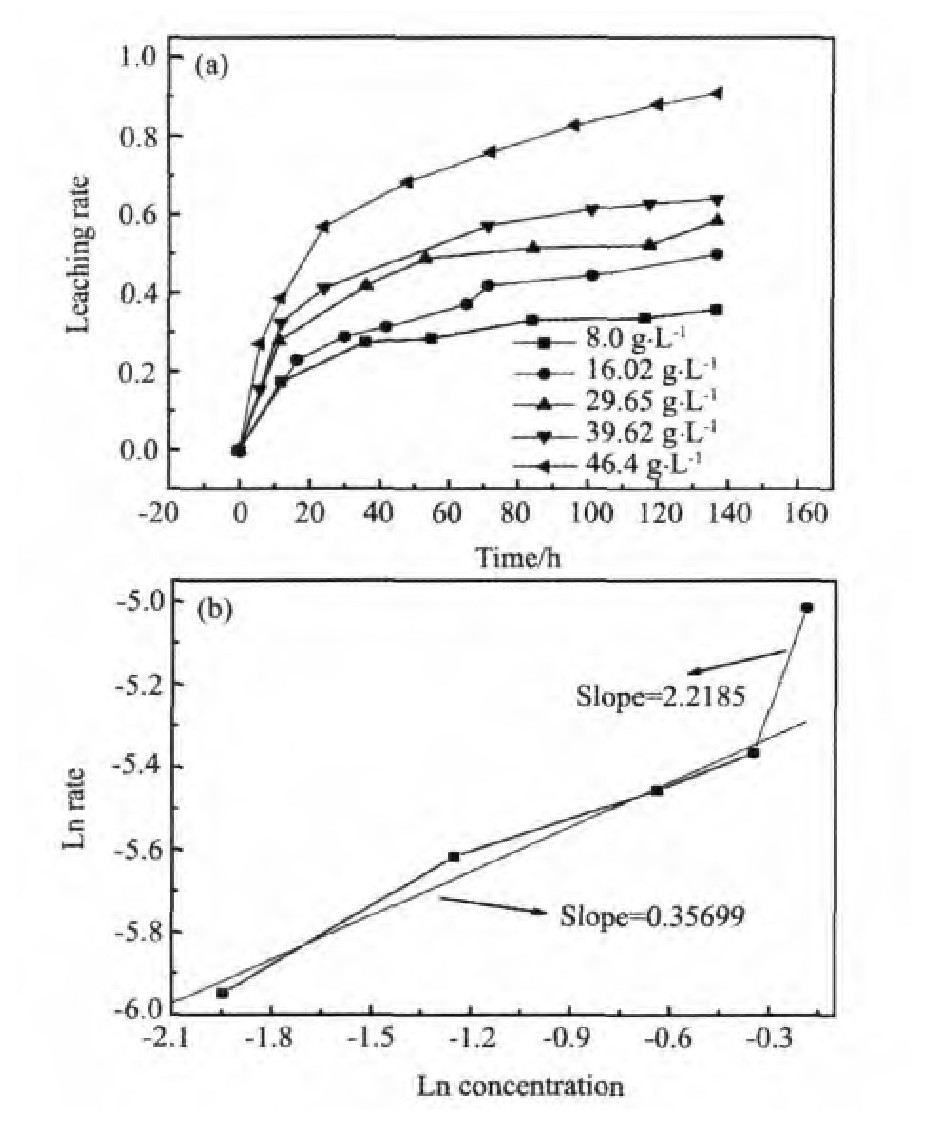
图6 Fe3+对黄铁矿浸出率的影响(a)及黄铁矿溶解的Ar-rhenius曲线图(b)Fig.6 Leaching rate(a)and the reaction order(b)of pyrite(T=75℃,Eh=725 m V,p H=1.0,S=400 r·min-1)
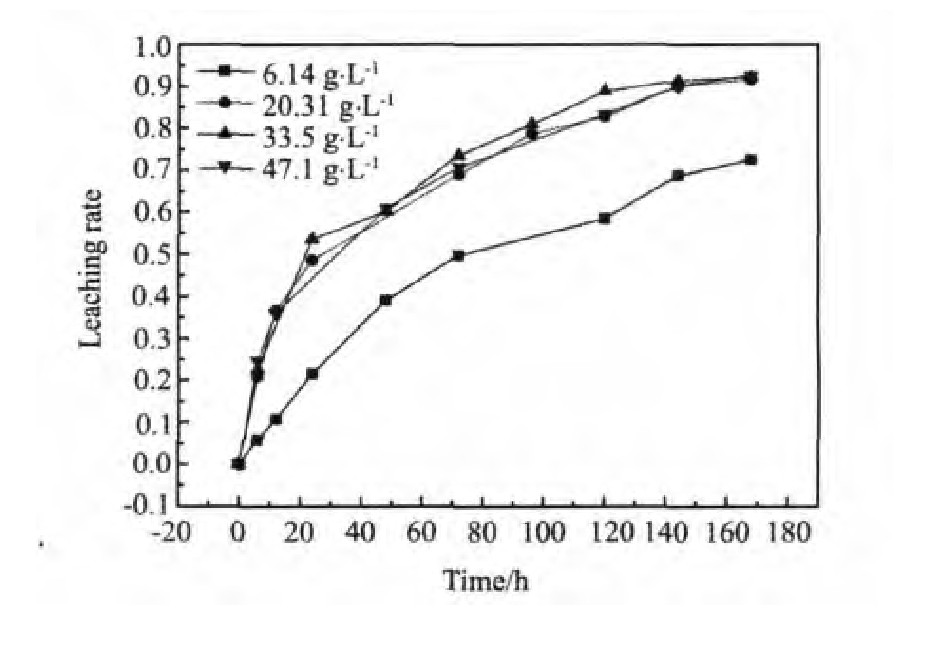
图7 酸度对黄铁矿浸出率的影响Fig.7 Leaching rate of the pyrite(T=75℃,Eh=725 m V,p H=1.0,S=400 r·min-1)
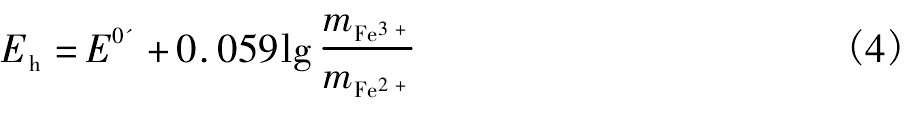
2.4 黄铁矿的浸出机制研究
根据最新研究报道,微生物浸出过程中,细菌并不直接氧化黄铁矿,而是通过Fe3+和(或)质子在晶格表面的作用实现金属硫化物的氧化,Fe3+通过细菌分泌物EPS再生循环。对于Fe3+氧化黄铁矿的方式有着不同的解释。Luther认为,在低p H下,Fe3+通过6键与黄铁矿表面键合,所形成的化学键有利于电子从黄铁矿中的硫转移到Fe3+。另外,根据价键理论,电子并非直接从硫的价带,而是从黄铁矿与铁离子所形成的t2g轨道转移到Fe3+。
在本研究中,针对本实验中所使用载金黄铁矿的特点,采集不同地区酸性矿坑水、生物堆浸厂、温泉等不同生态环境下含菌液体样品和固体样品。对采集的样品进行富集培养、功能初筛、驯化培养。采用荧光定量PCR鉴定系统进行菌群鉴定。结果显示,生物氧化体系中以嗜酸硫杆菌Acidithiobacillus、钩端螺旋菌Leptospirillum为主,Sulfobacillus、古菌Ferroplasma次之,浸出实验在酸性介质中进行是为了避免铁沉淀的影响。图8和表1为EDS测试结果,对比浸出前后谱图与数据,经过硫酸铁浸出的黄铁矿表面有一层类似膜的物质存在,这层膜为S单质或者是S22-氧化的中间产物,此点已经被前人实验所证实。
另外,S物相分析显示S22-能产生单质硫与硫酸根。这与XPS图谱的分析是一致的,但是没有检测到其他价态的S,可能的原因在于中间产物的不稳定或与仪器检测限有关。
至今,对于黄铁矿细菌氧化更深层次的机理尚不清楚,但基本认为黄铁矿的氧化溶解是通过氧化剂Fe3+的作用。即使对于p H中性环境,黄铁矿氧化过程中,相对分子氧,Fe3+更易得电子而成为氧化剂。在p H中性体系下,Fe2+仍会吸附于黄铁矿表面,并被溶解的分子氧氧化为Fe3+。可见,由于动力学参数及分子轨道特性,在低或者甚至较高p H下,Fe3+是黄铁矿氧化的决定性氧化剂。Sasaki等[17]在Fe Cl3溶液(p H=2)介质中观察到S膜层在黄铁矿的表面,Luther等进一步认为黄铁矿表面这层硫膜不是直接的氧化产物,而是来自S2O32-的分解,其分解如下所示
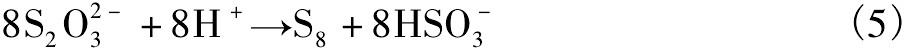
黄铁矿在溶液中的浸出产物除了SO42-和Fe2+离子外,还有其他产物,如单质硫、多硫化合物、硫化氢、氢氧化铁、氧化铁、氢氧化铁等。中间产物如硫代硫酸盐、亚硫酸盐、连多硫酸盐等。
表1 EDS能谱分析结果Table 1 EDS results of particles 下载原图
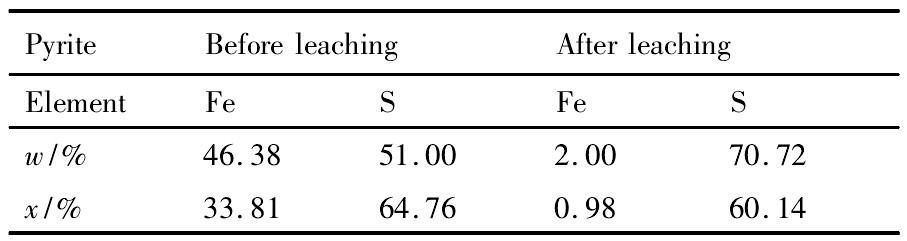
表1 EDS能谱分析结果Table 1 EDS results of particles
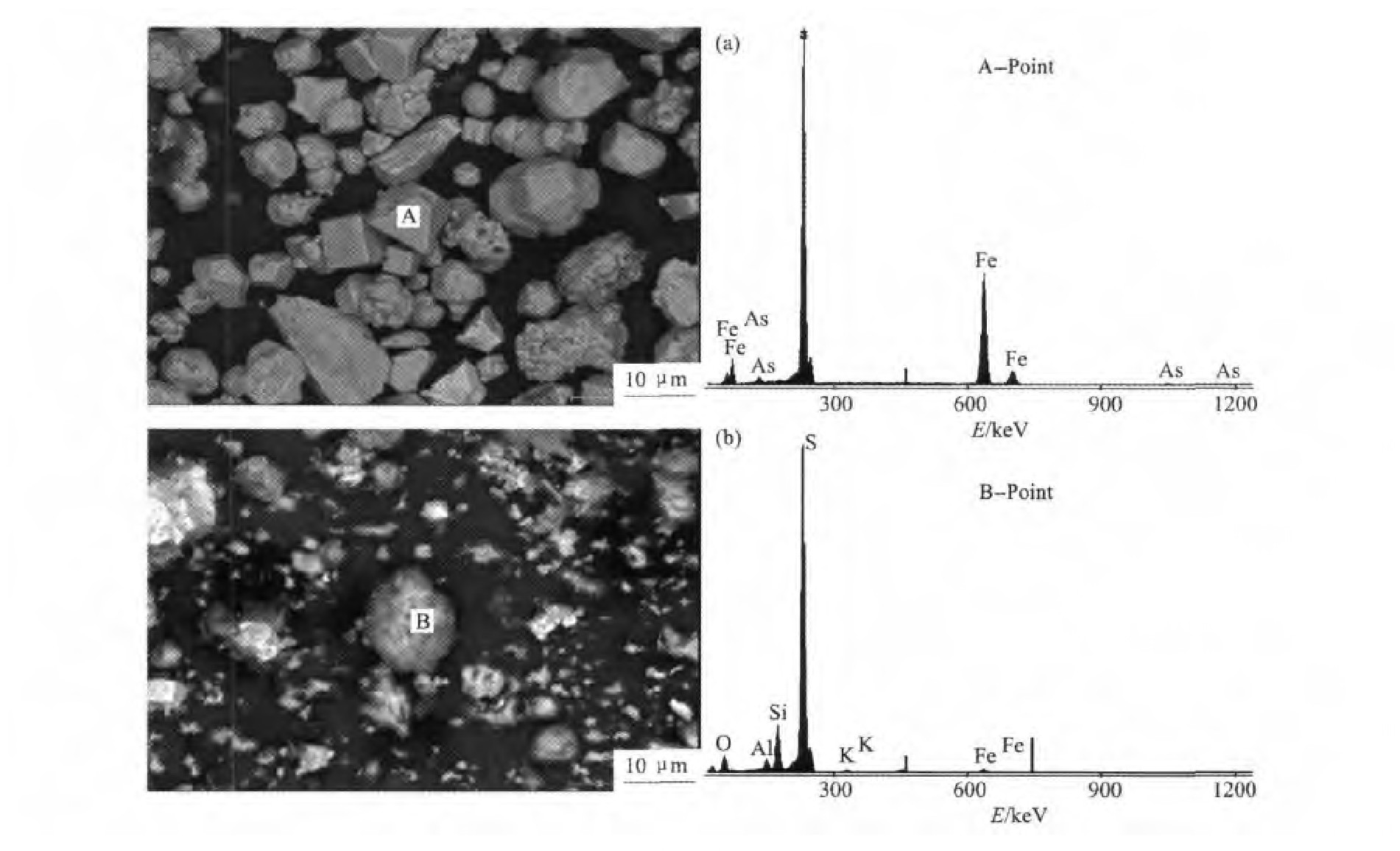
图8 黄铁矿的EDS图谱Fig.8 EDS patterns of pyrite
(a)Before leaching;(b)After leaching
3 结论
1.在Fe3+浓度为30 g·L-1(Eh=725 m V,p H=1.0,T=45~90℃,S=400 r·min-1)下黄铁矿的表观活化能为37.00 k J·mol-1,这种级别的活化能加上搅拌速度对黄铁矿的浸出无明显影响,表明黄铁矿的浸出由化学反应控制而不是物理吸附控制。
2.研究结果显示,Eh值在载金黄铁矿的硫酸铁溶液浸出中起关键作用,涉及到溶液中Fe3+与Fe2+的比例,在Fe3+浓度为30 g·L-1(T=75℃,Eh=725 m V,p H=1.0,S=400 r·min-1)条件下,酸度对黄铁矿的浸出几乎没有影响。
3.S物相分析结果显示,黄铁矿中S22-能生成单质硫和SO42-,结合EDS与XPS分析及在前人研究的基础上,认为S2O32-为中间过程的氧化机制。
参考文献
[1] Chandra A P,Gerson A R.The mechanisms of pyriteoxidation and leaching:a fundamental perspective[J].Surface Science Reports,2010,65(9):293.
[2] Gu G H,Su L J,Chen M L,Sun X J,Zhou H B.Bio-leaching effects of leptospirillum ferriphilum on thesurface chemical properties of pyrite[J].Mining Sci-ence and Technology,2010,20(2):286.
[3] Wu B,Ruan R M,Wen J K,Zhou G Y.Electrochem-ical oxidative behavior of pyrite during ore bioleaching[J].Metal Mine,2007,376:64.(武彪,阮仁满,温建康,周桂英.黄铁矿在生物浸矿过程中的电化学氧化行为[J].金属矿山,2007,376:64.)
[4] Ke J J.Present situation and problems of refractorygold ores[J].Gold Science and Technology,1998,6(1):32.(柯家骏.难浸金矿氰化提金的现状与问题[J].黄金科学技术,1998,6(1):32.)
[5] Boon M,Heijnen J J.Chemical oxidation kinetics ofpyrite in bioleaching processes[J].Hydrometallurgy,1998,48:27.
[6] Li H X,Wang D Z.Review of investigation on micro-organism behaviors in ore bio-leaching[J].NonferrousMetals,2003,55(2):58.(李宏煦,王淀佐.生物冶金中的微生物及其作用[J].有色金属,2003,55(2):58.)
[7] Descostes M,Vitorge P,Beaucaire C.Pyrite dissolu-tion in acidic media[J].Geochimica et CosmochimicaActa,2004,68(22):4559.
[8] Gu G H,Sun X J,Li J H,Su L J,Liu Y L,Zhao K L.Bioleaching of pyrite by L.ferriphilum[J].Journal ofCentral South University,2010,41(4):1223.(顾帼华,孙小俊,李建华,苏丽君,刘玉林,赵开乐.嗜铁钩端螺旋菌对黄铁矿浸出的影响[J].中南大学学报,2010,41(4):1223.)
[9] Li H G.The Principle of Metallurgy[M].Beijing:Science Press,2005.308.(李洪桂.冶金原理[M].北京:科学出版社,2005.308.)
[10] Long H,Dixon D G.Pressure oxidation of pyrite insulfuric acid media:a kinetic study[J].Hydrometallur-gy,2004,73:335.
[11] Zheng L Y,Yu S M,Liu B,Chen L,Huang L L.Ki-netics of leaching vanadium with alkaline from stone coal[J].Chinese Journal of Rare Metals,2011,35(1):101.(郑琍玉,于少明,刘彬,陈亮,黄伶俐.石煤提钒碱浸过程动力学研究[J].稀有金属,2011,35(1):101.
[12] Nicholson R V,Gillham R W,Reardon E J.Pyrite ox-idation in carbonate-buffered solution:2.Rate control byoxide coatings[J].Geochimica et Cosmochimica Acta,1990,54(2):395.
[13] Antonijevic M M,Dimitrijevic M,Jankovic Z.Leac-hing of pyrite with hydrogen peroxide in sulphuric acid[J].Hydrometallurgy,1997,46(1-2):71.
[14] Bockris J O,Nreddy A K.Modern Electrochemistry[M].Plenum Press,New York.1970.
[15] Garrels R M,Thompson M E.A chemical model forseawater at 25℃and one atmosphere total pressure[J].Am.J.Sci.,1962,260:57.
[16] Singer,P C,Stumm W.Acid mine drainage:the de-terming step[J].Science,1970,167:1121.
[17] Sasaki K.Effect of grinding on the rate of oxidation ofpyrite by oxygen in acid solutions[J].Geochimca etCosmochimica Acta,1994,58(21):4649.