紫外-微臭氧工艺中O3的产生及其在有机物降解中的作用
赵光宇,吕锡武,朱光灿,张然
(东南大学 能源与环境学院,江苏 南京,210096)
摘 要:
作为光源的高级氧化工艺中石英玻璃套管内O3的产生情况,考察紫外-微臭氧工艺(UV-microO3)对氯苯、苯胺和甲基叔丁基醚的去除能力,分析O3在降解有机物中的作用。研究结果表明:套管内空气接受185 nm紫外辐射能够产生一定质量浓度的O3,当空气以3.0 L/min的流量通过套管时产生O3质量浓度为0.778 mg/L,降低进气湿度和压强均有利于O3的产生;低质量浓度O3的投加能够显著提高UV对有机物的去除效果,不同工艺对氯苯、苯胺和甲基叔丁基醚的去除能力由大到小为:UV-microO3,UV/曝气,UV;投加羟基自由基(·OH)清除剂——叔丁醇对UV-microO3去除有机物产生抑制作用;UV-microO3去除有机物过程中O3分子的直接氧化作用可忽略,而O3受到紫外激发产生的·OH发挥了重要作用。在氯苯、苯胺和甲基叔丁基醚的去除中,·OH的贡献率分别为:48.29%,65.31%和69.05%,ACUCHEM程序模拟结果验证了该结论。
关键词:
紫外-微臭氧;羟自由基;高级氧化工艺;氯苯;苯胺;甲基叔丁基醚;
中图分类号:TU991.2 文献标志码:A 文章编号:1672-7207(2014)02-0655-08
Generation and contribution to degradation of organic pollutants of ozone in UV-microO3
ZHAO Guangyu, L Xiwu, ZHU Guangcan, ZHANG Ran
Xiwu, ZHU Guangcan, ZHANG Ran
(School of Energy and Environment, Southeast University, Nanjing 210096, China)
Abstract: The generation of ozone between the quartz glass tube and low pressure mercury lamp in advanced oxidation process was investigated, and the degradations of chlorobenzene, aniline and methyl tert-butyl ether (MTBE) by UV-microO3 were compared while the effect of ozone was analyzed. The results show that ozone is generated when air is exposed to the UV irradiation at 185 nm. When the air flow rate is 3.0 L/min, 0.778 mg/L of ozone is generated, and the decrease of humidity and pressure of inlet air is favorable to the generation of ozone. The removal of organic pollution is enhanced by the introduction of ozone in low-concentration, and the removal ability decreases in the following order: UV-microO3, UV/aeration, UV. The removal of organic pollutants is inhibited by Tert-butyl alcohol (TBA) in UV-microO3. The direct oxidation of organic pollutants by ozone can be ignored but ·OH generates as a production of photolysis of ozone plays an important role in the degradation of organic pllutants. The contributions of ·OH to the removal of chlorobenzene, aniline and MTBE are 48.29%, 65.31% and 67.50%, respectively, which is verified by the theoretical values of ACUCHEM program.
Key words: UV-microO3; hydroxyl radical; advanced oxidation processes; chlorobenzene; aniline; methyl tert-butyl ether
高级氧化工艺(AOPs)是近年来研究较多的一种水处理工艺,主要在反应中产生活性极强的自由基(如·OH )去除目标污染物。与传统的生物处理法相比,AOPs能够通过自由基的作用使有机物更迅速地降解,从而降低其对人体的危害[1-2]。其中,包括UV参与的AOPs有UV/O3,UV/H2O2和UV/Fenton等[3-5]。验证了AOPs具有良好的有机物去除能力,但该类工艺投资运行成本高成为其推广应用的严重障碍[6]。Du等[7]所研发的UV/微曝气即为范例之一,该工艺向UV系统中曝入空气,证实在反应过程中产生了·OH,从而具有良好的有机物去除能力[7]。受到低压汞灯辐射空气产生O3的启发,本研究采用的UV-microO3工艺在UV/微曝气基础上增加空气管路,空气并非直接进入水体,而是首先从紫外灯和石英玻璃套管之间穿过,使空气在紫外灯附近接受紫外辐射产生O3,再将该部分O3化空气通过曝气头使之与反应水体均匀混合,实现UV与O3的协同作用。为探究UV-microO3中O 3的产生及其在去除有机物过程中的作用,通过试验考察套管内O3的产生情况,并选择氯苯、苯胺和甲基叔丁基醚进行去除试验。其中,氯苯类化合物具有长期残留性、生物蓄积性、半挥发性和高毒性,并且具有“三致”效应[8];苯胺主要来源于农药、染料、塑料和医药工业等,有“三致”作用[9-10];甲基叔丁基醚则是一种广泛使用的汽油添加剂,对甲基叔丁基醚的毒理学进行研究发现,甲基叔丁基醚是一种人体可疑致癌物质[11]。以上述3种有机物为目标有机物,通过对比分析UV,UV/曝气和UV-mircroO3的去除能力,考察·OH清除剂——叔丁醇对UV-microO3去除有机物的影响,并从动力学角度分析UV-mircroO3去除有机物过程中O3的作用。
1 试验材料与方法
1.1 试验装置、材料
UV-microO3主反应器如图1所示。反应器有效容积为65 L,反应器高为580 mm,直径为400 mm。反应器中安装UVH40DT4-5Y型紫外灯管6支,紫外灯功率为40 W(上海国达特殊光源有限公司生产)。紫外灯管外为石英玻璃套管,内径为36 mm。选用YB-W60型无油空压机(上海勇霸机电技术有限公司生产),CF-G3-10型臭氧发生器(青岛国林实业股份有限公司生产),ST-512型紫外辐照计(Sentry公司生产),Testo-610空气湿度仪(德国Testo公司生产)。
试验所用药品均为分析纯,氯苯为江苏强盛功能化学股份有限公司生产,苯胺、甲基叔丁基醚为国药集团化学试剂有限公司生产,叔丁醇为南京化学试剂有限公司生产。
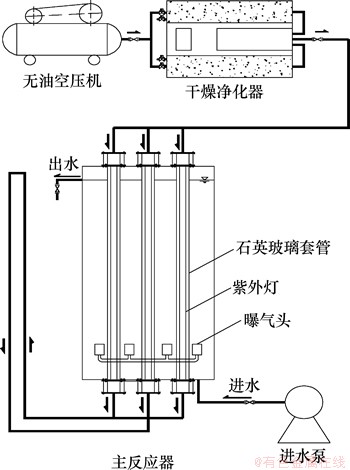
图1 UV-microO3工艺主反应器
Fig. 1 UV-microO3 reactor
1.2 试验方法
试验工艺主要有UV,UV/曝气和UV-microO3。运行UV-microO3时,空压机将经过干燥、净化的空气经进气管通入石英玻璃套管,使之在紫外灯辐射下产生一定质量浓度的O3,臭氧化空气从微臭氧导出管导出,再通过导入管导入反应器,经微孔曝气头与水体均匀混合。运行UV和UV/曝气时,直接向水体分别通入相同流量的氮气和空气。试验中除特殊说明外,反应水体中氯苯和苯胺浓度为0.04 mmol/L,甲基叔丁基醚浓度为0.01 mmol/L。测定紫外光强时,首先放空反应器,再将紫外辐照计探头固定在石英玻璃套管外进行测定。采用HCl,NaOH和pH缓冲溶液保持pH在7.0±0.2,试验温度为(24±3) ℃。
1.3 水质指标与分析方法
氯苯和甲基叔丁基醚浓度均采用Triplus Trace GC ITQ1100型离子阱气质联用仪测定,配有DB5-mass色谱柱,选用SIM模式测定,载气流量为1.0 mL/min,检测器温度为250 ℃。氯苯升温程序为:将温度40 ℃保持3 min;以5 ℃/min升温至130 ℃;保持5 min;以15 ℃/min升温至230 ℃,保持2 min。甲基叔丁基醚升温程序为:将温度30 ℃保持1 min;以5 ℃/min升温至80 ℃,保持5 min;以20 ℃/min升温至230 ℃,保持2 min。苯胺浓度采用N-(1-萘基)乙二胺偶氮分光光度法测定,气相O3质量浓度采用碘量法测定,液相O3浓度采用靛蓝三磺酸钾比色法测定,紫外光强采用紫外辐照计测定,空气湿度采用空气湿度仪测定,进气压强采用U型压力计测定。
2 结果与讨论
2.1 石英玻璃套管内O3的产生
2.1.1 石英玻璃套管内O3的产生和紫外光的损耗
AOPs中常采用低压汞灯作为光源,该灯主要波长为253.7 nm和185 nm。为了保护低压汞灯并使之稳定工作,将低压汞灯插入水体时一般在紫外灯外加装石英玻璃套管。套管内包围低压汞灯的空气接受185 nm紫外光辐射生成O3,253.7 nm紫外光则将一部分所产生的O3光解,反应过程如下[12]:
 (1)
(1)
 (2)
(2)
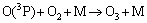 (3)
(3)
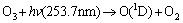 (4)
(4)
另外,由于O3分子比较活泼,O3分子间进行反应生成氧气:
 (5)
(5)
因此,采用低压汞灯作为光源的高级氧化工艺中,在套管内均发生了上述反应,当反应达到平衡时则产生一定质量浓度的O3。为了探究套管内O3的产生情况,试验考察套管内流通空气、氮气及套管封闭状态下套管外壁的紫外光强,并测定了通入不同流量空气时产生的O3浓度,见图2。
根据Lambert-beer定律,物质对253.7 nm紫外波长的吸收符合下式:
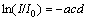 (6)
(6)
其中:I为套管内壁光强;I0为光源产生的光强;a为物质对253.7 nm波长的吸收系数;c为物质浓度;d为辐射距离。假设套管对253.7 nm紫外光的吸收系数为ε,则套管外壁光强为I(1-ε),并符合下式:
 (7)
(7)
当进气为氮气时,进气流量对紫外强度的影响微弱,6种进气流量下紫外强度保持在15.75 mW/s2左右。这是由于氮气分子对253.7 nm紫外光几乎没有吸收,改变氮气流量对紫外光强并无显著影响,因此,此时所测得的紫外强度值可认为等于I0(1-ε);在测定封闭状态下的紫外强度时,开启紫外灯,向套管内以一定流量通入空气一段时间后关闭进气阀门,使套管保持封闭状态,待紫外光强读数稳定后紫外光强为13.63 mW/s2。由于空气的主要组分氮气、氧气和二氧化碳等对253.7 nm紫外吸收均可忽略,此时测得的紫外强度明显低于通入氮气时的光强,表明套管内空气接受紫外辐射产生了一定质量浓度的O3,O3对253.7 nm紫外的吸收导致光强显著下降;在套管内流通空气后,紫外强度显著降低,且随空气流量从1.8 L/min增至3.0 L/min时紫外光强逐渐降低,当进气流量进一步升高时,紫外光强逐渐增高。产生O3质量浓度的变化趋势与紫外光强的变化趋势相反,当进气量为3.0 L/min时,取得O3最高质量浓度为0.778 mg/L,此时紫外光强为12.93 mW/s2。分析认为,开启紫外灯后所散射的热量能够促进式(5)向右进行,加剧了O3的分解,而通入空气以及进气流量的增加加强了冷却作用,有利于O3的积累,从而使紫外光强进一步降低。而当进气流量更大时,由于紫外辐射强度有限,空气接受紫外辐射时间缩短,从而O3质量浓度下降。

图2 石英玻璃套管内O3浓度及紫外光强的损耗
Fig. 2 Generation of ozone and consumption of UV irradiation in quartz glass tube
2.1.2 进气湿度和压强对O3产生的影响
考察不同湿度和压强下O3产生情况,结果见图3。在空气中含有水蒸气的情况下,O3光解的量子产率随水蒸气分压的平方根线性增加,发生以下反应[13]:
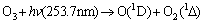 (8)
(8)
 (9)
(9)
 (10)
(10)

图3 进气湿度和压强对O3浓度的影响
Fig. 3 Influence of humidity and pressure of inlet air on generation of ozone
 (11)
(11)
因此,随着空气露点的升高,水蒸气分压增大,O3质量浓度逐渐下降。另外,在3种进气湿度条件下,进气压强的增大均导致O3质量浓度降低。增大压强促进了O3与其他气体分子和反应器壁的碰撞,故不利于O3的积累。因此,在实际运行UV-microO3时,应在考虑经济成本和进气压强满足需要的前提下尽可能降低进气湿度和压强,以取得较高的O3质量浓度。基于上述试验结果,有机物去除试验中采用的进气条件如下:UV-microO3,UV/曝气和单独曝气进气流量为3.0 L/min,UV-microO3进气露点保持在(-24±0.6) ℃,进气压强约为14 kPa。
综上所述,套管内空气在紫外辐射作用下产生了一定质量浓度的O3,UV-microO3运行时使套管内空气流通有利于O3的产生。但是,采用靛蓝三磺酸钾比色法测定水体中O3质量浓度时发现O3质量浓度均低于检测限,故其去除有机物能力有待进一步考察。
2.2 UV-microO3对氯苯、苯胺和甲基叔丁基醚的去除效果
2.2.1 UV,UV/曝气和UV-microO3对3种有机物的降解效果比较
采用UV,O3,UV/曝气和UV-microO3对水中氯苯、苯胺和甲基叔丁基醚进行去除试验,结果见图4。结果表明:尽管试验考察的3种有机物均有一定挥发性,但由于试验采用的气量较小,60 min内单独曝气对3种有机物的去除率均低于6%,可忽略不计。UV对以上3种有机物均有一定程度降解,其中对氯苯去除作用尤其显著,60 min即可去除80%以上的氯苯。Rao等[14]认为,UV去除有机物的反应可用下式表达:
 (12)
(12)
其中:c为目标有机物浓度;t为反应时间;f为去除有机物的量子产率;ε为有机物对紫外光的吸收系数;l为光反应器中紫外光穿透路径长度;I0为初始光强。
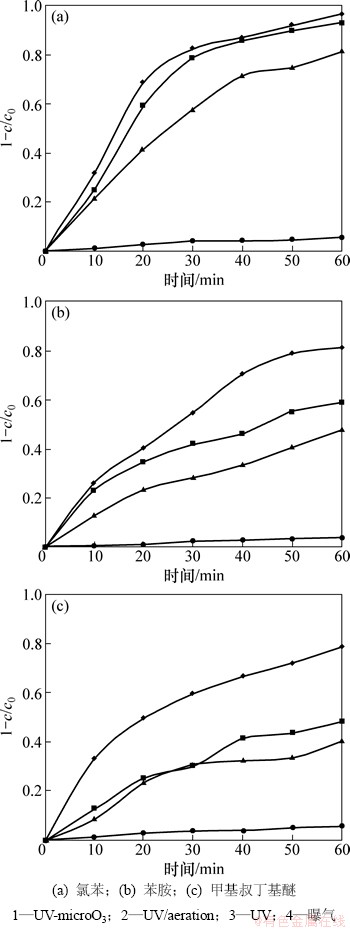
图4 UV-microO3, UV/aeration, UV和曝气对氯苯、苯胺和甲基叔丁基醚的去除
Fig. 4 Removal of chlorobenzene, aniline and MTBE by UV-microO3, UV/aeration, UV and aeration
氯苯和苯胺为苯系物,在本实验采用的紫外灯发射的波长范围内均有吸收,氯苯在253.7 nm处对紫外的吸收系数约为102.06[15],因此,UV对氯苯取得了较好的去除效果。值得注意的是,苯胺在253.7 nm处对紫外的吸收系数约为103.04[15],远远高于氯苯对该波长的吸收系数,而试验结果则表明,UV去除氯苯效率明显高于苯胺。这是由于苯胺遇到光辐射后水溶液迅速变为黄色,水的色度严重阻碍了紫外光在水中的穿透,从而大大降低了UV对苯胺去除能力。对于甲基叔丁基醚这类饱和烃类来说,由于只含有单键(σ键)产生σ到σ* 的跃迁,所需的能量高[16],因此,单独UV难以对其进行有效降解。在本试验中,尽管甲基叔丁基醚初始浓度低于氯苯和苯胺,为0.01 mmol/L,但UV去除率仍比其他2种物质的低。
在UV基础上进行曝气,在3种有机物的去除试验中均显著提高了去除水平,这与Du等[7]的研究结果一致。将UV/曝气管路进行改进,使空气首先在套管接受辐射,再投加到反应水体,即组成UV-microO3时,对3种有机物均取得了最佳去除效果。比较UV,UV/曝气和UV-microO3对3种有机物的去除结果可知:对于能够被UV有效去除的氯苯,UV-microO3去除率仅略高于UV/曝气,而在苯胺和甲基叔丁基醚的去除过程中,UV-microO3则显示出更大的优势:UV和UV/曝气对这2种有机物去除率分别低于50%和60%,但经过UV-microO3的60 min处理后,能够取得约80%的去除率。在UV-microO3运行时,水体中O3浓度低于靛蓝三磺酸钾比色法检测限,因此,有机物去除水平的提高显然不是O3氧化作用导致的。在UV-microO3中,O3与水体混合过程中接受紫外辐射,发生了以下反应[17]:
 (13)
(13)
 (14)
(14)
O3在上述过程中迅速降解,故检测不到O3分子存在,但是,该过程生成的氧化能力强的·OH能够有效去除水中有机物:因此,与UV和UV/曝气相比,UV-microO3显示出了更强的有机物去除能力。
2.2.2 叔丁醇对UV-microO3去除有机物的影响
叔丁醇是一种典型的·OH清除剂,它与·OH的反应速率常数高,在溶液中可以快速地与·OH发生反应,从而对有机物的氧化反应构成竞争[7]。为验证UV-microO3去除以上3种有机物中·OH发挥的作用,在反应初始投加不同浓度的叔丁醇,以考察对去除效果的影响。试验结果见图5。

图5 叔丁醇对UV-microO3去除有机物的影响
Fig. 5 Effect of TBA on removal of organic pollutants by UV-microO3
随着叔丁醇投加浓度的增加,UV-microO3去除氯苯、苯胺和甲基叔丁基醚的反应速率均逐渐降低。由于叔丁醇与·OH的反应速率常数高,叔丁醇能够与有机物竞争·OH,从而抑制·OH对有机物的降解。因此,在UV-mircroO3去除氯苯、苯胺和甲基叔丁基醚的过程中均有·OH产生并发挥作用,表现出AOPs的特点。氯苯反应速率常数从0.058 min-1降低为0.053 min-1,降低8.62%;苯胺从0.029 min-1降低为0.021 min-1,降低27.59%;甲基叔丁基醚由0.024 min-1降至0.015 min-1,降低了37.5%。比较3种有机物反应速率常数的降低情况可知:在苯胺和甲基叔丁基醚的去除过程中叔丁醇的抑制作用更加显著。因此,O3接受紫外辐射产生的·OH对这2种物质的去除发挥了更为重要的作用。
2.3 UV-microO3去除不同有机物过程中·OH反应的贡献
2.3.1 UV-microO3去除有机物中的·OH反应动力学
与UV/O3相似,UV-microO3在去除有机物过程中主要为3种作用的结合[2]:(1) UV对有机物的光降解;(2) O3分子对有机物的氧化作用;(3) ·OH对有机物的氧化作用。 因此,UV-microO3去除有机物的反应可以用以下方程来描述:
 (15)
(15)
其中:kG,kP,kO和kR分别为总反应、光降解、O3分子氧化和·OH氧化的反应速率常数。
由于UV-microO3紫外光激发空气产生的O3质量浓度较低,在经过曝气头与水体迅速混合的过程中,O3在紫外光的照射下迅速分解产生·OH,液相中O3分子质量浓度低,故忽略因O3造成的紫外光的损失和O3分子对有机物的去除,将式(11)简化为:
 (16)
(16)
则:
 (17)
(17)
因此,根据UV和UV-microO3的反应速率常数kP和kG可计算得出 kR,进而得出光降解和·OH反应在总反应中的贡献比例kP/kG和kR/kG。UV, UV-microO3对浓度为0.04 mmol/L的3种有机物的去除情况见图6和表1。
表1 UV-microO3对有机物去除中·OH贡献情况
Table 1 Contribution of ·OH to degradation of organic pollutants by UV-microO3

2.3.2 ACUCHEM程序模拟结果
为证实UV-microO3去除有机物的机制,利用ACUCHEM程序模拟去除效果,ACUCHEM程序可用于分析多组分化学反应系统,模拟得出各个反应物浓度随时间变化的行为[18],Benitez[19]等采用该程序对多种AOPs去除有机物进行拟合并分析这些工艺去除有机物的机制。将得出的kP,kR和kG输入ACUCHEM程序,分别得出模拟的UV,·OH和UV-microO3对有机物的去除情况,与试验结果对照见图7。
由图7可知:试验结果和模拟结果吻合较好,因此,UV-microO3去除3种有机物的过程可认为是UV和·OH 2方面作用的结果。根据表1,在氯苯的去除中,·OH反应贡献率低于50%,苯胺和甲基叔丁基醚中则超过65%,与前面试验推断结论一致。以上研究结果表明:UV-microO3去除有机物过程中,O3分子在水体中有机物的直接去除作用可忽略,O3主要通过产生·OH发挥作用。对于能够较好吸收紫外辐射的有机物,UV即可将其有效去除,UV-microO3能够进一步提高去除效果,但其中光降解作用仍占据主导地位。而对于UV难以有效去除的有机物来说,UV-microO3能够明显促进有机物的去除,其中O3受到紫外激发所产生的·OH发挥了重要作用。

图6 UV,UV-microO3去除有机物氯苯、苯胺和甲基叔丁基醚反应动力学
Fig. 6 Removal kinetics of chlorobenzene, aniline and MTBE by UV and UV-microO3

图7 UV-microO3去除氯苯,苯胺和甲基叔丁基醚
Fig. 7 Degradation of chlorobenzene, aniline and MTBE by UV-microO3
3 结论
(1) 在采用低压汞灯作为光源的AOPs中,套管内空气接受紫外辐射能够产生一定质量浓度的O3,进气流量、湿度和压强均对O3的产生有影响作用。UV-microO3的运行方式提高了O3的产生浓度,并将该部分O3化空气引导出套管加以利用,实现了UV与O3的协同作用。
(2) 对氯苯、苯胺和甲基叔丁基醚的去除水试验中,与UV相比,UV/曝气具有更强的有机物去除能力,UV-microO3则通过改进管路强化了紫外光激发空气产生O3环节,产生的O3在紫外激发作用下生成·OH,从而进一步提高了有机物去除水平。
(3) ·OH清除剂即叔丁醇的投加对UV-microO3去除有机物产生抑制作用,证实UV-microO3去除有机物过程中O3接受紫外辐射产生·OH并发挥重要作用。
(4) UV-microO3中O3分子直接去除有机物作用微弱,O3通过产生·OH发挥作用。UV-microO3去除有机物分为UV光解和·OH氧化2部分。动力学研究表明:在氯苯、苯胺和甲基叔丁基醚的去除过程中,·OH氧化反应的贡献率分别为48.29%,65.31%和69.05%。
参考文献:
[1] WANG Kunping, GUO Jinsong, YANG Min, et al. Decomposition of two haloacetic acids in water using UV radiation, ozone and advanced oxidation processes[J]. Journal of Hazardous Materials, 2009, 162(2/3): 1243-1248.
[2] XU Bingbing, CHEN Zhonglin, QI Fei, et al. Comparison of N-nitrosodiethylamine degradation in water by UV irradiation and UV/O3: Efficiency, product and mechanism[J]. Journal of Hazardous Materials, 2010, 179(1/2/3): 976-982.
[3] GONG Jianli, LIU Yongdi, SUN Xianbo. O3 and UV/O3 oxidation of organic constituents of biotreated municipal wastewater[J]. Water Research, 2008, 42(4/5): 1238-1244.
[4] YUAN Fang, HU Chun, HU Xuexiang, et al. Degradation of selected pharmaceuticals in aqueous solution with UV and UV/H2O2[J]. Water Research, 2009, 43(6): 1766-1774.
[5] Papi S, Vujevi
S, Vujevi D, Koprivanac N, et al. Decolourization and mineralization of commercial reactive dyes by using homogeneous and heterogeneous Fenton and UV/Fenton processes[J]. Journal of Hazardous Materials, 2009, 164(2/3): 1137-1145.
D, Koprivanac N, et al. Decolourization and mineralization of commercial reactive dyes by using homogeneous and heterogeneous Fenton and UV/Fenton processes[J]. Journal of Hazardous Materials, 2009, 164(2/3): 1137-1145.
[6] Gupta V K, Suhas. Application of low-cost adsorbents for dye removal: A review[J]. Journal of Environmental Management, 2009, 90(8): 2313-2342.
[7] DU Yingxun, Fu Q S, LI Yi, et al. Photodecomposition of 4-chlorophenol by reactive oxygen species in UV/air system[J]. Journal of Hazardous Materials, 2011, 186(1): 491-496.
[8] 李杰, 王芳, 杨兴伦, 等. 纳米铁和钯化铁对水体中高氯苯的降解特性[J]. 环境科学, 2011, 32(3): 692-698.
LI Jie, WANG Fang, YANG Xinglun, et al. Degradation of highly-chlorinated benzenes by nanoscale iron and palladized iron in aqueous system[J]. Environmental Science, 2011, 32(3): 692-698.
[9]  J L,
J L,  G, Hidalgo A M, et al. Application of reverse osmosis to remove aniline from wastewater[J]. Desalination, 2009, 245(1/2/3): 687-693.
G, Hidalgo A M, et al. Application of reverse osmosis to remove aniline from wastewater[J]. Desalination, 2009, 245(1/2/3): 687-693.
[10] Anotai J, Su C C, Tsai Y C, et al. Effect of hydrogen peroxide on aniline oxidation by electro-Fenton and fluidized-bed Fenton processes[J]. Journal of Hazardous Materials, 2010, 183(1/2/3): 888-893.
[11] Alnaizy R, Ibrahim T H. MTBE removal from contaminated water by the UV/H2O2 process[J]. Desalination and Water Treatment, 2009, 10(1/2/3): 291-297.
[12] Jeong J, Sekiguch K, Lee W, et al. Photodegradation of gaseous volatile organic compounds (VOCs) using TiO2 photoirradiated by an ozone-producing UV lamp: Decomposition characteristics, identification of by-products and water-soluble organic intermediates[J]. Journal of Photochemistry and Photobiology. A: Chemistry, 2005, 169(3): 279-287.
[13] Masschelein W J. Ozonization manual for water and wastewater treatment[M]. New York: John wiley and Sons Ltd, 1982: 166-178.
[14] RAO Yongfang, CHU Wei. A new approach to quantify the degradation kinetics of linuron with UV, ozonation and UV/O3 processes[J]. Chemosphere, 2009, 74(11): 1444-1449.
[15] Talrose V, Stern E B, Goncharova A A, et al. “UV/Visible Spectra” in NIST Chemistry WebBook, NIST Standard Reference Database Number 69. [2013-01-06]. [EB/OL]. http://webbook.nist.gov.
[16] 张建成, 王夺元. 现代光化学[M]. 北京: 化学工业出版社, 2006: 69-70.
ZHANG Jiancheng, WANG Duoyuan. Modern photochemistry[M]. Beijing: Chemical Industry Press, 2006: 69-70.
[17] Glaze W H. Destruction of polutants in water with ozone in combination with ultraviolet radiation[J]. Ozone Science & Engineering, 1987, 22(7): 335-350.
[18] Braun W, Herron J T, Kahanar D K. ACUCHEM: A computer program for modeling complex reaction systems[J]. International Journal of Chemical Kinetics, 1988, 20(1): 51-62.
[19] Benitez F J, Heredia J B, Acero J L, et al. Contribution of free radicals to chlorophenols decomposition by several advanced oxidation processes[J]. Chemosphere, 2000, 41(6): 1271-1277.
(编辑 何运斌)
收稿日期:2013-05-25;修回日期:2013-09-10
基金项目:国家“十一五”水专项(2009ZX07101-011);国家高技术研究发展计划(“863”计划)资源环境领域重大项目(2008ZX07421-004)
通信作者:吕锡武(1954-),男,安徽宣城人,博士,教授,博士生导师,从事饮用水深度处理、湖泊富营养化控制与治理和生活污水除磷脱氮等研究;电话:025-83794171;E-mail:xiwulu@seu.edu.cn
摘要:研究以低压汞灯作为光源的高级氧化工艺中石英玻璃套管内O3的产生情况,考察紫外-微臭氧工艺(UV-microO3)对氯苯、苯胺和甲基叔丁基醚的去除能力,分析O3在降解有机物中的作用。研究结果表明:套管内空气接受185 nm紫外辐射能够产生一定质量浓度的O3,当空气以3.0 L/min的流量通过套管时产生O3质量浓度为0.778 mg/L,降低进气湿度和压强均有利于O3的产生;低质量浓度O3的投加能够显著提高UV对有机物的去除效果,不同工艺对氯苯、苯胺和甲基叔丁基醚的去除能力由大到小为:UV-microO3,UV/曝气,UV;投加羟基自由基(·OH)清除剂——叔丁醇对UV-microO3去除有机物产生抑制作用;UV-microO3去除有机物过程中O3分子的直接氧化作用可忽略,而O3受到紫外激发产生的·OH发挥了重要作用。在氯苯、苯胺和甲基叔丁基醚的去除中,·OH的贡献率分别为:48.29%,65.31%和69.05%,ACUCHEM程序模拟结果验证了该结论。


