UV/H2O2工艺对水中典型药物卡马西平的光化学降解研究
邓靖1,邵益生1, 2,高乃云1,周石庆1,谈超群1,胡栩豪1
(1. 同济大学 污染控制与资源化研究国家重点实验室,上海,200092;
2. 中国城市规划设计研究院,北京,100037)
摘 要:
>2O2投加量、卡马西平初始浓度、UV辐照强度、初始pH和共存阴阳离子对卡马西平降解速率的影响。实验结果表明:单独UV辐照对卡马西平基本没有去除效果,而UV/H2O2联合工艺能够有效地去除卡马西平;卡马西平的降解速率随着H2O2投加量的增大而增大,随着卡马西平初始浓度的增大而降低;增强UV辐照强度能够显著提高卡马西平的降解速率;酸性和中性条件有利于UV/H2O2工艺对卡马西平的降解;水中阴离子对卡马西平的降解存在不同程度的抑制作用,抑制程度遵循如下顺序(由大至小):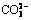 ,
,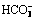 ,
,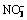 ,Cl-,
,Cl-,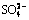 ;Fe3+能够显著地促进卡马西平的降解。
;Fe3+能够显著地促进卡马西平的降解。
关键词:
中图分类号:TU991.2 文献标志码:A 文章编号:1672-7207(2013)09-3933-07
Photochemical degradation of typical pharmaceutical carbamazepine in water by UV/H2O2 process
DENG Jing1, SHAO Yisheng1, 2, GAO Naiyun1, ZHOU Shiqing1, TAN Chaoqun1, HU Xuhao1
(1. State Key Laboratory of Pollution Control Reuse, Tongji University, Shanghai 200092, China;
2. China Academy of Urban Planning & Design, Beijing 100037, China)
Abstract: The effects of H2O2 dosage, initial carbamazepine concentrations, UV irradiation intensity, initial pH of solution, coexisting anions and cations on photochemical degradation of carbamazepine in water were studied. The results show that UV alone can not degrade carbamazepine. However, UV/H2O2 combined process can degrade carbamazepine effectively. The degradation rate of carbamazepine increases with the increase of the H2O2 dosage; the degradation rate of carbamazepine decreases with the increase of the initial carbamazepine concentrations. Enhancing UV radiation intensity can greatly improve carbamazepine degradation rate. The degradation of carbamazepine performs well in acidic and neutral conditions. Coexisting anions exhibit different degrees of inhibition effects, the degree of inhibition abiding from strong to weak by the following order: 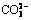 ,
, 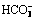 ,
,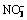 , Cl- and
, Cl- and 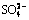 , and Fe3+ can significantly improve the degradation rate of carbamazepine.
, and Fe3+ can significantly improve the degradation rate of carbamazepine.
Keywords: UV/H2O2; pharmaceutical; carbamazepine; degradation
卡马西平是一种二苯并氮卓衍生物,用于治疗癫痫症、双向情感症、两极性情绪紊乱和急性狂躁症。每年大约有1 014 t卡马西平被消费,这导致超过30 t的卡马西平进入污水处理厂[1]。由于传统水处理工艺难以去除水中的卡马西平(CBZ),因此,它是目前水体中人们最关注的持久性的药物之一[2-4]。卡马西平已被发现存在于地下水、地表水和再生水中[5-7]。Alonso等[8]对马德里附近的不同河流进行调查,发现卡马西平存在于70%的水样中,其质量浓度在20~1 160 ng/L之间,平均质量浓度为82 ng/L。卡马西平被认为对水生生物包括细菌、藻类、无脊椎动物和鱼类动物[9]是有害的。由于其难以被传统的生物处理工艺降解,高级氧化技术被广泛地应用于卡马西平的去除。一些高级氧化工艺如O3[10],UV/TiO2[11],UV/Fe2+/H2O2[12]和US/Fe0/H2O2[13]能去除水中的卡马西平。UV/H2O2工艺也属于高级氧化技术的一种,它能产生氧化性极强的羟基自由基·OH,其氧化还原电位为2.80 V,比臭氧(2.07 V)、过氧化氢(1.77 V)和氯气(1.30 V)的还原电位高,使水中绝大多数的有机物完全矿化或者部分分解,具有广阔的应用前景[14]。而UV/H2O2工艺能否有效地去除卡马西平,国内外鲜有报道。本文以卡马西平作为目标污染物,考察H2O2初始浓度、卡马西平初始浓度、pH、UV辐照强度、水中共存阴离子和阳离子等影响因素对UV/H2O2工艺去除效果的影响,以期对实际工程中应用该工艺去除卡马西平提供一定的指导。
1 材料与方法
1.1 实验材料
卡马西平(纯度>99%)购自百灵威科技有限公司,其主要物理化学性质如表1所示。实验前配制10 mg/L储备液,使用时根据需要进行稀释。乙腈(HPLC级)购自Sigma-Aldrich公司。pH采用HCl和NaOH溶液调节。实验中所用的其他药品均为分析纯,购自上海国药集团化学试剂有限公司。实验中所用的溶液均采用Milli-Q超纯水配制。
1.2 卡马西平分析方法
卡马西平浓度采用高效液相色谱仪(Waters 2010)测定。使用Symmetry C18 柱(外径×长度为4.6 mm×250 mm,美国Waters公司制造)。流动相采用乙腈与水的质量比为60:40,检测波长为286 nm,流速为1 mL/min,柱温为35 ℃。
1.3 实验装置
实验所用的装置为自制,反应器的构造如图1所示。上部是紫外灯筒,内装低压汞灯(功率为75 W,额定工作电压为220 V,紫外灯主波长为254 nm,Philips公司生产),下面依次是灯筒、挡板、反应容器、磁力搅拌器和支撑系统。

图1 UV/H2O2反应装置图
Fig.1 Schematic of UV/H2O2 reactor
2 结果与讨论
2.1 UV/H2O2工艺及单独UV和H2O2对卡马西平的降解效果
实验中首先比较单独UV辐照、投加H2O2以及UV/H2O2工艺对卡马西平的降解效果。由图2可知:单独投加H2O2,卡马西平降解效果没有发生任何变化,这是因为H2O2的氧化能力(1.77 V)较低,不足以破坏卡马西平的化学键而使其得到降解。而单独UV辐照也不能有效地降解卡马西平,90 min内仅有5%左右的卡马西平被降解。Kim等[15]采用UV辐照对水中30种典型的PPCPs进行降解。发现卡马西平、环磷酰胺、DEET等属于慢速降解型PPCPs,这是因为这类PPCPs结构式中都存在酰胺键,对紫外光辐照具有较强的抵抗性。然而,UV/H2O2联合工艺对卡马西平具有良好的去除效果,90 min内96.22%的卡马西平被氧化去除。卡马西平的降解主要归因于通过光解H2O2产生·OH,反应过程如式(1)和(2)所示:
H2O2+hv→2·OH (1)
·OH+CBZ→降解产物 (2)
此外,Vogna等[16]认为UV/H2O2工艺能够有效地降解卡马西平在一定程度上是通过一系列吖啶中间体而发生的。
表1 卡马西平的主要物化性质
Table 1 Selected physicochemical properties of CBZ

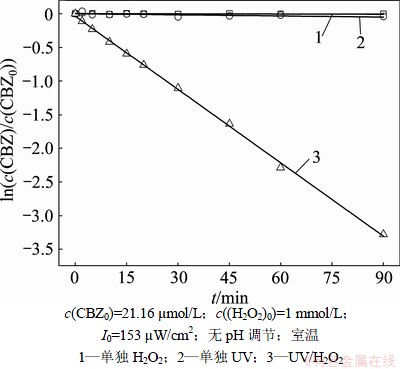
图2 对比UV/H2O2工艺及单独UV和H2O2对CBZ的降解效果
Fig.2 Comparison of UV/H2O2, UV and H2O2 alone for CBZ degradation
2.2 H2O2投加量的影响
在UV/H2O2工艺中,H2O2作为提供·OH的载体,其投加量是一个重要参数。实验中通过控制H2O2初始浓度在0~10 mmol/L来考察其对卡马西平降解效果的影响。不同H2O2投加量下ln(c(CBZ)/c(CBZ0))与反应时间的关系如图3所示。由图3可见:不同H2O2投加量下卡马西平的降解规律符合拟一级反应动力学:
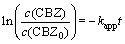 (3)
(3)
c(CBZ0)和c(CBZ)分别是卡马西平的初始浓度和t时刻的浓度;kapp是卡马西平降解的拟一级动力学常数。随着H2O2投加量的增加,卡马西平的去除率和降解速率均得到显著提高;当H2O2的初始浓度为0.5 mmol/L时,90 min内卡马西平的去除率仅为49.05%;而当H2O2的初始浓度提高到10 mmol/L时,30 min内卡马西平的去除率就能够达到99.27%;而当H2O2的初始浓度从0.50 mmol/L增加到10.00 mmol/L时,反应速率从0.007 4 min-1增加到0.162 4 min-1。不同H2O2投加量下卡马西平降解的拟一级反应动力学模型的拟合参数如表2所示。
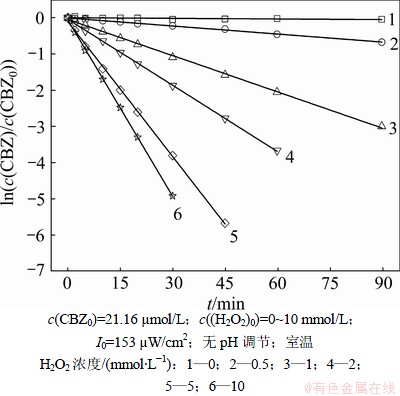
图3 不同H2O2投加量下ln(c(CBZ)/c(CBZ0 ))与反应时间的关系
Fig.3 Plot of ln(c(CBZ)/c(CBZ0 )) versu reaction time at various H2O2 dosages
表2 不同H2O2投加量下卡马西平降解的拟一级动力学模型的拟合参数
Table 2 Degradation parameters of pseudo-first-order kinetics model under different H2O2 dosages

此外,由表2可知:卡马西平的降解速率kapp并不是随着H2O2投加量的升高而呈线性提高的,而是存在一个阈值,当H2O2初始浓度超过这个值时,卡马西平降解速率的增加并不明显。这主要是由于卡马西平的降解受到UV/H2O2系统中有效·OH数量的影响。在H2O2投加量较低的情况下,增加氧化剂H2O2的浓度可以产生更多的有效·OH来攻击卡马西平分子,从而加快其反应速率;随着H2O2投加量的增加,过多的H2O2反而会抑制卡马西平的降解速率。这是因为过多的H2O2是·OH的淬灭剂(见反应式(4)和(5)),减少UV/H2O2系统中有效·OH的数量,从而降低卡马西平的降解速率。
H2O2+·OH→HO2·+H2O (4)
H2O2+HO2·→·OH+H2O+O2 (5)
2.3 卡马西平初始浓度的影响
目前,在世界各地的天然水体及污水中均能检测到卡马西平,因此,有必要研究UV/H2O2工艺中卡马西平初始浓度对降解速率的影响。实验中通过控制卡马西平初始浓度在10.58~42.32 μmol/L来考察其对降解速率的影响。在不同卡马西平初始浓度下,ln(c(CBZ)/c(CBZ0))与反应时间的关系如图4所示。

图4 不同卡马西平初始浓度下ln(c(CBZ)/c(CBZ0))与反应时间的关系
Fig. 4 Plot of ln(c(CBZ)/c(CBZ0)) versus the reaction time at various initial CBZ concentrations
由图4可知:随着卡马西平初始浓度的增加,卡马西平的降解速率(即曲线斜率)降低。经推导,当卡马西平的初始浓度由10.58 μmol/L升高到42.32 μmol/L时,卡马西平的降解速率降低至原速率的27.7%,即从0.062 min-1降低到0.017 2 min-1;此外,卡马西平的降解速率与其初始浓度并不呈线性关系,而是呈指数关系(如图4中的插图所示,拟一级动力学常数kapp=0.479×c(CBZ0)-0.863,R2=0.991)。Gao等[17]在研究UV/H2O2工艺降解农药莠灭净时也发现了相同的现象。增大卡马西平的浓度将引发一种内部过滤效应,使溶液的通透性变差从而影响UV辐照的效果[18]。这将减少H2O2对UV辐照的有效吸收,从而减少·OH的形成并降低卡马西平的降解速率。
2.4 UV辐照强度的影响
UV辐照强度是UV/H2O2工艺中另一个重要的参数。实验通过控制反应器中紫外灯筒的透光面积来调节UV辐照强度,分别为153.00,114.75,76.5和38.25 μW/m2。不同UV光强下ln(c(CBZ)/c(CBZ0))与反应时间的关系如图5所示。

图5 不同UV辐照强度下ln(c(CBZ)/c(CBZ0))与反应时间的关系
Fig.5 Plot of ln(c(CBZ)/c(CBZ0)) versus reaction time at various UV radiation intensities
由图5可见:增强UV辐照强度能够显著地提高卡马西平的降解速率(即曲线斜率增大)。经推导,当UV辐照强度为153 μW/cm2时,90 min内卡马西平的去除率可以达到96.22%;而当UV光强减小到35.28 μW/cm2时,90 min内卡马西平的去除率降至59.02%;在不同的辐照强度(38.25,76.5,114.75和153 μW/cm2)下卡马西平降解速率常数分别为0.009 5,0.016 9,0.027 4和0.036 3 min-1。UV辐照强度在·OH的形成过程中起着重要的作用,增强光强实质上提高了单位反应器体积内的光子流量,使得单位时间内被活化的H2O2分子数量增加,从而提高了卡马西平的降解速 率[19]。此外,如图5中的插图可见:卡马西平的降解速率与UV辐照强度呈现出良好的线性关系(kapp= 2.319×10-4I+5.198×10-4,R2=0.990)。
2.5 反应液初始pH值的影响
在UV/H2O2工艺中,反应液初始pH会对目标化合物的降解以及·OH的形成产生显著的影响[20-21]。不同溶液pH(3,5.06,7.05,9.03和10.95)下ln(c(CBZ)/ c(CBZ0))与反应时间的关系如图6所示。
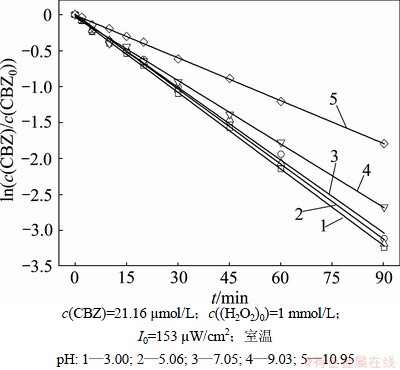
图6 不同初始pH值下ln(c(CBZ)/c(CBZ0))与反应时间的关系
Fig.6 Plot of ln(c(CBZ)/c(CBZ0)) versus reaction time at various initial solution pH
由图6可见:卡马西平在酸性和中性条件下能够得到很好的去除效果。经推导,其去除率均在92%以上;而在碱性条件下,随着溶液pH的提高,卡马西平的去除率降低。不同溶液pH下卡马西平的降解规律符合拟一级反应动力学。当溶液的pH在3.00~7.05范围内时,卡马西平的降解速率基本保持不变;而当溶液的pH继续提高时,卡马西平的降解速率出现降低。Vogna等[16]研究发现,当溶液的pH在2~8的范围时,UV/H2O2工艺对卡马西平的降解效果不受溶液pH变化的影响。
在酸性条件下更有利于UV/H2O2系统中·OH的产生,从而提高卡马西平的降解速率。酸性条件能够抑制H2O2分解产生H2O-(H2O-不仅能够捕获·OH,而且能够导致H2O2分解,见反应式(6)和(7))。据报道,·OH与H2O-的反应速率大约是其与H2O2反应速率的100倍[22]。此外,随着溶液pH的升高,H2O2自分解速率(见反应式(8))显著提高[23],这导致碱性条件下卡马西平降解速率降低。
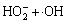 →HO2·+OH- (6)
→HO2·+OH- (6)
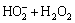 →H2O+O2+OH- (7)
→H2O+O2+OH- (7)
2H2O2→2H2O+O2 (8)
2.6 共存阴离子的影响
天然水体中存在一些阴离子如 和
和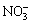 等在光照下可能会产生·OH而增强UV/H2O2工艺的氧化效率。但另一方面,它们又是·OH的活性组分,对·OH具有一定的消耗作用,不利于有机污染物的降解[24]。实验考察5种常见阴离子对卡马西平降解效果的影响,不同阴离子对卡马西平降解效果的影响如图7所示。采用拟一级动力学拟合投加不同阴离子情况下卡马西平浓度随反应时间的变化规律,主要的拟合参数如表3所示。
等在光照下可能会产生·OH而增强UV/H2O2工艺的氧化效率。但另一方面,它们又是·OH的活性组分,对·OH具有一定的消耗作用,不利于有机污染物的降解[24]。实验考察5种常见阴离子对卡马西平降解效果的影响,不同阴离子对卡马西平降解效果的影响如图7所示。采用拟一级动力学拟合投加不同阴离子情况下卡马西平浓度随反应时间的变化规律,主要的拟合参数如表3所示。
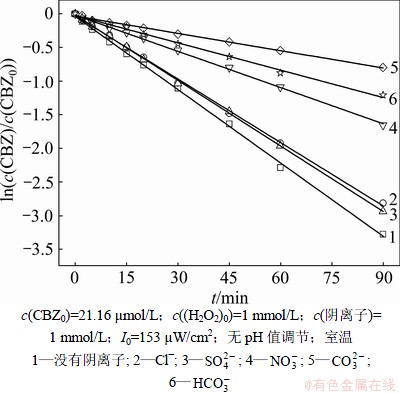
图7 不同阴离子对卡马西平降解效果的影响
Fig.7 CBZ degradation in presence of different anions
表3 不同阴离子条件下卡马西平降解的拟一级动力学模型的拟合参数
Table 3 Degradation parameters of pseudo-first-order kinetics model under different anions
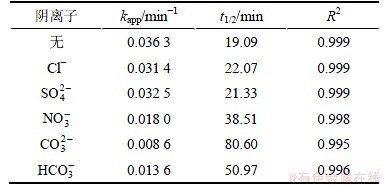
由图7和表3可知:5种阴离子能够以不同的速率与卡马西平竞争·OH,从而导致对卡马西平的降解产生不同程度的抑制作用。在这5种阴离子中,Cl-和 的影响较小,分别使卡马西平的降解速率下降13.49%和10.63%;而
的影响较小,分别使卡马西平的降解速率下降13.49%和10.63%;而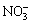 ,
,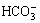 和
和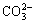 的影响较大,分别使卡马西平的降解速率下降50.56%,62.63%和76.32%。在各种阴离子投加量均为1 mmol/L的情况下,对卡马西平光降解的抑制程度遵循如下顺序(由大至小):
的影响较大,分别使卡马西平的降解速率下降50.56%,62.63%和76.32%。在各种阴离子投加量均为1 mmol/L的情况下,对卡马西平光降解的抑制程度遵循如下顺序(由大至小):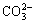 ,
,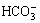 ,
,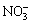 ,Cl-和
,Cl-和 。
。
由于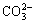 ,
,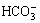 和
和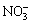 与·OH较高的反应速率,它们对卡马西平的降解产生显著的抑制作用。当
与·OH较高的反应速率,它们对卡马西平的降解产生显著的抑制作用。当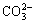 或
或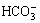 投加至溶液中时,它将继续反应并最终达到碳酸盐系统平衡。投加1 mmol/L
投加至溶液中时,它将继续反应并最终达到碳酸盐系统平衡。投加1 mmol/L 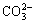 或
或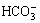 至溶液中,达到平衡时溶液的主要成分分别是0.35 mmol/L
至溶液中,达到平衡时溶液的主要成分分别是0.35 mmol/L 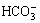 ,0.65 mmol/L
,0.65 mmol/L 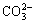 和0.98 mmol/L
和0.98 mmol/L 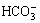 。0.01 mmol/L
。0.01 mmol/L 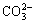 。
。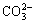 和
和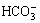 都是·OH的有效清除剂,而产生的碳酸盐自由基
都是·OH的有效清除剂,而产生的碳酸盐自由基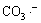 又会消耗系统中的H2O2,从而使UV/H2O2工艺降解效率显著降低,如反应式(9)~(11)所示:
又会消耗系统中的H2O2,从而使UV/H2O2工艺降解效率显著降低,如反应式(9)~(11)所示:
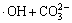 →
→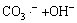 (9)
(9)
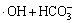 →
→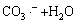 (10)
(10)
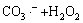 →
→ (11)
(11)
水中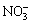 对卡马西平降解的影响存在两方面的作用。一方面,
对卡马西平降解的影响存在两方面的作用。一方面,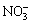 是天然水体中·OH产生的主要来源,在紫外光辐照下产生·OH可以提高氧化作用的效率(见反应式(12)~(14));另一方面,
是天然水体中·OH产生的主要来源,在紫外光辐照下产生·OH可以提高氧化作用的效率(见反应式(12)~(14));另一方面,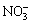 在紫外区具有较强的吸收,起着一种内在惰性滤层作用,阻止光线有效地通过溶液,从而使H2O2光解产生·OH效率降低。一般而言,
在紫外区具有较强的吸收,起着一种内在惰性滤层作用,阻止光线有效地通过溶液,从而使H2O2光解产生·OH效率降低。一般而言,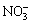 惰性滤层作用往往要比产生·OH的作用要强[25]。因此,本实验中
惰性滤层作用往往要比产生·OH的作用要强[25]。因此,本实验中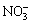 的存在对卡马西平的降解产生一定的抑制作用。
的存在对卡马西平的降解产生一定的抑制作用。
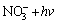 →
→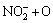 (12)
(12)
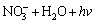 →
→ (13)
(13)
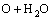 →
→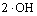 (14)
(14)
水中 和Cl-对卡马西平降解的影响则比较复杂,当离子浓度在一定范围内时,对目标化合物的降解不仅没有抑制作用,而且还有利于其降解[26]。在本实验中,投加1 mmol/L
和Cl-对卡马西平降解的影响则比较复杂,当离子浓度在一定范围内时,对目标化合物的降解不仅没有抑制作用,而且还有利于其降解[26]。在本实验中,投加1 mmol/L  和Cl-对卡马西平的降解起轻微的抑制作用。
和Cl-对卡马西平的降解起轻微的抑制作用。
2.7 共存阳离子的影响
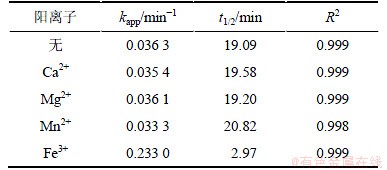
实验考察4种常见阳离子对卡马西平降解效果的影响。不同阳离子对卡马西平降解效果的影响如图8所示。采用拟一级动力学拟合投加不同阳离子情况下卡马西平浓度随反应时间的变化规律,主要的拟合参数如表4所示。
由图8和表4可知:Ca2+,Mg2+和Mn2+对卡马西平的降解基本没有影响,而Fe3+对卡马西平的降解产生显著地促进作用。经推导,当溶液中Fe3+的浓度为1 mmo/L时,卡马西平的降解速率达到0.233 min-1,10 min内卡马西平的去除率就能够达到90.17%,与空白实验相比卡马西平的降解速率增加6.41倍。在Fe3+/UV/H2O2系统中,将发生3个系列的反应:(1) H2O2的光解(反应式(1));(2) Fe3+的还原反应(反应式(15)和(16));(3) 还原反应生成的Fe2+与H2O2发生的芬顿反应(反应式(17))。这3个系列的反应均能够产生·OH,使得卡马西平的降解速率显著提高。
 →
→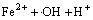 (15)
(15)
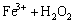 →
→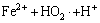 (16)
(16)
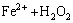 →
→ (17)
(17)
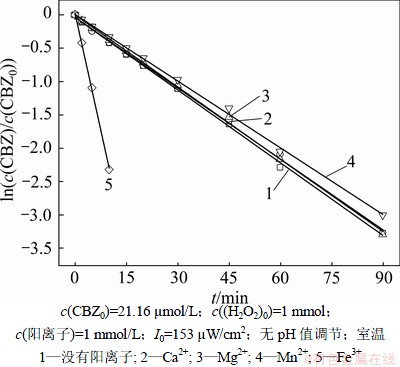
图8 不同阳离子对卡马西平降解效果的影响
Fig.8 CBZ degradation in presence of different cations
表4 不同阳离子条件下卡马西平降解的拟一级动力学模型的拟合参数
Table 4 Degradation parameters of pseudo-first-order kinetics model under different cations
3 结论
(1) 单独UV辐照对卡马西平基本没有去除效果;UV/H2O2联合工艺能够有效地降解水中的卡马西平。
(2) 卡马西平的降解速率随着H2O2投加量的增加而增加;随着卡马西平初始浓度的增加而降低。
(3) 增加UV辐照强度可以显著地提高卡马西平的降解速率;酸性和中性条件有利于UV/H2O2工艺对卡马西平的降解。
(4) 水中共存阴离子对卡马西平的降解存在不同程度的抑制作用,对卡马西平降解的抑制程度由大至小为: ,
, ,
,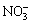 ,Cl-和
,Cl-和 。
。
(5) 水中共存阳离子对卡马西平的降解产生了不同的影响,Ca2+,Mg2+和Mn2+基本没有影响,而Fe3+能够显著地促进卡马西平的降解。
参考文献:
[1] Zhang Y J, Geiβen S U, Gal C. Carbamazepine and diclofenac: removal in wastewater treatment plants and occurrence in water bodies[J]. Chemosphere, 2008, 73(8): 1151-1161.
[2] Keen O S, Baik S, Linden K G, et al. Enhanced biodegradation of carbamazepine after UV/H2O2 advanced oxidation[J]. Environmental Science Technology, 2012, 46(11): 6222-6227.
[3] Clara M, Strenn B, Kreuzinger N. Carbamazepine as a possible anthropogenic marker in the aquatic environment: investigations on the behavior of carbamazepine in wastewater treatment and during groundwater infiltration[J]. Water Research, 2004, 38(4): 947-954.
[4] Xue W, Wu C, Xiao K, et al. Elimination and fate of selected micro-organic pollutants in a full-scale anaerobic/anoxic/aerobic process combined with membrane bioreactor for municipal wastewater reclamation[J]. Water Research, 2010, 44(20): 5999-6010.
[5] Loos R, Locoro G, Comero S, et al. Pan-European survey on the occurrence of selected polar organic persistent pollutants in ground water[J]. Water Research, 2010, 44 (14): 4115-4126.
[6] Tixier C, Singer H P, Oellers S, et al. Occurrence and fate of carbamazepine, clofibric acid, diclofenac, ibuprofen, ketoprofen, and naproxen in surface waters[J]. Environmental Science Technology, 2003, 37(6): 1061-1068.
[7] Zhou H D, Wu C Y, Huang X, et al. Occurrence of selected pharmaceuticals and caffeine in sewage treatment plants and receiving rivers in Beijing, China[J]. Water Environmental Research, 2010, 82(11): 2239-2248.
[8] Alonso S G, Catala M, Maroto R R, et al. Pollution by psychoactive pharmaceuticals in the rivers of Madrid metropolitan area (Spain)[J]. Environmental International, 2010, 36(2): 195-201.
[9] Ternes T A. Occurrence of drugs in German sewage treatment plants and rivers[J]. Water Research, 1998, 32(11): 3245-3260.
[10] Rosal R, Rodriguez A, Gonzalo M S, et al. Catalytic ozonation of naproxen and carbamazepine on titanium dioxide[J]. Applied Catalysis B: Environmental, 2008, 84(1/2): 48-57.
[11] Doll T E, Frimmel F H. Removal of selected persistent organic pollutants by heterogeneous photocatalysis in water[J]. Applied Catalysis B: Environmental, 2005, 81(3/4): 195-202.
[12] Klamerth N, Malato S, Maldonado M I, et al. Application of photo-fenton as a tertiary treatment of emerging contaminants in municipal wastewater[J]. Environmental Science Technology, 2010, 44(5): 1792-1798.
[13] Ghauch A, Baydoun H, Dermesropian P. Degradation of aqueous carbamazepine in ultrasonic/Fe0/H2O2 systems[J]. Chemical Engineering Journal, 2011, 172(1): 18-27.
[14] 李绍峰, 王丽, 黄君礼. UV-H2O2技术去除水中有机污染物[J]. 哈尔滨工业大学学报, 2004, 36(12): 1686-1689.
LI Shaofeng, WANG Li, HUANG Junli. Removing organic substance in water by UV/H2O2 system[J]. Journal of Harbin Institute of Technology, 2004, 36(12): 1686-1689.
[15] Kim I, Tanaka H. Photodegradation characteristics of PPCPs in water with UV treatment[J]. Environmental International, 2009, 35(5): 793-802.
[16] Vogna D, Marotta R, Andreozzi R, et al. Kinetic and chemical assessment of the UV/H2O2 treatment of antiepileptic drug carbamazepine[J]. Chemosphere 2004, 54(4): 497-505.
[17] Gao N Y, Deng Y, Zhao D D. Ametryn degradation in the ultraviolet (UV) irradiation/hydrogen peroxide (H2O2) treatment[J]. Journal of Hazardous Materials, 2009, 164(2/3): 640-645.
[18] Daneshvar N, Behnajady M A, Ali Mohammadi M K, et al. UV/H2O2 treatment of Rhodamine B in aqueous solution: Influence of operational parameters and kinetic modeling[J]. Desalination, 2008, 230(1/2/3): 16-26.
[19] 马艳, 高乃云, 郑琪, 等. UV-C辐照降解水中2,4,6-三氯酚[J]. 华中科技大学学报: 自然科学版, 2012, 40(6): 128-132.
MA Yan, GAO Naiyun, ZHENG Qi, et al. Degradation of 2,4,6-trichlorophenol in water by UV-C irradiation[J]. Journal of Huazhong University of Science and Technology, 2012, 40(6): 128-132.
[20] AlHamedi F H, Rauf M A, Ashraf S S. Degradation studies of Rhodamine B in the presence of UV/H2O2[J]. Desalination, 2009, 239(1/2/3): 159-166.
[21] 郭建伟, 高乃云, 殷娣娣, 等. UV/H2O2工艺降解微囊藻毒素-LR[J]. 环境科学, 2009, 30(2): 457-462.
GUO Jianwei, GAO Naiyun, YIN Didi, etal. Degradation of MC-LR by combination of UV/H2O2 process[J]. Environmental Science, 2009, 30(2): 457-462.
[22] Aleboyeh A, Moussa Y, Aleboyeh H. Photochemical oxidation of reactive azo dye with UV-H2O2 process[J]. Dyes Pigments, 2004, 62(3): 269-275.
[23] Qiao R P, Li N, Qi X H, et al. Degradation of microcystin-RR by UV radiation in the presence of hydrogen peroxide[J]. Toxicon, 2005, 45(6): 745-752.
[24] Rudder J D, Wiele T V, Dhooge W, et al. Advanced water treatment with manganese oxide for the removal of 17α-ethynylestradiol (EE2)[J]. Water Research, 2004, 38(1): 184-192.
[25] Sorensen M, Frimmel F H. Photochemical degradation of hydrophilic xenobiotics in the UV/H2O2 process: Influence of nitrate on the degradation rate of EDTA, 2-amino-1- naphthalenesulfonate, diphenyl-4-sulfonate and 4.4’- diaminostilbene-2,2’-disulfonate[J]. Water Research, 1997, 31(11): 2885-2991.
[26] Yuan R X, Ramjaun S N, Wang Z H, et al. Concentration profiles of chlorine radicals and their significances in ·OH-induced dye degradation: Kinetic modeling and reaction pathways[J]. Chemical Engineering Journal, 2012, 209(15): 38-45.
(编辑 邓履翔)
收稿日期:2012-08-15;修回日期:2012-10-17
基金项目:国家科技重大专项资助项目(2008ZX07421-002);住房和城乡建设部研究开发项目(2009-K7-4)
通信作者:邵益生(1958-),男,浙江江山人,博士,教授,从事饮用水处理技术研究;电话:021-65982691;E-mail: shaoyisheng2011@163.com
摘要:研究H2O2投加量、卡马西平初始浓度、UV辐照强度、初始pH和共存阴阳离子对卡马西平降解速率的影响。实验结果表明:单独UV辐照对卡马西平基本没有去除效果,而UV/H2O2联合工艺能够有效地去除卡马西平;卡马西平的降解速率随着H2O2投加量的增大而增大,随着卡马西平初始浓度的增大而降低;增强UV辐照强度能够显著提高卡马西平的降解速率;酸性和中性条件有利于UV/H2O2工艺对卡马西平的降解;水中阴离子对卡马西平的降解存在不同程度的抑制作用,抑制程度遵循如下顺序(由大至小):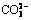 ,
,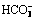 ,
,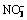 ,Cl-,
,Cl-,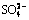 ;Fe3+能够显著地促进卡马西平的降解。
;Fe3+能够显著地促进卡马西平的降解。


