控制氧含量抑制黄铁矿浸出研究
北京有色金属研究总院生物冶金国家工程实验室
摘 要:
针对高硫铜比次生硫化铜矿生物浸出过程中酸铁过剩问题, 研究了通过通入N2和CO2限制矿柱中氧含量, 调控铁氧化菌的生长, 降低浸出液中氧化还原电位, 有效抑制黄铁矿的溶解, 减少浸出过程酸铁产量。结果表明:通入CO2和通入N2的同时接入富硫菌液的条件下, 有效地限制矿柱中氧含量, 使矿柱中的细菌以硫菌为优势菌群, 浸出液中氧化还原电位低于800 mV, pH保持在1.0以上。浸出180 d, 铜浸出率为77.52%, 铁浸出为16.46%, 电位为789 mV, pH为1.08, 在保证铜浸出率基本不变的情况下有效降低铁的浸出率, 浸出体系酸铁基本维持平衡。
关键词:
中图分类号: TF111.2
收稿日期:2010-06-10
基金:国家“863”计划资助项目 (2007AA090601);国家“973”重点资助项目 (2010CB630905);自然科学基金重点项目 (50934002);
Inhibit Bioleaching of Pyrite by Controlling Oxygen Content
Abstract:
Excess sulfuric acid was produced during bioleaching of secondary copper sulfides with high S/Cu.In order to solve this problem, it was important to control the growth of iron-oxidizing bacteria by sparging with N2 and CO2, to decrease the redox potential, and to inhibit the leaching of pyrite.The results showed that the sulfur-oxidizing bacteria were the dominant bacteria by sparging with N2 and CO2, keeping the solution redox potential lower than 800 mV and pH value higher than 1.0, the iron leaching rate could be inhibited and copper leaching was not affected.After leached for 180 d, the copper leaching rate was 77.52%, the iron leaching rate decreased from 24.58% to 16.46%, and the bioleaching system maintained the acid-iron balance.
Keyword:
pyrite;control the growth of bacteria;oxygen content;acid-iron balance;
Received: 2010-06-10
在生物浸矿过程中, 黄铁矿既是生物的能源, 又可以产酸。 当浸出体系中酸不足时, 可以促进黄铁矿的浸出, 为浸出体系补充一部分酸。 当浸出体系中酸过量时, 可有效的抑制黄铁矿的浸出, 减少酸性水排放量, 有利于环保
科学家对硫化矿细菌浸出机制进行了大量的研究
本文主要是通过限制矿柱中氧含量, 调控生物浸出体系中优势菌群, 降低氧化还原电位, 有效抑制黄铁矿的浸出。
1 实 验
1.1 试 样
试样采用来自福建紫金山次生硫化铜矿, 矿样化学元素分析和矿石物相分析见表1, 2所示。
矿石主要有价组份为铜, 以独立矿物的形式存在, 主要为次生硫化铜为主, 其中蓝辉铜矿、 铜蓝、 块硫砷铜矿、 硫砷铜矿占99%以上, 其次为辉铜矿、 斑铜矿等, 其他铜金属硫化物量极少, 其他金属硫化物主要为黄铁矿。
所采矿石经辊式破碎机两段破碎至≤15 mm, 然后装柱。
表1 矿石元素分析
Table 1 Main elements chemical composition of mineral sample
| Elements | Cu | S | As | Fe | Pb | SiO2 |
Content/% |
0.4300 | 2.6200 | 0.0300 | 3.8600 | 0.0100 | 73.6400 |
Elements |
MgO | CaO | K2O | Al2O3 | Na2O | |
Content/% |
0.0055 | 0.0082 | 1.0300 | 8.7600 | 0.0740 |
表2 铜矿物物相分析结果
Table 2 Copper mineralogical composition of mineral sample
| Mineralogical classification | Content/% | Percentage/% |
Primary copper sulfide |
0.01100 | 2.60 |
Secondary copper sulfide |
0.41000 | 96.77 |
Free copper oxide |
0.00240 | 0.57 |
Combination copper oxide with silicon |
0.00020 | 0.04 |
Combination copper oxide with iron |
0.00008 | 0.02 |
The total copper |
0.43000 | 100.00 |
1.2 菌种及培养基
实验所用细菌是从紫金山铜矿生物堆浸矿堆中分离筛选出来的。 将矿堆取回的浸渣用pH 1.5的酸性溶液冲洗, 然后接入9 K (3.0 g (NH4) 2SO4, 0.1 g KCl, 0.5 g K2HPO4, 0. 5 g MgSO4·7H2O, 0.01 g Ca (NO3) 2, 44.22 g FeSO4·7H2O) 。 培养基中培养, 多次转接后加入部分硫化矿粉进行驯化, 使菌株具有较高的氧化活性及耐受铜离子能力。
1.3 实验方法
在实验室采用柱浸试验模拟现场工业堆浸, 试验步骤如下:
矿石装填: 在浸出柱的多孔底板先垫上一层耐酸滤布, 然后在耐酸滤布上装填厚度约为5 cm、 粒度大于2 mm的块状试验矿样, 接着尽可能大小均一地装填试验矿样, 并在矿柱中预埋通气管道, 最后在矿柱的顶部装填约有2 cm厚度、 粒度大于2 mm的块状试验矿样, 使浸液尽可能均匀地流经矿柱的每一部位, 达到最佳浸矿效果。 在装柱的过程中, 采用pH=1.8的稀硫酸对矿石表面进行湿润, 然后尽可能均匀装柱
矿石预浸 矿石装填好后, 即开始用pH=1.8左右的稀硫酸溶液滴淋, 中和矿石中的耗酸脉石, 直到pH值基本稳定为止。 浸出液pH值随时用20%的稀硫酸溶液调节, 使pH值稳定在2.0左右。
布液休闲制度 采用滴淋方式进行布液浸出, 布液强度为12~15 L· (m2·h) -1, 实行轮休浸出制度。 采用轮休制度, 有利于浸矿剂渗入矿石内部, 与矿石进行充分反应。 增加浸矿柱内矿石空隙含氧量, 提高细菌生长繁殖速度和铜的浸出速率。
检测制度: 每天测pH、 电位的变化, 控制通气阀门, 检测通气强度, 每周取浸出液检测铜、 铁离子浓度一次, 30 d检测一次矿柱中及浸出液细菌菌群的组成。 最后, 对浸渣进行物相及多元素分析。
1.4 实验条件
本实验共设计7组实验, 在7根不同条件的柱子中进行生物浸出, 调控矿柱中优势种群的生长, 控制氧化还原电位的变化。 7根柱子的条件分别为: 1#通CO2气体, 温度40 ℃, 同时间断的接入培养好的富硫菌液; 2#通CO2气体, 温度40 ℃, 不接富硫菌液; 3#通N2, 温度40 ℃, 同时间断的接入培养好的富硫菌液; 4#通N2, 温度40 ℃, 不接富硫菌液; 5#温度40 ℃, 同时间断的接入培养好的富硫菌液; 6#温度40 ℃, 不接入富硫菌液; 7#常温浸出, 不接入富硫菌液。
2 结果与讨论
2.1 优势菌群的检测
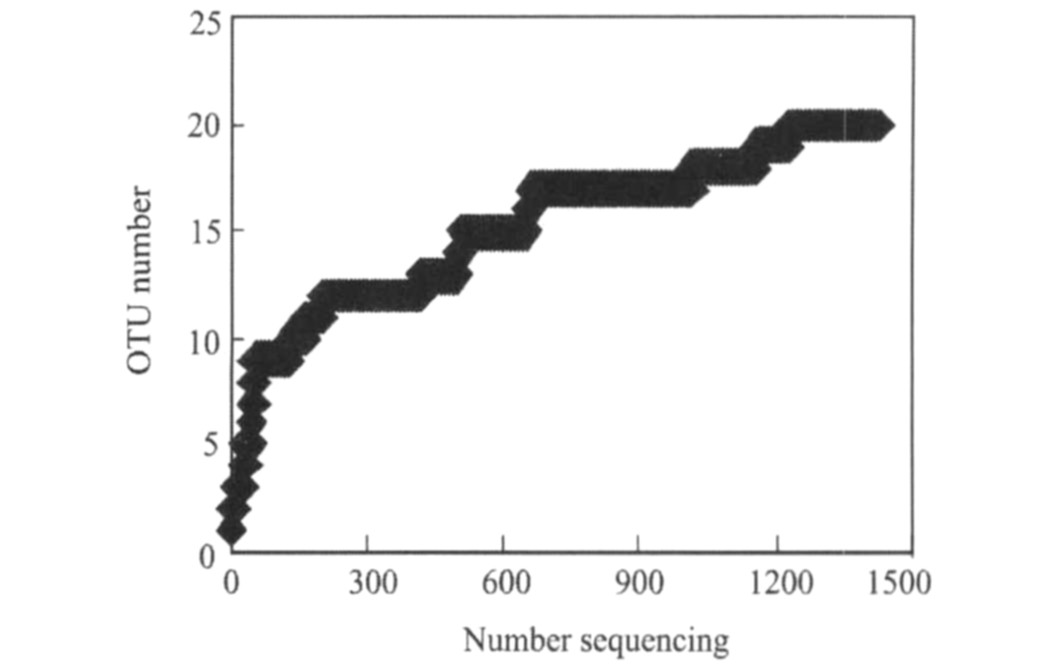
对浸出过程中微生物种群进行了检测和分析, 接菌后第45天7根柱子各取样品做克隆文库分析, 之后每隔3个星期取一次样做克隆文库分析, 试验中共建立了29个克隆文库, 测得有效序列1425条。 利用DOTUR软件对1425条有效序列划分OTUs。 从图1可以看出随着测序数目的增加, OTUs数目也趋于稳定, 最终的OTU数目为20个。 覆盖度较高, 因此所得数据能够较好的反应矿柱中微生物种群的多样性。
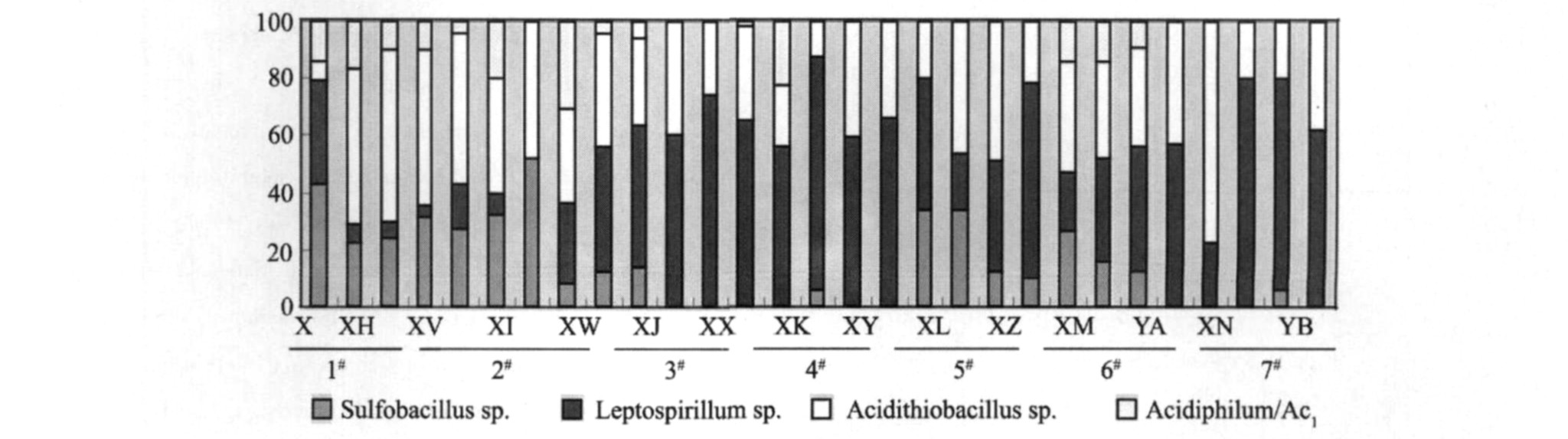
将每个OTUs的代表序列与Genbank中的16S rDNA数据比对, 找出与数据库中最相似的种或克隆, 并用NCBI的序列提交软件提交代表序列, 20个OTUs从分类学地位上来看, 分属于5个类群, 分别为: Nitrospirae (42.32%) 、 γ-Proteobacteria (32.84%) 、 Firmicutes (18.67%) 、 α-Proteobacteria (5.96%) 和Actinobacteria (0.21%) 。
由图2分析结果可得, 不同条件下柱浸中微生物多样性不高, 柱浸中的主要细菌为: Acidithiobacillus sp., Sulfobacillus sp., Leptospirillum sp.和Acidiphilum和Acidospera sp.。 通入CO2, 矿柱中细菌主要以硫氧化菌为主; 通入N2的同时接入富硫菌液, 微生物种群主要是以Leptospirillum sp.为主。
图1 样品收集曲线
Fig.1 Collector′s curves of observed and estimated OTU richness
控制氧含量, 可以有效的调控矿柱中优势菌群的生长, 通入CO2可使浸出体系以硫氧化菌为主, 有效的抑制铁氧化菌的繁殖
2.2 浸出率及电位的变化
不同条件下浸出效果见图3~6所示。
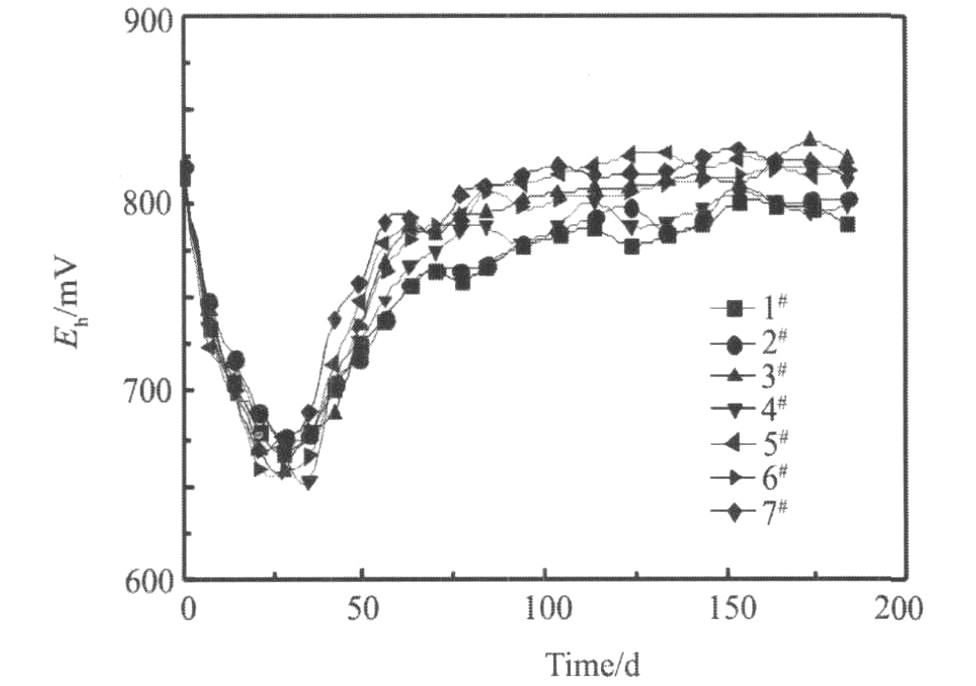
从实验结果可得, 温度对浸出速率影响显著, 随着温度的升高, 铜浸出速率显著提高。 通CO2和N2对铜浸出率影响较小, 但对铁浸出率影响明显。 通入气体后, 矿柱中氧含量降低, 影响了细菌的活性, 铁氧化菌的生长受到一定的抑制, 黄铁矿溶解速率减缓。 不同条件下, pH先升高后降低 (图5) , 变化幅度不大, 浸出185 d后, pH保持在1.2以上。 在浸出初期耗酸脉石反应较快, 耗酸量大, pH升高; 浸出后期, 耗酸脉石基本反应完, 部分低价硫被氧化后产酸, pH逐渐降低。 通气后, 浸出液中氧化还原电位降低, 基本保持在800 mV以下, 主要是因为浸出体系以硫氧菌为主, 降低了Fe2+氧化速率。 故通入CO2和通入N2的同时接入富硫溶液, 可使浸出体系保持以硫氧化菌为优势菌, 降低氧化还原电位, 不影响铜的浸出, 有效的抑制铁的浸出。
图2 矿柱中不同时间优势菌种变化图
Fig.2 Bacterial community difference between different samples
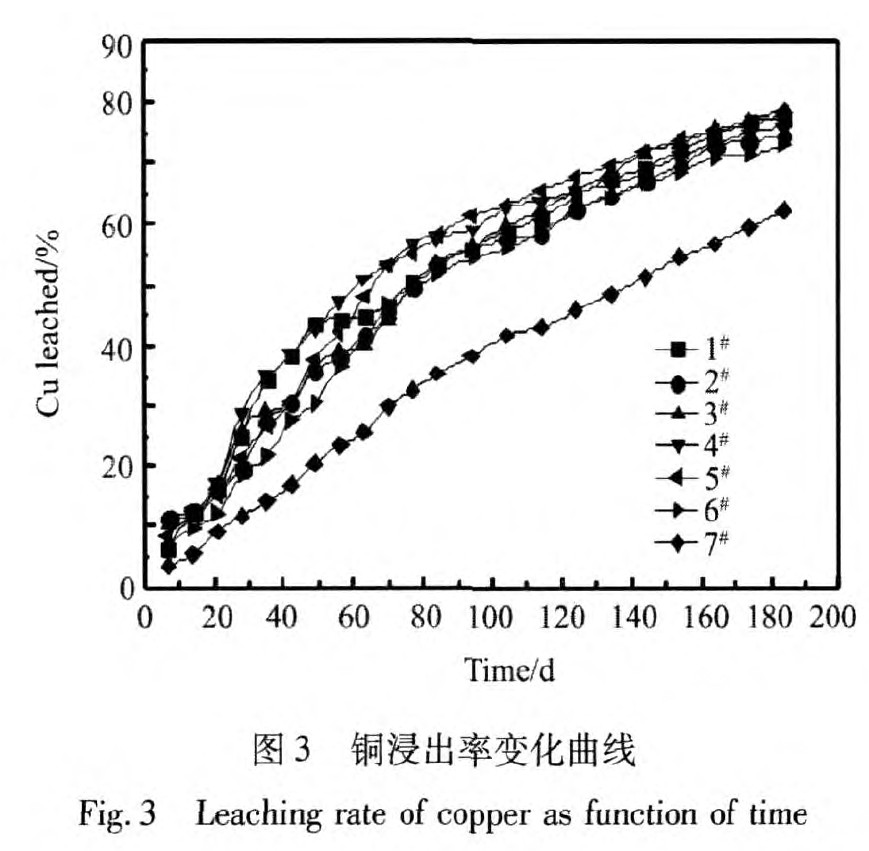

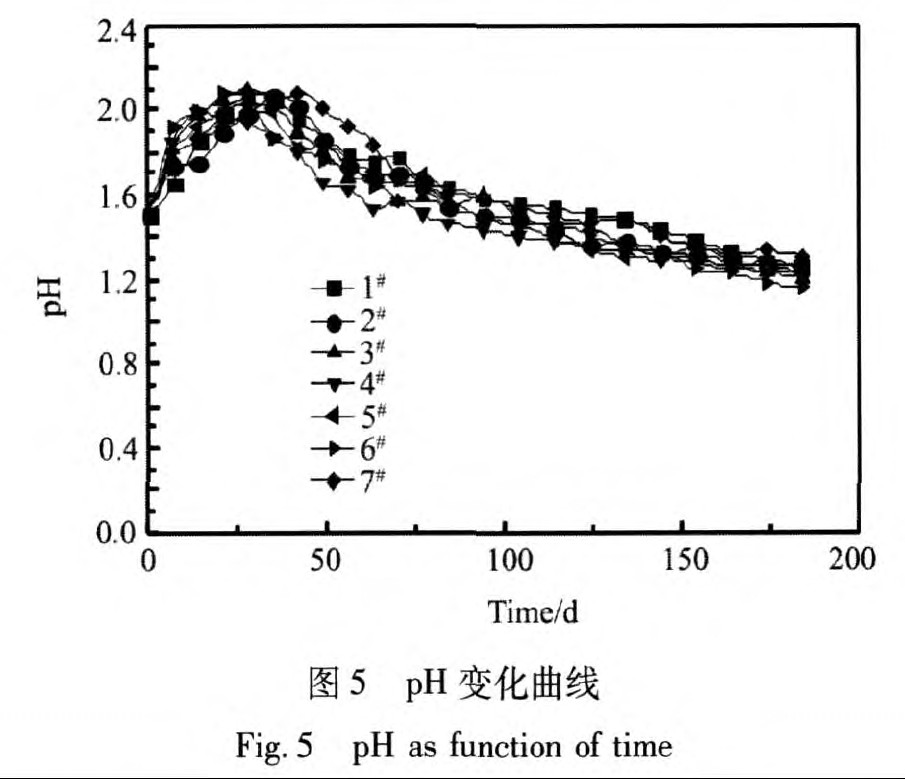
图6 电位变化曲线
Fig.6 Redox potential as function of time
3 结 论
1. 温度对硫化矿浸出过程影响较大, 随着温度的升高, 浸出速率明显加快。
2. 通过控制浸出过程氧传递, 可以调控浸出体系中优势菌群的生长, 控制浸出液中氧化还原电位的变化, 使浸出体系中氧化还原电位保持在800 mV以下。
3. 通入CO2和通入N2的同时接入富硫菌液的条件下, 可以调控矿柱中以硫菌为优势菌群, 浸出180 d, 铜浸出率为77.52%, 铜浸出率基本不变, 铁浸出率从24.58%下降到16.46%, 有效的抑制了黄铁矿的溶解。
参考文献
[2] Rossi G.Biohydrometallurgy[M].Hamburg:McGraw-Hill, 1990.259.
[9] Helmut Tributsch.Direct versus indirect bioleaching[J].Hy-drometallurgy, 2001, 59:177