网络首发时间: 2016-11-30 15:01
稀有金属 2017,41(09),1035-1041 DOI:10.13373/j.cnki.cjrm.xy16090021
咪唑离子液体对CsCl溶解度的影响
唐静 李淑妮 翟全国 蒋育澄 胡满成
陕西国际商贸学院医药学院
陕西师范大学化学化工学院
摘 要:
采用密度-折光率联立法研究了稀碱金属无机盐氯化铯在咪唑离子液体[Cnmim]Br (n=2, 4, 6, 8) 和水的混合溶剂中的溶解行为。测定了在T= (288.15, 298.15和308.15) K温度下CsCl+[Cnmim]Br (n=2, 4, 6, 8) +H2O三元体系不同组成比例下溶液的折光率和密度数据, 通过关联密度和折光率数据获得了CsCl维持[Cnmim]Br (n=2, 4, 6, 8) 水相的最高浓度。研究结果表明:当在[Cnmim]Br (n=2, 4, 6, 8) 水溶液中添加氯化铯, 混合系统发生复分解反应, 析出固体Cs Br。相同温度下, 饱和溶液中氯化铯的最大含量会随着离子液体含量的增加而降低。离子液体含量相同时, 混合溶液中CsCl的最高浓度随着离子液体侧链的增长而增加, CsCl含量顺序:[C2mim]Br<[C4mim]Br<[C6mim]Br<[C8mim]Br。同一体系中, CsCl饱和浓度随着温度的升高而增大。同时, 采用经验方程对CsCl饱和浓度进行了拟合, 拟合结果较好。此外还测定了饱和溶液的密度及折光率数据, 为描述溶液物理性质和组分之间的关系提供基础数据。
关键词:
CsCl;离子液体;密度;折光率;溶解度;
中图分类号: O645.1
作者简介:唐静 (1982-) , 女, 陕西西安人, 博士, 研究方向:稀有碱金属溶液化学;E-mail:tangjing224@126.com;;李淑妮, 副教授;电话:029-81530767;E-mail:lishuni@snnu.edu.cn;
收稿日期:2016-09-21
基金:国家自然科学基金项目 (21571120, 21301114);陕西省教育厅专项科研计划项目 (16JK2036);2016陕西省大学生创新创业训练计划项目 (2958);陕西国际商贸学院科研项目 (SMXY201605) ;陕西国际商贸学院人才引进科研启动经费资助;
Influence of Imidazolium Based Ionic Liquids on Solubility of CsCl
Tang Jing Li Shuni Zhai Quanguo Jiang Yucheng Hu Mancheng
School of Medicine, Shaanxi Institute of International Trade & Commerce
School of Chemistry & Chemical Engineering, Shaanxi Normal University
Abstract:
Dissolution behavior of cesium chloride in the mixture of imidazolium based ionic liquids ( [Cnmim]Br ( n = 2, 4, 6, 8) ) and water was studied by density and refractive index simultaneous method. The density and refractive index of CsCl + [Cnmim]Br ( n = 2, 4, 6, 8) + H2 O ternary systems with different component were measured at T = ( 288. 15, 298. 15 and 308. 15) K. The highest concentration of CsCl in [Cnmim]Br ( n = 2, 4, 6, 8) aqueous phase was obtained by correlating the density and refractive index data. The results indicated that the precipitation of cesium bromide was found in [Cnmim]Br ( n = 2, 4, 6, 8) aqueous solution when adding cesium chloride. The complex decomposition reaction occurred in the system. The highest concentration of CsCl in the saturated solution decreased with the increasing of ionic liquid concentration at the same temperature. For a constant mass fraction of ionic liquid, the order of the highest concentration of CsCl in [Cnmim]Br ( n = 2, 4, 6, 8) + H2O mixtures was [C2mim]Br <[C4mim]Br <[C6mim]Br <[C8mim]Br. Furthermore, the concentration of CsCl in saturated solutions increased with the system temperature increasing. The empirical equation was used to fit the concentration of CsCl in saturated solutions. It was found that empirical equation could qualitatively represent the equilibrium behavior. In addition, the density and refractive index of the saturated solutions were determined for describing the relationship between the physical property and the solution composition.
Keyword:
CsCl; ionic liquid; density; refractive index; solubility;
Received: 2016-09-21
离子液体又被称为“液体分子筛”, 由于特殊的溶解能力和宽液态范围使其在分离过程中得到了广泛应用, 尤其是在萃取领域[1,2,3,4]。离子液体-无机盐-水混合溶液的相化学的研究对于了解离子液体的阳离子和阴离子种类与其溶解能力之间的联系, 明确离子液体用于分离过程的原理, 离子液体的开发和应用具有重要意义[5,6,7]。
我国盐湖卤水中铷、铯资源丰富, 但常与钾、镁等元素伴生, 且这些元素性质相近, 给铷、铯盐的分离带来困难。近些年, 有关稀碱金属铷、铯盐在传统溶剂中的相化学研究较多[8,9,10], 以及对稀碱金属铷、铯盐在传统溶剂中的相化学也有大量研究[11,12,13,14], 此外, 也有初步探讨离子液体对稀碱金属铷铯在水溶液中溶解度的影响[15,16]。为了进一步研究离子液体对无机盐溶解度影响, 本文选择了对空气和水性质稳定且较易获得的咪唑类离子液体[Cnmim]Br (n=2, 4, 6, 8) , 研究了其含量、烷基链链长和温度对Cs Cl+[Cnmim]Br+H2O饱和溶液中Cs Cl浓度的影响及饱和溶液密度、折光率。
1 实验
1.1 试剂与仪器
1.1.1 试剂
氯化铯 (上海中锂实业有限公司, 质量分数≥99.5%) , 溴化1-乙基-3-甲基-咪唑离子液体 ([C2mim]Br) , 溴化1-丁基-3-甲基-咪唑离子液体 ([C4mim]Br) , 溴化1-己基-3-甲基-咪唑离子液体 ([C6mim]Br) , 溴化1-辛基-3-甲基-咪唑离子液体 ([C8mim]Br) (4种咪唑离子液体均为上海成捷化学有限公司提供, 质量分数≥99%) , 使用前在真空干燥箱中60℃下烘干48 h, 然后保存在真空干燥器中备用。实验所用到的水均为二次蒸馏水。
1.1.2 仪器
密度仪 (DMA4500, 精确度±1×10-5g·cm-3, 奥地利Anton Paar公司) ;折光率仪 (RXA 170, 精确度±4×10-5, 奥地利Anton Paar公司) ;电子天平 (AL 204, 精确度±0.0001g, 上海梅特勒-托利公司) ;超纯水机 (YS-10A型, 上海摩科科技集团) , X射线衍射仪 (XRD, XRD-7000S, 岛津) 。
1.2 方法
饱和溶液中个组分含量的测定采用密度-折光率联立法获得。一定浓度范围内, 三元混合溶液中各组分含量与溶液密度和折光率间的关系可以用经验方程表示为[17]:

式中ρ和nD分别表示密度和折光率, wS和wIL分别表示混合溶液中Cs Cl和离子液体质量分数。联立方程 (1) 和 (2) , 通过测量溶液的密度和折光率数据计算体系中各物质含量。参数a0, a1, a2, b0, b1和b2通过标准曲线获得并列于表1。标准曲线的制作如下:配制质量分数wS分别为0%, 3%, 6%和wIL<0.12的标准溶液, 测定了其在298.15K时密度及折光率 (表1) 。以wIL为横坐标, 分别以ρ和nD为纵坐标绘图得到密度和折光率标准曲线图, 如图1所示。
饱和样品的配制是通过向已知质量的一系列不同比例的离子液体和水混合溶液中加入过量Cs Cl得到, 将配好的样品固定于平衡装置载样盘上在所测定温度下搅拌48 h, 然后在水浴中静置24 h以使其达到平衡。取样, 稀释后测量其密度及折光率。
饱和三元体系平衡时取出析出的固相, 用滤纸吸干表面水分后采用XRD分析, 结果如图2所示。
2 结果与讨论
Cs Cl+[Cnmim]Br (n=2, 4, 6, 8) +H2O三元体系在T为288.15, 298.15和308.15 K时均未出现分层现象, Cs Cl不同于碱金属碳酸盐和磷酸盐, 加入离子液体水溶液不能使其分层的主要原因是Cl-为负一价的离子, 相对于CO32-和PO43-其电荷数较少、静电引力小、溶剂化能力较差, 促使离子液体水溶液分层的能力小。
表1 Cs Cl+[Cnmim]Br+H2O体系密度及折光率经验方程 (1) 和 (2) 的参数Table 1 Parameters of Eqs. (1) and (2) for density and refractive index for Cs Cl+[Cnmim]Br+H2O system 下载原图
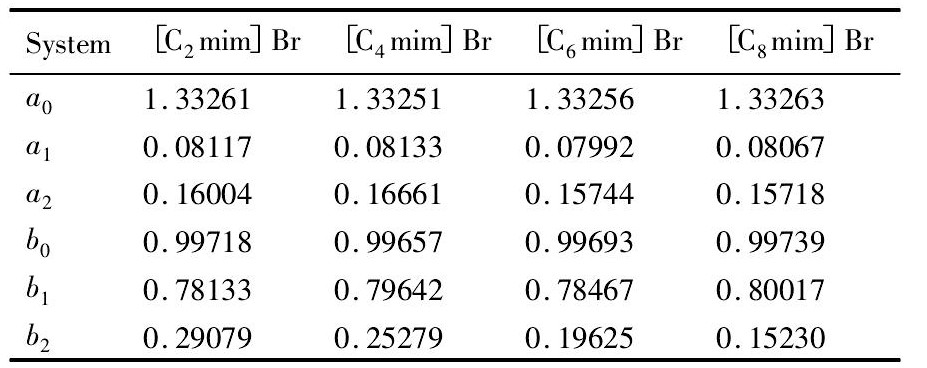
表1 Cs Cl+[Cnmim]Br+H2O体系密度及折光率经验方程 (1) 和 (2) 的参数Table 1 Parameters of Eqs. (1) and (2) for density and refractive index for Cs Cl+[Cnmim]Br+H2O system
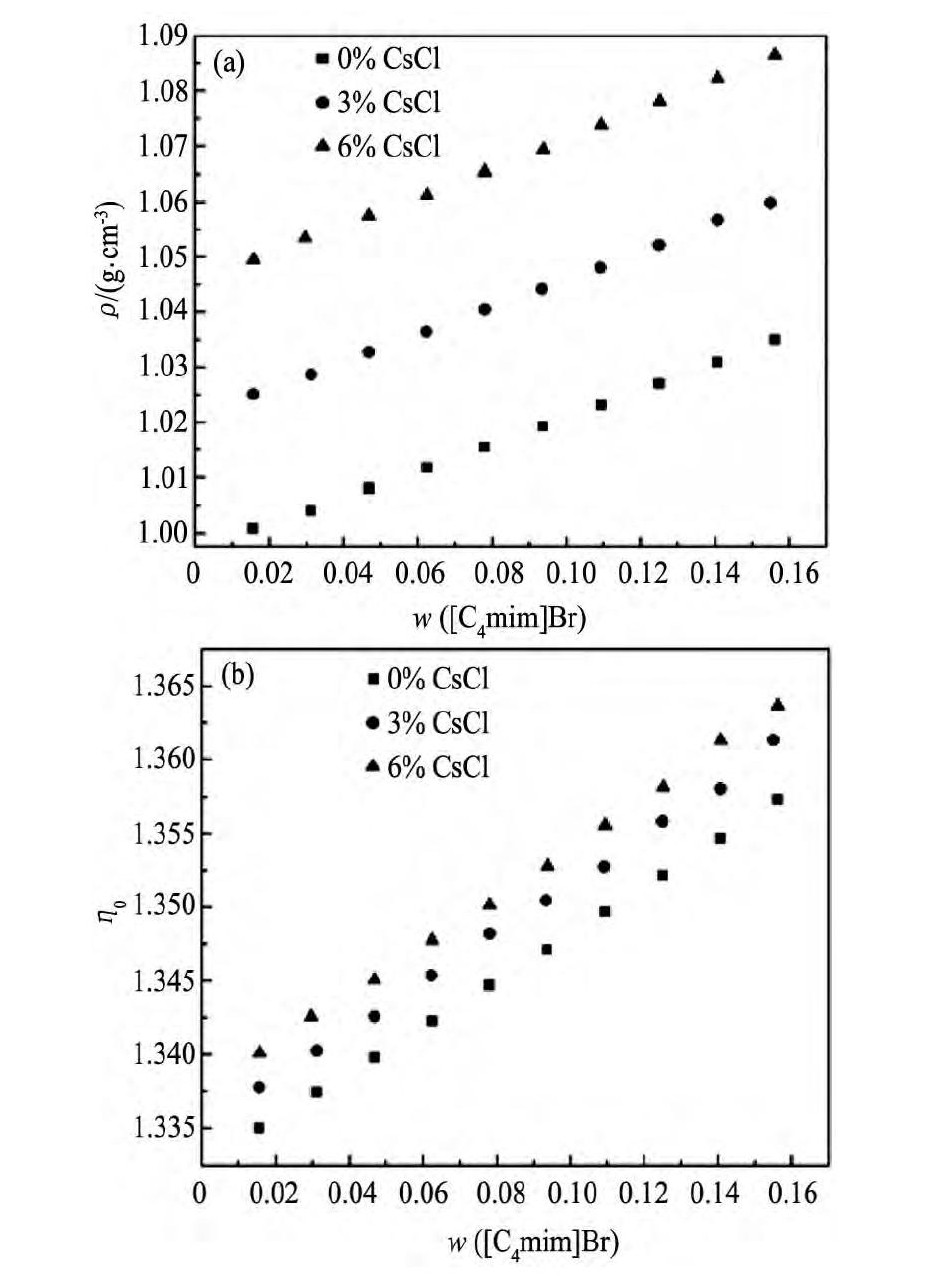
图1 298.15 K时Cs Cl+[C4mim]Br+H2O体系的标准曲线Fig.1 Calibration curves of Cs Cl+[C4mim]Br+H2O ternary system at 298.15 K
(a) Density; (b) Refractive index
2.1 密度及折光率标准曲线
图1为Cs Cl+[C2mim]Br+H2O (其他体系结果相似) 三元体系的密度及折光率标准曲线图。由图1可以看出密度及折光率随着体系中离子液体浓度的增大呈现出较好的线性关系, 方程 (1) 和 (2) 适用于一定浓度范围wS≤0.06, wIL≤0.12。
由标准曲线图获得的参数a0, a1, a2, b0, b1和b2数值列于表1。当方程 (1) 和 (2) 中wIL和wS为0时, a0和b0分别表示二次去离子水在298.15 K下的密度和折光率。表1中参数a0和b0与二次去离子水折光率和密度文献值 (ρ=0.99703 g·cm3[18], nD=1.3330[19]) 十分吻合, 表明了此方法的可行性和实验数据的可靠性。
2.2 平衡固相分析
采用XRD分析得知Cs Cl+[Cnmim]Br (n=2, 4, 6, 8) +H2O三元体系饱和时析出固体均为CsBr晶体 (图2以Cs Cl+[C2mim]Br+H2O为代表给出了固相XRD曲线图) , 说明体系中发生了复分解反应, Cs Cl+[Cnmim]Br Cs Br+[Cnmim]Cl, 生成了新的无机盐。无机盐的溶解度由构成无机盐的离子所带电荷、离子半径及结构共同决定, 对于Cs Cl和Cs Br均属于离子晶体, 且Cl-和Br-所带电荷相同, 所以其溶解度的差异主要是离子半径的不同引起的。构成无机盐的阴阳离子半径差异越大盐的溶解度越大, 而Cl-离子半径与Cs+离子半径相差较大 (γCl-=0.167 nm和γCs+=0.181nm) , Br-半径与Cs+离子半径几乎相同 (γBr-=0.182和γCs+=0.181 nm) [20], 所以混合溶液中Cs Br先析出。本实验所测定的平衡状态混合溶液的组成实际上是Cs Cl在离子液体水混合溶液中处于均相时的最高浓度, 不是传统的Cs Cl溶解度。
2.3 平衡时体系中Cs Cl的含量
T=288.15, 298.15和308.15 K下不同离子液体体系处于均相时Cs Cl的最高浓度列于附表2。图3直观地给出了离子液体含量及温度对平衡体系中Cs Cl最大含量的影响。从图3中可以看出:
(1) Cs Cl+[Cnmim]Br+H2O三元体系饱和溶液中Cs Cl的含量随着离子液体含量的增加逐渐减小, 这是因为随着体系中离子液体含量的增加, 离子液体与水分子形成氢键作用, 导致单位体积混合溶液中水分子减小, Cs Cl溶剂化能力减小, 其溶解度随之减小。
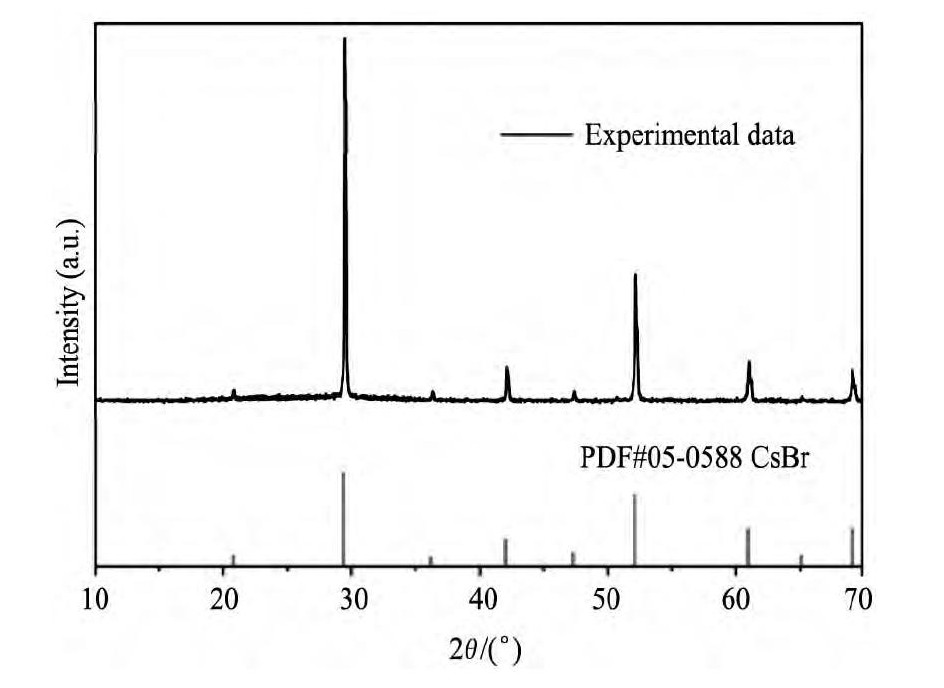
图2 298.15 K时Cs Cl+[C2mim]Br+H2O三元体系中, 当wIL=0.5473时所对应平衡固相的XRD图谱Fig.2XRD patterns for equilibrium solid phase of Cs Cl+[C2mim]Br+H2O ternary system with wIL=0.5473at 298.15 K
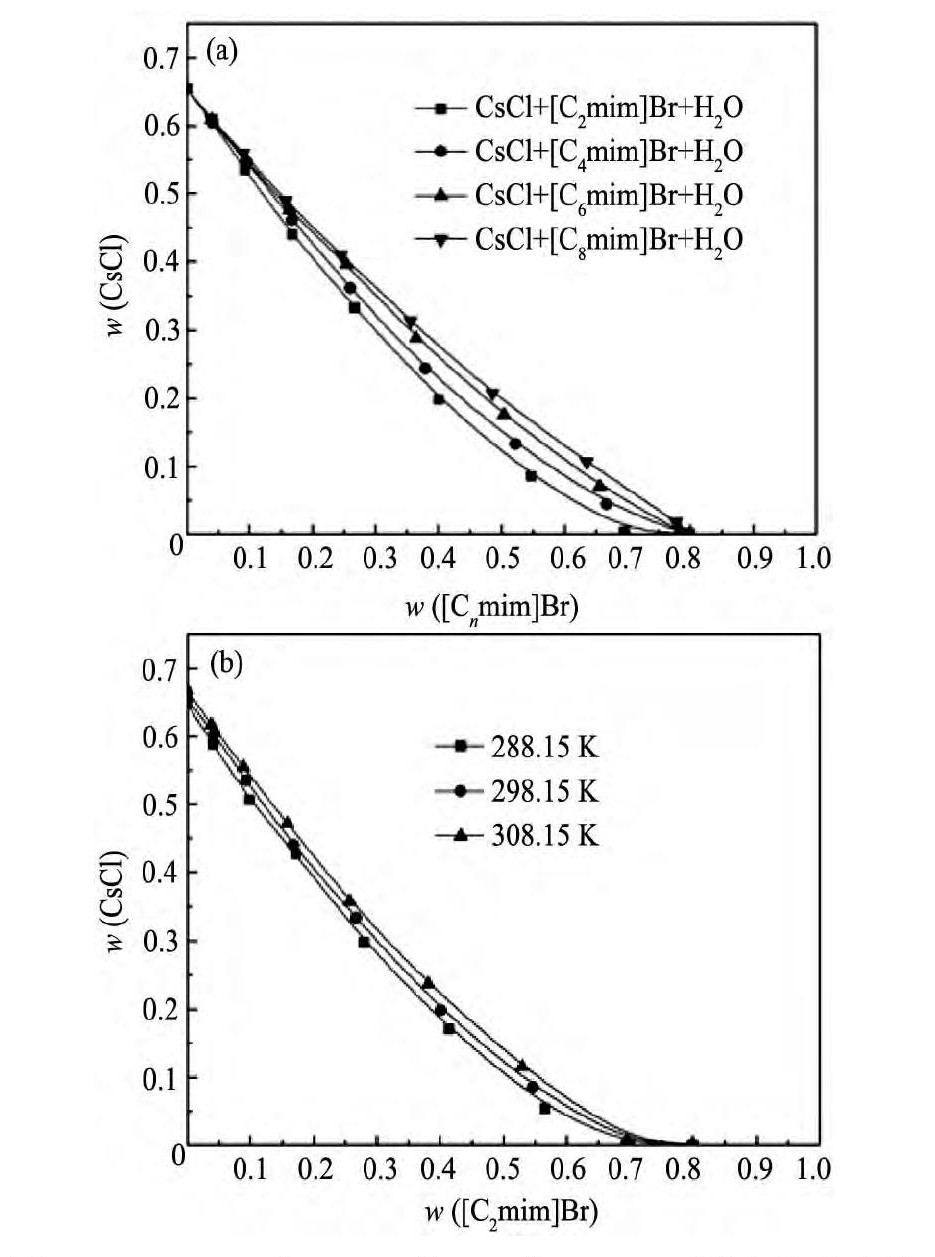
图3 298.15 K时Cs Cl+[Cnmim]Br+H2O混合溶液中溶解度随离子液体含量的变化曲线和Cs Cl+[C2mim]Br+H2O溶解度随温度的变化曲线Fig.3 Solubility data of Cs Cl+[Cnmim]Br+H2O mixed so-lution at 298.15 K (a) and Solubility data of Cs Cl+[C2mim]Br+H2O mixed solution at different tempera-tures (b)
(2) 随着离子液体阳离子侧链的增长, Cs Cl+[Cnmim]Br+H2O三元体系饱和溶液中Cs Cl的含量增大。这是因为离子液体阳离子侧链的增长使其疏水性增加, 离子液体与水分子形成氢键能力减弱, 使其与Cs Cl争夺水分子能力下降, 最终使Cs Cl的溶解度增加。
(3) 温度对Cs Cl+[C2mim]Br+H2O三元混合溶液溶解度的影响如图3 (b) 所示, 随着温度的增加Cs Cl的溶解度逐渐增加。其原因是Cs Cl在水中的溶解过程是吸热的, 所以随着温度的升高, Cs Cl在离子液体水混合溶液中的溶解度增大。
本文采用半经验方程:
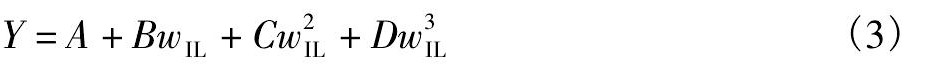
拟合了Cs Cl+[Cnmim]Br+H2O三元混合溶液体系中Cs Cl含量, 此处Y表示平衡时Cs Cl的最大含量, wIL表示混合溶液中离子液体所占质量分数, 采用最小二乘法得到的经验参数A, B, C和D列于表2中, 表2中同时给出了拟合的标准偏差 (SD) 且SD值较小, 说明四参数经验方程可以较好关联Cs Cl+[Cnmim]Br+H2O体系中Cs Cl含量。
2.4 饱和溶液的密度及折光率
实验所得到的不同温度下Cs Cl+[Cnmim]Br+H2O饱和溶液的密度和折光率列于附表2。以离子液体质量分数为横坐标, 分别以体系密度和折光率为纵坐标绘制了物化性质组成图。如图4所示Cs Cl+[Cnmim]Br+H2O体系物化性质随着离子液体含量的增大, 其变化趋势与Cs Cl+[Cnmim]Cl+H2O相似[12], 结果如下:
(1) 随着体系中离子液体含量的增大, Cs Cl+[Cnmim]Br+H2O三元体系的密度呈现整体减小的趋势。细小的差别是Cs Cl+[C2mim]Br/[C4mim]Br+H2O体系的密度先减小后增大;而Cs Cl+[C6mim]Br/[C8mim]Br+H2O体系的密度呈现出单调减小的趋势。这是由于溶液中离子液体含量较低时, 体系密度主要受Cs Cl性质的影响, 而当离子液体含量较高时, 离子液体自身性质成为影响体系的密度主要因素。Cs Cl+[Cnmim]Br+H2O三元体系的折光率与密度的变化趋势不同, 随着离子液体含量的增加呈现单调增大的趋势, 这是因为体系的折光率主要受离子液体的影响。
表2 由经验方程拟合Cs Cl+[Cnmim]Br+H2O平衡时各组分含量数据得到的参数和相对标准偏差Table 2 Parameters (A, B, C and D) and standard deri-ation (SD) of empirical equation for equilibrium data of Cs Cl+[Cnmim]Br+H2O mixed solution 下载原图
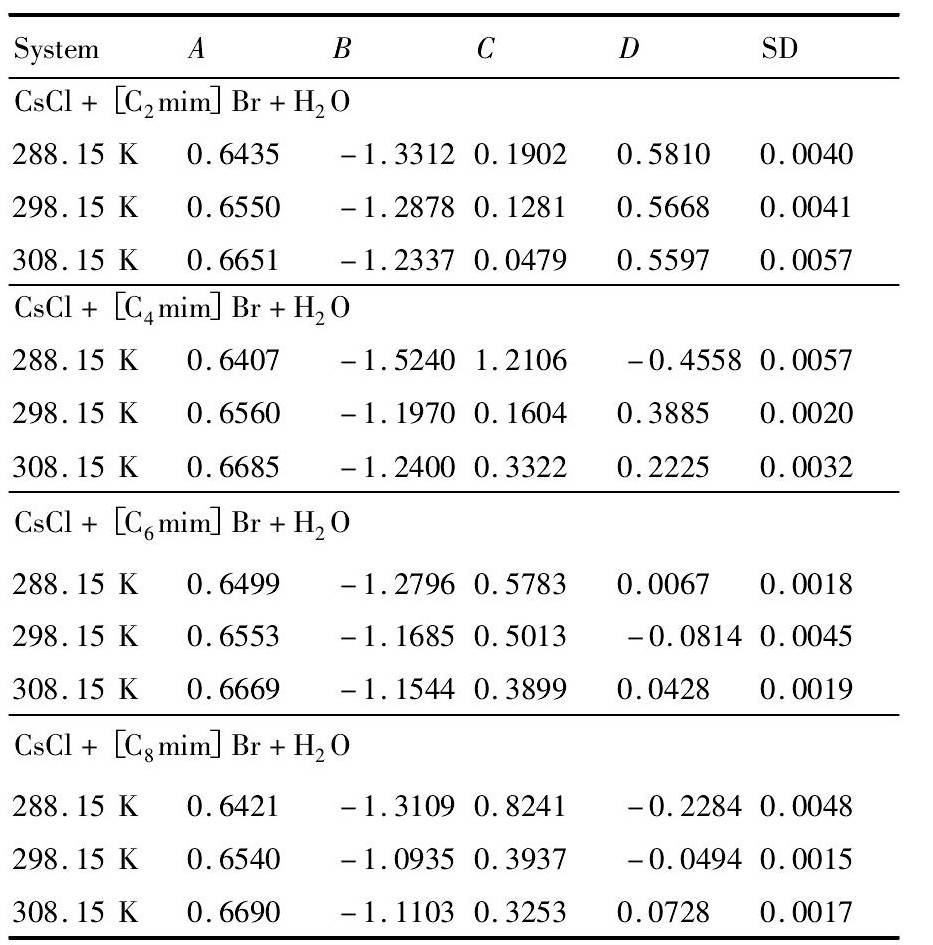
表2 由经验方程拟合Cs Cl+[Cnmim]Br+H2O平衡时各组分含量数据得到的参数和相对标准偏差Table 2 Parameters (A, B, C and D) and standard deri-ation (SD) of empirical equation for equilibrium data of Cs Cl+[Cnmim]Br+H2O mixed solution
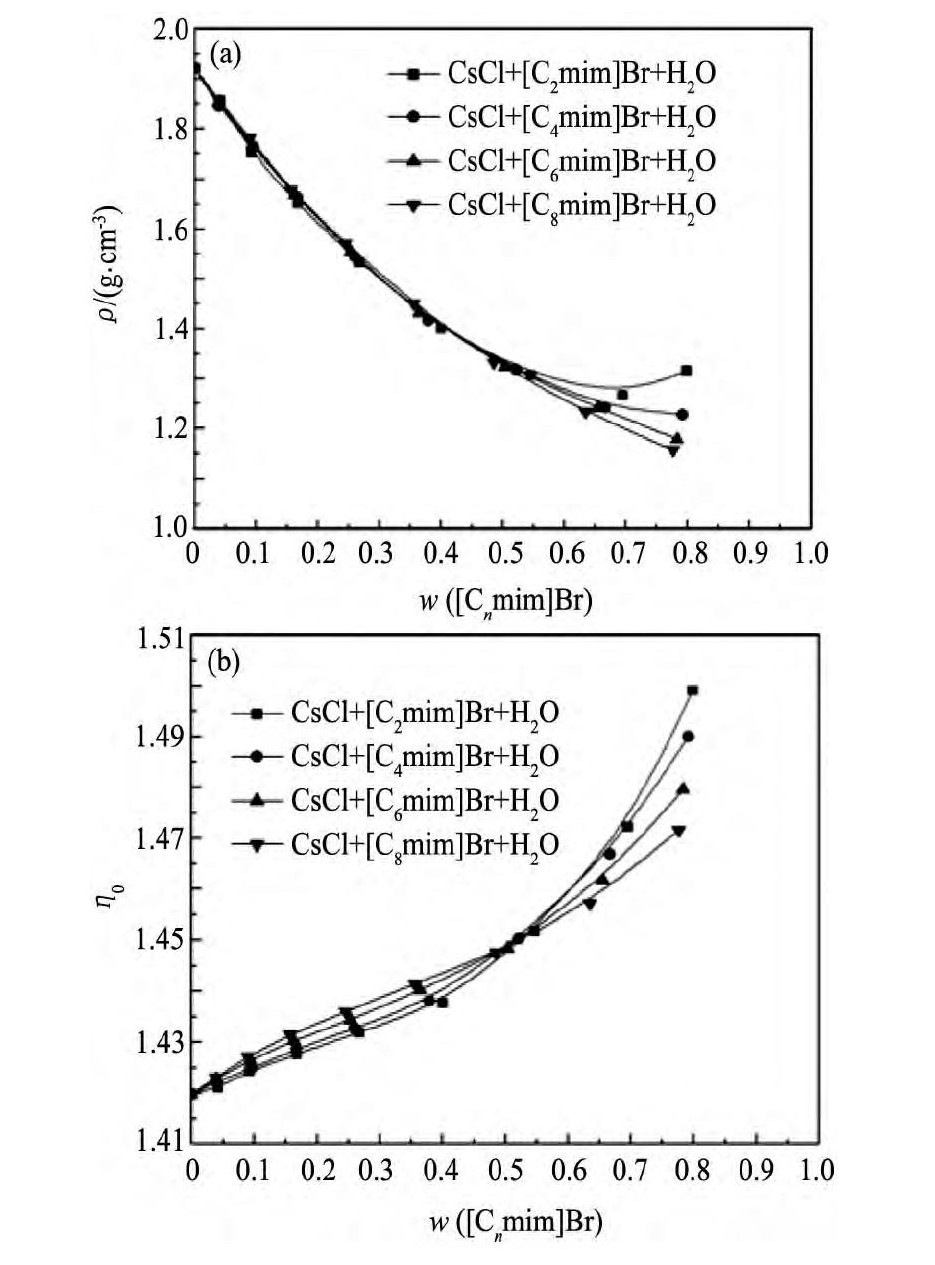
图4 298.15 K时Cs Cl+[Cnmim]Br+H2O体系物化性质变化趋势Fig.4 Physicochemical properties curves of Cs Cl+[Cnmim]Br+H2O ternary system at 298.15 K
(a) Density; (b) Refractive index
(2) 离子液体阳离子取代基的增长对Cs Cl+[Cnmim]Br+H2O三元体系的密度和折光率的影响如下:当离子液体质量分数较低时, 体系密度和折光率随着离子液体阳离子取代基的增长变化很小, 这是由于体系中Cs Cl含量较高, 其密度和折光率主要受Cs Cl的影响;随着离子液体含量的增大, 体系密度及折光率受离子液体取代基长短的影响增大, 离子液体含量较高时体系的密度及折光率大小为[C2mim]Br>[C4mim]Br>[C6mim]Br>[C8mim]Br, 此现象是由于体系中Cs Cl含量急剧下降其密度和折光率主要受离子液体的影响。
图5以Cs Cl+[C2mim Br]+H2O三元体系为例, 描述了所研究体系物化性质随着温度的变化趋势图, 从图5中可以看出密度和折光率曲线图中均出现了交点。交点之前平衡液相的物化性质随着温度的升高而升高, 交点之后随着温度的升高平衡液相的物化性质减小。这是因为体系中离子液体含量较低时体系中Cs Cl含量较高为影响体系物化性质的主要因素;而当体系中离子液体含量较高时其中Cs Cl的含量较小, 该三元混合溶液趋近于离子液体+水二元体系, 此时离子液体成为了影响体系物化性质的主要因素, 而离子液体自身的密度和折光率随着温度的升高而减小所以体系密度和折光率呈现出减小趋势。
3 结论
1.向Cs Cl水溶液中加入离子液体[Cnmim]Br, 体系发生复分解反应, 析出固体Cs Br。
2.Cs Cl+[Cnmim]Br+H2O三元体系饱和溶液中Cs Cl的含量随着离子液体含量的增加、逐渐减小;三元体系中离子液体的侧链增长及体系温度升高导致饱和溶液中Cs Cl饱和浓度增加。
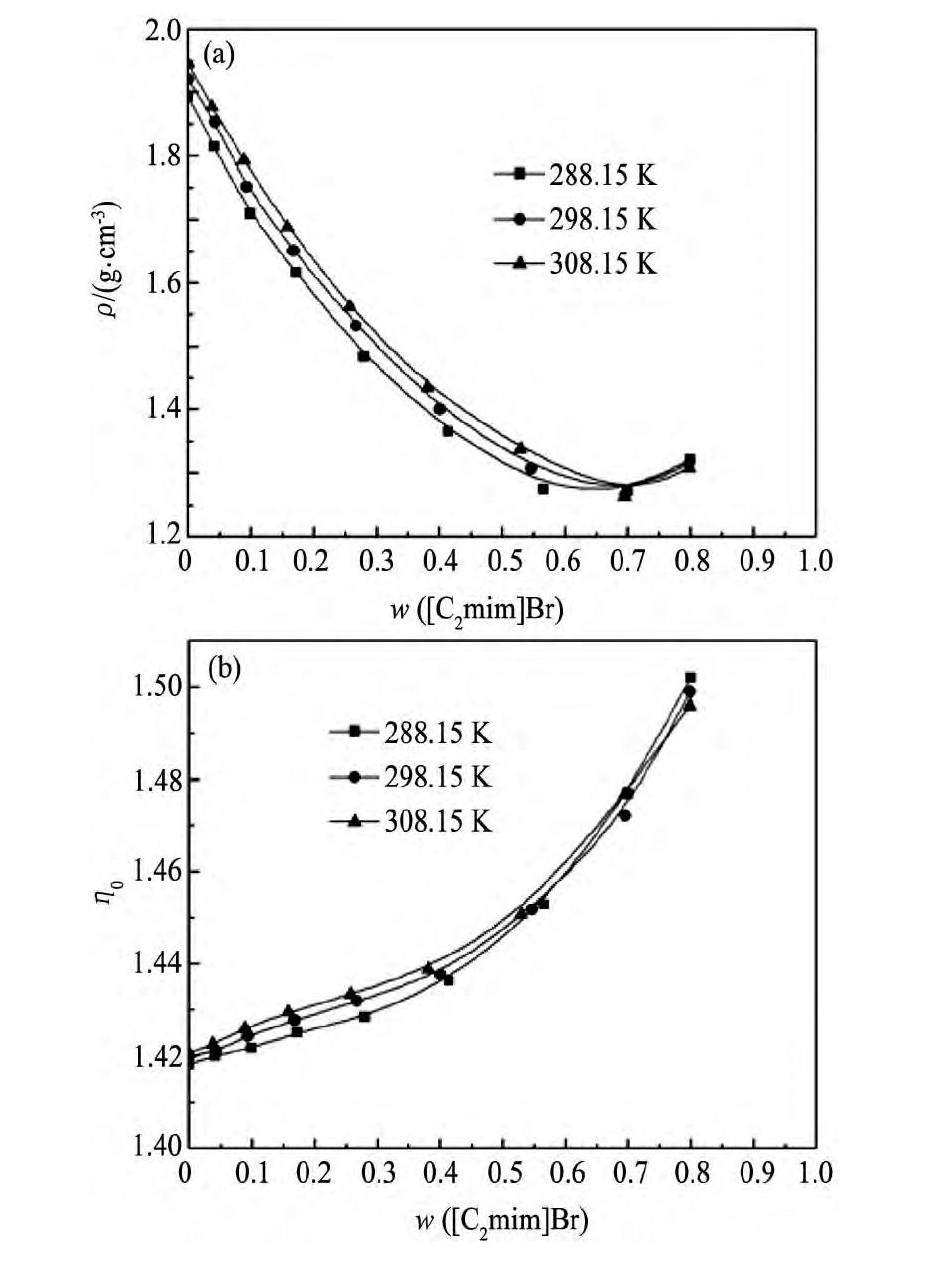
图5 Cs Cl+[C2mim]Br+H2O三元体系物化性质随温度的变化曲线Fig.5Physicochemical properties of Cs Cl+[C2mim]Br+H2O ternary system at different temperatures (a) Density; (b) Refractive index
3.Cs Cl+[Cnmim]Br+H2O饱和溶液的密度和折光率随着离子液体含量的增大呈现不同变化趋势, 体系密度整体下降, 而折光率整体升高。
参考文献
[1] Li Z, Pei Y, Wang H, Fan J, Wang J.Ionic liquidbased aqueous two-phase systems and their applications in green separation processes[J].Trac.Trends in Analytical Chemistry, 2010, 29 (11) :1336.
[2] Wu C, Wang J, Li Z, Jing J, Wang H.Relative hydrophobicity between the phases and partition of cytochrome-c in glycine ionic liquids aqueous two-phase systems[J].Journal of Chromatography A, 2013, 1305 (1) :1.
[3] Pei Y, Li L, Li Z, Wu C, Wang J.Partitioning behavior of wastewater proteins in some ionic liquids-based aqueous two-phase systems[J].Separation Science&Technology, 2012, 47 (2) :277.
[4] Shu Y, Gao M, Wang X, Song R, Lu J, Chen X.Separation of curcuminoids using ionic liquid based aqueous two-phase system coupled with in situ dispersive liquid-liquid microextraction[J].Talanta, 2016, 149:6.
[5] Ren Y Q, Lu Y Q, Peng C J, Liu H L.Solubilities of MBr (M=Na, K) in aqueous systems containing ionic liquid[Bmim]Br[J].CIESC Journal, 2012, 62 (10) :3011. (任颖倩, 陆轶群, 彭昌军, 刘洪来.MBr (M=Na, K) 在离子液体[Bmim]Br水溶液中的溶解度[J].化工学报, 2012, 62 (10) :3011.)
[6] Ren Y, Yue W, Liu G, Peng C, Liu H, Ying H.Solubilities of MCl (M=Na, K) in aqueous systems containing the ionic liquid[Bmim]Cl from (298.15 to 343.15) K[J].Journal of Chemical&Engineering Data, 2011, 56:1341.
[7] Qian J G, Li X, Luan H J, Li H T, Li P R.Electrochemical properties of ionic liquids and solubility of Ir Cl3[J].Chinese Journal of Rare Metals, 2015, 39 (2) :136. (钱建刚, 李鑫, 栾海静, 李海婷, 李彭瑞.离子液体电化学性质及其Ir Cl3溶解度的研究[J].稀有金属, 2015, 39 (2) :136.)
[8] Zeng Y, Xie G, Wang C, Yu X.Stable phase equilibrium in the aqueous quaternary system Rb+, Mg2+//Cl-, borate-H2O at 323 K[J].Journal of Chemical&Engineering Data, 2016, 61 (7) :2419.
[9] Cheng L, An L Y, Zhou K.Solubility of rubidium chloride in different organic solvents[J].Chemical Engineering, 2015, 43 (6) :30. (程丽, 安莲英, 周堃.氯化铷在有机溶剂中的溶解度[J].化学工程, 2015, 43 (6) :30.)
[10] Yang S H, Xie B R, Wang J, Lai X H, Wang H R, Fang M Z.Leaching rubidium oxide hydrated ore in alkaline solution[J].Chinese Journal of Rare Metals, 2015, 39 (9) :861. (杨少华, 谢宝如, 王君, 赖晓晖, 王浩然, 房孟钊.氧化铷熟矿的碱浸出[J].稀有金属, 2015, 39 (9) :861.)
[11] Zhang H, Li S, Zhai Q, Jiang Y, Hu M.Solubilities, densities, and refractive indices for the ternary systems1, 2-propylene glycol+MNO3+H2O (M=Na, K, Rb, Cs) at 25 and 35℃[J].Chemical Engineering Communications, 2014, 201 (3) :323.
[12] Meng R, Li S, Zhai Q, Jiang Y, Lei H, Zhang H, Hu M.Solubilities, densities, and refractive indices for the ternary systems glycerin+MCl+H2O (M=Na, K, Rb, Cs) at (298.15 and 308.15) K[J].Journal of Chemical&Engineering Data, 2011, 56 (12) :4643.
[13] Li Y, Li S, Zhai Q, Marcilla A, Jiang Y, Hu M.Solubility, density, refractive index and viscosity for the polyhydric alcohol+Cs Br+H2O ternary systems at different temperatures[J].Journal of Chemical&Engineering Data, 2013, 58 (6) :1577.
[14] Zhao D, Li S, Zhai Q, Jiang Y, Hu M.Solid-liquid equilibrium (SLE) of the N, N-Dimethylacetamide (DMA) +MCl (M=Na, K, Rb, and Cs) +water ternary systems at multiple temperatures[J].Journal of Chemical&Engineering Data, 2014, 59 (5) :1423.
[15] Tang J, Li S, Zhai Q, Jiang Y, Hu M.Measurements and correlations of the solid-liquid equilibrium of Rb Cl/Cs Cl+[Cnmim]Cl (n=2, 4, 6, 8) +H2O ternary systems at T= (288.15, 298.15, and 308.15) K[J].Journal of Chemical&Engineering Data, 2014, 59 (3) :726.
[16] Li X, Li S, Zhai Q, Jiang Y, Hu M.Phase behavior of[Cnmim]Cl/Br (n=2, 4, 6, 8) +MNO3 (M=Na, K, Rb, Cs) +H2O systems at 298.15 K[J].Journal of Molecular Liquids, 2016, 215:237.
[17] Yin G, Li S, Zhai Q, Jiang Y, Hu M.Phase behavior of aqueous two-phase systems composed of 1-alkyl-3-methylimidazolium bromide+Rb2CO3/Cs2CO3+water[J].Thermochimica Acta, 2013, 566 (16) :149.
[18] Gómez E, González B, Domínguez, A, Tojo A E, Tojo J.Dynamic viscosities of a series of 1-alkyl-3-methylimidazolium chloride ionic liquids and their binary mixtures with water at several temperatures[J].Journal of Chemical&Engineering Data, 2006, 51 (2) :696.
[19] Zhou X T, Fan S S, Liang D Q.Determination of composition of THF solutions by using refractive index[J].China Measurement Technology, 2007, 33 (1) :15. (周锡堂, 樊栓狮, 梁德青.折光率法测定四氢呋喃溶液的组成[J].中国测试, 2007, 33 (1) :15.)
[20] Shannon R.Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides[J].Acta Crystallographica Section A:Crystal Physics, Diffraction, Theoretical and General Crystallography, 1976, 32 (5) :751.