网络首发时间: 2015-06-01 09:39
稀有金属 2016,40(02),149-154 DOI:10.13373/j.cnki.cjrm.2016.02.009
氯化锂溶液磷酸盐沉淀法除镁的热力学分析
肖超 肖连生 曾理 高从堦
中南大学冶金与环境学院
摘 要:
锂镁离子性质接近,锂镁分离是高纯氯化锂制备过程的关键问题。针对磷酸盐沉淀法除镁工艺进行热力学分析。根据平衡原理和质量守恒定律,分别绘制了298 K时Mg2+-PO3-4-H2O,Li+-Mg2+-PO3-4-H2O,Li+-Mg2+-NH+4-PO3-4-H2O系热力学平衡图,并考察了工艺参数对除镁的影响。研究结果表明:锂离子的存在不利于磷酸盐除镁,磷酸铵镁盐法除镁效果优于磷酸镁盐法,平衡镁含量随着溶液中总氮浓度升高、锂浓度降低而降低。当氯化锂溶液中[Li]T=1.00 mol·L-1,[N]T=0.03 mol·L-1,初始[Mg]T=0.01 mol·L-1,初始[P]T=0.03 mol·L-1时,p H范围为4.5~13.0时,存在4个平衡固相稳定区即Mg HPO4(5.9<p H<6.6),Mg NH4PO4(6.6<p H<9.6),Mg(OH)2(10.0<p H<13.0),Li3PO4(6.6<p H<13.0),此时Mg NH4PO4稳定区对应镁浓度约为1×10-3.5mol·L-1,满足深度除镁的效果。验证实验表明,当溶液p H为8.0时,溶液初始Li2O,Mg浓度分别为14.95和0.45 g·L-1,加入1.35倍镁摩尔量的磷酸铵,25℃搅拌4 h后,溶液残留镁、磷量分别为0.011和0.004 g·L-1,镁除去率为97.56%。理论计算与验证实验结论相符。
关键词:
氯化锂;除镁;磷酸铵镁;热力学;
中图分类号: TQ131.11
作者简介:肖超(1984-),男,湖南衡阳人,博士研究生,研究方向:稀有金属提取冶金;E-mail:shawchao@qq.com;;肖连生,教授;电话:13975894859;E-mail:xls1211@sina.com;
收稿日期:2014-12-30
基金:人力资源与社会保障部中国博士后科学基金项目(2013M531809)资助;
Thermodynamic Study on Removal of Magnesium from Lithium Chloride Solutions Using Phosphate Precipitation Method
Xiao Chao Xiao Liansheng Zeng Li Gao Congjie
School of Metallurgy and Environment,Central South University
Abstract:
The separation of magnesium from lithium chloride solution is the key point of pure Li Cl preparation for the similar chemical property between lithium and magnesium. Thermodynamic analysis was conducted on the removal of magnesium from lithium chloride solutions by phosphate precipitation method. The thermodynamic equilibrium diagrams of Mg2 +-PO3-4-H2 O,Li+-Mg2 +-PO3-4-H2 O,Li+-Mg2 +-NH+4-PO3-4-H2 O system at 298 K were established based on the thermodynamic calculation,respectively. The effect of process parameters on the removal of magnesium was also investigated. The results showed that the presence of lithium ion was harmful to the removal of magnesium. The method of magnesium ammonium phosphate precipitation was better than phosphate magnesium precipitation on the separation of magnesium from lithium chloride solutions. Equilibrium concentration of magnesium decreased with the increase in total nitrogen concentration and the decrease in lithium concentration. There were four stable solid phase regions in p H range of 4. 5 ~ 13. 0 at [Li]T= 1. 00 mol·L- 1,[N]T= 0. 03 mol·L- 1,the original [Mg]= 0. 01 mol·L- 1,[P]= 0. 03 mol·L- 1in lithium chloride solutions,which were Mg HPO4( 5. 9 < p H < 6. 6),Mg NH4PO4( 6. 6 < p H < 9. 6),Mg( OH)2( 10. 0 < p H < 13. 0)and Li3PO4( 6. 6 < p H < 1. 3),respectively,and the corresponding magnesium concentration in Mg NH4PO4 stable solid phase regions was 1 × 10- 3. 5mol·L- 1,which satisfied the efficient removal of magnesium requirements. The demonstration test results showed that the concentrations of Li2 O and Mg were 14. 95 and 0. 45 g·L- 1,respectively,with ammonium phosphate trihydrate addition of 1. 35 times theoretical amount at p H 8. 0 and stirring at 25 ℃ for 4 h,the concentrations of residual magnesium and phosphorus were only 0. 011 and0. 004 g·L- 1,respectively,and magnesium removal rate was 97. 56%. Theoretical calculation and experimental results were consistent.
Keyword:
lithium chloride; magnesium removal; magnesium ammonium phosphate; thermodynamics;
Received: 2014-12-30
锂是重要的化学原料,广泛应用于冶金、材料、新能源等领域[1,2,3,4]。锂和镁的性质接近且常共生,多数锂产品对镁的含量要求非常高,例如无水氯化锂、电池级碳酸锂等产品标准中均严格限定了镁的含量。因此在盐湖卤水提锂、氯化锂产品精制、电池级碳酸锂产品制备等诸多锂冶炼过程均面临锂镁分离的问题[5,6]。目前从锂盐溶液中除镁的方法主要包括溶剂萃取法[7,8,9,10]、离子交换法[11]、膜分离[12]、沉淀法[13,14]等。其中沉淀法因具有除镁效果好、过程操作简单、成本低等突出优点而得到广泛研究和应用。目前沉淀法分离锂镁主要利用锂镁氢氧化物溶度积的差异,通过加入氨水、氢氧化钠等使得镁选择性沉淀而与锂分离,氨水沉淀法无法深度除镁,氢氧化钠沉淀法则容易造成锂的损失,故亟需开发新的锂盐除镁工艺。
利用镁盐能够与磷酸盐在一定条件下形成难溶的磷酸镁或磷酸铵镁的特点,在( 铵) 镁盐除磷[15,16]、镁盐除氨氮[17]等领域已有较深入的研究和应用,而采用磷酸盐除镁却鲜有报道。因此,本文通过热力学分析,依次绘制一定条件下的Mg2 +-PO43--H2O,Li+-Mg2 +-PO43--H2O,Li+-Mg2 +-NH4+-PO43--H2O系中磷酸盐除镁的热力学平衡图,以期能够深化对磷酸盐除镁的认识,最终对锂盐体系采用磷酸盐除镁工艺的确定提供理论指导。
1 热力学数据处理及计算
在Li+-Mg2 +-NH4+-PO43--H2O体系中,可能存在H+, OH-, Mg2 +, Mg OH+, Mg PO4-, Mg HPO4( aq),Mg H2PO4+,Mg NH32+,Mg ( NH3)22+,Mg( NH3)32+, NH3, NH4+, Li+, Li OH, Li HPO4-,PO43-,HPO42-,H2PO4-,H3PO4; 可能存在的沉淀物有Li3PO4,Mg HPO4,Mg3( PO4)2,Mg NH4PO4,Mg( OH)2。溶液中可能存在的平衡反应以及对应的平衡常数列于表1。
设[Mg]T,[P]T,[Li]T,[N]T分别为溶液中游离镁、磷、锂、氮的总浓度,“[]”为溶液中各游离组分的浓度,由于缺乏相关的物质活度系数,故本研究计算过程均以离子浓度代替活度。为了便于研究除杂过程,设定未有不溶物出现时,体系某物质的浓度,即为初始浓度“初始[]T”,即“初始[A]T”= ( 游离态A物质的量+ 不溶态A物质的量) /溶液体积。
表1 Li+-Mg2 +-NH4+-PO43--H2O体系化学反应及其平衡常数( 298 K)Table 1Equilibrium reactions and constants for Li+-Mg2 +-NH4+-PO43--H2O system at 298 K 下载原图
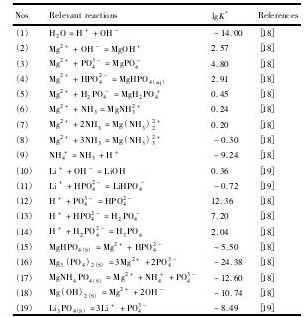
K-Reaction equilibrium constant
表1 Li+-Mg2 +-NH4+-PO43--H2O体系化学反应及其平衡常数( 298 K)Table 1Equilibrium reactions and constants for Li+-Mg2 +-NH4+-PO43--H2O system at 298 K
根据同时平衡和物质守恒原理,可以得到如下关系式。
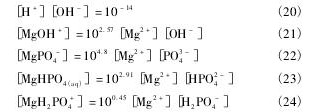
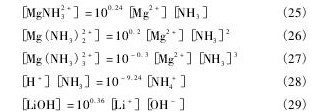
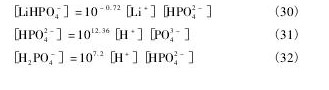
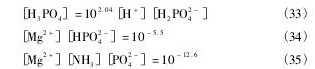
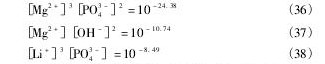
根据质量守恒定律,溶液中Mg,P,Li,N总量如下:
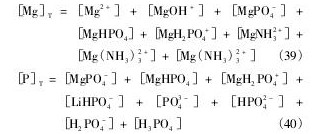
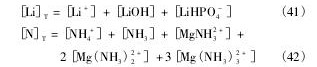
[Mg]T,[P]T,[Li]T,[N]T分别指溶液中Mg,P,Li,N的总量。
分别设定各体系游离镁、磷、锂、氮的总浓度,以及溶液的p H值,通过各体系内各游离物质之间的对应关系,同时联立体系[Mg]T,[P]T,[Li]T,[N]T的计算式求解,即可得到各体系中各物质的浓度。
2 结果与讨论
本文依次对Mg2 +-PO43--H2O,Li+-Mg2 +-PO43--H2O,Li+-Mg2 +-NH4+-PO43--H2O系的热力学进行研究,以论证磷酸盐除镁的可行性,并研究溶液中Li+,NH4+含量和p H值变化对磷酸盐除镁的影响,最终对Li+-Mg2 +-NH4+-PO43--H2O系进行系统的研究,以期阐明氯化锂体系中磷酸盐除镁的原理。
2. 1 Mg2 +-PO43--H2O系中磷酸盐除镁
图1 为Mg2 +-PO43--H2O系在不同游离磷浓度下溶液中游离镁量与溶液p H关系。由图1 可知:随着溶液p H值的增大,稳定存在的固相依次为Mg HPO4,Mg2( PO4)3,Mg( OH)2。随着溶液游离磷浓度的增大,Mg3( PO4)2的稳定区域向高p H值范围移动,对应稳定区内游离镁量随游离磷浓度的增大反而升高。说明该体系以Mg2( PO4)3除镁应控制溶液p H = 8. 9 ~ 11. 6,溶液游离[P]T~ 0. 005mol·L- 1时,溶液中镁浓度可以降至1 × 10- 2. 2~1 × 10- 5. 2mol·L- 1,无需再增加磷盐使用量,可以实现低磷过量系数下有效除镁。
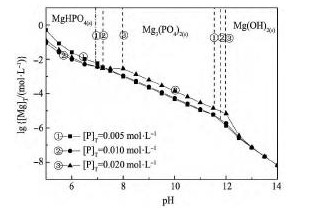
图1 Mg2 +-PO43--H2O系lg[Mg]T与p H关系Fig. 1lg[Mg]T- p H diagram of Mg2 +-PO43--H2O system at different [P]Tconcentrations
2. 2 Li+-Mg2 +-PO43--H2O系中磷酸盐除镁
图2 所示Li+-Mg2 +-PO43--H2O系中游离镁浓度与溶液p H关系。从图2 可知随着溶液p H值的增加,溶液中镁的稳定固相依次为Mg HPO4,Mg3( PO4)2,Mg ( OH)2; p H = 7. 5 ~ 13. 0 时,有Li3PO4固相产生。随着溶液中锂浓度降低,Li3PO4和Mg3( PO4)2的稳定区均向高p H值方向移动。在Mg3( PO4)2稳定区,溶液游离锂浓度的增大,对应游离镁的平衡浓度也增大,说明锂和镁与磷酸根的结合具有竞争性,高锂溶液( [Li]T= 1. 00mol·L- 1) 不利于镁与磷酸根结合,而且游离镁的浓度随p H值的增大而基本保持不变,这与Mg2 +-PO43--H2O体系完全不同。
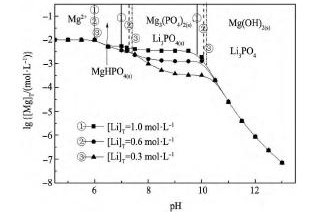
图2 Li+-Mg2 +-PO43--H2O系不同锂浓度下lg[Mg]T与p H关系Fig. 2 lg[Mg]T- p H diagram of Li+-Mg2 +-PO43--H2O system at different [Li]Tconcentrations ( Initial [P]T= 0. 03mol·L- 1,initial [Mg]T= 0. 01 mol·L- 1)
图3 为Li+-Mg2 +-PO43--H2O系中,不同初始[P]T下lg[Mg]T与p H关系。结果表明,当初始[P]T由0. 03 mol·L- 1增至0. 06 mol·L- 1时,Mg3( PO4)2稳定区对应的镁浓度几乎相同。具体来说,在高锂低镁( [Li]T= 1. 00 mol·L- 1,初始[Mg]T=0. 01 mol·L- 1) 溶液中,加入4. 5 ~ 9. 0 倍理论沉淀镁量( 初始[P]= 0. 03 ~ 0. 06 mol·L- 1) 的磷,体系对应[Mg]T= 1 × 10- 2. 4mol·L- 1( 0. 004 mol·L- 1) ,说明未能达到高效除镁的效果。
热力学计算说明在高锂低镁体系中,以Mg3( PO4)2形式无法实现低沉淀剂磷加入系数下高效除镁。
2. 3 Li+-Mg2 +-NH4+-PO43--H2O系中磷酸铵盐除镁
图4,5 表示不同条件下Li+-Mg2 +-NH4+-PO43--H2O系中lg[Mg]T与p H关系。在本研究p H范围内,Mg HPO4,Mg NH4PO4,Mg3( PO4)2,Mg( OH)2对应稳定区p H分别为6. 1 ~ 6. 5,6. 5 ~ 9. 5,9. 5 ~10. 5,10. 5 ~ 13. 0,Li3PO4的稳定区p H为6. 5 ~13. 0。
图4 表示, 随着溶液游离锂浓度增大,Mg NH4PO4的稳定区压缩,对应游离镁浓度降低。说明该体系中Li+和Mg2 +与PO43-的结合同样形成竞争, 锂的存在降低溶液磷浓度, 不利于Mg NH4PO4的生成。
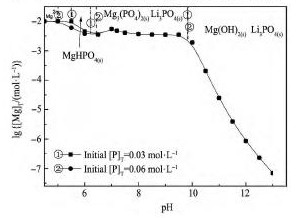
图3Li+-Mg2 +-PO43--H2O体系不同磷浓度下lg[Mg]T与p H关系Fig. 3 lg[Mg]T- p H diagram of Li+-Mg2 +-PO43--H2O system at different [P]additions( Initial [Mg]T= 0. 01 mol·L- 1)
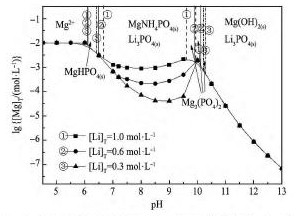
图4Li+-Mg2 +-NH4+-PO43--H2O体系不同锂浓度下lg[Mg]T与p H关系Fig. 4lg[Mg]T- p H diagram of Li+-Mg2 +-NH4+-PO43--H2O system at different [Li]Tconcentrations ( Initial [Mg]T= 0. 01 mol·L- 1,initial [P]T= 0. 03 mol·L- 1)
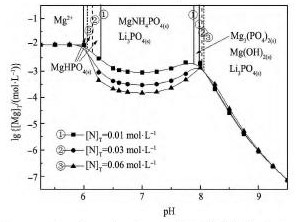
图5Li+-Mg2 +-NH4+-PO43--H2O体系不同铵浓度下lg[Mg]T与p H关系Fig. 5lg[Mg]T- p H diagram of Li+-Mg2 +-NH4+-PO43--H2O system at different [N]Tconcentrations( Initial [Mg]T= 0. 01 mol·L- 1,initial [Li]T= 0. 1 mol·L- 1)
图5 表明, 随着溶液游离铵浓度增加,Mg NH4PO4的稳定区明显增大,而Mg HPO4,Mg3( PO4)2的稳定区减少甚至消失。当溶液[N]T分别为0,0. 01,0. 03,0. 06 mol·L- 1时,在Mg NH4PO4的稳定区,对应[Mg]T浓度分别为1 × 10- 2. 5,1 ×10- 3. 0,1 × 10- 3. 5,1 × 10- 3. 8mol·L- 1,说明提高[N]T能降低Mg NH4PO4的稳定区对应游离镁浓度,实现磷酸铵镁法从锂盐溶液中高效除镁。
图6 表示,除镁时,随着磷加入量从0. 025 增至0. 050 mol·L- 1,Mg NH4PO4稳定区对应平衡镁浓度几乎不变,说明磷酸铵镁法除镁时,沉淀剂磷的加入量略高于理论量即可,再增加磷的加入量并不能提高镁的沉淀率。
热力学分析表明,对于含[Li]T= 1. 00 mol·L- 1,[Mg]T= 0. 01 ~ 0. 10 mol·L- 1的的高锂低镁溶液,较好的Mg NH4PO4法除镁工艺为: 控制溶液p H =7. 5 ~ 9. 0,溶液[N]T= 0. 075 mol·L- 1,加入的磷酸盐略大于理论量,当温度为25 ℃,反应达到平衡时,溶液中镁浓度为1 × 10- 3. 5~ 1 × 10- 3. 8mol·L- 1。说明,采用磷酸铵镁沉淀法能有效地除去氯化锂溶液中的镁。
2. 4 验证性实验
取1000 ml含镁氯化锂溶液,Li2O的浓度为14. 95 g·L- 1,Mg的浓度为0. 45 g·L- 1,加入5. 1 g三水磷酸铵( 1. 35 倍镁量) ,反应过程溶液p H ~8. 0,于25 ℃ 搅拌4 h后过滤,得到除镁后液。除镁后液定容至1000 ml采用ICP-AES分析溶液Li2O,P,Mg浓度分别为14. 350,0. 004 g·L- 1( 1 × 10- 3. 89mol·L- 1) 和0. 011 g·L- 1( 1 × 10- 3. 34mol·L- 1) ,计算表明镁的除去率为97. 56% 。理论计算结果表明,净化后溶液磷、镁浓度分别为0. 0031 g·L- 1( 1 ×10- 4mol·L- 1) 和0. 006 g·L- 1( 1 × 10- 3. 7mol·L- 1) ,镁除去率为98. 66% ,实验值与理论值非常接近,证明了该热力学模型的正确性。
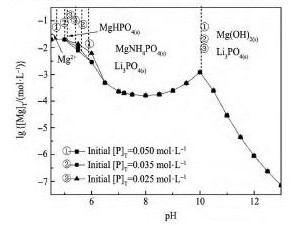
图6Li+-Mg2 +-NH4+-PO43--H2O体系初始磷浓度下lg[Mg]T与p H关系Fig. 6 lg[Mg]T-p H of system with different concentrations ( Initial [Li]T=1. 00 mol·L- 1,initial [Mg]T= 0. 02 mol·L- 1,initial [N]T=0. 075 mol·L- 1)
3 结论
1. 分别绘制了25 ℃ 时Mg2 +-PO43--H2O,Li+-Mg2 +-PO43--H2O, Li+-Mg2 +-NH4+-PO43--H2O系热力学平衡图,论证了磷酸盐除镁的可行性。
2. Li+-Mg2 +-PO43--H2O系中在本研究p H范围,在磷酸镁沉淀区域,镁的平衡浓度随着溶液中锂浓度的降低而越低,而与磷的加入量和溶液p H值关系不明显,在本文热力学研究范围内,Mg3( PO4)2的稳定区,对应镁浓度[Mg]T约1 × 10- 2. 4mol·L- 1,证明采用磷酸镁法难以深度除镁。
3. Li+-Mg2 +-NH4+-PO43--H2O系在本研究p H范围内,随着溶液初始[Li]T浓度降低或[N]T浓度的提高,Mg NH4PO4的稳定区均向p H值两侧增大,对应游离镁浓度可以降至1 × 10- 3. 5~ 1 × 10- 4mol·L- 1,故通过控制溶液初始[Li]T,[N]T浓度可以采用磷酸铵镁法达到深度除镁的目的。
4. 实证取1000 ml含镁氯化锂溶液( Li O2为14. 95 g·L- 1,Mg为0. 45 g·L- 1) ,加入5. 1 g三水磷酸铵,控制反应p H值为8. 0,在25 ℃ 搅拌4 h后过滤,滤液中氧化锂、磷、镁浓度分别为14. 350,0. 004 和0. 011 g·L- 1,镁除去率为97. 56% 。理论计算与实验数据得到很好的吻合。
参考文献
[1] Chen T,Yan S Y,Kang Z H.Progress on the extraction of lithium from the salt lake brine in China[J].Salt and Chemical Industry,2006,36(2):19.(陈婷,闫书一,康自华.我国盐湖卤水提锂的研究进展[J].盐业与化工,2006,36(2):19.)
[2] Lin D Z.Uses of lithium and its resource exploitation[J].China Safety Science Journal,2004,14(9):72.(林大泽.锂的用途及其资源开发[J].中国安全科学学报,2004,14(9):72.)
[3] Zhang S B,Gao B L,Wang Z W,Shi Z N,Hu X W.Preparation of lithium oxide from lithium hydroxide monohydrate[J].Chinese Journal of Rare Metals,2015,39(9):807.(张世镖,高炳亮,王兆文,石忠宁,胡宪伟.单水氢氧化锂制备氧化锂的研究[J].稀有金属,2015,39(9):807.)
[4] Xue J,Hu S Y.Review on lithium industry in China[J].Chemical Industry and Engineering Progress,2011,30(4):782.(雪晶,胡山鹰.我国锂工业现状及前景分析[J].化工进展,2011,30(4):782.)
[5] Yin H J,Deng T L,Li D C.Progress on lithium and magnesium separation and recovery from the salt lake brines[J].Inorganic Chemical Industry,2009,41(5):1.(尹红军,邓天龙,李栋婵.盐湖卤水资源锂镁分离提取的研究进展[J].无机盐工业,2009,41(5):1.)
[6] Liu X L,Zhong H,Tang Z J.Current status and existing problems of lithium extraction technology from salt lake[J].Inorganic Chemical Industry,2009,16(6):4.(刘向磊,钟辉,唐中杰.盐湖卤水提锂工艺技术现状及存在的问题[J].无机盐工业,2009,16(6):4.)
[7] Yang L X,Wu S X,Liu X L,He J,Chen W G.Lithium and magnesium separation from salt lake brine by tributyl phosphate under action of co-extraction reagent Cl O-4[J].Chemical Journal of Chinese Universities,2013,34(1):55.(杨立新,邬赛祥,刘肖丽,何靖,陈文光.共萃剂Cl O-4作用下磷酸三丁酯分离盐湖卤水锂镁[J].高等学校化学学报,2013,34(1):55.)
[8] Shi D,Li J F,Zhang B,Nie F,Zeng Z M,Li L J.Process study on N523-TBP-sulfonated kerosene extraction system for extraction of lithium from brine saturated by magnesium chloride[J].Journal of Salt Lake Resarch,2013,21(2):52.(时东,李晋峰,张波,聂峰,曾忠民,李丽娟.N523-TBP-磺化煤油萃取体系从饱和氯化镁卤水中萃取锂的工艺研究[J].盐湖研究,2013,21(2):52.)
[9] Bukowskya H,Uhlemann E,Gloeb K,Mühlb P.The separation of calcium and magnesium from lithium chloride by liquid-liquid extraction with di(2-ethylhexyl)phosphoric acid[J].Hydrometallurgy,1992,28(3):323.
[10] Sun X L,Chen B Z,Xu H,Shi X C.Extraction of lithium from bittern[J].Journal of Central South University:Science and Technology,2007,38(2):262.(孙锡良,陈白珍,徐徽,石西昌.从盐湖卤水中萃取锂[J].中南大学学报:自然科学版,2007,38(2):262.)
[11] Zhang L F,Chen B Z,Shi X C,Ma L W,Chen Y.Synthesis and adsorption property of H2Ti O3type adsorbent[J].Chinese Journal of Nonferrous Metals,2010,20(9):1849.(张丽芬,陈白珍,石西昌,马立文,陈亚.偏钛酸型锂吸附剂的合成及吸附性能[J].中国有色金属学报,2010,20(9):1849.)
[12] Yang G,Shi H,Liu W Q,Xing W H,XU N P.Investigation of Mg2+/Li+separation by nanofiltration[J].Chinese Journal of Chemical Engineering,2011,19(4):586.
[13] Cui X Q,Cheng F Q,Zhang A H,Li Y G.Study on precipitation separating technique for magnesium and lithium from salt lake brine[J].Inorganic Chemical Industry,2012,44(7):33.(崔小琴,程芳琴,张爱华,李永刚.盐湖卤水镁锂沉淀分离工艺研究[J].无机盐工业,2012,44(7):33.)
[14] Xu H,Xu L,Chen B Z,Shi X C,Yang X.Separating technique for magnesium and lithium from high Mg/Li ratio salt lake brine[J].Journal of Central South University:Science and Technology,2009,40(1):36.(徐徽,许良,陈白珍,石西昌,杨鑫.高镁锂比盐湖卤水镁锂分离工艺[J].中南大学学报(自然科学版),2009,40(1):36.)
[15] He G X,He L H,Zhao Z W,Chen X Y,Gao L L,Liu X H.Thermodynamic study on phosphorus removal from tungstate solution via magnesium salt precipitation method[J].Transactions of Nonferrous Metals Society of China,2013,23(11):3440.
[16] Uludag-demirer S,Demirer G N,Chen S.Ammonia removal from anaerobically digested dairy manure by struvite precipitation[J].Process Biochemistry,2005,40(12):3667.
[17] Jia Y H,Li J,Liu H B,Sun J Y.A new method for removing NH3-N in landfill leachate MAP precipitation[J].Chinese Journal of Environmental Engineering,2007,1(8):229.(贾玉鹤,李晶,刘洪波,孙建业.磷酸铵镁沉淀法去除垃圾渗滤液中氨氮的实验研究[J].环境工程学报,2007,1(8):229.)
[18] Michalowski T,Pietrzyk A.A thermodynamic study of struvite+water system[J].Talanta,2006,68(3):594.
[19] Lee Myeong-Hee,Kim Jin-Young,Song Hyun-Kon.A hollow sphere secondary structure of Li Fe PO4nanoparticles[J].Chem.Commun.,2010,46(36):6795.