DOI:10.19476/j.ysxb.1004.0609.2017.08.26
拜耳法过程中水合铝硅酸钠的析出活性
潘晓林,蒋 涛,侯宪林,吴 艳,于海燕,涂赣峰
(东北大学 冶金学院,沈阳 110819)
摘 要:以分析纯化学试剂NaAlO2、NaOH和Na2SiO3·9H2O为原料配制过饱和含硅铝酸钠溶液,模拟三水铝石型铝土矿溶出过程研究不同时间析出水合铝硅酸钠的活性,并通过XRD、SEM-EDS和FT-IR等手段探讨其影响铝酸钠溶液稳定性的机理。结果表明:在145 ℃、SiO2初始浓度为4.9 g/L时,大部分的脱硅产物在前30min内生成,反应到60 min后,基本达到平衡;脱硅产物主要由无定型沸石、沸石、A型沸石和方钠石组成,其中A型沸石只在反应初期生成,形貌为规则的立方体晶体,晶胞体积很大,随着反应时间的延长,A型沸石消失;脱硅产物在铝酸钠溶液中的稳定性由大到小的顺序为沸石、方钠石、A型沸石、无定型沸石;延长脱硅反应时间可以增加水合铝硅酸钠的晶体尺寸和结晶度,降低其析出活性,有利于提高铝酸钠溶液的稳定性。
关键词:拜耳法;脱硅产物;水解;铝酸钠溶液;晶体活性
文章编号:1004-0609(2017)-08-1748-08 中图分类号:TF821 文献标志码:A
在三水铝石型铝土矿溶出的过程中,矿石中活性含硅矿物如高岭石会被铝酸钠溶液溶解,致使溶液中含有大量的二氧化硅。这种含硅的铝酸钠溶液很不稳定,很容易反应生成结构复杂且溶解度很低的水合铝硅酸钠,这种脱硅产物俗称“钠硅渣”。生成的水合铝硅酸钠从液相中析出,会造成氧化铝和氧化钠的损失、在加热器壁和管道上形成结疤、恶化赤泥沉降活性和降低成品质量等危害。近年来,相关的研究工作主要集中在水合铝硅酸钠的形成机理和铝酸钠溶液脱硅动力学和热力学等方面[1-10]。彭志宏等[1]在研究二氧化硅在铝酸钠溶液中的反应行为时认为溶液中游离碱和氧化铝浓度升高可阻碍钠硅渣析出反应的进行,不利于钠硅渣的形成。刘桂华[2]等对含硅铝酸钠溶液中相关反应进行了热力学计算。BARNES等[3-4]在研究脱硅动力学时比较了添加方钠石、钙霞石作种子和不添加种子时的脱硅动力学行为。张亦飞等[6]研究铝酸钠溶液分解条件下溶液中过饱和二氧化硅的稳定性,并得出了铝酸钠溶液中超溶解度的计算公式,进而分析铝硅酸钠的成核机理。PARK等[10]研究水合铝硅酸钠的形成热力学。
在含硅铝酸钠的溶液中存在着Al—O—Al和 Al—O—Si以及Si—O—Si键连接的网状大阴离子[11],其中硅主要以SiO2(OH)22-形式存在,硅浓度较高的铝酸钠溶液中也有聚合态硅酸根离子。在不同条件下析出水合铝硅酸钠的主要物相[12]为沸石类(zeolite/ZEO)、方钠石类(sodalite/SOD)、霞石类(cancrinite/CAN)等。溶液中硅铝酸根离子和聚合的铝酸根离子可与Al(OH)4-、SiO2(OH)22-相互转化,这使得水合铝硅酸钠的结构和形成机理十分复杂。同时,在溶出后稀释的过程容易发生水解反应,使得本已溶入液相中的氧化铝重新进入赤泥,造成损失[13-14]。本文作者前期研究[15-16]发现:增加预脱硅工序和在溶出过程中添加CaO可以大幅降低脱硅产物的活性,从而降低铝酸钠溶液的水解率。其中析出水合铝硅酸钠的活性对铝酸钠溶液的水解反应有着直接的影响。因此,为降低拜耳法过程的实际水解损失,研究含硅铝酸钠溶液中脱硅产物的析出机理及其活性具有重要意义。
本文作者以分析纯化学试剂为原料,配制过饱和的含硅铝酸钠溶液,模拟三水铝石溶出时的脱硅反应条件,通过研究不同时间生成的水合铝硅酸钠的物相组成和微观组织形态,确定水合铝硅酸钠结构演变规律与析出活性的关系,为降低拜耳法过程实际水解损失提供理论支持和实际指导。
1 实验
1.1 过饱和含硅铝酸钠溶液的制备
以分析纯NaAlO2、NaOH和Na2SiO3·9H2O为原料,配制溶液的苛性碱浓度(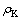 )为148.6 g/L,氧化铝浓度(
)为148.6 g/L,氧化铝浓度(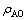 )为104.7 g/L,二氧化硅浓度(
)为104.7 g/L,二氧化硅浓度(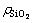 )为4.9 g/L,苛性比(
)为4.9 g/L,苛性比(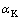 )。其中苛性碱、Al2O3和SiO2浓度分别采用酸碱中和滴定法、EDTA络合滴定法和硅钼蓝比色光度法测定。苛性比
)。其中苛性碱、Al2O3和SiO2浓度分别采用酸碱中和滴定法、EDTA络合滴定法和硅钼蓝比色光度法测定。苛性比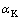 按式(1)计算:
按式(1)计算:
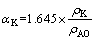 (1)
(1)
1.2 水合铝硅酸钠的制备
试验在低压群釜试验装置中进行,取100 mL配制好的溶液装入钢弹中,密封。设置反应温度为145 ℃,转速为100 r/min,反应时间分别为15、30、60、120和240 min。反应完成后进行固液过滤分离,分析液相中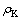 、
、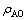 和
和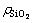 浓度并计算含硅铝酸钠溶液中SiO2反应率,其中SiO2反应率(
浓度并计算含硅铝酸钠溶液中SiO2反应率,其中SiO2反应率(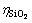 )按式(2)计算;固相用去离子水洗净,烘干待用。
)按式(2)计算;固相用去离子水洗净,烘干待用。
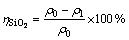 (2)
(2)
式中: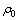 为原始溶液中SiO2浓度;
为原始溶液中SiO2浓度;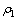 为反应后溶液中SiO2浓度。
为反应后溶液中SiO2浓度。
1.3 水合铝硅酸钠的表征
对析出的水合铝硅酸钠固相进行XRD(岛津XRD-7000,Cu Kα靶辐射)、SEM(SHIMADZU SSX-550)、粒度(Mastersizer Hydro 2000MU,分散介质为水)和FT-IR(岛津IRAffinity-1型傅里叶红外变换光谱仪)分析。
1.4 铝酸钠溶液稳定性影响试验
以分析纯NaAlO2和NaOH为原料,配制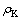 =144.2 g/L、
=144.2 g/L、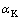 =1.44的铝酸钠溶液,分别添加水合铝硅酸钠制备的不同时间析出的脱硅产物,添加量为5 g/L,控制反应温度为95 ℃,搅拌速度为100 r/min,在反应时间为30、60、120 min时分别取样分析液相成分并计算铝酸钠溶液水解率。水解率(
=1.44的铝酸钠溶液,分别添加水合铝硅酸钠制备的不同时间析出的脱硅产物,添加量为5 g/L,控制反应温度为95 ℃,搅拌速度为100 r/min,在反应时间为30、60、120 min时分别取样分析液相成分并计算铝酸钠溶液水解率。水解率(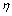 )按式(3)计算。
)按式(3)计算。
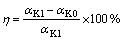 (3)
(3)
式中: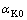 为反应前铝酸钠溶液的苛性比;
为反应前铝酸钠溶液的苛性比;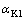 为添加脱硅产物反应后铝酸钠溶液的苛性比。
为添加脱硅产物反应后铝酸钠溶液的苛性比。
2 结果与讨论
2.1 时间对铝酸钠溶液浓度的影响
过饱和的含硅铝酸钠溶液很不稳定,反应开始便会有水合铝硅酸钠析出。随着时间的延长,水合铝硅酸钠析出量逐渐增多直至反应达到平衡,溶液的成分也发生相应的变化。不同反应时间铝酸钠溶液成分分析结果见表1。
表1 不同反应时间铝酸钠溶液成分的变化
Table 1 Change of concentration of sodium aluminate solution at different reaction times
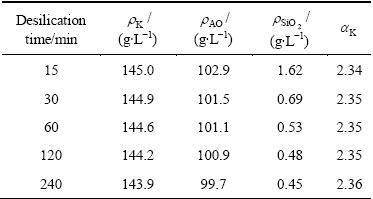
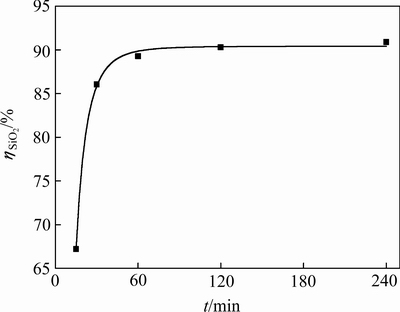
图1 铝酸钠溶液中SiO2反应率与反应时间关系
Fig. 1 Relationship between reaction rate of SiO2 and reaction time in sodium aluminate solution
由表1可知,溶液中苛性碱、Al2O3和SiO2浓度均随着反应时间的延长而逐渐降低,说明反应时间的增加有利于水合铝硅酸钠的生成。反应时间与溶液中SiO2反应率的关系如图1(曲线斜率表示SiO2的反应速率)所示。由图1分析可知,大部分脱硅反应在前30 min内完成,随着反应时间的延长溶液中SiO2反应率逐渐升高,但反应速率逐渐降低至趋近于0。在反应初期,由于溶液中SiO2浓度很高,化学反应推动力强,脱硅反应会迅速进行。随着时间的延长,溶液中SiO2浓度降低,化学反应推动力减弱,脱硅反应速率也相应降低,在60 min后脱硅反应趋于平衡。
2.2 时间对脱硅产物晶体结构的影响
对反应时间为15、60、240 min生成的水合铝硅酸钠进行XRD分析,结果如图2所示。由图2可以看出,不同时间生成水合铝硅酸钠的主要物相为沸石(化学式为1.08Na2O·Al2O3·1.68SiO2·1.8H2O)和方钠石(化学式为3Na2O·3Al2O3·6SiO2·4H2O),表明沸石和方钠石为脱硅产物中的稳定物相。在反应时间为15 min脱硅产物的XRD谱中出现几处强度较弱的A型沸石(化学式为Na2O·Al2O3·1.85SiO2·5.1H2O)衍射峰,而在其他反应时间产物的XRD谱中没有相应的衍射峰出现。表明A型沸石为反应初期生成的不稳定物相,随着反应时间的延长,A型沸石消失。这是由于A型沸石在含硅铝酸钠溶液中有一定的溶解度,在含硅铝酸钠溶液中不能稳定存在,生成的少量A型沸石被铝酸钠溶液溶解。在20°~28°和32°~36°之间有两处较大的无定型鼓包,且随着时间的延长,无定型鼓包的面积逐渐减小,表明在生成的脱硅产物中含有部分无定型沸石,随着反应时间的延长,无定型沸石的含量逐渐降低。
根据X射线衍射数据采用Rietveld全谱拟合法对脱硅产物中的A型沸石、沸石和方钠石相的结晶度和含量进行半定量分析,其结果如表2所列。由表2可知,反应初期生成的A型沸石含量很低(5.6%)。在反应时间为60 min和240 min的脱硅产物中,沸石的含量(分别为78.6%和78.5%)和方钠石的含量(分别为21.4%和21.5%)变化不大。结合表1中液相分析结果可知,反应进行到60 min以后脱硅反应速率很低,只有很少量的SiO2参与脱硅反应,析出的水合铝硅酸钠中物相组成与含量已相对稳定,并且在A型沸石溶解后析出的水合铝硅酸钠中沸石的含量高于方钠石的含量。由此可以得出不同形态的结晶水合铝硅酸钠在含硅铝酸钠溶液中的溶解能力由大到小的顺序为A型沸石、方钠石、沸石。脱硅产物中各物相的结晶度均随着脱硅反应时间的增加而增加,表明延长脱硅反应时间有利于提高晶体结晶程度,进而降低脱硅产物的活性。
利用Celref软件计算出不同反应时间生成的水合铝硅酸钠中各物相的晶胞参数如表3所列。由表3可知,A型沸石、沸石和方钠石均为立方晶系。A型沸石的晶格常数和晶胞体积要远远大于方钠石和沸石的晶格常数和晶胞体积,表明A型沸石晶体结构不稳定,具有很强的化学反应活性,这也是造成A型沸石不能稳定存在的原因之一。沸石和方钠石的晶格常数和晶胞体积均呈现增加的趋势,增加量较小,表明时间对脱硅产物各物相晶胞参数的影响不大。
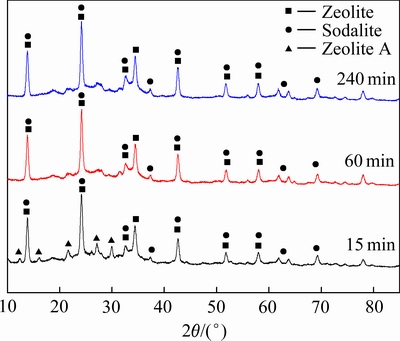
图2 不同析出时间脱硅产物XRD谱
Fig. 2 XRD patterns of desilication products with different precipitation time
表2 不同析出时间脱硅产物各物中相的含量和结晶度
Table 2 Content and crystallinity of crystalline desilication products at different precipitation time
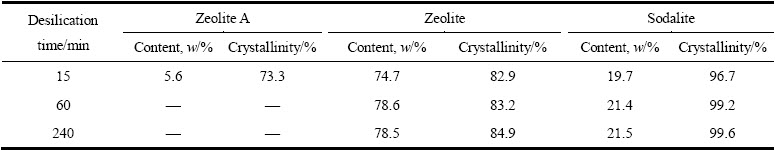
表3 不同析出时间脱硅产物各物相晶胞参数
Table 3 Cell parameters of desilication products at different precipitation time
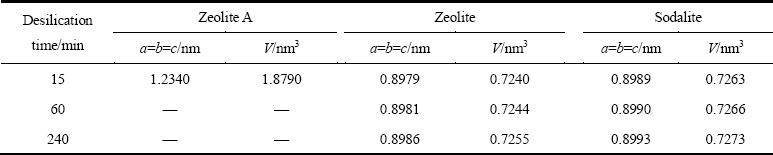
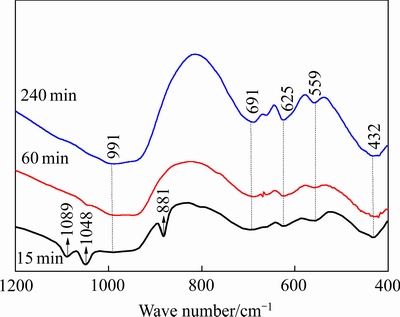
图3 不同析出时间脱硅产物红外光谱
Fig. 3 Infrared spectra of desilication products at different precipitation time
对不同反应时间生成的水合铝硅酸钠进行红外光谱分析,其结果如图3所示。从图3可以看出,不同反应时间生成的水合铝硅酸钠的红外光谱整体形状相似,但随着脱硅反应时间的延长,各对应峰的强度相应增加,表明脱硅反应时间越长所得脱硅产物的稳定性越高,活性越低。3种脱硅产物的红外光谱在950~1100 cm-1内均有很强的振动谱带,这是沸石骨架振动红外光谱的特点,表明不同时间生成的脱硅产物主要成分为沸石,这与XRD分析结果一致。在432 cm-1处为硅(铝)氧键Si—O(Al—O)的弯曲振动峰,在559 cm-1处为硅铝外部四面体中双四元环振动峰,在625 cm-1处是Al—O—Al键对称伸缩振动峰,在691 cm-1处是硅铝内部四面体Si—O—Si键的对称伸缩振动峰。由图3可以看出,当反应时间为240 min时,在559、625、694 cm-1处的峰强度明显高于其他两个反应时间生成水合铝硅酸钠所对应的峰强度,这是由于这3处均对应更稳定的四面体结构,表明随着反应时间的延长有利于结构稳定。在991 cm-1处是硅铝内部四面体Si—O—Si键的反对称伸缩振动峰。由图3可知,在反应时间为15 min时,生成水合铝硅酸钠的红外谱在881、1048、1089 cm-1处出现明显的峰,其中1048和1089 cm-1处为Si—O—Si键反对称伸缩振动峰,在881 cm-1处为硅氧四面体(SiO4)的对称伸缩振动峰,这是因为在反应初期有A型沸石生成的缘故。随着反应时间的延长,A型沸石消失,这3处所对应的峰也消失,这也与XRD谱的分析结果吻合。
2.3 时间对脱硅产物微观形貌的影响
为了探究不同时间生成水合铝硅酸钠的微观形貌,通过扫描电镜(SEM)对反应时间为15、60、240 min生成的水合铝硅酸钠进行分析,其结果如图4所示。从图4(a)、(c)、(e)可以看出,不同反应时间所生成水合铝硅酸钠的主体形貌相似,均为许多大小相似的“毛线团”形晶粒团聚。每一个“毛线团”形晶粒都是由许多同心的圆片状结构团聚在一起形成的。对比图(b)、(d)、(f)可知,随着反应时间的延长,圆形片状结构厚度逐渐增大(依次约为75、140、180 nm)。在图4(b)、(d)、(f)中“毛线团”形晶粒表面上发现少量未结晶的无定型沸石,其含量随着时间延长逐渐降低,与XRD分析结果一致。当反应时间为15 min时,有立方体形状的晶粒嵌入到球形晶粒的表面,这种立方体结构为A型沸石所特有的结构[17],证明产物中含有A型沸石,这种立方体晶粒结构完整且表面光滑,各晶粒形状大小基本一致,边长约为950 nm。在60 min和240 min的反应产物中不存在立方体晶粒,表明A型沸石只在反应初期生成。随着反应时间的延长,A型沸石消失,此分析结果与XRD物相分析结果相一致。
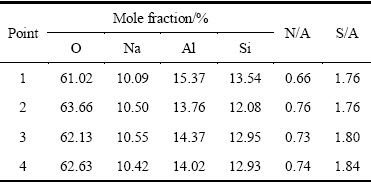
对不同时间生成水合铝硅酸钠取点进行EDS分析,其元素分析结果如表4所示。其中点1为A型沸石物相点。由表4可知,点3、4各元素分析结果基本相同,表明反应进行到60 min后,水合铝硅酸钠中物相组成及其含量稳定,反应已达到平衡,与表2中的分析结果一致。不同时间生成水合铝硅酸钠成分中Na2O和Al2O3的比值(N/A)均小于1,这是由于水合铝硅酸钠固体的分子结构中存在孔洞,可以吸附溶液中的铝酸根离子。其中点1的N/A明显低于点2、3、4的,结合晶格常数分析结果可知,A型沸石晶胞体积很大且分子结构中的孔洞空间也很大,致使A型沸石可以吸附更多的铝酸根离子,表明A型沸石分子结构不稳定,活性很高。不同时间生成水合铝硅酸钠成分中的SiO2和Al2O3的比值(S/A)均小于2,这是由于动力学非平衡导致硅缺位的晶格缺陷。随着反应时间的延长,脱硅产物结晶度逐渐升高,水合铝硅酸钠晶体结构更加完整,硅缺位程度降低。因此,S/A值逐渐升高。

图4 不同析出时间脱硅产物的SEM像
Fig. 4 SEM images of desilication products with different precipitation times
表4 1~4点EDS能谱分析结果
Table 4 EDS results of points 1-4
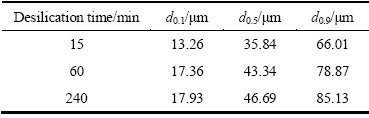
对反应时间为15、60、240 min生成水合铝硅酸钠进行粒度分析,其结果如图5和表5所示。水合铝硅酸钠粒度整体分布均匀,分布区间相对较窄,主要集中在35.84~44.69 μm之间。d0.1、d0.5和d0.9都逐渐增大,说明随着反应时间的增加,有利于水合铝硅酸钠晶粒的生长,生成粒度更大的颗粒,这种粒度的变化能够相应影响水合铝硅酸钠的活性。
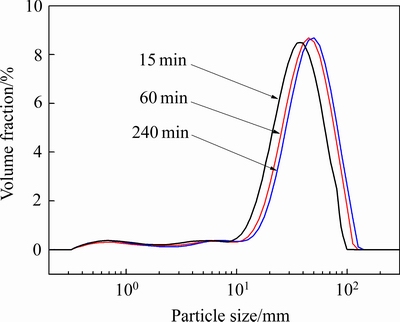
图5 不同析出时间脱硅产物粒度分布
Fig. 5 Size distribution of desilication products at different precipitation time
表5 不同时间下析出脱硅产物粒度参数
Table 5 Grain-size parameters of desilication products at different precipitation time
2.4 脱硅产物对溶液稳定性的影响
不同反应时间生成的脱硅产物对铝酸钠溶液稳定性影响分析结果如表6和图6所示。由表6和图6可知,反应时间为15、30、60和120 min生成的水合铝硅酸钠对铝酸钠溶液水解的影响逐渐降低。其中反应时间为15 min和30 min生成的水合铝硅酸钠对铝酸钠溶液水解的影响明显高于反应时间为60 min和120 min生成的水合铝硅酸钠。表明随着脱硅反应时间的延长,生成水合铝硅酸钠对铝酸钠溶液水解的影响逐渐降低。
表6 不同析出时间下脱硅产物对铝酸钠溶液的影响
Table 6 Effect of desilication products on concentration of sodium aluminate solution at different precipitation time
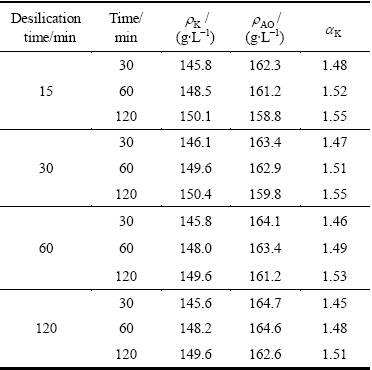
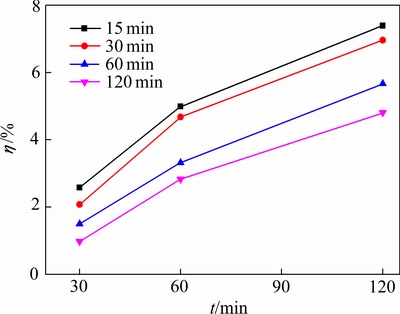
图6 不同析出时间脱硅产物对铝酸钠溶液水解率的影响
Fig. 6 Effect of desilication product on hydrolysis rate of sodium aluminate solution at different precipitation time
在反应初期,溶液中SiO2浓度很高,化学反应推动力很强使脱硅反应迅速进行,生成了大量的水合铝硅酸钠。但此时生成的水合铝硅酸钠晶粒生长并不完整,粒度和晶体结晶程度较低,且有少量不稳定的A型沸石生成,使得此时水合铝硅酸钠析出活性很高。随着脱硅反应时间的延长,溶液中SiO2浓度降低,化学反应推动力减弱,生成的A型沸石溶解且不再析出,水合铝硅酸钠晶粒生长更加完整,粒度和晶体结晶程度逐渐升高,水合铝硅酸钠析出活性降低。由此可以得出,水合铝硅酸钠析出活性与铝酸钠溶液稳定性的辩证关系,脱硅反应时间越短,溶液中二氧化硅的浓度越高,水合铝硅酸钠析出活性越高,越能促进铝酸钠溶液的水解,不利于铝酸钠溶液的稳定性。
3 结论
1) 在145 ℃下,过饱和含硅铝酸钠溶液很不稳定,脱硅反应速率很高,大部分水合铝硅酸钠在前30 min内生成;随着反应时间延长,溶液中SiO2浓度下降很快,化学反应推动力减弱,脱硅反应速率降低至趋于零,反应在60 min后基本达到平衡。
2) 反应初期有少量A型沸石生成,其晶胞体积很大且其分子结构内部孔洞空间也很大,随着反应时间延长,A型沸石消失;沸石和方钠石为脱硅产物中稳定物相,其中大部分为沸石。
3) 不同时间生成的脱硅产物具有沸石骨架振动红外光谱的特点,在881 cm-1、1048 cm-1、1089 cm-1处为A型沸石特有振动峰;脱硅产物主体形貌为“毛线团”形晶粒,A型沸石为立方体晶粒。
4) 反应初期,水合铝硅酸钠晶体粒度较小,晶体结晶程度较低,此时生成的水合铝硅酸钠活性很高。
5) 随着反应时间的延长,晶体尺寸和结晶度逐渐升高,生成的水合铝硅酸钠活性逐渐降低,有利于提高铝酸钠溶液的稳定性。水合铝硅酸钠在铝酸钠溶液中的稳定性顺序由大到小依次为沸石、方钠石、A型沸石、无定型沸石。
REFERENCES
[1] 彭志宏, 王浩宇, 刘桂华, 周秋生, 李小斌. 二氧化硅在铝酸钠溶液中的反应行为[J]. 矿冶工程, 2009, 29(6): 57-60.
PENG Zhi-hong, WANG Hao-yu, LIU Gui-hua, ZHOU Qiu-sheng, LI Xiao-bin. Reaction behavior of silica in sodium aluminate solution[J]. Mining and Metallurgical Engineering, 2009, 29(6): 57-60.
[2] 刘桂华, 齐天贵, 田 侣, 周秋生, 彭志宏, 李小斌. 氧化镁在铝酸钠溶液脱硅中的反应行为[J]. 中国有色金属学报, 2013, 23(7): 2055-2060.
LIU Gui-hua, QI Tian-gui, TIAN Lü, ZHOU Qiu-sheng, PENG Zhi-hong, LI Xiao-bin. Reaction behavior of MgO in desilication process of sodium aluminate solution[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(7): 2055-2060.
[3] BARNES M C, MENSAH J A, GERSON A R. The kinetics of desilication of synthetic spent the Bayer liquor and sodalite crystal growth[J]. Colloids and Surfaces A, 1999, 147: 283-295.
[4] BARNES M C, MENSAH J A, GERSON A R. The kinetics of synthetic spent Bayer liquor seeded with cancrinite and cancrinite/sodalite mixed-phase crystals[J]. Crystal Growth, 1999, 200: 251-264.
[5] OSTAP S. Control of silica in the Bayer process used for alumina production[J]. Canadian Metallurgical Quarterly, 1985, 25: 101-106.
[6] 张亦飞, 郑诗礼, 张 懿. 铝酸钠溶液中过饱和氧化硅的稳定性[J]. 化工学报, 2004, 55(5): 695-698.
ZHANG Yi-fei, ZHENG Shi-li, ZHANG Yi. Stability of supersaturated silica in sodium aluminate solution[J]. Journal of Chemical Industry and Engineering, 2004, 55(5): 695-698.
[7] BARNES M C, MENSAH J A, GERSON A R. The kinetics of desilication of synthetics spent Bayer liquor seeded with pure sodalite, puer cancrinite and their dimorphic phase mixtures[C]// Light Metals. San Diego, California: TMS, 1999: 121-129.
[8] MENSAH J A, GERSON A R, ZHENG K, O’DEA A, SMART R S C. The precipitation mechanism of sodium aluminosilicate scale in bayer plants[C]// Light Metals. Orlando, Florida: TMS, 1997: 23-28.
[9] DUNCAN A, MULLER H, VERITY B, WELCH B. An investigation of desilication kinetics in spent Bayer liquor[C]// Light Metals. Las Vegas, Nevada: TMS, 1995: 37-44.
[10] PARK H, ENGLEZOS P. Thermodynamic modeling of sodium aluminosilicate formation in aqueous alkaline solution[J]. Industrial and Engineering Chemistry Research, 1999, 38: 4959-4965.
[11] 王雅静, 翟玉春, 田彦文, 韩跃新, 刘连利, 姬生利. 铝酸钠和含硅铝酸钠溶液的红外光谱和拉曼光谱[J]. 中国有色金属学报, 2003, 13(1): 271-275.
WANG Ya-jing, ZHAI Yu-chun, TIAN Yan-wen, HAN Yue-xin, LIU Lian-li, JI Sheng-li. Infrared and Raman spectra of aluminate and SiO2-containing sodium aluminate solutions[J]. The Chinese Journal of Nonferrous Metals, 2003, 13(1): 271-275.
[12] GERSON A R, ZHENG Ka-li. Bayer process plant scale: transformation of sodalite to cancrinite[J]. Crystal Growth, 1997, 171: 209-218.
[13] MENSAH J A, RALSTON J. The influence of interfacial structuring on gibbsite interactions in synthetic Bayer liquors[J]. J Colloid and Interface Science, 1999, 215(1): 124-130.
[14] LI Hui-xin, Mensah J A, Thomas J C. The influence of Al(Ⅲ) supersaturation and NaOH concentration on the rate of crystallization of Al(OH)3 precursor particles from sodium aluminate solutions[J]. Colloid and Interface Science, 2005, 286(2): 511-519.
[15] PAN Xiao-lin, YU Hai-yan, TU Gan-feng, BI Shi-wen. Effects of precipitation activity of desilication products (DSPs) on stability of sodium aluminate solution[J]. Hydrometallurgy, 2016, 165: 261-269.
[16] JIANG Tao, PAN Xiao-lin, YU Hai-yan, HOU Xian-lin, TU Gan-feng, ZHANG Ren, Lu Yu. Effect of lime addition during digestion on stability of digested liquor of diasporic bauxite[C]// Light Metals. Nashville, Tennessee: TMS, 2016: 45-49.
[17] 白 璞, 刘艳娜, 梅丽宝, 孙彦琳. 硅源对纳米A型沸石结构及形貌的影响[J]. 硅酸盐通报, 2013, 32(9): 1866-1871.
BAI Pu, LIU Yan-na, MEI Li-bao, SUN Yan-lin. Influence of silica source on the structure and morphology of zeolite A nanocrystal[J]. Bulletin of the Chinese Ceramic Society, 2013, 32(9): 1866-1871.
Precipitation activity of sodium aluminosilicate hydrate during Bayer process
PAN Xiao-lin, JIANG Tao, HOU Xian-lin, WU Yan, YU Hai-yan, TU Gan-feng
(School of Metallurgy, Northeastern University, Shenyang 110819, China)
Abstract: The activity of sodium aluminosilicate hydrates at different precipitation time in supersaturated silica-containing sodium aluminate solution prepared by analytical reagents of NaAlO2, NaOH and Na2SiO3·9H2O was investigated through simulating the digestion conditions of gibbsitic bauxite, the mechanism of which influencing the stability of sodium aluminate solution was also discussed by the XRD, SEM-EDS and FT-IR methods. The results show that most of sodium aluminosilicate hydrates can generate within 30min and the reaction reaches equilibrium after 60min at 145℃ when the initial SiO2 concentration is 4.9 g/L. The desilication products mainly constitute of amorphous phase, zeolite, zeolite-A and sodalite. The zeolite-A, which is a cubic crystal with a larger unit cell volume than other desilication products, precipitates at the initial reaction stage, and disappears gradually with the extension of reaction time. The stability sequence from big to little of the desilication products in sodium aluminate solution is zeolite, sodalite, zeolite-A and amorphous phase. The increase of the desilication time can increase the crystal size and crystallinity of sodium aluminosilicate hydrates to reduce the activity, which improves the stability in sodium aluminate solution.
Key words: Bayer process; desilicication products; hydrolysis; sodium aluminate solution; crystal activity
Foundation item: Project(51104041) supported by the National Natural Science Foundation of China; Project (N130402010) supported by the Fundamental Research Funds for the Central Universities, China
Received date: 2016-06-28; Accepted date: 2016-12-01
Corresponding author: PAN Xiao-lin; Tel: +86-24-83686460; E-mail: panxl@smm.neu.edu.cn
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51104041);中央高校基本科研业务费资助项目(N130402010)
收稿日期:2016-06-28;修订日期:2016-12-01
通信作者:潘晓林,副教授,博士;电话:024-83686460;E-mail: panxl@smm.neu.edu.cn