稀有金属 2012,36(01),129-134
液氯化法浸金过程热力学
金创石 张廷安 牟望重 郑大录 曾勇 蒋孝丽
东北大学材料与冶金学院多金属共生矿生态化利用教育部重点实验室
金策工业综合大学物理化学教研室
摘 要:
针对氯化物体系中金的浸出反应进行热力学计算,分别绘制出Au-Cl-H2O体系电位-pH图、lg[Au(Ⅲ)]-pH图、lg[Cl-]-pH图,并分析了金氯化浸出过程的热力学影响因素。电位-pH图中存在着金氯络合物的稳定区域,在pH为中性或弱酸性并保持氧化电位高于0.9 V的条件下,金将以AuCl4-的形态浸出。AuCl4-的稳定性很差,易受氯化物浓度、AuCl4-浓度等热力学因素的影响。加大氯化物浓度或降低AuCl4-浓度,在热力学上有利于金的浸出。在保证金尽可能浸出的角度来说,热力学上最佳条件为pH 3.5~7.8、氧化电位高于0.9 V、氯化物浓度高于1 mol.L-1,AuCl4-浓度1×10-5~1×10-4mol.L-1。
关键词:
液氯化法;浸出;金;
中图分类号: TF831
作者简介:金创石(1974-),男,朝鲜咸镜北道人,博士研究生,讲师;研究方向:有色金属冶金;张廷安(E-mail:kchs2005@126.com,zta2000@163.net);
收稿日期:2011-04-08
基金:国家“十一五”科技支撑计划项目(2008BAB34B01);东北大学国家自然科学基金项目(51004033,50974035,51074047)资助;
Thermodynamics of Gold Chlorination Leaching Process
Abstract:
Thermodynamic calculation of gold leaching chlorination leaching system were performed,E-pH diagram,lg-pH diagram and lg-pH diagram of Au-Cl-H2O system were drawn respectively,and affected factors of feasibility of gold chlorination leaching system were analyzed in thermodynamics.To ensure the neutral or low acidic concentration condition,and the potential was kept above 0.9 V,the stable region of chlorocomplex of gold existed and Au could be extracted as AuCl-4.AuCl-4 had a poor stability,and was affected by the concentration of chloride,AuCl-4and other factors.Increasing concentration of chloride and/or decreasing concentration of AuCl-4 could make Au easily extracted in thermodynamics.Optimal condition of gold chlorination leaching in thermodynamics was 3.5~7.8 of pH value,above 0.9 V of oxidation potential,above 1 mol · L-1 of concentration of chloride and 1×10-5~1×10-4 mol · L-1 of AuCl-4concentration respectively.
Keyword:
chlorination;leaching;gold;
Received: 2011-04-08
随着金冶炼工艺的发展,世界黄金产量逐年增长。氰化法浸金自19世纪末诞生以来,由于工艺流程完善、生产过程稳定以及易于操作等优点,一直在黄金冶炼工业中占据主导地位[1,2,3,4]。近年来,随着金矿的大规模开采,易处理金矿资源日趋枯竭。品位低、粒度细、含砷、硫、锑、碳等有害杂质较高的难处理金矿必将成为提金的主要原料,而难处理金矿的冶炼方法成为当前黄金工业的热点问题。用常规的氰化法处理此类金矿,金的浸出率一般不高,已无法适应从难处理金矿中提金的要求。虽然到目前为止,非氰试剂由于种种原因尚未能真正取代氰化物,但非氰化法浸金技术指明了今后黄金工业的生产及研究方向[5,6,7]。
液氯化法浸金技术始于1848年,后经发展成为19世纪末主要的提金方法之一,由于当时直接使用氯气作为原料,生产成本较高,同时耐腐蚀材料在当时不易解决,因此该方法在氰化法问世后逐渐停止使用。近年来,由于难处理金矿资源化和环保的需求,加之可以使用次氯酸盐取代氯气,以及防腐材料的发展,液氯化法浸金的研究较为活跃。与氰化法相比,该方法具有浸金速度快、试剂价格低、方法简单、污染程度相对较低等优点,并且对影响氰化过程的某些杂质(如铜、硫、砷等)提取的选择性较好,易于净化[8,9,10,11,12]。
目前,对液氯化法浸金过程的理论研究较少,因此对浸出过程中金的转化行为进行热力学分析有着重要的指导意义。电位-p H图是研究湿法冶金过程重要的热力学依据,它将水溶液中基本反应的电位与p H值、离子活度的函数关系,在指定的温度、压力下表示在图上,用来表明反应自动进行的条件以及物质在反应系中稳定存在的区域[13,14,15]。本文研究了298.15 K条件下Au-Cl-H2O体系的电位-p H图、lg[Au(Ⅲ)]-p H图、lg[Cl-]-p H图,为液氯化法浸金过程的开展提供了热力学上的依据。
1 液氯化法浸金的基本原理
金的标准电极电位为
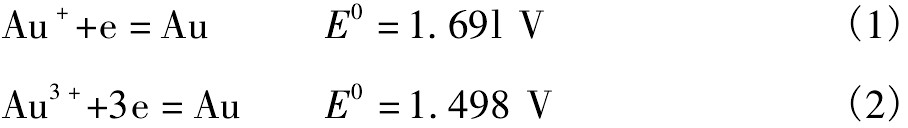
黄金属于高正电位的金属,在自然界中主要以单质的形式存在,在水溶液中结构稳定,这意味着金的溶解需要电极电位高的活性氧化剂。仅从标准电极电位的角度考虑,例如,氯气(E0Cl/Cl-=1.36 V)、次氯酸(E0HCl O/Cl-=1.49 V)的标准电极电位均小于金的氧化电位,不足以将金氧化为Au+或Au3+而浸出。但在有氯离子存在的溶液中,由于金离子与氯离子生成稳定的络离子Au Cl2-,Au Cl4-,使其活度降低,从而使金的溶解电位大幅度降低。

由式(3)和(4)可知:金氯化溶解过程中,热力学上更有利于金以3价金氯络合物的形态溶解。
液氯化法(亦称水氯化法或湿法氯化法)是在含有氯化钠等氯化物的水溶液中加入次氯酸盐等氯化剂,使金生成可溶性金氯络离子的一种浸金方法,浸金反应式如下:
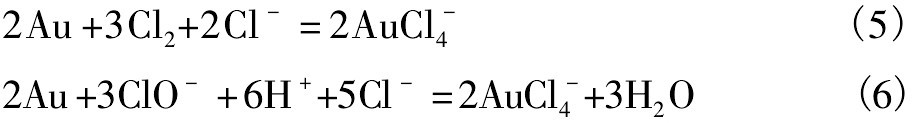
从浸金动力学角度来看,氯化法也优于氰化法。据文献报道,用纯金片进行的试验结果表明,通入氧时金在氰化物溶液中的最大溶解速度为5.7 mg·(cm2·h)-1,通空气时为1.7 mg·(cm2·h)-1,而在氯化物溶液中金的最大溶解速度可达73 mg·(cm2·h)-1[16-21]。
2 液氯化浸金过程的热力学分析
Au-Cl-H2O体系电位-p H图可以预测在水溶液中浸金反应发生的可行性,是重要的热力学数据。假定氯化浸金过程中金以三价金氯络合物的形态溶解,该体系内各物质的ΔfG0值见表1[22]。
根据表1中的数据,以及式(7),(8)的计算方法,计算了Au-Cl-H2O体系主要反应的吉布斯自由能变化,得到了电位-p H表达式如表2所示。
表1 298.15 K时Au-Cl BH2O体系ΔfG0值Table 1 Values ofΔfG0Au-Cl-H2O system at 298.15 K 下载原图

表1 298.15 K时Au-Cl BH2O体系ΔfG0值Table 1 Values ofΔfG0Au-Cl-H2O system at 298.15 K
表2 Au-Cl-H2O体系的反应式及298.15 K E-pH计算式Table 2 Equilibrium reactions of Au-Cl-H2O system and E-pH equations at 298.15 K 下载原图

表2 Au-Cl-H2O体系的反应式及298.15 K E-pH计算式Table 2 Equilibrium reactions of Au-Cl-H2O system and E-pH equations at 298.15 K
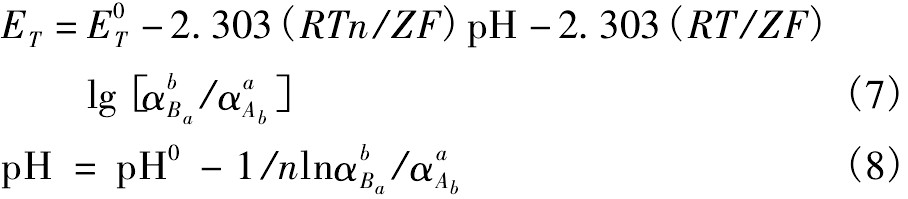
根据上述体系各反应的反应式和电位表达式,可绘制出T=298.15 K,PO2=PCl2=1 Pa,[Cl-]=[HCl O]=[Cl O-]=1 mol·L-1时AU-Cl-H2O体系的电位-p H图,如图1所示。由图1可知,在氯化物的稳定区内,存在着金氯络合物Au Cl4-的稳定区,氯成为推动金氯化溶解的氧化剂。此稳定区的存在,从热力学的角度说明金从矿物中通过氯化的方式被浸出具有可行性。但Au Cl4-稳定区的面积与Au(CN)2-相比较小,说明Au Cl4-的稳定性与Au(CN)2-相比较差。Au Cl4-,Au(CN)2-的稳定常数分别为1×1026,2×10[15,16,17,18,19,20,21,22]。
Au Cl4-稳定性多受体系的电位、p H值、金氯络合物浓度、氯化物浓度等热力学因素的影响。在氯化物体系中,金在p H值低于7.8和电位高于0.9 V的条件下以稳定的Au Cl4-形存在,在弱碱性范围内提高p H值时金以氢氧化物Au(OH)3的形态开始沉淀。当继续碱化时,Au(OH)3表现出两性,进而溶解于强碱溶液中,生成H2Au O3-,并进一步生成HAu O32-。
因此氯化法浸金过程中只要维持中性或酸性及较高电位的条件,金便能转化成为稳定的Au Cl4-的形式存在,并能获得较高浸金率。p H值升高或氧化电位下降会导致Au Cl4-形成沉淀析出,降低浸金率。
Au-Cl-H2O体系的电位与溶液中氯氧化剂的形态及其浓度有关,在水溶液中氯氧化剂化学种类
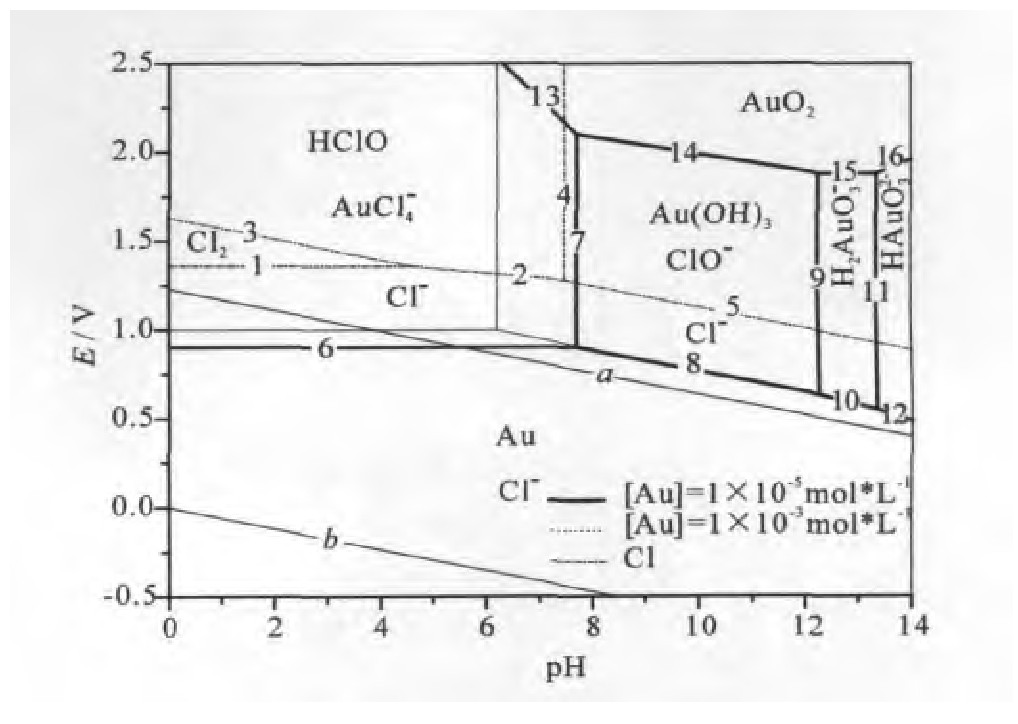
图1 298.15 K时Au-Cl-H2O体系电位-p H图(P=1.0)Fig.1 E-p H diagram of Au-Cl-H2O system at 298.15 K
之间的平衡式如式(9),(10),(11)[20,21]。
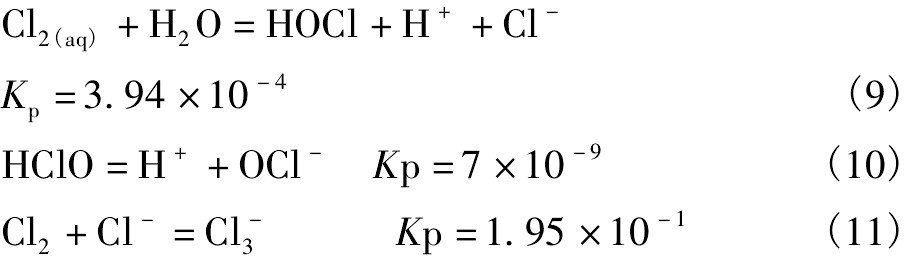
总氯浓度CCl 2的守恒公式为:
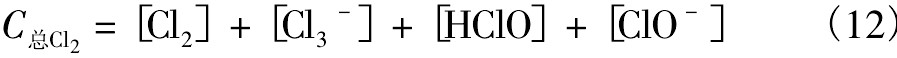
氯氧化剂的百分比浓度分别为
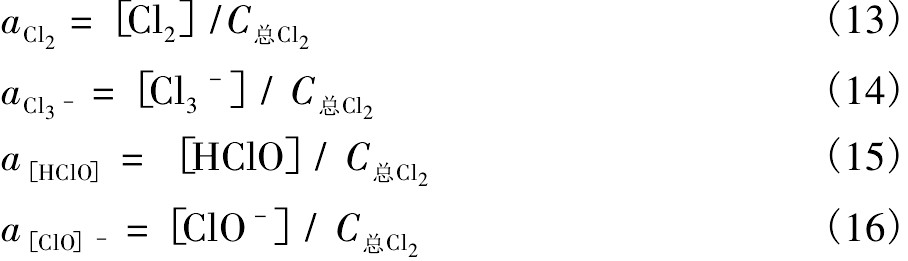
由式(9)~(16)可知,在水溶液中p H值与氯氧化剂分布关系如图2所示。由图2可知,p H<3.5时,氯氧化剂以Cl2为主要存在形态;p H>8.0时,以Cl O-为主要存在形态;p H值介于3.5和8.0之间时,以HCl O为主要存在形态;整个p H范围内,Cl3-并不其主要的存在形态。
由图1及图2可知,Au Cl4-稳定地存在于p H<7.8的范围内,此时氯氧化剂以Cl2或HCl O为主。
在热力学上,HCl O比Cl2更有利于金的浸出,因为E0-HCl O/Cl=1.495 V比E0-Cl 2/Cl=1.359 V更高,同时在较强的酸性条件下,Cl2溶解度较小,氯气具有强烈的腐蚀性,容易逸出造成环境污染。因此从浸金的角度来说,适于氯化浸金的p H范围为3.5~7.8。
除了介质的p H及电位外,溶液中Au Cl4-和氯化物浓度也影响Au Cl4-的稳定性及浸金率。
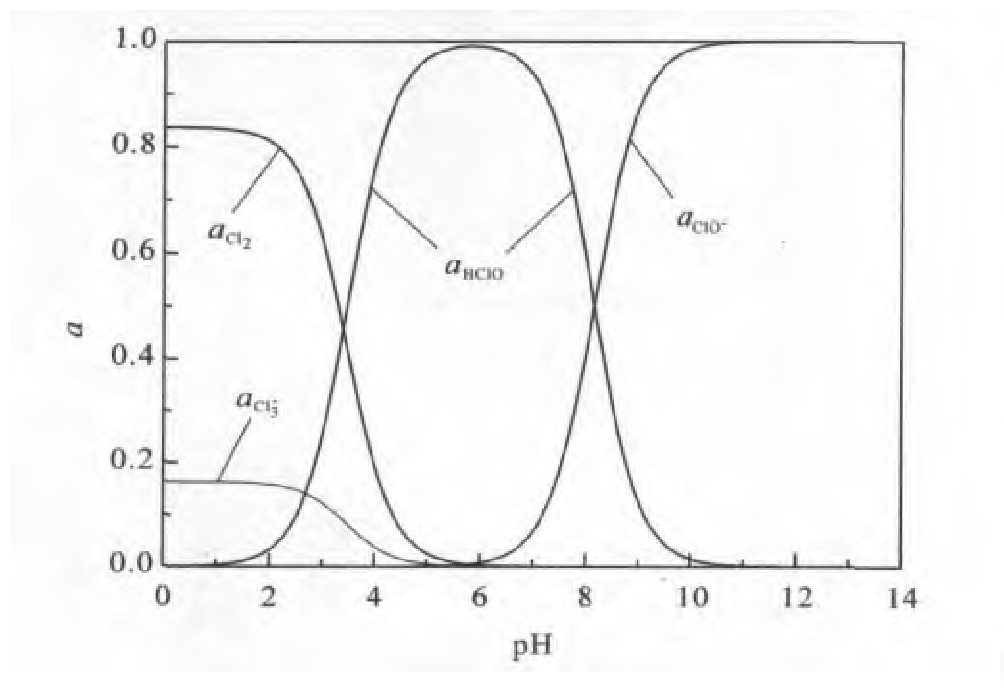
图2 298.15 K时氯氧化剂分布与p H的关系Fig.2 Distribution diagram for chlorine species at 298.15 K
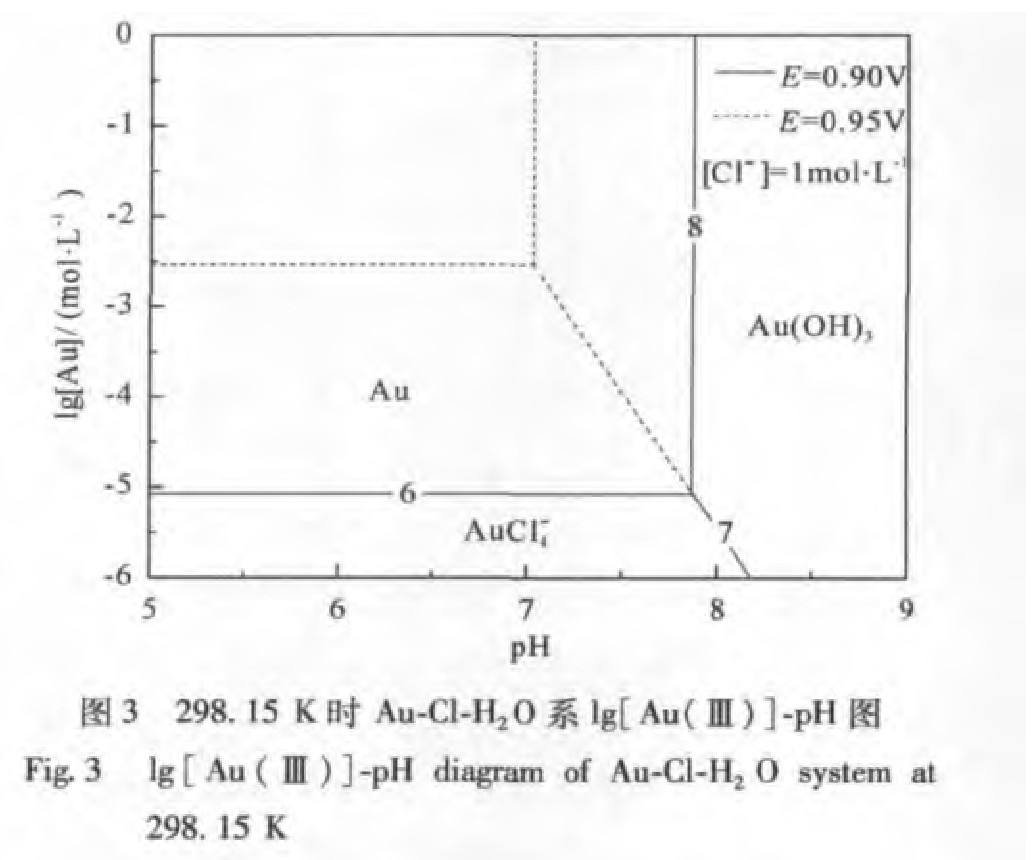
由表2的数据,绘制出Au-Cl-H2O体系的lg[Au]-p H图及lg[Cl-]-p H图,分别如图3,4所示。它们分别反映了不同含金离子浓度和不同氯化物浓度对金浸出率的影响。
从图3可知,随着Au Cl4-浓度的增加,Au(OH)3沉淀p H值下降,且Au Cl4-的氧化还原电位升高,这表明增大Au Cl4-的浓度不利于液氯化浸金反应的进行,溶液中的金离子易于形成Au(OH)3沉淀而难以被浸出,降低浸金率。因此,在浸出过程中,金氯络合物的浓度不宜过高。在实际浸出体系中金的体系浓度不超过1×10-5~1×10-4mol·L-1。为了得到最低浓度1×10-5mol·L-1的金溶液,需要保证p H值低于7.8以下、氧化电位高于0.9 V以上的条件。

由图4可知,随着氯化物浓度的降低,Au(OH)3沉淀p H值下降,且Au Cl4-的氧化还原电位升高,因此在较低浓度的氯化物体系中不利于浸金过程。
所以,在实际浸金过程中,要尽可能地加大氯化物浓度以有利于金的充分浸出。在介质的p H值低于7.8、氧化电位高于0.9 V的条件下,要得到1×10-5mol·L-1的金溶液所需氯化物的最低浓度为1 mol·L-1。
对于液氯化浸金过程的AU-Cl-H2O体系的电位-p H图、lg[Au(Ⅲ)]-p H图、lg[Cl-]-p H图,是在标态下得到的计算结果,其分析只能作为热力学上的参考,并不能完整描述氯化浸出这一复杂过程。因此在实际应用中还需要进一步的补充完善。
3 结论
1.通过热力学计算绘制了298.15 K时AU-ClH2O体系电位-p H图、lg[Au(Ⅲ)]-p H图、lg[Cl-]-p H图,为液氯化浸金过程提供了热力学上的依据。
2.由AU-Cl-H2O体系电位-p H图可知,图中存在着金氯络合物的稳定区域,控制体系p H为中性或弱酸性且电位高于0.9 V以上,金将以Au Cl4-的形态浸出,但Au Cl4-的稳定性很差,易受Au Cl4-浓度、氯化物浓度等热力学因素影响。
3.由AU-Cl-H2O体系电位-p H图、氯氧化剂分布图、lg[Au(Ⅲ)]-p H图、lg[Cl-]-p H图可知,增大氯化物浓度或减小Au Cl4-浓度,在热力学上均利于金的浸出。从浸金的角度来说,热力学上的最佳条件为p H值3.5~7.8、电位高于0.9 V、氯化物浓度高于1 mol·L-1、Au Cl4-浓度1×10-5~1×10-4mol·L-1。
参考文献
[1] Bai C Q.Application status and development of non-cyanide goldleaching reagents[J].Express Information of Mining Industry,2008,(12):12.(白成庆.非氰浸金试剂的应用现状及发展[J].矿业快报,2008,(12):12.)
[2] Zhang X Y,Chen L,Fang Z L.Review on gold leaching fromPCB with non-cyanide leach reagents[J].Nonferrous Metals,2009,61(1):72.(张潇尹,陈亮,方宗堂.非氰试剂从废印刷线路板中浸金进展[J].有色金属,2009,61(1):72.)
[3] Aylmore M G.Alternative lixiviants to cyanide for leaching goldores[J].Developments in Mineral Processing,2005,15:501.
[4] Senanayake G.Gold leaching in non-cyanide lixiviant systems:critical issues on fundamentals and applications[J].MineralsEngineering,2004,17:785.
[5] Cui Y X,Shen Y.The difficult processing gold mine stone refines[J].The Technique Research Development Gold Science andTechnology,2007,15(3):53.(崔永霞,沈艳.难处理金矿石提炼技术研究进展[J].黄金科学技术,2007,15(3):53.)
[6] Cao W T,Huang C J,Chen J,Wang L J.Study on gold leachingexperiment in non-cyanide of pyrite type gold concentrate[J].Chemical Engineering and Equipment,2007,15(3):53.(曹文涛,黄成进,陈洁,王丽娟.黄铁矿型金矿非氰提金实验研究[J].化学工程与装备,2009,(9):24.)
[7] Gavin Hilson,Monhemius A J.Alternatives to cyanide in the goldmining industry:what prospects for the future[J].Journal ofCleaner Production,2006,14:1158.
[8] Li G C,LüJ Y.Experimental study on gold leaching with sodiumhypochlorite-iodide[J].Mining and Metallurgical Engineering,2010,30(1):44.(李桂春,吕进云.次氯酸钠-碘化物浸金的实验研究[J].矿冶工程,2010,30(1):44.)
[9] Fang Z H.Hypochlorous leaching of refractory carbonaceous mi-cro-size gold ores[J].Gold Science and Technololgy,2002,10(2):29.(方兆珩.碳质微细粒浸染型金矿的直接氯化浸出工艺[J].黄金学技术,2002,10(2):29.)
[10] Baghalha M.Leaching of an oxide gold ore with chloride and hy-pochlorite solutions[J].International Journal of Mineral Process,2007,82:178.
[11] Puvvada G V K,Murthy D S R.Selective precious metals leachingfrom a chalcopyrite concentrate using chloride/hypochlorite media[J].Hydrometallurgy,2000,58:185.
[12] Kwang Soo Nam,Byoung Hi Jung,Jeon Woong An,Tae Jun Ha,Tam Tran,Myong Jun Kim.Use of chloride-hypochlorite leacha-nts to recover gold from tailing[J].International Journal of Min-eral Process,2008,86:131.
[13] Wang Z K,Ye C L,Fan S L,Chen D H.Eh-pH diagrams andthermodynamic analysis of gold leaching systems[J].NonferrousMetals(Extractive Metallurgy),2008,(3):37.(王治科,叶存玲,范顺利,陈东辉.浸金体系的Eh-pH图及其热力学分析[J].有色金属(冶炼部分),2008,(3):37.)
[14] Wang Z K,Chen D H,Chen L.Thermodynamic analysis of com-mon regularities for gold chlorination leaching systems[J].Chi-nese Journal of Rare Metals,2006,30(5):703.(王治科,陈东辉,陈亮.热力学分析氯化浸金体系规律[J].稀有金属,2006,30(5):703.)
[15] John Marsden,Iain Hous.The Chemistry of Gold Extraction[M].Littleton:SME,2006.271.
[16] Li M Q,Guan Y R.Study on mechanism of chlorination-leachinggold[J].Gold,2003,24(2):35.(李民权,关玉蓉.氯化浸金机理研讨[J].黄金,2003,24(2):35.)
[17] Jeffrey M I,Breuer P L,Choo W L.A kinetic study that com-pares the leaching of gold in the Cyanide,Thiosulfate,and Chlo-ride systems[J].Metallurgical and Materials Transactions B,2001,32B:979.
[18] Vinals J,Nunez C,Herreros O.Kinetics of the aqueous chlorina-tion of gold in suspended particles[J].Hydrometallurgy,1995,38:125.
[19] Kozin L F,Prokopenko V A,Bogdanova A K.Kinetics andmechanism of the gold corrosion dissolutionin hypochlorite solu-tions[J].Protection of Metals,2005,41:22.
[20] Mahir Alkan,Munir Oktay,M Muhtar Kocakerimc,Mehmet Co-pur.Solubility of chlorine in aqueous hydrochloric acid solutions[J].Journal of Hazardous Materials,2005,A119:13.
[21] Bunyamin Donmez,Zafer Ekinci,Cafer Celik,Sabri Co-lak.Optimisation of the chlorination of gold in decopperized anodeslime in aqueous medium[J].Hydrometallurgy,1999,52:81.
[22] Dean J A.Shang Fangjiu translate.Chemical Manual Bacterium[M].Beijing:Science Press,1991.(Dean J A,尚久方译.兰氏化学手册[M].北京:科学出版社,1991.)