采用固相配位法制备超细LiMn2O4正极材料
陈立宝1,2, 贺跃辉1, 汤义武3
(1. 中南大学 粉末冶金国家重点实验室,湖南 长沙, 410083;
2. 中国科学院 上海微系统与信息技术研究所,上海, 200050;
3. 长沙力元新材料股份有限公司,湖南 长沙, 410100)
摘要: 采用固相配位反应法制备锂离子a电池正极材料LiMn2O4,并对配位络合剂用量和反应温度对最终产物的物相、比表面积、粒径和电性能的影响进行研究。研究结果表明:采用固相配位法可制备超细LiMn2O4粉末,配位化合物前驱体在550℃时焙烧12h,粉末的粒度细小,粒径在0.06~0.50μm的粉末占82.10%;粉末的平均粒径为138.12nm,比表面积为10.15m2/g,颗粒形貌规则,内部有很多微孔;材料的首次充、放电比容量分别为126.0mA·h/g和124.2mA·h/g,首次充放电效率为98.6%,经15次循环后,材料的容量保持率为 91%。
关键词: 固相配位化学;尖晶石LiMn2O4;超细粉末;电极材料
中图分类号:TM911 文献标识码:A 文章编号: 1672-7207(2005)03-0390-06
Preparation of ultrafine LiMn2O4 cathode materials
by solid state coordination method
CHEN Li-bao1,2, HE Yue-hui1, TANG Yi-wu3
(1. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China;
2. Shanghai Institute of Microsystem and Information Technology, Chinese Academy of Sciences, Shanghai 200050, China;
3. Changsha Liyuan Novel Materials Limited Company, Changsha 410100, China)
Abstract: The solid state coordination method was used to synthesize ultrafine LiMn2O4 powder. The influences of the volume fraction of citric acid and the calcining temperature on the purity, specific surface area, particle size and electrochemical properties of LiMn2O4 powders were investigated. The ultrafine LiMn2O4 powder with an average particle size of 138.12nm and a specific surface area of 10.15m2/g is obtained when the initial materials is calcined at 550℃ for 12h. The powders with the particle size in range of 0.06-0.5μm account for 82.10%, and the powder show regular morphology and porous internal structure. The first charge and discharge specific capacity of the powders is 126.0mA·h/g and 124.2mA·h/g, respectively, the Coulomb efficiency is 98.6%, and the capacity remains 91% after 15 cycles.
Key words: solid state coordination method; spinel LiMn2O4; ultrafine powder; cathode material
目前,用于锂离子电池正极的材料主要有层状LiCoO2,LiNiO2和尖晶石LiMn2O4。虽然LiCoO2正极材料具有制备工艺简单,电性能好的优点,但是,钴是稀有金属,而且有毒,限制了其使用潜力;而尖晶石LiMn2O4正极材料因其结构稳定,且具有制备容易,成本低,无毒,可回收的优点,正成为电极材料的研究热点。
制备尖晶石型LiMn2O4正极材料的方法很多,主要有高温固相法[1]、熔融浸渍法[2,3]、微波烧结法[4]、Pechini法[5,6]、共沉淀法[7,8]、溶胶凝胶法[9,10]、微乳液法[11]等。电极材料的电化学性能强烈依赖于粉末的粒度和形貌。为提高电极材料的充、放电性能和循环性能,B.J.Hwang等[12]进行了用纳米粉末制作电极的研究。研究结果表明,由于纳米颗粒分散均匀,比表面积大,离子扩散路径短,扩散速率较快,可使Li+在整个晶体中有效地嵌入和脱出,使纳米粉末与电解液的接触面增大,有利于离子传递。目前,利用低热固相法成功合成了纳米LiCoO2电池正极材料[13]、纳米铈镍铁氧体粉末[14]、纳米ZnO和NiO粉末[15]等。
1 实验部分
1.1 实验方法
将分析纯的硝酸锂、醋酸锰和配位络合剂柠檬酸按比例混合,在陶瓷研钵中研磨1h,混合物变成淡红色黏稠状的配位化合物中间体。然后,将中间体在70~80℃时真空干燥4h,得到白色疏松块状配合物前驱体。将前驱体在空气气氛中于300~800℃时焙烧12h,随炉冷却得到产物LiMn2O4。
1.2 材料的表征
固相配位化合物前驱体的红外吸收光谱用Nicolet-740FT-IR型光谱仪测定;热重/差热分析在上海天平仪器厂生产的WRT-3P型微量热天平上进行;采用日本RIGAKU D/MAX-3A型Cu靶Kα辐射X射线衍射仪,对材料的晶体结构进行研究;采用美国MICRO-PLUS型激光衍射粒度分析仪测定材料的粒度分布; 采用美国QUANTACHROME公司生产的MONOSORB型比表面测试仪测定产物的比表面积;用北京光谱仪器公司生产的原子吸收分光光度计,测定材料中锂的含量;采用日本JEOL公司生产的JSM-5600LV型扫描电子显微镜观察粉末的形貌。
1.3 电性能测试
将所制得的LiMn2O4粉末、乙炔黑和粘结剂以质量比8∶1∶1混合后,加入蒸馏水和分散剂丙酮,不停搅拌混合均匀,然后蒸干水分,轧制成约30μm厚的电极薄膜。将薄膜在120℃时真空干燥3h,得到正极电极片。用金属锂作负极,Celgard2400为隔膜,PC+DMC(体积比为1∶1)+1mol/L LiPF6的混合液做电解液,在氩气气氛的手套箱中组装电池。
电性能测试在武汉兰电电子有限公司生产的LAND CT2001A型测试系统上进行,使用计算机采集数据。测试电流密度为0.1C,电压范围为3.00~4.35V。
2 结果与分析
2.1 配位化合物前驱体的制备
将量比为1∶2∶3的硝酸锂、醋酸锰和柠檬酸混合物进行研磨时,混合物由颗粒状晶体逐渐变潮,成为粉红色团块;当继续研磨时,混合物团块逐渐变黏变稀,并放出浓烈的醋酸气味,最后成为略带淡红色的黏稠状中间体。
由于易形成sp3杂化的锂离子(Li+)和易形成d2sp3杂化的锰离子(Mn2+)都容易与配体形成配位化合物[16],在研磨过程中发生固相配位化学反应:
C6H8O7·H2O+Mn(Ac)2·4H2O →
C8H10O9Mn·xH2O + HAc↑ + (5-x)H2O; (1)
C6H8O7·H2O+LiNO3 →C6H7O7Li·
xH2O+HNO3+(1-x)H2O; (2)
C8H10O9Mn·xH2O+LiNO3 →
C8H9O9MnLi·xH2O+HNO3。 (3)
醋酸锰和柠檬酸在研磨过程中发生配位化学反应,Mn2+与柠檬酸发生反应(1),形成单齿配位化合物C8H10O9Mn·xH2O,部分Li+发生反应(2),还有部分Li+参加反应(3)。在干燥时,配位化合物中间体放出醋酸和水蒸气,硝酸发生分解,中间体转变为多孔疏松的配位化合物前驱体。
对干燥后所得的配位化合物前驱体进行红外吸收光谱检测,其结果如图1所示。与柠檬酸的红外吸收光谱相比,前驱体在1400~1600cm-1的区域,存在羧酸盐的不对称伸缩振动吸收带和对称伸缩振动吸收带,它们分别位于1384cm-1和1596cm-1处,这2个吸收带是羧酸盐的特征吸收谱带,说明Mn2+和Li+与柠檬酸发生了螯合作用,形成了柠檬酸盐。
2.2 差热/热重分析
通过醋酸锰和柠檬酸的差热分析可知,醋酸锰和柠檬酸在250℃以前发生了多个脱水吸热和融化吸热反应。醋酸锰在280℃时开始燃烧放热,柠檬酸在250℃开始氧化燃烧。将量比为1∶2∶3的硝酸锂、醋酸锰和柠檬酸混合研磨,经干燥得到的配位化合物前驱体的热重/差热分析(TG/DTA)曲线如图2所示。
![]()
1—前驱体; 2—柠檬酸
图 1 配位化合物前驱体和柠檬酸的红外吸收光谱
Fig. 1 Infrared spectra of coordination
compound and citric acid
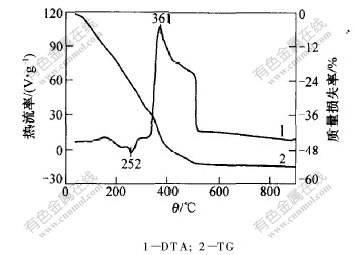
图 2 配位化合物前驱体的热重和差热分析
Fig. 2 TG/DTA analysis for precursor of
coordination compound
从图2可以看出,在20~340℃的失重是因为在前驱体中存在结合水,在低温干燥时,未完全除去,在较高的温度下逐步脱出。在DTA曲线上,在252℃出现了相对应的脱水吸热峰。在约340℃时,TG曲线的失重率增大,在DTA曲线上也开始出现放热峰,说明从340℃开始过量的柠檬酸和柠檬酸根开始氧化燃烧,放出大量的热,同时尖晶石相的LiMn2O4开始形成。当温度达到504℃后,TG曲线和DTA曲线都趋于水平。对样品进行X射线衍射分析可知,样品是纯的尖晶石相LiMn2O4。
2.3 配位剂的用量对产物的影响
柠檬酸作为Mn2+和Li+的配位络合剂,其含量对金属离子是否完全形成配合物起决定作用。另外,前驱体在焙烧过程中,过量的柠檬酸氧化燃烧放出大量热,促使形成尖晶石相LiMn2O4。同时,放出大量的CO2和水汽,使产物变得多孔疏松。因此,柠檬酸的用量对产物的结构和性能都有影响。
按不同的量比将硝酸锂、醋酸锰、柠檬酸混合,得到的前驱体在550℃时保温12h,得到的产物物相如图3所示。从图3可以看出, 当n(Li+)∶n(Mn2+)∶n柠檬酸为1.0∶2.0∶1.0时,最终产物中含有Mn2O3杂质相。这是由于柠檬酸少,金属离子不能完全形成固相配合物,Li+和Mn2+没有完全结合;又由于焙烧温度较低,时间较短,不能提供金属离子长程扩散的能量,因此,在缺锂区域出现Mn2O3杂质相。当n(Li+)∶n(Mn2+)∶n柠檬酸为1.0∶2.0∶(1.5~5.0)时,最终产物都为纯尖晶石相LiMn2O4。当柠檬酸过量时,在焙烧过程中燃烧放出的热量可促进尖晶石相的形成,故选择n(Li+)∶n(Mn2+)∶n柠檬酸为1.0∶2.0∶3.0作为实验的原料配比。
![]()
n(Li+)∶n(Mn2+)∶n柠檬酸: a—1.0∶2.0∶1.0;
b—1.0∶2.0∶1.5; c—1.0∶2.0∶2.0; d—1.0∶2.0∶3.0;
e—1.0∶2.0∶4.0; f—1.0∶2.0∶4.5; g—1.0∶2.0∶5.0
图 3 不同柠檬酸用量所得产物的XRD图谱
Fig. 3 XRD patterns of lithium manganese
oxide with various amount of citric acid
2.4 焙烧温度对产物的影响
通过差热分析可知,在310℃时尖晶石相LiMn2O4开始形成。按n(Li+)∶n(Mn2+)∶n柠檬酸为1.0∶2.0∶3.0所得的前驱体,在不同温度下焙烧12h,对产物用X射线进行晶体结构和物相分析,结果如图4所示。可见,在350℃和400℃时焙烧的产物的X射线图谱中,出现尖晶石型的LiMn2O4特征衍射峰,但衍射峰存在明显的宽化现象,衍射强度也较低。这说明产物的晶形不完整,晶化程度不高。同时,也出现了贫锂的Mn3O4杂质相。这是因为焙烧温度过低,金属离子扩散距离短,扩散不均匀。当焙烧温度高于500℃时,尖晶石型的LiMn2O4特征衍射峰变得尖锐,衍射强度也较高,说明得到了结晶完全的尖晶石LiMn2O4。在500℃和550℃时焙烧得到的产物是纯的尖晶石相LiMn2O4,没有出现用高温固相法在500℃时反应得到的LiMnO2,Li2MnO3和Mn2O3等杂质相。这些杂质在500~1000℃都很稳定[17]。通过原子吸收光谱测定可知,在550℃时焙烧12h的产物中锂含量为3.79%,与理论锂含量(3.84%)相差不大,这说明在低温下焙烧锂没有损失。再结合热重/差热分析可知,500~550℃是焙烧的最佳温度范围。当温度高于600℃时,产物中又出现了杂质相Mn3O4和Mn2O3。这是因为随着焙烧温度的升高,一方面尖晶石LiMn2O4晶体生长逐渐完善,另一方面,由于能量的升高使部分Mn—O键断裂,Mn3O4和Mn2O3从尖晶石LiMn2O4结构中脱离出来,形成杂质相。
![]()
焙烧温度/℃: a—350; b—400; c—500; d—550;
e—600; f—700; g—800; h—900
图 4 不同温度下焙烧12h所得产物的XRD图谱
Fig. 4 XRD patterns of lithium manganese
oxide calcined at various temperatures
与传统的高温固相反应法相比,采用固相配位法大幅度缩短了反应物的焙烧时间,降低了焙烧温度。高温固相反应法必须在800℃以上的温度下间歇式焙烧48h以上[18],而且必须严格控制升温速度和升温方式。因为固相反应是一个扩散控制反应,若反应物之间的界面明显,反应物颗粒大,接触面积小,则会增大物相之间的扩散自由程,导致反应时间延长和反应温度升高。而采用固相配位反应法,金属离子混合均匀,避免了金属离子的长程扩散,因此,反应时间短,焙烧温度低。
2.5 材料的粒径和形貌分析
采用激光衍射法测得在550℃时焙烧12h的样品的粒径分布,如图5所示。
![]()
1—体积分数; 2—累积体积分数
图 5 LiMn2O4材料的粒径分布
Fig. 5 Distribution of LiMn2O4 particle size
从图5可以看出,LiMn2O4材料的粒径分布范围较宽,粒径分布不均匀,出现了2个粒径峰,峰值粒径为0.23μm。粒径范围在0.06~0.50μm的粉末占82.10%,说明在此条件下合成的LiMn2O4材料为超细粉。粒径分布不均匀和存在大颗粒的主要原因有两方面:一方面,由于配位化合物中间体的黏度较大,干燥后得到的前驱体是比较坚硬的饼块,虽然在焙烧后发生膨胀,自动发生破碎,但还有一部分没有得到有效地粉碎,仍以大颗粒存在;另一方面,由于粉末的粒径小,比表面积较大,表面能高,发生团聚。发生了硬团聚的粉末,不容易分散,导致在0.50~0.80μm的范围出现粒径间断现象。
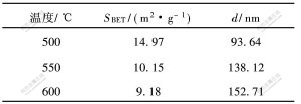
采用BET法测定产物的比表面积,分析结果如表1所示。可见,在500℃时焙烧所得产物的比表面积达14.97m2/g,通过公式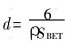 ,求得产物的粒径为93.64nm。当温度升到550℃时,产物的平均[CM(22] 粒径变为138.12nm,与激光衍射分析的平均粒径有差别。这是因为粉末颗粒的内部存在微孔,增大了粉末的比表面积,导致计算得出的平均粒径数值偏小。随着焙烧温度的升高,产物粒径变大,说明可以通过调节合成温度来控制超细尖晶石LiMn2O4粉末的粒径。
,求得产物的粒径为93.64nm。当温度升到550℃时,产物的平均[CM(22] 粒径变为138.12nm,与激光衍射分析的平均粒径有差别。这是因为粉末颗粒的内部存在微孔,增大了粉末的比表面积,导致计算得出的平均粒径数值偏小。随着焙烧温度的升高,产物粒径变大,说明可以通过调节合成温度来控制超细尖晶石LiMn2O4粉末的粒径。
表 1 在不同温度时焙烧所得产物的比表面积和粒径
Table 1 Specific surface area and particle size of
LiMn2O4 powders calcined at various
temperatures for 12h
粉末的形貌如图6所示。可见,粉末颗粒细小,粒度均匀。由比表面积分析结果可知,颗粒内部存在很多孔隙。这是由于柠檬酸根在分解过程中放出大量的CO2和H2O,使颗粒内部产生很多微孔,形成联通的网络,这种粉末形貌会对材料的电化学性能有很大影响。

图 6 超细尖晶石LiMn2O4粉末的
电子扫描显微镜照片
Fig. 6 SEM image of ultrafine spinel LiMn2O4
powders calcined at 550℃ for 12h
2.6 材料的电性能
按n(Li+)∶n(Mn2+)∶n柠檬酸为1.0∶2.0∶3.0得到前驱体,在550℃时焙烧12h,合成的尖晶石LiMn2O4粉末物相纯,粒径小,选择这种粉末做首次充、放电实验,其首次充、放电循环曲线如图7所示。可见,在充电和放电曲线上各出现2个对称性很好的平台。充电平台出现在电压为4.05V和4.15V时,放电平台出现在4.05V和3.95V时,表现出明显的LiMn2O4特征充、放电性能。放电的前一个平台对应λ-MnO2和Li0.5Mn2O4两相平衡,后一个平台对应Li0.5Mn2O4和LiMn2O4两相平衡[19],显示出良好的电压稳定性。这说明锂离子的嵌入和脱出都分2步进行,嵌入和脱嵌各出现2个稳定的电压平台。
材料的首次充电比容量为126.0mA·h/g,首次放电比容量为124.2mA·h/g,充放电效率为98.6%。材料的充放电比容量较高,这是因为粉末的粒径小,比表面积大,一方面使Li+能在整个晶体中有效地嵌入和脱出;另一方面,使颗粒与电解质充分接触,有利于Li+迁移。
在550℃时合成材料的循环曲线如图8所示。可见,经15次循环后,材料的放电比容量保持在113.1 mA·h/g,为首次放电比容量的91%,说明材料的循环性能较好。
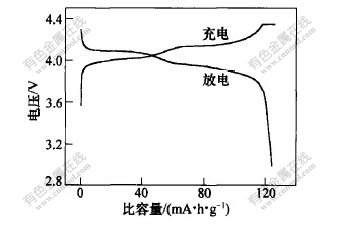
图 7 超细尖晶石LiMn2O4粉末
首次充、放电曲线
Fig. 7 First charge-discharge curves of
ultrafine spinel LiMn2O4 powder cell
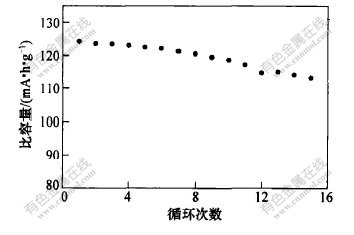
图 8 550℃时合成材料的循环充、放电曲线图
Fig. 8 Charge-discharge curves of
LiMn2O4 calcined at 550℃
3 结 论
a.采用固相配位化学反应法可制备超细LiMn2O4正极材料,与传统的高温固相法相比,具有焙烧时间短,反应温度低,工艺简单等优点。
b.采用固相配位化学反应法合成LiMn2O4,在340℃时配位化合物前驱体开始氧化燃烧,放出热量,尖晶石型的LiMn2O4开始形成,于504℃反应结束。
c.当配位化合物前驱体的焙烧温度低于500℃,或高于600℃时都出现杂质相,500~550℃为尖晶石型LiMn2O4的最佳合成温度。
d.在550℃时焙烧12h合成的LiMn2O4粉末,形貌规则整齐,颗粒呈多孔结构,粒径分布范围为0.08~0.50μm,比表面积为10.15 m2/g,为超细粉末;其锂含量为3.79%,与理论锂含量(3.84%)相差不大。首次放电容量为124.2mA·h/g,循环性能稳定。
参考文献:
[1] Tarascon J M, Mckinnon W R, Coowar F, et al. Synthesis condition and oxygen stoichiometry effects on Li insertion into spinel LiMn2O4[J]. J Electrochem Soc, 1994, 141(6): 1421-1427.
[2]Aoshima T, Okahara K, Kiyohara C, et al. Mechanism of manganese spinels dissolution and capacity fade at high temperature[J]. J Power Sources, 2001, (97-98): 377-380.
[3]Xia Y, Noguchi H, Yoshio M. A new three-volt spinel Li1+xMn1.5Ni0.5O4 for secondary lithium batteries[J]. J Solid State Chem, 1995, 119(1): 216-218.
[4]郝华, 刘韩星, 欧阳世翕. 微波合成锂离子电池正极材料的电性能影响因素[J]. 功能材料, 2001, 32(4): 385-387.
HAO Hua, LIU Han-xing, OUYANG Shi-xi. Electrochemical influence factors of microwave synthesis cathode material for lithium ion battery[J]. Functional Materials, 2001, 32(4): 385-387.
[5]Liu W, Kowal K, Farington G C. Electrochemical characteristics of spinel phase LiMn2O4 based cathode materials prepared by the Pechini process[J]. J Electrochem Soc, 1996, 143(11): 3590-3596.
[6]Wang G X, Bradhurst M H, Liu H K, et al. Improvement of electrochmical properties of the spinel LiMn2O4 using a Cr doping effect[J]. Solid State Ionics, 1999, 120(4): 95-101.
[7]Barboux P, Tarascon J M, Shokoohi F K. The use of acetates as precursors for the low-temperature synthesis of LiMn2O4 and LiCoO2 intercalation compounds[J]. J Solid State Chem, 1991, 94(1): 185-196.
[8]Haitao H, Peter G B. A 4 V lithium manganese oxide cathode for rocking-chair lithium-ion cells[J]. J Electrochem Soc, 1994, 141(9): L106-L107.
[9]Amine K, Tukamoto H, Yasuda H, et al. Differences in electrochemical behavior of LiMn2O4 and Li1+x·Mn2O4 as 4V Li-cell cathodes[J]. J Electrochem Soc, 1996, 143(5): 1607-1613.
[10]Choy J H, Kim D H, Kwon C W, et al. Physical and electrochemical characterization of nanocrystalline LiMn2O4 prepared by a modified citrate route[J]. J Power Sources, 1999, 77(1): 1-11.
[11]Hwang K T, Um W S, Lee H S, et al. Powder synthesis and electrochemical properties of LiMn2O4 prepared by a emulsion-dying method[J]. J Power Sources, 1998, 74(2): 169-174.
[12]Hwang B J, Santhanam R, LIU D G. Characterization of nanoparticles of LiMn2O4 synthesized by citric acid sol-gel method[J]. J Power Sources, 2001, 97-98: 443-446.
[13]夏熙, 努丽燕娜, 郭再萍. 低热固相反应法制备纳米LiCoO2的研究(I)[J]. 高等学校化学学报, 1999, 20(12): 1847-1849.
XIA Xi, NULI Yan-na, GUO Zai-ping. Studies of nanophase LiCoO2 synthesized by solid state reaction with low heating temperature(I)[J]. Chemical Journal of Chinese Universities, 1999, 20(12): 1847-1849.
[14]庄稼, 迟燕华, 石均宁, 等. 低热固相反应制备纳米铈镍铁氧体粉末[J]. 功能材料, 2002, 33(3): 253-255.
ZHUANG Jia, CHI Yan-hua, SHI Jun-ning, et al. A Ce0.25NiFeO3 powder prepared by solid state reaction with low temperature[J]. Functional Material, 2002, 33(3): 253-255.
[15]俞建群, 贾殿赠, 郑锍峰, 等. 纳米氧化镍、氧化锌的合成新方法[J]. 无机化学学报, 1999, 15(1): 95-98.
YU Jian-qun, JIA Dian-zeng, ZHENG Yu-feng, et al. A novel preparation route to nanocrystalline nickel oxide and zinc oxide[J]. Journal of Inorganic Chemistry, 1999, 15(1): 95-98.
[16]朱声逾, 周永洽, 申泮文. 配位化学简明教程[M]. 天津: 天津科学技术出版社, 1990.
ZHU Sheng-yu, ZHOU Yong-qia, SHEN Pan-wen. Coordination chemistry[M]. Tianjin: Tianjin Science and Technology Press, 1990.
[17]郭炳焜, 徐徽, 王先友, 等. 锂离子电池[M]. 长沙: 中南大学出版社, 2002.
GUO Bin-kun, XU Hui, WANG Xian-you, et al. Lithium ion battery[M]. Changsha: Central South University Press, 2002.
[18]杨文胜, 刘庆国. 尖晶石型LiMn2O4电极材料的制备及性能研究[J]. 北京化工大学学报, 2000, 27(1): 65-68.
YANG Wen-sheng, LIU Qing-guo. Synthesis and electrochemical studies of spinel phase LiMn2O4[J]. Journal of Beijing University of Chemical Technology, 2000, 27(1): 65-68.
[19]Chung-Hsin Lu, LIN Shang-wei. Influence of the particle size on the electro-chemical properties of lithium manganese oxide[J]. J Power Sources, 2001(97-98): 458-460.
收稿日期:2004 -09 -12
作者简介:陈立宝(1979-),男,安徽砀山人,博士研究生,从事锂离子电池相关材料研究
论文联系人: 陈立宝,男,博士研究生;电话:021-62511070-8907; E-mail: libao_chen@163.com