单晶型镍锰钴三元正极材料的形成和失效机理研究进展
陈卫晓1,高 鹏1,张 珊1,王 珊1,胡会利1,朱永明1, 2
(1. 哈尔滨工业大学(威海) 应用化学系,威海 264209;
2. 松山湖材料实验室,东莞 523808)
摘 要:
单晶型正极材料因其高循环性和高压实密度,已成为目前最有应用前景的材料之一。单晶材料是对二次球形颗粒的改进,了解单晶的形成和循环机制对单晶的制备有着很好的指导作用。本文首先分析了单晶材料的结构特征,单晶氧化物与球形二次颗粒氧化物都是层状结构;接着阐述了单晶的稳定性机理,单晶无内部晶界,在循环过程中不存在晶间破碎。本文还对单晶的形成和循环失效机理进行了总结,重点阐述单晶型正极材料在合成过程中溶解-再结晶的形成机理,即二次颗粒前驱体崩解,一次颗粒慢慢长大形成单晶颗粒;在循环过程中当截止电压小于4.3V时,晶内层间滑移可逆,多次充放电后存在滑移痕迹;当截止电压大于4.3V时,多次循环后出现晶内断裂,电池性能下降。
关键词:
锂离子电池;单晶;形成机理;失效机理;三元材料;
文章编号:1004-0609(2021)-11-3289-14 中图分类号:O614.51 文献标志码:A
引文格式:陈卫晓, 高 鹏, 张 珊, 等. 单晶型镍锰钴三元正极材料的形成和失效机理研究进展[J]. 中国有色金属学报, 2021, 31(11): 3289-3302. DOI: 10.11817/j.ysxb.1004.0609.2021-42059
CHEN Wei-xiao, GAO Peng, ZHANG Shan, et al. Research progress on formation and failure mechanism of monocrystalline Ni-Mn-Co ternary cathode materials[J]. The Chinese Journal of Nonferrous Metals, 2021, 31(11): 3289-3302. DOI: 10.11817/j.ysxb.1004.0609.2021-42059
近年来,新能源汽车技术日新月异的发展对锂离子动力电池的能量密度提出了越来越高的要求。层状镍锰钴(NMC)三元正极材料,尤其是高镍型材料,具有相对较高的比能量和工作电压,成为当下最有商业前景的正极材料[1-3]。单晶作为二次球形颗粒的改性工艺,弥补了二次颗粒的不足,将在未来锂离子电池材料上发挥重要作用。目前商业化三元正极材料主要是二次球形颗粒,但有些问题也亟待解决:1) 二次球形颗粒内部的一次颗粒在充放电过程中因相变产生较大的残余应力易导致微裂纹,进而影响电池的热稳定性和循环寿命[4-5];2) 材料内部一次颗粒粒径小,结构不完整,高电压充放电条件下界面副反应难控制,易发生结构坍塌[6-8];3) 在极片压制的过程中颗粒易破碎,电解液渗透严重导致产气等副反应发生,安全性能大大降低[9-10]。
相比于二次球颗粒,单晶型三元正极材料具有以下优点:1) 单晶颗粒内部不存在晶间界面,多次充放电循环后不发生晶间破碎[11-12];2) 单晶颗粒比表面积小,与电解液接触面积小,副反应小[13-14];3) 单晶材料机械强度高,压实过程中不易破碎,压实密度高[15]。因此,越来越多的研究者将目光转移到了单晶型三元正极材料上。近年来,关于NMC单晶正极材料的制备方法的综述较多,而对其形成机理和循环过程中的失效机理鲜见报道,本文将在这两方面进行重点阐述。
1 单晶型NMC氧化物的晶体结构
单晶NMC氧化物是标准的层状结构,属于六方晶系α-NaFeO2相R m空间群[16-17]。其中,过渡金属(TM)和锂离子分别位于六方阵列中的八面体3a和3b位置(见图1(a))。当设计六边形单晶时,由于沿着[001]晶面方向上厚度增加(见图1(b)),沿3a或3b方向多具有开放的{010}平面,有利于锂离子的传输[18]。在单晶型正极材料中,(003)、(101)、(006)/(012)、(104)等晶面可作为电池性能及层状结构的表征判断[19-23]。Jeff Dahn团队[24-25]曾利用晶面(104)在XRD中对应的峰型位置与峰的分裂程度,探究单晶的合成参数。在高镍单晶材料的循环过程中,与球形二次颗粒一致,也存在着H1-H2-H3的相变[26],H1、H2和H3相都是R
m空间群[16-17]。其中,过渡金属(TM)和锂离子分别位于六方阵列中的八面体3a和3b位置(见图1(a))。当设计六边形单晶时,由于沿着[001]晶面方向上厚度增加(见图1(b)),沿3a或3b方向多具有开放的{010}平面,有利于锂离子的传输[18]。在单晶型正极材料中,(003)、(101)、(006)/(012)、(104)等晶面可作为电池性能及层状结构的表征判断[19-23]。Jeff Dahn团队[24-25]曾利用晶面(104)在XRD中对应的峰型位置与峰的分裂程度,探究单晶的合成参数。在高镍单晶材料的循环过程中,与球形二次颗粒一致,也存在着H1-H2-H3的相变[26],H1、H2和H3相都是R m空间群中的近似六边形结构相,三者在结构上没有明显的不同,只是晶格参数不同,但当相变至H3时,电池的性能迅速下降[27]。在高截止电压下(>4.3 V),正极材料发生H2-H3的相变,导致电池极化增大,易引发析氧副反应[28]。
m空间群中的近似六边形结构相,三者在结构上没有明显的不同,只是晶格参数不同,但当相变至H3时,电池的性能迅速下降[27]。在高截止电压下(>4.3 V),正极材料发生H2-H3的相变,导致电池极化增大,易引发析氧副反应[28]。
2 单晶型正极材料的循环稳定性机理
材料的结构决定性能,多晶二次球颗粒是由一次晶体颗粒团聚形成,一次晶粒之间存在晶间界面,晶粒之间会随机各向异性取向。在多次充放电循环过程中,各向晶粒晶格常数同时发生变化,使得层状结构沿轴向产生扩大或缩小的应力,多晶颗粒中的径向微裂纹向各个方向延伸,引起一次颗粒脱附,最终导致球形二次颗粒的破碎。
而单晶内部不存在晶界,压实后仍能保持单晶结构,不产生各向异性的应力变化,有效地提高了电池循环过程中的稳定性和安全性。LI等[29]对比了单晶NMC532与常规未包覆的多晶NMC532和包覆Al2O3的多晶材料进行了比较。结果表明单晶NCM532电池在40 ℃下循环1600次后,容量保持率达92%,容量保持能力好于其他材料。多晶和单晶的压制过程和循环过程如图2所示[14]。由图2可知,单晶在多次循环后,材料仍能保持结构完整,抑制了电解液的渗入,减少了产气等副反应。
3 单晶型正极材料的形成机理
WANG等[30]使用水热法制备了特殊形貌的NCM622前驱体(见图3),然后与锂源混合,锂离子和过渡金属(TM)的摩尔比n(Li)/n(TM)=1.06,在不同温度下烧结制得小颗粒的单晶样品。随着水热反应时间的增加,初始粒径增大。反应时间是决定草酸前驱体形貌的关键因素。在10 h的反应时间内,颗粒以135 nm左右的宽度均匀分散,有利于晶体的生长。这种方法不必使用过量太多的锂源,不过烧结温度仍然有着十分重要的影响。
而制备单晶最常用的方法就是固相烧结法和熔盐辅助法,这些方法大都遵循溶解-再结晶的机理,即多晶二次颗粒在高温条件下二次颗粒崩解,一次颗粒暴露出来,随着温度的升高和保温时间的延长,一次颗粒慢慢长大出现结晶面,形成单晶。接下来将对溶解-再结晶的机理影响因素进行详细阐述。

图1 NMC材料的层状结构(白色圆圈为6c位置的氧,白色小球为3a位置的TM,黑色小球为3b位置的Li+)(a)和LiNi1/3Mn1/3Co1/3O2的晶体结构(红色和绿色的球分别是氧原子和锂原子,八面体代表MO6)[18](b)
Fig. 1 Layered structure of NCM material (white circle for oxygen at position 6c, white ball for TM at position 3a and black ball for Li+ at position 3b) (a) and Crystal structure of LiNi1/3Mn1/3Co1/3O2 (Red and green balls are oxygen and lithium atoms, respectively, and octahedron represents MO6 unit)[18] (b)

图2 电极压制过程和电化学循环过程中多晶和单晶正极材料的形态和界面变化[14]
Fig. 2 Schematics diagram showing morphological and interfacial changes of polycrystalline and single crystalline cathode during electrode pressing process and electrochemical cycling[14]

图3 不同水热反应时间所得单晶NCM622前驱体的SEM像
Fig. 3 SEM images of precursors of single-crystal LiNi0.6Co0.2Mn0.2O2 for different hydrothermal reaction time
3.1 温度和混锂量的影响
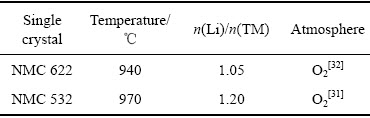
研究者对固相烧结法中混锂量、烧结温度、烧结时间和前驱体尺寸等重要参数进行了详细研究,具体见表1和表2。Jeff Dahn团队[31]在固相烧结法中采用LiOH·H2O助熔剂,探究了单晶型LiNi0.5Mn0.3Co0.2O2正极材料的制备过程。实验选取不同颗粒尺寸的前驱体,分别以1:1.15、1:1.2、1:1.25的摩尔比混锂,在930、950、970、990和1020 ℃下,烧结6 h或12 h,采用控制变量法研制单晶NMC 532。SEM、XRD和电化学性能分析表明:随着n(Li)/n(TM)摩尔比的增大,晶粒尺寸增大,晶面(104)对应的峰分裂明显,且峰向高角度偏移。较高的温度(950~970 ℃)与较高的n(Li)/n(TM)比率(约1.2)下晶体颗粒迅速生长;烧结时间越长,晶粒尺寸越大。随着n(Li)/n(TM)摩尔比(>1.2)和温度的进一步升高(970~ 1020 ℃),晶粒尺寸过大,单晶中的锂损失严重,锂镍混排从3% 增大到6.9%,造成可逆容量下降。这表明,单晶应选择在适当温度下以较小的n(Li)/n(TM)制备,以实现最高的能量密度。此外,较大的前驱体尺寸会使得终产品的晶粒尺寸变大,晶面(104)对应的峰随着前驱体尺寸的适当增大,峰型变窄且分裂明显。应采用较短的加热时间,尽可能达到零间隙,最大限度地提高可逆容量;应综合考虑晶粒尺寸、可逆和不可逆容量以及材料的结构/电化学稳定性等因素慎重选取合成条件。该团队又对单晶NCM622进行了不同温度和混锂量的探究[32]。证明烧结温度和n(Li)/n(TM)摩尔比是影响可逆容量和极化的两个关键因素。
表1 制备各单晶过程中前驱体的影响[30-31, 39]
Table 1 Influence of precursors in preparation of each single crystal[30-31, 39]
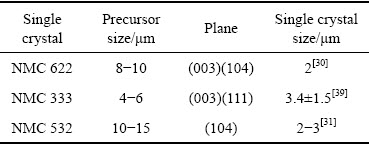
表2 制备各单晶过程中的温度和混锂量的影响[31-32]
Table 2 Parameters in process of preparing each single crystal[31-32]
3.2 助熔剂的影响
晶体生长机理影响着单晶材料的精确尺寸和形状[33-34],在正极材料制备过程中助熔剂的选择对性能有显著影响[35-36]。QIAN等[37]利用少量熔盐Li2SO4通过固相烧结法制备单晶NMC622材料。与基于热扩散的多晶NMC固态形成机理不同,单晶NMC622颗粒的形成遵循溶解-再结晶机理。采用原位XRD和SEM技术,探究单晶 NMC622颗粒的形成机理(见图4)。将Ni0.6Mn0.2Co0.2(OH)2前驱体混锂与一定量的助熔剂Li2SO4混合,以2.5 ℃/min的速率升温到900 ℃。与Ni0.6Mn0.2Co0.2(OH)2、LiOH和Li2SO4相关的峰分别在约200和300 ℃时消失,随后(003)、(101)、(006)/(012)、(104)等晶面出现,NMC层状结构形成(见图4(a))。随着温度的升高和保持时间的延长,层状结构的XRD峰的强度持续增加。通过平行实验可探究合成过程中单晶NMC622颗粒的形态演变(见图4(b)):在500 ℃时,颗粒类似于前驱体Ni0.6Mn0.2Co0.2(OH)2,即由纳米晶粒组成的球形多晶颗粒;当温度达到900 ℃时,球形颗粒破裂,晶粒尺寸变大,单晶形成;随着保温时间的增加,原始颗粒的聚集体继续崩解,单晶颗粒的尺寸继续增大并形成结晶面。900 ℃保持10 h并在2 ℃/min下缓慢冷却后,得到单晶NMC622颗粒。该单晶材料1C倍率循环时表现出良好的循环稳定性,在300次循环后仍保留了94%的初始容量,明显高于相同条件下的多晶NMC622材料。
KIM[38]利用过量KCl/NaCl熔盐辅助法制备了Li(Ni0.8Mn0.1Co0.1)O2 (NMC811)单晶颗粒,并利用不同的助熔剂控制单晶晶型的变化。实验选取NaCl和KCl两种熔剂制备NMC811单晶颗粒,前驱体是由初级晶体团聚成的二次球形颗粒。将KCl或NaCl用作助熔剂时,二次球裂开,团聚体解离,一次颗粒慢慢生长成较大单晶颗粒(见图5)。由两种助熔剂得到的单晶NMC811粒径均随烧结温度的升高而增大,但颗粒形状不同。以KCl为助熔剂于1000 ℃烧结所得样品的颗粒为圆形,颗粒表面较模糊;而以NaCl为助熔剂于1000 ℃烧结所得样品的颗粒为八面体,颗粒表面清晰可见。使用KCl作为助熔剂时,表面出现(012)晶面和其等效面,减少了晶面之间的表面能差异,使得生长的颗粒出现各向同性,单晶颗粒呈圆形。而当(003)和(111)及其各个等效面存在时,晶体的表面能较低,易形成八面体结构,所以使用NaCl助熔剂时,在液相NaCl存在下(003)和(111)等效面发育良好,比其他晶面更稳定,故形成特定的八面体形状。但无论使用何种助熔剂,半电池测量的结果显示,采用两种不同的助熔剂得到的NMC811颗粒的充放电容量都随着烧结温度的升高而降低。在相同烧结温度下,用NaCl熔剂煅烧的样品比用KCl熔剂煅烧的样品容量略高,但差异可以忽略不计。采用NaCl用作助熔剂并经900 ℃煅烧得到的单晶材料放电比容量为176 mA·h/g,振实密度为4.83 g/cm3。由此可知,液相状态下一次颗粒能更好地分散开来;这与固相烧结法中单纯改变固体反应的加热温度相比,使用氯化物助熔剂更有利于控制颗粒形貌。

图4 NMC622单晶颗粒的形成过程
Fig. 4 Formation process of NMC 622 single crystal particles

图5 不同助熔剂下NMC811单晶的生长过程
Fig. 5 Growth process of single crystal NMC811 under different fluxes
KIMIJIMA等[39]利用Na2SO4助熔剂及其代替物探究Na+在单晶Li(Ni1/3Co1/3Mn1/3)O2合成过程中对形貌的影响。相比于氯化物助熔剂,硫酸盐用热水很容易从产品中洗去,氧化物(如铁氧体)在熔融硫酸盐中的溶解度高于在卤化物中的溶解度,这意味着少量的硫酸盐熔剂就足以溶解氧化物。实验通过共沉淀法合成前驱体,将前驱体与锂源混合均匀,加入Na2SO4熔盐进行烧结(最佳溶质摩尔浓度比为80%),得到分散的NMC晶粒,平均尺寸为(3.4±1.5) μm(见图6(a))。如图6(b)所示,2θ为64.3°和65.0°处,对应着晶体的(108)面和(110)面,峰分裂明显,无锂镍混排。采用Li2SO4做助熔剂合成的单晶平均尺寸小、形貌模糊,如图6(c)所示,正如上述QIAN等[37]利用少量Li2SO4合成的单晶,尺寸较小边界模糊,表明同离子效应大大促进了NMC的溶解度。使用Na2CO3助熔剂则促进了具有尖角的八面体的形成如图6(d),且Na+本身不会进入晶格,不影响单晶的化学组成成分,Na+的存在有助于(003)、(111)晶面的生长,正如KIM[38]用NaCl助熔剂合成了八面体单晶。截止电压为2.8~4.4 V时,所有不同形貌的NMC晶体0.1C首次放电比容量均为160 mA·h/g,与助熔剂无关。
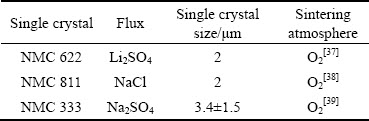
综上所述可知,单晶NMC 溶解-再结晶的生长机制是在混锂煅烧过程中氢氧化物团聚型前驱体二次颗粒崩解形成一次颗粒。随着温度的升高,一次颗粒慢慢长大,在助熔剂的作用下,一次颗粒分散开来;随着保温时间的增长,纳米晶粒渐渐长大并形成结晶面,产生单晶颗粒。从表3可以看出,不同助熔剂对单晶的生长晶面影响不同,且前驱体的尺寸、烧结气氛也有所不同。

图6 以Na2SO4为助熔剂所得的单晶体的SEM像(a);单晶体的XRD谱(b);以Li2SO4为助熔剂所得的单晶体的SEM像(c); 以Na2CO3为助熔剂所得的单晶体的SEM像(d)[39]
Fig. 6 SEM images of single crystal NCM synthesized with Na2SO4 as flux (a); XRD patterns of single crystal corresponding to (a) (b); SEM images of single crystal NCM synthesized with Li2SO4 as flux (c); SEM images of single crystal NCM synthesized with Na2CO3 as flux (d)[39]
表3 制备各单晶过程中助熔剂选择的影响
Table 3 Influence of flux selection in preparation of single crystals
4 单晶型正极材料循环过程中的失效机理
与多晶材料相比,单晶材料是一次颗粒长大形成的大颗粒,不存在晶间界面,循环过程中不会发生晶间破碎,在100 ℃以下具有极强的抗氧损失能力,但在循环过程中也不能保持完全稳定,也存在容量的下降。随着Li的嵌入和脱出过程加深,高电压下会导致SEI膜生长区域发生变化导致分层,使循环稳定性变差[29, 40-42]。
相比于仅需较低合成温度的多晶高镍正极材料,单晶生长需经更耗时的高温煅烧,且其在高电压下的循环稳定性也亟待改善[43]。BI等[44]研究了电势的改变对平均粒径为3 μm的单晶LiNi0.76Mn0.14Co0.1O2(NMC76)正极材料在循环过程中形态的变化(见图7(a1)~(a3)),提出了单晶型正极材料在循环过程中层间滑移的机理。当截止电压升高时,电解质分解加剧且极化增强,电池的容量损失变大(见图7(b1)~(b3))。由于正极钝化膜和单晶晶格的变化,导致阻抗升高,可以看到单晶NMC76经高电压下循环后,晶体内发生层间滑移(见图7(d))。在2.7~4.2 V之间,整个单晶在200次循环后(相对于石墨)保持率良好(见图7(c1));将截止电压提高到4.3 V后,200次循环后,晶体表面出现了一些滑移线(见图7(c2));循环到4.4 V时,沿(003)晶面出现了“切片”现象,但晶面间距不变(见图7(c3)),这种滑移对应着断裂力学中的II型面内剪切裂纹。虽然NMC76单晶作为整体颗粒结构仍然完整(见图7(d)),但层间滑移是单晶材料在高电压充放电循环中的主要失效方式。
值得注意的是,晶粒在循环中形成的“滑动步骤”与多晶NMC粒子沿晶间边界开裂是完全不同的。在单晶的滑移过程中,层状结构保持良好,单晶材料的晶格对称性不变,均匀的元素分布和紧密相连的晶格滑移界面也证明虽然层间滑动,但没有生成新的边界,切片区域保持相同的晶格结构(见图8)。在4.3 V以下,晶粒内的滑移是沿着(003)晶面的可逆滑移,发生滑移的地方在充电过程中可恢复原状。超过4.3 V,虽然滑移没有明显影响内部晶格的对称性,但晶面附近的反复滑动最终会演变成微裂纹,使新的表面暴露在电解液中。
REN等[45]的研究表明,4 μm的单晶NCM111材料在循环过程中位错缺陷会持续地积累,导致二次颗粒的断裂强度持续降低,最终导致NCM111材料的颗粒无法承受颗粒内的应力沿着(110)晶面发生破碎。在更高的截止电压下,循环后的NCM111材料会使晶格结构产生更大的膨胀,这也意味着在高电压下循环的NCM111材料也更容易产生裂纹。图9所示为在不同截止电压下循环后的NCM111材料的SEM像。从图9可以看出,只有当截止电压为4.1 V时,NCM111材料在经过200次循环仍然保持了初始的形貌,颗粒没有产生裂纹,如果提高充电截止电压到4.3、4.5和4.7 V后,经过循环后都出现了不同程度的颗粒破碎的现象。
较高的截止电压会增加材料的应力。图10所示为NCM111材料在不同截止电压下颗粒的张应力与循环次数之间的关系。从图10能够看到,NCM111材料在4.1 V截止电压下,颗粒的张应力没有发生明显的变化。将充电截止电压提高到4.3 V、4.5 V和4.7 V后,在前60次循环中颗粒受到的张应力也没有发生显著的变化,但超过60次循环后由于二次颗粒的破碎使得张应力释放,张应力出现了显著的下降。在更高的充电截止电压下,张应力释放也越显著,表明更高的截止电压下颗粒的破碎也更为严重。
通过理论计算可以预测单晶材料内部断裂临界粒度的存在[46-47]。QIAN等[37]采用断裂力学分析,探究了高截止电压下单晶正极材料在循环过程中晶内断裂现象,并首次证实了单晶LiNi0.6Mn0.2Co0.2O2(NMC 622)在2.7~4.3 V下能稳定地防止晶内断裂,但严重过充将导致裂纹产生。如上述失效机制,截止电压大于4.3 V时,晶粒内存在层间滑移,在多次充放电循环后,滑移虽可恢复原状但也保留一定的痕迹。单晶NMC 622在0.1C倍率4.3~2.8 V下具有183 mA·h/g的较高比容量,1C循环300次后仍有94%的容量保持率。与制备的常规多晶NMC 622颗粒相比,单晶NMC622的晶粒尺寸约为1~2 μm,循环后的单晶样品中几乎没有裂纹(平均粒径约为2 μm),这说明微米级单晶NMC622颗粒可较好的抵抗颗粒内破裂并提供更好的容量保持能力。

图7 单晶NMC76电池的循环稳定性(a1)-(a3)(灰线为库伦效率,实线为放电容量)[44];单晶NMC76充放电曲线(b1)-(b3) [44];单晶NMC76循环200次后的SEM像(c1)-(c3) [44];4.4 V下NMC 76循环200次的SEM像和滑移STEM图(d) [44];单晶NMC622的晶面图(e) [37]
Fig. 7 Cycling stability of single-crystalline NMC76 in full cells within different electrochemical windows (a1)-(a3) ( The top grayish lines and solid black lines represent coulombic efficiencies and discharge capacities at different cycles of the cells, respectively)[44]; Corresponding charge and discharge curves of single-crystalline NMC76 (b1)-(b3) [44]; SEM images corresponding to ((a1)-(a3)) after 200 cycles(c1)-(c3) [44]; Slippage STEM image of single-crystalline NMC76 at 4.4 V for 200 cycles(d) [44]; Plane map of single-crystal NMC622 (e) [37]

图8 单晶NMC76的形貌与结构
Fig. 8 Morphologies and structure of single crystal NMC76

图9 在不同截止电压下的10、30、60、200次循环后样品的SEM像[45]
Fig. 9 SEM images of studied samples after 10, 30, 60 and 200 cycles at different cut-off voltages[45]
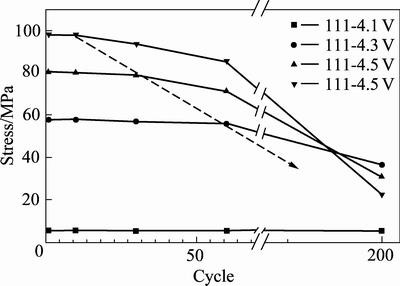
图10 NCM111材料在不同截止电压下颗粒的张应力与循环次数之间的关系[45]
Fig. 10 Relationship between tensile stresses of electrodes and cycle number at different cut-off voltages[45]
然而,当单晶NMC622正极严重过充时,循环后的晶内也出现了许多微裂纹。图11所示为充电至4.7 V的单晶NMC622电极(Li1-xNi0.6Mn0.2Co0.2O2,x=0.16)横截面的SEM像,由图11可以看出,单晶颗粒层间滑移过度后,出现了晶内微裂纹,此时H2和H3相共存[28]。许多颗粒在(001)面内出现了颗粒内开裂。根据断裂力学分析,层状结构在深层活跃时增加的不稳定性使得裂纹扩展的临界尺寸远远大于几微米,所以这与多晶的晶间裂纹是不同的。实验发现,在晶内裂纹形成之前,循环到4.7 V的NMC333和NMC622在初级晶粒内部形成了高密度的平面缺陷,其特征是增大了(003)平面间距(0.6~0.8 nm)。这表明,深度脱锂一方面削弱了层间键合,降低了沿(001)面结构的断裂韧性。另一方面,在具有不同n(TM)/n(O)摩尔比的尖晶石和岩盐结构中,从富镍层状氧化物中去除较多Li可以显著降低氧空位形成能量[48],进而促进局部氧释放和相转变。由此产生的结构不均匀性将导致层状相、尖晶石相和岩盐相之间的错配,同时增大了颗粒内部的热应力,导致裂纹扩展加速,这是过充的另一有害影响。合成温度和n(Li)/n(TM)是合成高性能富镍单晶NMC材料的两个关键参数,对于大尺寸的单晶NMC颗粒,需要考虑颗粒内断裂的风险及其对循环寿命的影响。单晶NMC材料可以更好地维持活性粒子和固态电解质之间的界面稳定性,有望提高固态电池的机械可靠性[49]。
综上所述可知,单晶型正极材料在2.7~4.3 V循环下,晶内存在可逆层间滑移,此时滑移随着充电过程恢复原状,单晶颗粒仍保持完整的晶型结构,但当电压超过4.3 V时,晶内的层间滑移在充电过程中不能恢复完好,而是会留下滑移的“痕迹”。在高截止电压充放电循环下,单晶出现平面缺陷,(003)晶面间距增大,在深度脱锂的过程中(001)晶面的断裂韧性降低,多次循环后单晶内部出现裂纹。单晶的晶内断裂与多晶的晶间断裂不同,对于大尺寸的单晶颗粒,晶内断裂裂纹可达几微米,单晶的尺寸直接影响着电池性能。

图11 严重过充的单晶NMC622粒子的SEM像[37]
Fig. 11 SEM image of severely overcharged single crystal NMC622 particles[37]
5 结语
多晶二次颗粒内部存在各向异性晶界,在多次循环过程中颗粒内易发生变化导致二次颗粒破碎,从而增大与电解液的接触面积,增加副反应,使电池容量降低。而单晶颗粒可改善团聚型二次颗粒多次循环后性能迅速降低的问题,其颗粒无内部晶界,在压制过程中不发生变形,具有高压实密度,多次充放电循环后颗粒不存在晶界破碎,副反应较少,可大幅增加电池的循环稳定性。
单晶制备过程遵循溶解-再结晶的形成机理,前驱体混锂煅烧过程中,当温度达到一定程度时球形颗粒崩解,一次颗粒暴露出来,随着保温时间的延长,一次颗粒慢慢长大形成结晶面。与固相烧结法不同,有助熔剂存在时高温下呈液相,可制得分散性良好的单晶颗粒。不同助熔剂会促进不同的晶面优先形成,进而使单晶颗粒呈现不同的形状,但助熔剂中特定的离子本身不会影响单晶的化学成分。在单晶的制备过程中,前驱体的尺寸、烧结温度及保温时间的选择,是影响单晶的尺寸和形貌的重要因素。
单晶型正极材料在截止电压小于4.3 V的多次循环过程中,晶内存在层间可逆滑移;但当截止电压大于4.3 V时,晶内出现滑移痕迹,反复滑动最终会演变成微裂纹,降低单晶正极材料的循环稳定性。了解单晶的形成机制和循环机理,有助于设计单晶的晶粒尺寸和形貌特征,结合掺杂包覆改性,可进一步合成容量更高循环更稳定的单晶颗粒,可使单晶材料在动力电源领域得到更广泛的应用。
REFERENCES
[1] HUANG Z D, LIU X M, OH S W, et al, et al. Microscopically porous, interconnected single crystal LiNi1/3Co1/3Mn1/3O2 cathode material for Lithium ion batteries[J]. Journal of Materials Chemistry, 2011, 21(29): 10777-10784.
[2] LIANG L, DU K, PENG Z, et al. Co-precipitation synthesis of Ni0.6Co0.2Mn0.2(OH)2 precursor and characterization of LiNi0.6Co0.2Mn0.2O2 cathode material for secondary lithium batteries[J]. Electrochimica Acta, 2014, 130(1): 82-89.
[3] WANNG F X, XIAO S Y, ZHENG C, et al. Nanoporous LiNi1/3Co1/3Mn1/3O2 as an ultra-fast charge cathode material for aqueous rechargeable lithium batteries[J]. Chemical Communications, 2013, 49(80): 9209-9211.
[4] BANDHAUER T M, GARIMELLA S, FULLER T F. A critical review of thermal issues in lithium-ion batteries[J]. Journal of the Electrochemical Society, 2011, 158(3): R1-R25.
[5] RYU H H, PARK K J, CHONG S Y, et al. Capacity fading of Ni-rich Li[NixCoyMn1-x-y]O2 (0.6≤x≤0.95) cathodes for high-energy-density lithium-ion batteries: Bulk or surface degradation[J]. Chemistry of Materials, 2018, 30(3): 1155-1163.
[6] LI J W, LIU Y, YAO W L, et al. Li2TiO3 and Li2ZrO3 co-modification LiNi0.8Co0.1Mn0.1O2 cathode material with improved high-voltage cycling performance for lithium-ion batteries[J]. Solid State Ionics, 2020, 349(1): 1-10.
[7] REN Si-jia, TIAN Lei-wu, SHAO Qin-jun. The single crystal LiNi(0.8)Co(0.1)Mn(0.1)O2 cathode material was prepared by the flux method[J]. Energy Storage Science and Technology, 2020, 9(6): 1702-1713.
[8] LI W, ASL H Y, XIE Q, et al. Collapse of LiNi1-x-yCoxMnyO2 lattice at deep charge irrespective of nickel content in lithium-ion batteries[J]. Journal of the American Chemical Society, 2019, 141(13): 5097-5101.
[9] WATANABE S, KINOSHITA M, HOSOKAWA T, et al. Capacity fade of LiAlyNi1-x-yCoxO2 cathode for lithium-ion batteries during accelerated calendar and cycle life tests (surface analysis of LiAlyNi1-x-yCoxO2 cathode after cycle tests in restricted depth of discharge ranges)[J]. Journal of Power Sources, 2014, 258: 210-217.
[10] ZAGHIB K, DUBE J, DALLAIRE A, et al. Enhanced thermal safety and high power performance of carbon-coated LiFePO4 olivine cathode for Li-ion batteries[J]. Journal of Power Sources, 2012, 219: 36-44.
[11] ZHU J, ZHENG J C, CAO G L, et al. Flux-free synthesis of single-crystal LiNi0.8Co0.1Mn0.1O2 boosts its electrochemical performance in lithium batteries[J]. Journal of Power Sources, 2020, 464(1): 1-11.
[12] CHEN X, TANG Y, FAN C L, et al. A highly stabilized single crystalline nickel-rich LiNi0.8Co0.1Mn0.1O2 cathode through a novel surface spinel-phase modification[J]. Electrochimica Acta, 2020, 341(1): 1-12
[13] LIU W, HP O, LIU X E, et al. Nickel-rich layered lithium transition-metal oxide for high-energy lithium-ion batteries[J]. Angewandte Chemie International Edition, 2015, 54(15): 4440-4457.
[14] KIM J, LEE H, CHA H, et al. Prospect and reality of Ni-rich cathode for commercialization[J]. Advanced Energy Materials, 2018, 8(6): 1702028.
[15] KIM T H, PARK J S, CHANGS K et al. The current move of lithium ion batteries towards the next phase[J]. Advanced Energy Materials, 2012, 2(7): 860-872.
[16] HWANG B J, TSAI Y W, CARLIER D, et al. A combined computational/experimental study on LiNi1/3Co1/3Mn1/3O2 [J]. Chemistry of Materials, 2003, 15(19): 3676-3682.
[17] KATANA N J, CHERNOVA N A, MA M M, et al. The synthesis, characterization and electrochemical behavior of the layered LiNi0.4Mn0.4Co0.2O2 compound[J]. Journal of Materials Chemistry, 2004, 14(2): 214-220.
[18] FU Fang, XU Gui-liang, WANG Qi, et al. Synthesis of single crystalline hexagonal nanobricks of LiNi1/3Co1/3Mn1/3O2 with high percentage of exposed {010} active facets as high rate performance cathode material for lithium-ion battery[J]. Journal of Materials Chemistry A, 2013, 1(12): 3860-3864.
[19] LI X L, PENG W X, TIAN R Z, et al. Excellent performance single-crystal NCM cathode under high mass loading for all-solid-state lithium batteries[J]. Electrochimica Acta, 2020, 363: 137185.
[20] FAN X M, HU G R, ZHANG B, et al. Crack-free single-crystalline Ni-rich layered NCM cathode enable superior cycling performance of lithium-ion batteries[J]. Nano Energy, 2020, 70: 104450.
[21] CHIBA K, YOSHIZAWA A, ISOGAI Y J. Thermal safety diagram for lithium-ion battery using single-crystal and polycrystalline particles LiNi0.8Co0.1Mn0.1O2[J]. Journal of Energy Storage, 2020, 32: 101775.
[22] CHENG L, ZHANG B, SU S L, et al. Highly ordered structure in single-crystalline LiNi0.65Co0.15Mn0.20O2 with promising Li-ion storage property by precursor pre-oxidation[J]. Journal of Solid State Chemistry, 2021, 297: 122045.
[23] LEE S H, SIM S J, JIN B S, et al. High performance well-developed single crystal LiNi0.91Co0.06Mn0.03O2 cathode via LiCl-NaCl flux method[J]. Materials Letters, 2020, 270: 127615.
[24] LI H Y, LI J, MA X W, et al. Synthesis of Single Crystal LiNi0.6Mn0.2Co0.2O2 with Enhanced Electrochemical Performance for Lithium Ion Batteries[J]. Journal of the Electrochemical Society, 2018, 165(5): A1038-A1045.
[25] LI H Y, LI J, ZAKER N, et al. Synthesis of single crystal LiNi0.88Co0.09Al0.03O2 with a two-step lithiation method[J]. Journal of the Electrochemical Society, 2019, 166(10): A1956-A1963.
[26] JUNG R, METZGER M, MAGLIA F, et al. Oxygen release and its effect on the cycling stability of LiNixMnyCozO2 (NMC) cathode materials for Li-ion batteries[J]. Journal of the Electrochemical Society, 2017, 164(7): A1361-A1377.
[27] LI J, LIU H, XIA J, et al. The impact of electrolyte additives and upper cut-off voltage on the formation of a rock salt surface layer in LiNi0.8Mn0.1Co0.1O2 electrodes[J]. Journal of the Electrochemical Society, 2016, 164(4): 655-665.
[28] ZHENG S Y, HONG C Y, GUAN X Y, et al. Correlation between long range and local structural changes in Ni-rich layered materials during charge and discharge process[J]. Journal of Power Sources, 2019, 412(1): 336-343.
[29] LI Jing, CAMERON A R, LI Hong-yang, et al. Comparison of single crystal and polycrystalline LiNi0.5Mn0.3Co0.2O2 positive electrode materials for high voltage Li-ion cells[J]. Journal of the Electrochemical Society, 2017, 164(7): A3529-A3537.
[30] WANG L, WU B R, MU D B, et al. Single-crystal LiNi0.6Co0.2Mn0.2O2 as high performance cathode materials for Li-ion batteries[J]. Journal of Alloys and Compounds, 2016, 674(1): 360-367.
[31] LI J, LI H Y, STONE W, et al. Synthesis of single crystal LiNi0.5Mn0.3Co0.2O2 for lithium ion batteries[J]. Journal of the Electrochemical Society, 2017, 164(14): A3529-A3537.
[32] LI H Y, LI J, MA X W, et al. Synthesis of single crystal LiNi0.6Mn0.2Co0.2O2 with enhanced electrochemical performance for lithium ion batteries[J]. Journal of the Electrochemical Society, 2018, 165(5): A1038-A1045.
[33] OISHI M, NAGASAKI Y,ITAKA K, et al. Lactosylated poly(ethylene glycol)-siRNA conjugate through acid-labile β-thiopropionate linkage to construct pH-sensitive polyion complex micelles achieving enhanced gene silencing in hepatoma cells[J]. Journal of the American Chemical Society, 2005, 127(1): 1624-1625.
[34] ZHU X H, ZHOU J, JIANG M C, et al. Molten salt synthesis of bismuth ferrite nano‐ and microcrystals and their structural characterization[J]. Journal of the American Ceramic Society, 2014, 97(7): 2223-2232.
[35] YABUUCHI N, OHZUKU T. Novel lithium insertion material of LiCo1/3Ni1/3Mn1/3O2 for advanced lithium-ion batteries[J]. Journal of Power Sources, 2003, 119/121(3): 171-174.
[36] YANG S Y, WANG X Y, YANG X K, et al. Influence of Li source on tap density and high rate cycling performance of spherical Li[Ni1/3Co1/3Mn1/3]O2 for advanced lithium-ion batteries[J]. Journal of Solid State Electrochemistry, 2012, 16(3): 1229-1237.
[37] QIAN G N, ZHANG Y T, LI L S, et al. Single-crystal nickel-rich layered-oxide battery cathode materials: Synthesis, electrochemistry, and intra-granular fracture[J]. Energy Storage Materials, 2020, 27(1): 140-149.
[38] KIM Y. Lithium nickel cobalt manganese oxide synthesized using alkali chloride flux: Morphology and performance as a cathode material for lithium ion batteries[J]. ACS Appl Mater Interfaces, 2012, 4(5): 2329-2333.
[39] KIMIJIMAT, ZETTSUN, TESHIMAK. Growth manner of octahedral-shaped Li(Ni1/3Co1/3Mn1/3)O2 single crystals in molten Na2SO4[J]. Crystal Growth & Design, 2016, 16(5): 2618-2623.
[40] ZENG X F, JIAN T Z, LU Y, et al. Enhancing high-temperature and high-voltage performances of single-crystal LiNi0.5Co0.2Mn0.3O2 cathodes through a LiBO2/LiAlO2 dual- modification strategy[J]. ACS Sustainable Chemistry & Engineering, 2020, 8: 6293-6304.
[41] Pinson M B, BAZANT M Z. Theory of SEI formation in rechargeable batteries: Capacity fade, accelerated aging and lifetime prediction[J]. Journal of the Electrochemical Society, 2012, 160(2): A243-A250.
[42] ZHANG Y R, KATAYAMA Y, TATARA R, et al. Revealing electrolyte oxidation via carbonate dehydrogenation on Ni-based oxides in Li-ion batteries by in situ Fourier transform infrared spectroscopy[J]. Energy & Environmental Science, 2019, 13 (1): 183-199.
[43] YAN P F, ZHENG J M, CHEN T W, et al. Coupling of electrochemically triggered thermal and mechanical effects to aggravate failure in a layered cathode[J]. Nature Communications, 2018, 9(1): 2437-2445.
[44] BI Y J, TAOJ H, QI Y, et al. Reversible planar gliding and microcracking in a single-crystalline Ni-rich cathode[J]. Science, 2020, 370: 1313-1317.
[45] REN Z M, ZHANG X H, LIU M, et al. Constant dripping wears away a stone: Fatigue damage causing particles’ cracking[J]. Journal of Power Sources, 2019, 416(15): 104-110.
[46] HUY H, ZHAOX H, SUOZ G. Averting cracks caused by insertion reaction in lithium-ion batteries[J]. Journal of Materials Research, 2016, 25(6): 1007-1010.
[47] WOODFORD W H, CARTER W C, CHIANG Y M. Design criteria for electrochemical shock resistant battery electrodes[J]. Energy & Environmental Science, 2012, 5: 8011-8024.
[48] KONG F T, LIANG C P, WANG L H, et al. Kinetic stability of bulk LiNiO2 and surface degradation by oxygen evolution in LiNiO2-based cathode materials[J]. Advanced Energy Materials, 2019, 9(2): 1802586.
[49] BUCCI G, SWAMY T, CHIANG Y, et al. Modeling of internal mechanical failure of all-solid-state batteries during electrochemical cycling, and implications for battery design[J]. Journal of Materials Chemistry A, 2017, 5(36): 1-8.
Research progress on formation and failure mechanism of monocrystalline Ni-Mn-Co ternary cathode materials
CHEN Wei-xiao1, GAO Peng1, ZHANG Shan1, WANG Shan1, HU Hui-li1, ZHU Yong-ming1, 2
(1. Department of Applied Chemistry, Harbin Institute of Technology, Weihai 264209, China;
2. Songshan Lake Materials Laboratory, Dongguan 523808, China)
Abstract: Single crystal cathode materials have become one of the most promising materials due to their high cycling and high pressure density. Single crystal material is an improvement on secondary spherical particles. Understanding the formation and cycling mechanism of single crystal has a good guiding role in the preparation of single crystal. In this paper, the structural characteristics of single crystal materials were firstly analyzed. Both single crystal oxides and spherical secondary particle oxides have layered structures. Then, the stability mechanism of single crystal was described. Single crystal has no internal grain boundary and there is no intercrystal breakage during the cycle. In this paper, the formation and cyclic failure mechanism of single crystal cathode materials were summarized. In addition, the formation mechanism of dissolution and recrystallization of the secondary particle precursor disintegrating and the primary particle gradually growing into the single crystal particle during the synthesis process of the single crystal cathode material was emphasized. When the cutoff voltage is less than 4.3 V, the slippage is reversible and there are slippage traces after multiple charging and discharging. When the cutoff voltage is greater than 4.3 V, the intragranular fracture occurs after several cycles and the battery performance deteriorates.
Key words: lithium-ion battery; single-crystal; formation mechanism; failure mechanism; ternary materials
Foundation item: Project(2019YFA0705100) supported by the National Key Research and Development Program of China
Received date: 2021-07-19; Accepted date: 2021-10-25
Corresponding authors: HU Hui-li; Tel: +86-15094914290; E-mail: whhhl@126.com
ZHU Yong-ming; Tel: +86-13754609913; E-mail: hitonline@163.com
(编辑 龙怀中)
基金项目:国家重点研发计划资助项目(2019YFA0705100)
收稿日期:2021-07-19;修订日期:2021-10-25
通信作者:胡会利,副教授,博士;电话:15094914290;E-mail:whhhl@126.com
朱永明,教授,博士;电话:13754609913;E-mail:hitonline@163.com
摘 要:单晶型正极材料因其高循环性和高压实密度,已成为目前最有应用前景的材料之一。单晶材料是对二次球形颗粒的改进,了解单晶的形成和循环机制对单晶的制备有着很好的指导作用。本文首先分析了单晶材料的结构特征,单晶氧化物与球形二次颗粒氧化物都是层状结构;接着阐述了单晶的稳定性机理,单晶无内部晶界,在循环过程中不存在晶间破碎。本文还对单晶的形成和循环失效机理进行了总结,重点阐述单晶型正极材料在合成过程中溶解-再结晶的形成机理,即二次颗粒前驱体崩解,一次颗粒慢慢长大形成单晶颗粒;在循环过程中当截止电压小于4.3V时,晶内层间滑移可逆,多次充放电后存在滑移痕迹;当截止电压大于4.3V时,多次循环后出现晶内断裂,电池性能下降。

 m空间群[16-17]。其中,过渡金属(TM)和锂离子分别位于六方阵列中的八面体3a和3b位置(见图1(a))。当设计六边形单晶时,由于沿着[001]晶面方向上厚度增加(见图1(b)),沿3a或3b方向多具有开放的{010}平面,有利于锂离子的传输[18]。在单晶型正极材料中,(003)、(101)、(006)/(012)、(104)等晶面可作为电池性能及层状结构的表征判断[19-23]。Jeff Dahn团队[24-25]曾利用晶面(104)在XRD中对应的峰型位置与峰的分裂程度,探究单晶的合成参数。在高镍单晶材料的循环过程中,与球形二次颗粒一致,也存在着H1-H2-H3的相变[26],H1、H2和H3相都是R
m空间群[16-17]。其中,过渡金属(TM)和锂离子分别位于六方阵列中的八面体3a和3b位置(见图1(a))。当设计六边形单晶时,由于沿着[001]晶面方向上厚度增加(见图1(b)),沿3a或3b方向多具有开放的{010}平面,有利于锂离子的传输[18]。在单晶型正极材料中,(003)、(101)、(006)/(012)、(104)等晶面可作为电池性能及层状结构的表征判断[19-23]。Jeff Dahn团队[24-25]曾利用晶面(104)在XRD中对应的峰型位置与峰的分裂程度,探究单晶的合成参数。在高镍单晶材料的循环过程中,与球形二次颗粒一致,也存在着H1-H2-H3的相变[26],H1、H2和H3相都是R













