二次电池电极材料电化学基础与调控
陈 悦1,谭小平1,方国赵1, 2,梁叔全1, 2
(1. 中南大学 材料科学与工程学院,长沙 410083;
2. 中南大学 电子封装与先进功能材料湖南省重点实验室,长沙 410083)
摘 要:
能源和环境安全是人类21世纪面临的最大难题之一,由于可再生能源大多受地域限制,且具有间歇性,寻找合适的储能系统显得至关重要。二次电池作为最主要的储能系统,电极材料在改善电池性能方面起着至关重要的作用。尽管二次电池的选择多种多样,电极材料的种类数不胜数,但二次电池系统在发展过程中面对的问题总是相似的,如易坍塌的电极材料结构、不稳定的界面等。本文综述了二次电池的发展历史,从电池热力学和动力学基础角度构建结构-性能关系,总结了电极材料的设计原则和目前常用的优化策略,最后针对调控手段的优势以及相应存在的技术障碍进行了讨论,希望为未来的电池研究开辟新途径、带来新机遇。
关键词:
二次电池;电极材料;能量储存机制;电化学;结构设计;
文章编号:1004-0609(2021)-11-3232-22 中图分类号:TM912.9;O646.54 文献标志码:A
引文格式:陈 悦, 谭小平, 方国赵, 等. 二次电池电极材料电化学基础与调控[J]. 中国有色金属学报, 2021, 31(11): 3232-3253. DOI: 10.11817/j.ysxb.1004.0609.2021-42326
CHEN Yue, TAN Xiao-ping, FANG Guo-zhao, et al. Electrochemical basis and regulation of electrode materials for secondary batteries[J]. The Chinese Journal of Nonferrous Metals, 2021, 31(11): 3232-3253. DOI: 10.11817/j.ysxb.1004.0609.2021-42326
化石能源的短缺和日益增长的生态环境需求,敦促人们改变传统的能源获取方式,发展太阳能、风能、海洋能和地热能等绿色环保的可再生能源[1]。然而,这些可再生能源的制约因素多,受地域、天气等因素的影响大,不能保证电力的稳定输出,因此高效储能设备的研发在推动能源结构调整中至关重要[2]。在各种储能技术中,电池储能具有寿命长、灵活性高、能量密度高等优点,在便携式电子设备、混合动力/电动汽车、储能电网等领域有着广泛应用[3]。
从1799年Volta电池堆发明以来,电池技术已有二百多年的历史。1859年PLANTE开发了铅酸电池,标志着二次电池的诞生,图1(a)概述了电池技术的简要发展历史[4]。随着人们对电池结构、制作工艺和电极材料等方面的改进,化学电源的性能得到不断改善。20世纪90年代,锂离子电池的商业化开创了一个新时代,直接推动了便携式电子产品的快速发展,极大地重塑了我们的生活。相比于传统二次电池(如铅酸电池、镍镉电池、镍氢电池),锂离子电池具有工作电压高(3.6 V)、比能量高、自放电小、循环寿命长等优点[5]。2019年诺贝尔化学奖授予德州大学奥斯汀分校教授John B. Goodenough,纽约州立大学宾汉姆顿分校教授M. Stanley Whittingham以及日本名城大学教授吉野彰,以表彰他们在发明锂电池过程中做出的贡献。目前对于锂离子电池的大量研究工作致力于充分开发已有材料的理论极限值,同时寻找具有更高能量密度的新型电极材料[6-8]。近年来,锂离子电池的整体市场份额正在迅速上升,但地壳中锂资源丰度较低,地理分布差异大,大规模增长的市场给资源和供应链带来巨大压力。因此,为未来的储能电池创造新的选择具有重要的战略意义[9]。
除了锂离子电池,其他碱金属(如Na、K)和多价金属(如Ca、Mg、Zn、Al等)电池体系的研究也是当前极具前景的方向[10](见图1(b))。钠/钾与锂元素位于同主族,化学性质与锂相似、分布广、成本低,近年来得到了大家的广泛关注[11]。值得一提的是,早在20世纪80年代已有钠离子电池相关的研究,与锂离子电池的研究几乎是同时进行的。1980年,NEWMAN 等[12]报道了Na+在室温下嵌入TiS2的电化学反应,1988年,SHACKLETTE[13]报道了层状氧化物NaxCoO2的储钠性能。但嵌钠材料的容量和结构稳定性较差,与性能优异的锂离子电池相比存在一定差距,有关钠离子电池的研究进程缓慢,大部分研究从此中断。直到2008年,钠离子电池重新成为研究热点,丰富的钠资源是这项技术的主要优势[14]。与锂离子电池相比,钠离子电池的能量密度相对较低,因此其应用领域一般局限对能量密度要求不高的领域,如短途运输的车辆、储能系统等。Na+/K+与Li+有很多相似之处,因此钠/钾离子电池在选择电极材料的过程中,很大程度上可以借鉴锂离子电池的研究经验。由于Na+、K+离子半径(Na+,1.02 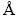 ; K+,1.39
; K+,1.39 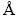 )比Li+半径(Li+,0.76
)比Li+半径(Li+,0.76 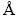 )大很多(见图1(c)),在正负极材料中的脱嵌过程相对困难,电极材料的结构易受到破坏。此外,不同离子在电极材料内的脱嵌过程受到离子配位数、晶体结构等因素的影响,在电极-电解液界面处的行为(比如电荷转移过程、溶剂化/脱溶剂化过程)也会发生改变。例如,在传统酯类电解液中Li+、K+、Rb+和Cs+可以在层状石墨材料中可逆地脱嵌,而石墨作为钠离子电池负极材料时却几乎没有容量。从热力学角度来说,钠离子插入石墨是非常困难的[15],但通过改变溶剂,使得石墨作为钠离子电池电极材料成为可能。2014年,JACHE等[16-17]研究发现,在乙二醇二甲醚基电解液中可以实现高度可逆的钠离子-醚共嵌。钠离子电池和锂离子电池在浆料配方设计、电极生产过程和电池装配过程几乎没有差别,唯一的差别体现在锂离子电池中采用铜箔作为负极集流体,因为铝会和锂形成合金导致集流体粉化,而钠离子正负极集流体均可采用铝箔作为集流体。目前钠离子电池常用的正极材料体系主要有层状氧化物、普鲁士蓝类和聚阴离子型,负极材料体系主要有软碳、硬碳以及软硬复合无定形碳[18]。尽管低成本是文献中常提到的钠离子电池优势,但相比于工艺成熟的锂离子电池(石墨/磷酸铁锂),钠离子电池体系所需正负极材料的生产工艺和产品质量还有待进一步提高[19]。因此,在钠/钾离子电池大规模商业化之前,仍然需要克服很多困难,包括改善循环寿命、能量密度以及优化生产规模、降低单位成本等[20]。
)大很多(见图1(c)),在正负极材料中的脱嵌过程相对困难,电极材料的结构易受到破坏。此外,不同离子在电极材料内的脱嵌过程受到离子配位数、晶体结构等因素的影响,在电极-电解液界面处的行为(比如电荷转移过程、溶剂化/脱溶剂化过程)也会发生改变。例如,在传统酯类电解液中Li+、K+、Rb+和Cs+可以在层状石墨材料中可逆地脱嵌,而石墨作为钠离子电池负极材料时却几乎没有容量。从热力学角度来说,钠离子插入石墨是非常困难的[15],但通过改变溶剂,使得石墨作为钠离子电池电极材料成为可能。2014年,JACHE等[16-17]研究发现,在乙二醇二甲醚基电解液中可以实现高度可逆的钠离子-醚共嵌。钠离子电池和锂离子电池在浆料配方设计、电极生产过程和电池装配过程几乎没有差别,唯一的差别体现在锂离子电池中采用铜箔作为负极集流体,因为铝会和锂形成合金导致集流体粉化,而钠离子正负极集流体均可采用铝箔作为集流体。目前钠离子电池常用的正极材料体系主要有层状氧化物、普鲁士蓝类和聚阴离子型,负极材料体系主要有软碳、硬碳以及软硬复合无定形碳[18]。尽管低成本是文献中常提到的钠离子电池优势,但相比于工艺成熟的锂离子电池(石墨/磷酸铁锂),钠离子电池体系所需正负极材料的生产工艺和产品质量还有待进一步提高[19]。因此,在钠/钾离子电池大规模商业化之前,仍然需要克服很多困难,包括改善循环寿命、能量密度以及优化生产规模、降低单位成本等[20]。
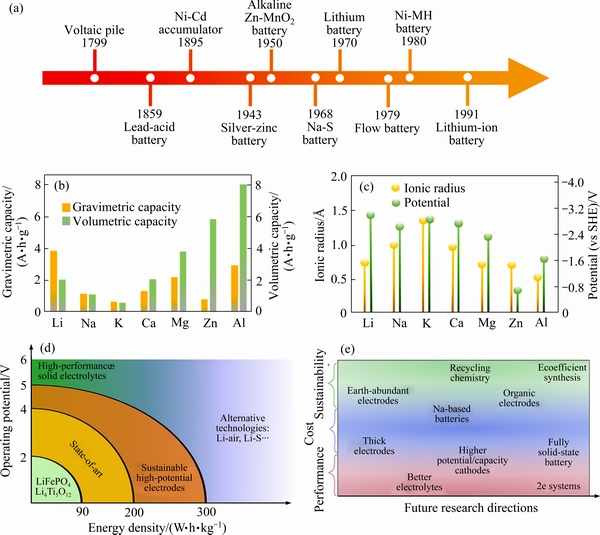
图1 二次电池的发展历史[4]、单价与多价金属的质量与体积能量密度[21]、单价与多价金属的离子半径与标准电极电势[21、电极材料的电压与能量密度[22]和电池类型发展方向[22]
Fig. 1 Brief history of secondary battery development[4], comparison of theoretical capacities of various metal anodes[21], ionic radius and potential of different metal anodes[21], voltage and energy density of various electrode materials[22] and development direction of various battery types[22]
基于多价金属离子的二次电池(例如Mg2+,Ca2+,Al3+和Zn2+)可以在单个氧化还原对中转移更多的电子,具有较高的体积能量密度,在大规模储能方面很有前途[21-23]。在二次非水系电池系统中,Ca、Mg和Al的体积能量密度最高,金属资源丰富。多价金属的活性低于碱金属,且熔点高(Li,180 ℃;Mg,650 ℃;Ca,839 ℃;Al,659 ℃),降低了电池燃烧等风险,但目前镁、钙、铝离子电池仍处于研发初始阶段,最大的挑战是缺乏合适的电极材料和与电极匹配的电解质以实现多价离子的快速扩散[24-25]。锌离子电池在水系电解液中可直接将金属用作负极,具有独特优势,是最有前途的大型储能系统。水系电解液直接以水作为溶剂,具有很多优点:成本低,对环境无害,离子电导率高,对制造条件的要求相对较低,并且可以从根本上避免有机电解液的易燃问题。但由于水的电压窗口窄(1.23 V),难以实现较高的能量密度,目前水系锌离子电池的研究工作主要集中在提升电池电压、探索储锌机理以及正负极的改善等方面[26]。
除上述电池体系外,金属-空气/氧气电池、金属-硫电池、液流电池等技术也逐渐成为储能设备的研究热点[27](见图1(d)和(e))。金属-空气/氧气电池以周围空气中的氧气作为正极材料,早在 1996年被提出,它的一个显著特点是开放式电池结构,可以防止电池内部的压力积聚[28]。金属-硫电池是大规模商用的电池体系之一,如钠-硫电池,但由于高温的使用环境使其不具备安全可靠性[29]。近年来,室温钠硫电池也在逐步成为研究热点[30]。液流电池技术的储能原理介于燃料电池和锂离子电池体系之间,其主要特点是能在外部储层中储存大量液态的反应物用于储存电能,而固体电极只负责传递电流[31]。尽管这些体系高的理论容量极具吸引力,但金属负极与电解液接触的稳定性、电池本身的安全性等问题都有待解决。考虑到此类体系的特殊性,液流电池的相关内容不在本文的讨论范围内。
无论是已经大规模商业化的锂离子电池还是近年来正在开发和探索的新型电池系统,电池发展的方向需要考虑成本、安全性、能量密度、充放电速率和使用寿命[32]。电极材料作为电池的关键组分,决定了电极的理论容量大小和电极电位,从而决定电池的容量和电压大小[33]。材料的结构决定性能,电极材料的电化学性能(如电压、容量、倍率、循环稳定性等)与材料内在的结构、离子扩散机制密切相关。通过对电极材料微纳结构的调控可以有效改善电极材料的性能,例如,利用离子掺杂、空位调控等方法可以有效增加储能活性位点、改善离子传输动力学等[34]。在电池的研发进程中,新型电池系统遇到的问题与历史电池发展中总是相似的,如电极材料的容量衰减、复杂的电极/电解液界面等。对传统电极材料的大量研究使得人们对影响电极性能和循环寿命的因素有了更多的了解,近年来表征技术的进步,极大地推动了电极材料的发展。目前已有多种先进的表征技术用于电极材料的研究,例如,利用X射线衍射(X-ray diffraction, XRD)、X射线近边结构谱(X-ray absorption near edge structure, XANES)和中子衍射(Neutron diffraction)等可以获得不同空间尺度的结构信息,还可以通过原位测试获得材料的实时演化过程[35-36]。基础理论知识和先进的技术表征手段的结合,有助于研究人员更好地了解电池的储能机制、设计电极材料,以应对未来的储能挑战。
本文围绕锂、钠、钾离子电池以及多价金属离子电池,综述了电极材料在结构和性能优化方面的研究进展:介绍了电极材料的发展历史与储能机制,从热力学和动力学角度分析了电极材料的设计原则,结合现有文献中的先进表征技术、理论计算等总结了电极材料在微纳结构尺度的调控策略,最后讨论了二次电池电极材料有待解决的关键科学问题和未来展望。
1 电极材料电化学基础
电池是通过化学反应储存能量的,典型的锂离子电池结构包括正极、负极、电解液和隔膜。在充电过程中,锂离子从正极材料晶格中脱出,经过电解液嵌入至负极材料中。放电时,化学反应经过外部设备反向进行。电极材料不仅决定了电池容量大小,同时是影响二次电池能否达到长寿命、低成本和可靠的安全性的重要因素[37]。为了满足现代社会快速发展的需求,开发新型低成本和环境友好的二次电池系统是很重要的,而电极材料是储能系统取得进展的核心。目前,大量的研究工作致力于改善锂离子电池的性能,但近年来电池能量密度的提高主要是靠改善制造工艺,通过减少电极材料中非活性组分的比例,提升电池的能量密度[38]。然而当前电池生产工艺下,非活性组分已经降到很低,能量密度难以进一步提升,新型电极材料的开发是在能量密度上实现突破的关键[39-40]。
为了获得高性能电池,了解电极材料的储能和离子/电子传输机制是非常重要的。本节内容介绍了典型的电极材料储能机理,接着结合热力学和动力基础,以获得对电极材料的结构性能关系的深入理解,揭示电极材料结构优化策略的基本原则。
1.1 储能机制
经过几十年的发展,二次电池电极材料的种类已经相当丰富,储能机制也由最初的插层化学向多种多样转变。根据不同的储能机理,电极材料主要可以分为三大类:嵌入型材料,合金类材料,转化型材料[41],如图2(a)所示。
嵌入型材料作为宿主晶格网络,离子可以可逆地插入/脱出,是目前商业化锂离子电池中主要的电极材料[42]。嵌入型材料结晶结构较为稳定,具有优异的循环性能,根据宿主晶体结构框架又可分为:层状结构、隧道型结构和聚阴离子型等。嵌入过程中,客体离子伴随着电荷转移插入在主体化合物的结构中,如:
(1-x)Li++LixCoO2 LiCoO2 (1)
LiCoO2 (1)
客体离子的可用空位、可转移电荷数和主体的结构稳定性决定了可嵌入离子量的多少,从而决定电极材料的容量大小。一般来说嵌入型材料容量有限,大量离子嵌入时面临着结构的不可逆转变。例如当Li+嵌入到层状材料V2O5中,随着不同嵌入量的锂离子,材料结构发生一系列相转变,形成不同的LixV2O5相(0<x<3)[43]:α-V2O5(x<0.01)、ε-LixV2O5(0.35<x<0.7)、△-LixV2O5(x=1)、γ-LixV2O5 (x<2)、ω-LixV2O5(2<x<3)。在x≤1时,锂离子脱出后能恢复到原始的V2O5结构,相转变完全可逆,LiV2O5对应142 mA·h/g的容量;γ相在0<x<2范围内能可逆循环而不改变γ相结构,Li2V2O5对应274 mA·h/g的容量。当进一步嵌入第三个锂离子时,γ相会不可逆地转变成岩盐结构的ω相,Li3V2O5对应397 mA·h/g的容量。对于多价金属离子电池,由于Al3+、Ca2+、Zn2+、Mg2+等多价离子与Li+半径大致相同,但两倍或三倍电荷使得多价离子在电解液中面临着严重的溶剂化作用,因此对于基于脱嵌储能机制的电极材料,常常伴随着困难的脱溶剂化过程或者溶剂分子等共嵌反应[44]。
基于合金化和转化反应的电极材料具有高的理论比容量,是目前最具吸引力的储能材料之一[45-46]。合金型材料主要有Si、Ge、Sn、Al等可与锂、钠形成合金的金属或非金属,它的研究起始于20世纪70年代,与插层化合物的研究几乎是同时开始的,但两者在实际应用方面却迥然不同。Si负极完全合金化(Li21Si5)时理论容量可达4 A·h/g,是传统石墨电极材料的10倍(372 mA·h/g),且锂的合金化反应一般都发生在低于1 V(vs. Li+/Li)的电位下,理论上Si是非常合适的锂离子电池负极材 料[47]。但大幅度提升电化学容量的同时伴随着较大的体积变化(体积膨胀率可达420%),巨大的体积膨胀使材料在循环过程中结构迅速坍塌、粉化,甚至从电极表面脱落,因此它们的循环性能通常很差。
图2 电极材料的储能机理分类[41] (a)和锌离子电池体系中的溶解-沉积机制[51] (b)
Fig. 2 Energy storage mechanism classification of electrode materials[41] (a) and schematic illustration of intercalation/ deintercalation mechanism in Zn/MnO2 battery[51](b)
解决合金材料体积膨胀等问题是实现高比容材料的关键,目前解决材料体积膨胀问题的方法有纳米化、制备特殊形貌、与碳材料复合等方法。例如斯坦福大学崔屹团队设计并构建了硅纳米线阵列、硅/石墨复合材料等,有效地改善了硅负极的循环性能[48]。
转化型材料种类繁多,可以概括为MaXb(M为过渡金属,X为O、S、F、P、N、H等非金属元素),其理论容量介于转化型和合金类材料之间[49]。许多过渡金属化合物的结构中没有空位可以插入离子,因此一直没有得到关注,直到2000年,TARASCON等[50]首次报道了过渡金属氧化物(Transition-metal oxides,MO)作为锂离子电池负极材料,其转化机理可以概括为
2Li+Mo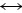 Li2O+M (M=Co, Ni, Cu, Fe) (2)
Li2O+M (M=Co, Ni, Cu, Fe) (2)
转化反应的电位与M—X键的强度有关,一般在0.5~1 V之间,氟化物的电位可接近3 V,因此,基于转化反应的电极材料根据其电位的不同可以用作电池的正负极材料。尽管转化型材料的容量很高,体积膨胀率适中,但它们在实际应用中存在较大的电压滞后以及首圈库伦效率低等问题。
电极材料的储能方式通常是多种多样的,也有些电极材料多种储能方式共存。例如多种离子共同嵌入、复合电极体系的转化合金机制以及一些新型储能机制。此外,相同的材料也存在多种储能机制,特别地,如锌离子电池体系中α-MnO2材料除传统的储能机制外,还有近几年报道的沉积-溶解机理[51]。Mn2+的溶出和羟基硫酸锌(ZSH)的生成常被看作是硫酸锌水系电解液的锌离子电池中的副反应,是导致容量衰减的重要原因[52]。因此,通常MnSO4被用作水系锰基锌离子电池的电解液添加剂,以同离子效应抑制正极材料的溶解[53]。然而,最近的研究表明,ZSH的生成是贡献了电池容量,提出了一种新的储能机理:沉积-溶解[54]。基于沉积溶解机制的储能机理可以用下式表示:
3MnO2+6H2O 3Mn2++12OH- (3)
3Mn2++12OH- (3)
在首圈放电过程中,MnO2正极材料和水反应生成可溶性Mn2+,同时生成的OH-将与 和Zn2+反应生成ZSH。充电时,ZSH与Mn2+反应,生成层状水钠锰矿型MnO2(见图2(b))。目前,对于锰基材料在水系锌离子电池体系中的储能方式仍具有争议,如报道过的储锌机理有:锌离子嵌入、锌离子和氢离子共同嵌入、基于MnO2和MnOOH之间的转化反应、插层和转化共存以及沉积-溶解机制等[55]。对于α-MnO2在锌离子电池体系中的储能机理仍需要更深入的研究,特别是利用原位检测技术以排除非原位检测过程中对材料的干扰。随着理解的深入和先进表征技术的出现,科研人员逐渐揭示出电极材料更加复杂的储能行为。电极材料发展是循序渐进的,目前仍然需要加大对储能本质的研究力度,以更好地具有针对性地提升电池的电化学性能。
和Zn2+反应生成ZSH。充电时,ZSH与Mn2+反应,生成层状水钠锰矿型MnO2(见图2(b))。目前,对于锰基材料在水系锌离子电池体系中的储能方式仍具有争议,如报道过的储锌机理有:锌离子嵌入、锌离子和氢离子共同嵌入、基于MnO2和MnOOH之间的转化反应、插层和转化共存以及沉积-溶解机制等[55]。对于α-MnO2在锌离子电池体系中的储能机理仍需要更深入的研究,特别是利用原位检测技术以排除非原位检测过程中对材料的干扰。随着理解的深入和先进表征技术的出现,科研人员逐渐揭示出电极材料更加复杂的储能行为。电极材料发展是循序渐进的,目前仍然需要加大对储能本质的研究力度,以更好地具有针对性地提升电池的电化学性能。
除上述储能机制的传统无机材料外,近年来有机材料作为电极材料也逐渐发展起来[56-57]。1969年,羰基化合物作为一次锂电池正极材料,开创了有机电极材料研究的先河[33]。有机材料的储能过程可以概括为特殊官能团的可逆化学键合机理,如羰基等[58-61]。尽管这类材料的来源丰富、结构多样,但在离子传输、材料设计与合成、稳定性等方面仍存在一些技术挑战,如体积能量密度低、速率和循环性能适中等[62]。由于有机材料结构的特殊性,本文主要集中在无机电极材料的调控。
1.2 热力学基础
1.2.1 电池电动势、理论容量
电池电动势越高,电池的可输出能量就越大。对于一个电化学反应,其化学方程式可以表示
αA+βB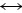 γC+△D (4)
γC+△D (4)
式中:α、β、γ、△分别为反应物A、B和生成物C、D对应的化学计量数。该反应的标准吉布斯自由能(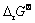 )可以由参与反应物质的标准吉布斯生成能(
)可以由参与反应物质的标准吉布斯生成能(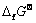 )计算得到:
)计算得到:
 (5)
(5)
如果该反应的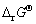 为负值,则说明该反应可以自发进行,可考虑将该反应用于电化学储能。进一步地可以由下式计算出该电池的电动势E:
为负值,则说明该反应可以自发进行,可考虑将该反应用于电化学储能。进一步地可以由下式计算出该电池的电动势E:
 (6)
(6)
式中:n为该反应转移电子数;F为法拉第常数,96485 C/mol。
电池的理论能量密度 和体积能量密度
和体积能量密度 分别为
分别为
 (7)
(7)
 (8)
(8)
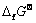 可以在热力学数据手册上找到,或者通过第一性原理计算得到,根据式(7)和(8),便计算出电池的理论电压和理论能量密度。此外对于给定的某种电极材料,还可通过实验值(电极电位表)估算电池的电动势大小,由Nernst方程可知,浓度和温度都会影响到电池电压的大小。
可以在热力学数据手册上找到,或者通过第一性原理计算得到,根据式(7)和(8),便计算出电池的理论电压和理论能量密度。此外对于给定的某种电极材料,还可通过实验值(电极电位表)估算电池的电动势大小,由Nernst方程可知,浓度和温度都会影响到电池电压的大小。
对于某种特定材料来说,其理论容量C(mA·h/g)可以根据法拉第定律、电量与电流的关系式得出:
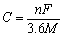 (9)
(9)
式中:M为该电极材料的相对分子质量。对于整个电池体系,其理论容量可由下式计算:
 (10)
(10)
1.2.2 费米能级和开路电压
二次电池充放电过程涉及电子在固体电极材料中的迁移,电子迁移则遵循与量子力学相关的理论。根据费米-狄拉克原理,在热平衡状态下,无相互作用的电子,占据能级E的几率为:
 (11)
(11)
式中:f(E)为费米-狄拉克分布函数,即能量为E的本征态被一个电子占有的几率,费米能级是指电子占据概率为0.5时的能级。kB为波尔兹曼常数;T为温度;EF为电子费米能级。由于其分布类似于一个阶跃函数,因此可以近似认为在限定的温度下,电子主要填充费米能级以下的能级,而费米能级以上的能级未被占据。处在费米能级负极的能级其电子占据率从0到1,被称为“过渡态”。
事实上,在电池反应中EF是电子输运的驱动力,使EF附近的电子在放电过程中从高能级的负极,经由外电路迁移到低能级的正极,充电过程则相反,从而实现能量的转换与输出[63]。通常正极和负极的化学势差称为电池的开路电压,其满足以下方程:
 (12)
(12)
式中:F代表法拉第常数;Voc为开路电压;μA和μC分别表示正极和负极的化学势。
对于电极材料中,费米能级又取决于材料的功函数。因此,在锂离子电池中,一般而言,其可逆充放电主要是通过正极材料中过渡金属电子结构调整,以适应锂离子浓度在比较宽范围变化实现的。在大部分正极材料中,过渡金属离子的外层电子构型具有3d4s构造,3d轨道失去或获得电子对应于在充放电过程中过渡金属元素的氧化或还原(TM(x+1)++e TMx+)(见图3(a))[63]。由于强电荷密度库仑力相互作用,3d轨道中的电子,表现出明显的限域特征,能带较窄。但当材料中有原子d轨道能带靠近阴离子p能带时,将会引起3d能带中的电子与p能带中电子的混杂,引起能带结构宽化,电子将部分失去限域特性,造成费米能级进入导带,因此,正极材料的电势取决于过渡金属离子氧化还原对的能级。如在LixNi0.5-yMn1.5-yCr2yO4化合物中,不同过渡金属离子氧化还原对具有不同的电势值(见图3(b))[64]。当电子从高能级的负极迁移到低能级的正极时,由于只涉及费米能级处的电子转移,不会引起明显的电极材料电压曲线变化,即会出现平稳的电压平台。
TMx+)(见图3(a))[63]。由于强电荷密度库仑力相互作用,3d轨道中的电子,表现出明显的限域特征,能带较窄。但当材料中有原子d轨道能带靠近阴离子p能带时,将会引起3d能带中的电子与p能带中电子的混杂,引起能带结构宽化,电子将部分失去限域特性,造成费米能级进入导带,因此,正极材料的电势取决于过渡金属离子氧化还原对的能级。如在LixNi0.5-yMn1.5-yCr2yO4化合物中,不同过渡金属离子氧化还原对具有不同的电势值(见图3(b))[64]。当电子从高能级的负极迁移到低能级的正极时,由于只涉及费米能级处的电子转移,不会引起明显的电极材料电压曲线变化,即会出现平稳的电压平台。
1.2.3 电化学稳定电压窗口
电池材料的稳定性是其能否应用的先决条件,除了从实验经验上选择合适的储能材料外,还可以通过理论计算的方法从理论上判断电池的设计是否合理。2010年,GOODENOUGH等[65]提出在电池中,电解质的最高占据分子轨道(Highest occupied molecular orbital,HOMO)能级要低于正极材料的费米能级,而最低未占分子轨道(Lowest unoccupied molecular orbital,LUMO)能级要高于负极材料的费米能级,即电极材料的费米能级处于电解液的电化学窗口Eg内,如式(13)所示:
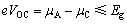 (13)
(13)
式中:e为电荷转移数;VOC为开路电压。否则,电解质会与正极或负极材料发生氧化还原反应,消耗电解液形成钝化层。即固体电极材料采用费米能级的概念,对于液态电解质采用前线轨道理论的方法。例如,Li4Ti5O12则因其费米能级(Ti4+/Ti3+, ~1.5 eV)低于电解质的LUMO,所以,它在充放电过程中不会生成SEI膜,具有快充和快放的安全优势。在水系电解液中,如果电极材料与电解液稳定电压窗口不匹配,电解液则会发生分解,氢气、氧气析出导致电池失效。实际电池系统,负极材料的化学势(μA)有可能高于电解液的LUMO能级,那么负极材料的电子流向电解液,电解液被还原,并在负极表面形成固态电解液、电极界面(SEI)膜。同样地,当正极材料的化学势(μC)低于电解液的HOMO能级时,正极材料将夺取电解液中的电子发生还原反应,导致正极材料极化、甚至遭到破坏。为了维持电池系统稳定,正极表面也会形成阻挡电子转移的界面膜,如图3(c)所示。
通过改变电极材料中的键合环境可以改变其电极电位。例如,GOODENOUGH团队发现Fe3+/Fe2+氧化还原电对的电极电势( )在Fe2(MoO4)3或者 Fe2(WO4)3中约为3.0 V,而在Fe2(SO4)3中
)在Fe2(MoO4)3或者 Fe2(WO4)3中约为3.0 V,而在Fe2(SO4)3中 高达3.6 V[66]。考虑到所有3种化合物类似的结构F—O—L(L=Mo、W、S),本文作者认为这种增加是由于
高达3.6 V[66]。考虑到所有3种化合物类似的结构F—O—L(L=Mo、W、S),本文作者认为这种增加是由于 基团的电负性增大,从而增加了Fe—O键的离子特性。当金属M与配体X之间的电负性相差较大时,M—X之间的离子键成分增强,成键轨道和反键轨道之间的分离减小,从而未占据电子空轨道σ*的能量降低[22]。相当于正极材料的费米能级μC降低,从而可以增加电池的电动势,如图3(d)所示。除了轨道能级的计算,电极材料的电子结构计算中还常采用能带结构(Band structures)、DOS图(Density of states,DOS)、电荷分布来分析材料的导电性、电子结构变化、原子间的键合情况等。
基团的电负性增大,从而增加了Fe—O键的离子特性。当金属M与配体X之间的电负性相差较大时,M—X之间的离子键成分增强,成键轨道和反键轨道之间的分离减小,从而未占据电子空轨道σ*的能量降低[22]。相当于正极材料的费米能级μC降低,从而可以增加电池的电动势,如图3(d)所示。除了轨道能级的计算,电极材料的电子结构计算中还常采用能带结构(Band structures)、DOS图(Density of states,DOS)、电荷分布来分析材料的导电性、电子结构变化、原子间的键合情况等。
1.3 动力学基础
化学热力学是从静态的角度研究化学反应,只考虑始终态,不考虑过程的细节和时间因素。电极材料的热力学参数决定了该材料的电极电位和理论容量,而离子在固相电极材料中的扩散速率快慢是影响电池是否可以快速充放电的关键因素。晶体中的离子传导较为复杂,同一种离子在不同晶体结构、不同离子在同一种固体晶体框架中的迁移方式和迁移速率不同[25]。因此,深入理解固体中的离子运输规律对于电极材料的结构设计具有重要指导意义[67]。
1.3.1 离子扩散系数
离子在晶格中的运动可分为微观和宏观两个层次。宏观离子输运过程是通过一系列在不同时间和长度范围内的微观离子输运产生的。宏观离子输运过程发生在相对较大的时间尺度和长度尺度上,微观离子输运的性质是理解长程离子移动过程的基础[68]。长程尺度结构可以利用X射线衍射、中子、电子衍射等技术探测,局部/短程结构(如局部畸变、位点无序、配位环境和缺陷等)对离子输运有很大影响,可以用X射线吸收光谱和核磁共振光谱等表征,现有的电池测试技术如图3(e)所示。
电极材料中离子扩散的过程是很复杂的,如脱嵌、合金化等反应,既包括离子晶体中“换位机制”的扩散,也有浓度、化学势影响的扩散。在电池中,离子的扩散系数一般可以用化学扩散系数来表示,即包括以上扩散过程的宏观概念。离子在电极材料中的脱嵌反应,固相扩散一般是电极反应的决速步骤,决定了反应速度。扩散系数越大,电极在大电流下的放电能力更高,材料的倍率性能更好,因此扩散系数的测定是研究电极动力学性能的重要手段。目前常采用恒电流间歇滴定技术(Galvanostatic intermittent titration technique, GITT)、恒电位间歇滴定技术(Potentiostatic intermittent titration technique, PITT)、电化学阻抗谱(Electrochemical impedance spectroscopy,EIS)、循环伏安法(Cyclic voltammetry, CV)等技术测定电极材料的离子扩散系数。
1.3.2 离子的扩散与迁移路径
离子在晶体结构中的扩散除了用上述实验技术获得以外,还可以利用第一性原理、分子动力学模拟等理论计算方法,理论计算在一定程度上弥补了实验在探索原子尺度离子迁移机制的空缺,计算与实验的结合,可以揭示离子的详细扩散过程[69]。其中基于第一性原理的微动弹性带(Nudged elastic band,NEB)方法和改进的爬坡弹性带(Climbing image nudged elastic band,CI-NEB)方法是最常用来模拟离子的扩散路径、计算反应势垒的工具。分子动力学模拟根据统计物理学规律可以提供在亚飞秒到纳秒的时间尺度上的离子移动信息,通过轨迹的可视化信息,可直接观察来确定扩散机制[70]。
离子的迁移和扩散行为是影响电极材料倍率性能的最重要参数之一,与电极材料的化学性质、晶体结构以及宿主体内局部离子浓度有关。对于热力学和动力学理想嵌入型化合物,其基本参数离子扩散系数(D)可表达为[71]:
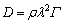 (14)
(14)
式中:ρ是一个几何因子,取决于填隙位点格子的对称性;λ是相邻填隙位点之间的跳跃距离。Γ为跳跃频率,其表达式为[72]
 (15)
(15)
式中: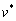 是振动因子;△E是迁移势垒。因此,在理想的嵌入化合物中(以锂离子电池为例),Li+的离子扩散系数随Li+浓度的任何变化都是由迁移势垒和振动因子对Li+平均浓度的依赖引起的。由于扩散系数对迁移势垒具有指数依赖性,所以,因材料化学成分、晶体结构变化引起的离子迁移势垒的小变化都会引起扩散系数的巨大变化。CEDER课题组[25]利用NEB模拟方法计算了不同离子(Li+,Mg2+,Zn2+,Ca2+和Al3+)在尖晶石Mn2O4,橄榄石FePO4,层状NiO2和正交晶系△-V2O5结构中的扩散路径,他们发现,与主体结构的扩散路径拓扑结构相匹配的插入位点是控制离子迁移速率的主要因素,这为寻找可供多价离子快速扩散的结构提供了实用的准则,如图3(f)所示。
是振动因子;△E是迁移势垒。因此,在理想的嵌入化合物中(以锂离子电池为例),Li+的离子扩散系数随Li+浓度的任何变化都是由迁移势垒和振动因子对Li+平均浓度的依赖引起的。由于扩散系数对迁移势垒具有指数依赖性,所以,因材料化学成分、晶体结构变化引起的离子迁移势垒的小变化都会引起扩散系数的巨大变化。CEDER课题组[25]利用NEB模拟方法计算了不同离子(Li+,Mg2+,Zn2+,Ca2+和Al3+)在尖晶石Mn2O4,橄榄石FePO4,层状NiO2和正交晶系△-V2O5结构中的扩散路径,他们发现,与主体结构的扩散路径拓扑结构相匹配的插入位点是控制离子迁移速率的主要因素,这为寻找可供多价离子快速扩散的结构提供了实用的准则,如图3(f)所示。
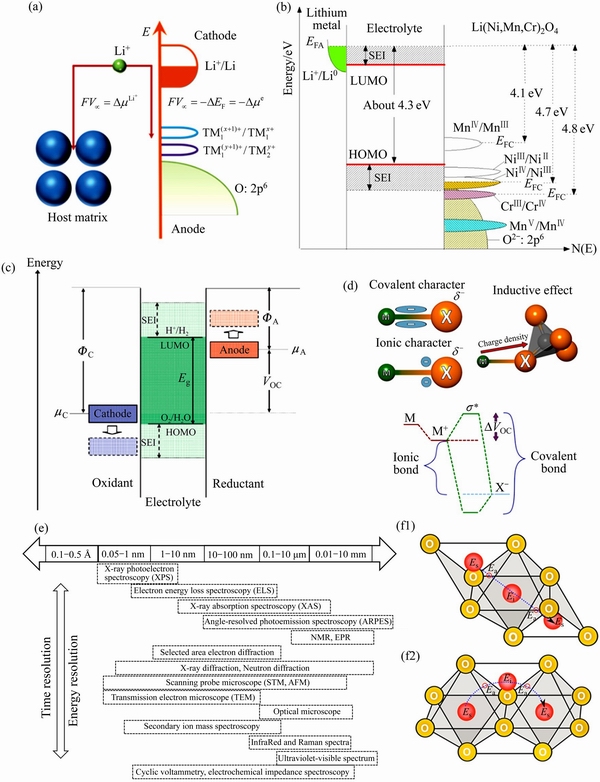
图3 费米能级与锂离子电池的开路电压(a);具有稳定SEI膜的LixNi0.5-yMn1.5-yCr2yO4氧化物电极电池费米能级与电子态密度示意图[64](b);水系电解液电池系统能量适配状态示意图[65](c);电极材料中两种常见的成键类型:共价键与离子键[22](d);电池技术常用的检测技术(e);密堆积氧化物中低活化能的离子迁移路径:四面体中心位(tet)→八面体中心位oct→tet (f1)或oct→tet→oct,即始于稳定的插入位点(Es),通过三配位的氧原子面(Ea)进入中间位点(Ei),最后通过对称路径[25] (f2)
Fig. 3 Schematic open-circuit energy diagram of an aqueous electrolyte(a); Fermi energy level and electron state density of LixNi0.5-yMn1.5-yCr2yO4 oxide electrode with stable SEI film[64](b); Schematic diagram of energy adaptation state of water electrolyte battery system[65](c); Two common bonding types in electrode materials: Covalent bond to ionic bond[22](d); Common characterization techniques used in battery technology(e); Ion migration paths with low activation energy in densely packed oxides: (f1) Tetrahedral center (tet)→Octahedral central position (oct)→tet; (f2)oct→tet→oct. It starts at a stable insertion site (i.e. Es), then enters intermediate site (Ei) through the oxygen plane of tricoordination (Ea), lastly, goes through symmetric path[65]
1.3.3 离子电导率
宏观离子电导率可以用与离子导体基本跃迁相关的参数表示[73]:
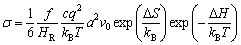 (16)
(16)
式中:c为移动离子浓度;q为移动离子电荷;a为跳跃距离;v0为跳跃频率;T为温度;f和HR为相关因子(与离子扩散过程有关);kB为玻尔兹曼常数;△S和△H分别为迁移熵和活化能。以上物理参数受到固体材料的晶格体积、迁移路径的瓶颈尺寸大小、配位环境、局部无序、局部畸变、缺陷和晶格动力学等因素的影响。而且其中一种因素,如晶格体积,会影响与离子输运有关的多个物理参数,并进一步影响离子电导率。
2 电极材料调控手段
电池电动势越高,则电池能量越高,理论上选择电极电位相差最大的电极材料组装出的电池电动势最高,如Li-F2电池,但受制造工艺的限制,很难实用化。因此,电极材料作为电池的核心,需要从材料结构本身、与电解液的匹配性、材料的成本、安全性等多方面考虑:正负极材料分别选择更高与更低的电极电位,满足电池电动势要求;具有电化学活性,质量和体积比容量高;具有高的电子导电性、有效的离子传输通道和优异的结构稳定性;在电解液中化学稳定性高,且不溶于电解液,电池自放电效应小;资源充足、成本低,环境友好。
当前极具研究价值及实际应用的电极材料都存在着容量低、离子扩散系数和电子传输能力差、结构不稳定等缺点。通常需要特定的合成方法制备出商用电池材料,以获得具有电化学活性的电极材料。针对电极材料存在的弊端,研究者在电极材料结构调控方面进行了大量的研究,包括对材料本体的改善,如结构调控、形貌调控,以及与其他材料复合等。本节内容将从体相结构设计、形貌调控、表界面调控和综合调控等四个方面进行介绍电极材料的调控手段。
2.1 体相结构调控
考虑到原始材料中固有缺陷的浓度通常是有限的,掺杂和取代已被广泛地用于增加载流子以改善材料的离子输运性能[74-75]。对于层状结构材料,层间引入离子可以有效改善材料的结构稳定性[76-77]。此外通过不同离子的掺杂还可改变电极材料结构中的键合环境,例如引入缺陷、改变电极材料的电子结构等[78-79]。例如,在材料结构中引入强的吸电子基团(如,氟等)是提升电极材料工作电压的常用方法[22]。
YUAN等[80]发现K+的存在可以扩大α-MnO2的隧道结构(见图4(a)),同时通过第一性原理计算发现,K0.25MnO2中电子带隙明显降低,材料的导电性得以提升,提高了锂离子的扩散速率。锰基材料由于其独特的隧道或者层状结构,是水系锌离子电池常用的正极材料之一。但Zn2+与主体材料之间有强烈的静电相互作用,导致反应动力学过程缓慢。FANG等[52]通过在K0.8Mn8O16(KMO)中引入氧空位的方法,有效改善了电极材料的电化学活性(见图4(b))。通过光致发光光谱(PL)、X射线光电子能谱(XPS)和近边X射线吸收精细结构(NEXAFS)等技术验证了KMO中存在丰富的氧缺陷,如图4(c)~(e)所示。氧缺陷的存在大大提高了KMO的电子浓度,实现了快速的电荷转移和离子扩散,从而改善了电化学性能。
钒基材料是锌离子电池中最主要的正极材料,但基于V的氧化电位较低。WAN等[81]通过将较弱的P—O键取代了结合更牢固的V—O键合成了VOPO4,增加氧的活性,在0.8~2.1 V(vs. Zn2+/Zn)的电压区间内实现了钒和氧的氧化还原,平均充放电电压提高到了约1.56 V(约为传统层状钒基正极的两倍),如图4(f)~(h)所示。由于普通水系电解液中通常在1.9 V(vs. Zn2+/Zn)发生析氧反应(Oxygen evolution reaction,OER),因此该电池体系选择了盐包水电解液(Water in salts,WIS)体系(OER可扩宽至约2.6 V)。但WIS电解液体系价格昂贵,很难大规模商用化,因此水系锌离子电池的在提升工作电压问题上仍存在巨大挑战。FANG等[82]利用阴离子(N元素)对V2O5进行结构的改性,合成VNxOy正极材料。通过非原位XRD、N K-edge NEXAFS图谱、表面漫反射红外图谱、1H的固态核磁共振谱等测试表明VNxOy电极中同时发生了阳离子(V3+)和阴离子(N3-)的氧化还原反应,当Zn2+嵌入时V3+还原至V2+并伴随着N3-氧化至N2-。这两项工作为锌离子电池体系储能机理提供了一种新的视角,同时也为提高水系锌离子电池的性能提供了新思路。
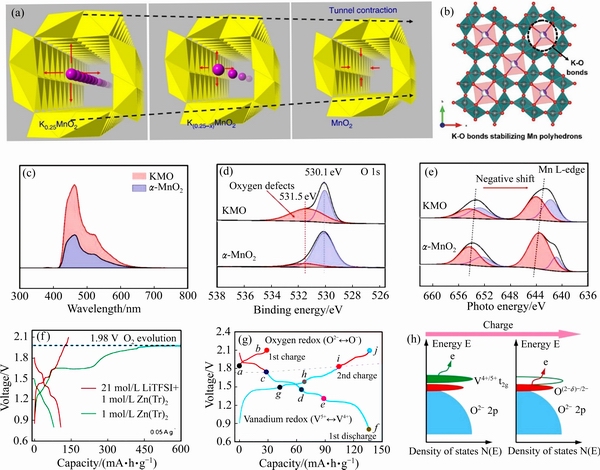
图4 MnO2与K0.25MnO2结构示意图[80](a);K0.8Mn8O16结构示意图[52](b);K0.8Mn8O16与MnO2的PL图谱[52](c); K0.8Mn8O16的O 1s 高倍XPS图谱[52](d);K0.8Mn8O16 的Mn L边 NEXAFS图谱[52](e);VOPO4在不同电解液体系中的充放电曲线[81](f);VOPO4充放电曲线中的氧还原反应电压区间[81](g);VOPO4的态密度[81](h)
Fig. 4 Structural representation of MnO2 and K0.25MnO2[80](a); Structural representation of K0.8Mn8O16[52](b); PL spectra of MnO2 and K0.8Mn8O16[52](c); O 1s high-resolution XPS spectra of K0.8Mn8O16[52](d); Mn L-edge NEXAFS spectra of K0.8Mn8O16[52](e); Charge-discharge curves of VOPO4 in different electrolytes[81](f); Voltage range of oxygen redox reaction in charge-discharge curves[81] (g); Schematic diagram of energy versus density of states in VOPO4[81] (h)
由于材料都有其固有特性,用于电极材料时各有优劣,通过不同材料之间的复合可以获得更为优异的电化学性能[83-86]。如层状结构的V2O5理论容量高,但结构不稳定,而钒酸盐材料的结构稳定,但容量偏低[87]。QIN等[88]通过构建双相复合材料来的策略合成了V2O5/NaV6O15材料用于水系锌离子电池。一方面,由双相结构引起的高电导率和赝电容效应大大提升了材料的倍率性能,V2O5/NaV6O15电极在10 A/g的电流密度下循环4000次后仍具有116.7 mA·h/g的容量。另一方面,两相的存在增加了界面面积,增加了离子存储的活性位点。
2.2 形貌调控
除体相结构调控外,调整电极材料的形貌以获得多孔和高表面积的电极,是提高电极容量的另一条途径。通常块体材料的电化学活性很低,很难直接用作电极材料。材料纳米化可以提高电荷输运(在电解质和活性物质中)和电子转移(在两相界面中)有关的反应速率,同时具有更高的电极/电解液接触面积,减小极化,还可抑制脱嵌过程引起的体积变化。除制备低维结构(如纳米颗粒、纳米线、纳米棒、纳米管等)的电极材料外,还可通过改变制备方法合成具有特殊形貌的三维结构,如纳米花、核壳、中空等分级结构,常用的制备方法有硬/软模板法、刻蚀法、Kirkendall效应、Ostwald熟化、离子交换等[89]。更为独特的分级结构,如空腔结构,可以有效改善电极材料的体积变化,提高循环稳定性。
纳米化是激发材料电化学活性、快速离子迁移,实现高比容量、高倍率、长循环的有效手段。北京大学郭少军教授课题组[90]利用分子筛咪唑盐骨架(ZIFs)的多孔性和静电纺纳米纤维的高孔隙率、表面积大等特点,在聚丙烯腈静电纺丝纳米纤维上通过浸渍和后续炭化相结合的方法合成了叶状Co-ZIFs (ZIF-L),构建了一个独立多级多孔氮掺杂碳结构。在热处理时采用相对低温的氧化工艺,利用钴纳米粒子转化为Co3O4空心结构时产生的Kirkendall效应(反应物在固态中的扩散速率不同),实现了对氧空位数量的调节和控制,如图5(a)~(b)所示。
值得一提的是,复杂的纳米材料结构通常需要经历复杂的合成过程。纳米化方案尽管可以提高容量和倍率性能,但也会增加材料表面的副反应。例如中国科学技术大学余彦课题组通过硼、氮掺杂制备出的相互连接纤维形态的硬碳材料(BN-CNFs)[91]。这种独特的三位相连接的结构有利于Na+的迁移,实现了优异的倍率储钠性能,但这样的优化未能提升材料的首圈库伦效率(见图5(c)和(d))。此外,纳米材料其低的振实密度也会降低电池的体积容量/能量密度。综合材料的性能和实用化效果,目前商业化的锂离子电池正负极材料通常采用块体微米级材料,在保证容量和倍率性能的同时,又可以很好地适用于工业化生产。例如四川大学陈云贵教授报道了一种自上而下策略制备低成本、超致密、无钴的微尺度镍正极材料并用于开发实用型镍锌全电池[92]。基于阴离子交换和柯肯达尔效应,NiS纳米点及丰富的介孔渗透至整个微球基体,从而增强了电化学活性与质子扩散动力学(见图5(e))。该独特结构的正极材料可以实现160 mg/cm2的高负载量,并在一步压实后,其电极压实密度可达2.86 g/cm3,高于所报道的纳米多孔材料。
2.3 表界面调控
前面所提到的调控手段集中在电极材料的体相,如体相结构和形貌调控是改善电极材料性能的常用方法。表界面是电荷转移发生的区域,其结构与体相结构有明显差异,材料的失效,如容量衰减、循环性能差等,常起源于表面结构的不可逆转变,因此对材料的表界面结构调控是非常重要的[93]。表界面的调控可以分为两大类:1) 改善电极材料内部结构的界面;2) 改善与电解液接触时的不稳定状态。
基于转换反应及合金化反应的金属硫化物氧化还原电位丰富,理论比容量高,但金属硫化物的传统合成常常伴随着高温、高压、副产物污染严重等问题。我国的天然硫化物矿产资源丰富,通过清洁环保的途径获取金属硫化物,并直接运用于能源存储,可以极大降低传统制备流程所带来的能耗及污染问题。基于此,中南大学孙伟团队通过矿物加工技术从天然辉锑矿中获得了高纯辉锑矿原材料,并与碳基质进行界面键合,有效提升了矿物基材料的电化学性能[94]。通过长效微分中值曲线分析,未经改性的辉锑矿材料在多圈循环以后,分解为锑电极与硫电极两部分,进而导致多硫化物的生成,不能再进行有效的可逆反应,引起容量衰减。碳基质材料的不仅提升了原材料的导电性,同时有效地缓解了循环过程中的体积膨胀问题。Raman和FTIR测试发现,改性后复合材料的特征峰发生蓝移,说明材料内部价键震动发生变化,结合XPS分析,发现辉锑矿与碳基表面形成了Sb—C价键结构,界面桥键在界面处形成离子快速传输通道,有效地提升电极材料整体电化学性能(见图6(a)~(c))。
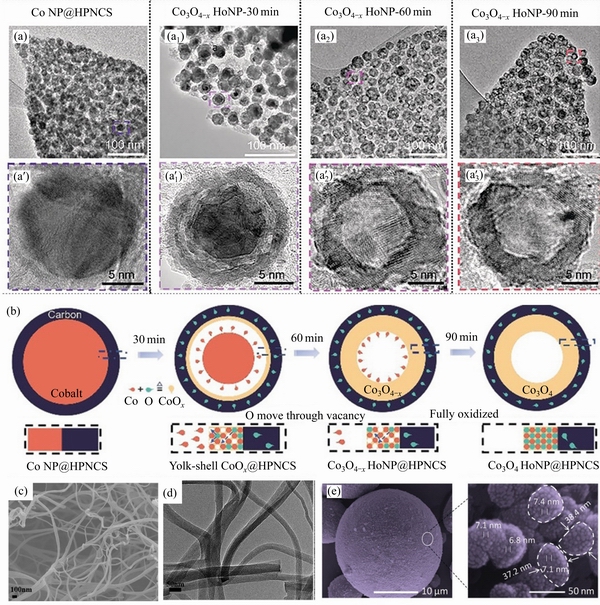
图5 不同时间下的TEM图像((a), (a′), (a1)-(a3), (a′1)-(a′3));氧空位形成过程示意图[90](b);BN-CNFs的SEM图像(c);BN-CNFs的TEM图像[91](d);具有纳米微球形貌的镍正极[92](e)
Fig. 5 TEM images at different times((a), (a′), (a1)-(a3), (a′1)-(a′3)); Schematic diagram of oxygen vacancy formation[90](b); SEM images of BN-CNFs(c); TEM images of BN-CNFs[91](d); SEM images of Ni cathode with morphology of nanospheres[92](e)
对于正极材料来说,通过表面包覆的方法可以有效缓解正极材料的溶解、改善导电性等。常用的包覆材料包括碳材料、导电聚合物、氧化物、氟化物、氮化物等。此外,界面的存储可以增加电极材料的容量。LFP价格低廉、安全性高,目前广泛应用在电动大巴等领域,然而其本征电子电导率低以及Li/Fe反位缺陷等问题限制了其能量密度和使用寿命的提高。很多研究表明,经过特殊包覆的LFP常常超过其理论容量(170 mA·h/g),高达200 mA·h/g,多余容量常常被归因于碳包覆层储锂。北京大学潘锋团队[95]研究发现,碳包覆在LFP的表面形成了C—O—Fe的化学键合作用,导致表面的FeO6八面体变为PO5五面体,多余的O则形成了悬挂键,因此可以储存更多的Li(208 mA·h/g)(见图6(d))。天津大学刘恩佐团队[96]通过第一性原理计算了石墨烯与LFP界面储锂过程时界面处的稳定性和电子结构演变,理论计算结果支持了表面重构能够增加锂储存位的观点。
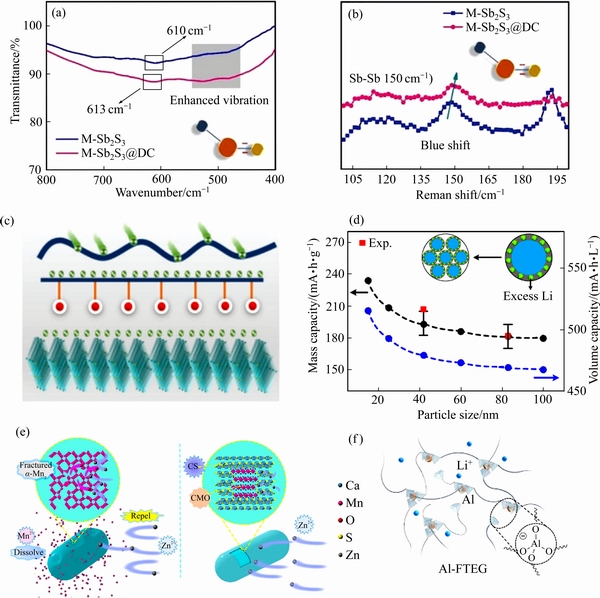
图6 辉锑矿材料的Raman与IR表征[94]((a), (b));及其表面结构示意图[94](c);不同颗粒尺寸下碳包覆LFP的容量对比[95](d);Ca2MnO4正极表面原位SEI膜的形成示意图[102](e);人工SEI膜的结构示意图[106](f)
Fig. 6 FTIR spectra and Raman spectra of Sb2S3[94]((a), (b)); Simplified mechanism of interface[94](c); Comparison of capacities of LFP with different carbon coating particle sizes[95](d); Schematic diagram of in-situ SEI film formation on Ca2MnO4 cathode[102](e); Structure diagram of artificial SEI membrane[106](f)
部分电极材料(例如锂金属负极、部分正极材料)与电解液的接触界面不稳定,常常生成固体电解质界面膜(Solid electrolyte interface,SEI)。SEI膜一方面消耗部分电解液,使得首圈库伦效率降低,另一方面,该界面层电子绝缘,是优良的离子导体,可以有效防止溶剂分子共嵌,可有效提高电极的循环稳定性[97-99]。电极/电解液界面在稳定充电电池的循环性能、延长电池的使用寿命种起着至关重要的作用,因此对表界面的组成结构、稳定性及影响因素的深入研究,是提升电池性能的关键之一[100-101]。近年来,研究人员又将电极/电解液界面进一部分为负极/电解液界面(Anode/electrode interface, AEI)和正极/电解液界面(Cathode/electrode interface, CEI)。在正极界面方面,GUO等[102]采用Ca2MnO4作为锌离子电池正极材料,研究发现,在循环过程中电极表面原位形成SEI膜(CaSO4·2H2O)(见图6(e))。该保护膜降低了电极的阻抗,改善界面并降低活化能,可有效抑制锰的溶解,延长了电池使用寿命,在1 A/g的电流密度下,经过1000次循环后,容量没有明显的衰减。尽管水系电解液具有电导率高、环境友好等众多优点,但水的高活性也意味着电池体系中常常伴随着不良的副反应。在锌负极方面,枝晶和腐蚀问题仍然是该系统的一个严峻的挑战。DENG等[103]以人工保护锌金属/电解质界面为基础,设计了高岭土涂层的锌负极(KL-Zn)。KL空隙分布均匀,且具有独特的筛元功能(Zn2+的选择性通道),有效地抑制了副反应的发生,保证了锌负极长期稳定性。
从SEI膜组成出发,目前也有很多研究采用人工SEI膜的方法改善电极材料的稳定性[104-105]。例如斯坦福大学鲍哲南团队[106]设计了一种单离子导体作为锂金属负极处的人工SEI膜,实现了锂金属全电池在商用碳酸酯电解液中的长周期寿命。该人工SEI膜以Al—OR键为中心,结合交联化学,构筑了具有动态性能的SEI膜,可适应锂剥离/沉积过程中的大体积变化(见图6(f))。人工SEI膜本身具有化学和电化学惰性,可减少电解质渗透,以减缓界面处的不利副反应,同时具有均匀快速的锂离子传导减少“热点”,形成相对均匀的锂沉积形态,稳定锂金属负极。测试结果表明,人工SEI膜中Li+迁移数高达0.96,显著的锂离子导电性降低了界面阻抗和锂金属沉积的过电位,在锂锂对称电池、锂铜半电池和锂NMC全电池中实现了稳定的锂金属循环。
2.4 综合调控
针对当前电极材料面临的共同问题,如导电性差、结构不稳定等,多种调控手段相结合是获得优异电化学性能的常用方法。
聚阴离子型磷酸盐具有稳定的框架结构、合适的工作电压和快速的离子迁移路径等特征,是一类极具研究价值和应用前景的钠离子电池正极材料。例如,CAO等[83]通过简单的水热法合成了一系列氮掺杂碳包覆的Na3V2(PO4)3/C微球。该材料以油酸钠为钠源和结构导向剂,通过调整水热时间和前驱体浓度,合成出了由纳米片组装的分级微球(见图7(a))。氮掺杂碳包覆和独特的微纳结构有效构筑了双连续的电子和离子扩散通道,增加了电极和电解液的接触面积,同时增强了结构稳定性。进一步地将其与SnS/C负极匹配组装钠离子全电池,获得了223 W·h/kg的实际能量密度。针对钒磷酸盐能量密度低等缺点,MA等[107]通过引入氧化还原电势更高的Mn3+/Mn2+,并采用碳包覆和纳米结构调控的方法合成了Na3.5Mn0.5V1.5(PO4)3/C(NMVP)正极材料。NMVP作为钠离子正极材料,在高负载量以及高低温(-20~50 ℃)条件下依然具有优异的倍率性能和循环稳定性(见图7(b))。NMVP匹配硬碳全电池,获得了3.26 V的工作电压,在200 mA/g的电流密度下循环140圈后容量保持率为88.7%(见图 7(c))。此外,用电负性更高的氟取代NASICON结构的磷酸钒钠,以V—F键取代部分V—O键是提高材料的工作电压的有效方法,从而可以增加电池的能量密度[108-110]。
此外,基于异质结构设计的电极材料内部存在多项界面,在不同相之间的连接处,形成内置电场,可以加速电化学反应的电极动力学过程[111-112]。例如,FANG等[113]通过对双金属有机骨架(CoZn-MOFs)进行简单硫化和煅烧,合成了中空氮掺杂碳包覆双金属硫化物(Co9S8/ZnS)纳米片,如图 7(d)~(f)所示。Co9S8和ZnS相间的丰富相界为快速电子和离子输运创造了大量的非本征缺陷和活性位点。含氮的碳基体极大地增强了赝电容效应,保证了电子和离子的快速扩散动力学。根据柯肯达尔效应,由于Zn2+/Co2+半径远小于S2-,因此Zn/Co2+在缓冲壳中的扩散速度比S2-快,随着硫化时间的延长,中空结构逐渐形成。Co9S8/ZnS纳米片与Na3V2(PO4)3组装的全电池在1.65 mA的大电流下,500个循环后保持93%的容量,表现出较好的结构稳定性。
在锌金属负极材料研究方面,XIE等[114]通过液相沉淀法得到一种三维网状结构ZnO功能修饰的Zn@ZnO-3D负极(见图7(g)和(h)),从材料结构调控和界面修饰的角度,实现了99.55%的锌利用率和长达1000次的高可逆沉积/剥离次数。结合动力学和热力学分析、第一性原理计算,发现O元素可以优先吸附并容易结合Zn2+,减少水和锌离子的结合,抑制了氢气的析出,匹配MnO2全电池在电流密度0.5 A/g下循环500次后容量基本维持100%。
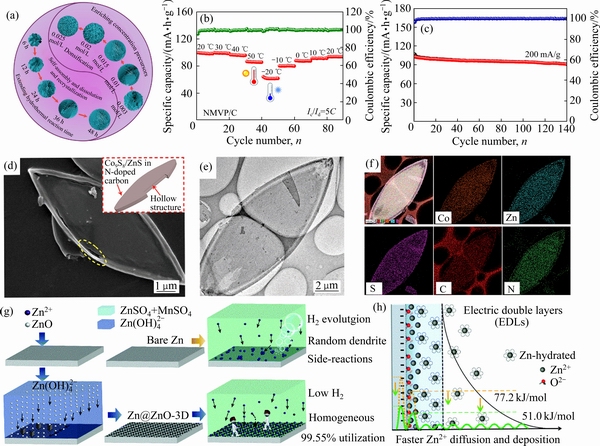
图 7 Na3V2(PO4)3/C微球合成过程示意图[83](a);NMVP在不同温度下的电化学性能[107](b);NMVP的全电池性能[107](c);Co9S8/ZnS纳米片的SEM图与结构示意图[113](d);Co9S8/ZnS纳米片的TEM图[113](e);Co9S8/ZnS纳米片的元素分布图[114](f);Zn@ZnO-3D负极的合成过程示意图[114](g);Zn@ZnO-3D负极界面处的电双层结构及其与裸Zn相对应的能垒[114](h)
Fig. 7 Schematic diagram of Na3V2(PO4)3/C microsphere synthesis process[83](a); Electrochemical performance of NMVP electrodes at different temperatures[107](b); Cycling performance of full-cell between 2.0 and 3.8 V[107](c); SEM images and structure diagram of Co9S8/ZnS nanosheets[113](d); TEM images of Co9S8/ZnS nanosheets[113](e); Elemental mappings of Co9S8/ZnS nanosheets[114](f); Diagram of Zn@ZnO-3D anode synthesis process[114](g); Electrical bilayer structure at anode/electrolyte interface and energy barrier[114](h)
3 总结与展望
经过几十年的发展,二次电池的研究取得了巨大的进步,其中对电极材料微纳结构的理解是很重要的一部分。回顾历史可以使我们更好地了解底层的结构-性能关系,进而从基础理论和前沿成果的角度对电极材料进行更巧妙的设计,有助于指导新兴的二次电池体系。
锂离子电池的成功商业化,其高能量密度、长循环寿命等特点革命性地改变了人类的生活,逐渐取代了传统铅酸、镍镉电池等。由于锂资源分布不均、资源匮乏等特点,推动了研究人员寻找新的体系,以满足不同领域的需求。钠离子电池与锂离子电池类似,是二次电池新体系中最有望大规模应用的下一代储能设备。2021年,国内宁德时代发布了第一代钠离子电池,能量密度可达160 W·h/kg,预期未来钠离子电池在低速交通和大规模储能领域将占有重要一席之地。水系锌离子电池是目前水系电池领域中最重要的部分,近几年发展迅速。水系电解液的使用避免了有机电解液带来的可燃性问题,降低了电池组装成本等。但该的研究仍处于较为初级的阶段,存在许多挑战。在储能机理方面,电解液中的许多载荷子如Zn2+、H+以及来自电解液添加剂的其他阳离子(如Li+、Na+、Mn2+)都能够和正极材料反应,使得反应变得十分复杂。在正极材料方面,锌离子与正极材料具有很强的静电相互作用,使得Zn2+的扩散受阻,导致结构坍塌和容量衰减。负极材料方面,锌枝晶、腐蚀等问题严重阻碍了该体系的进一步商业化应用。在电解液方面,由于受限于水系电解液的稳定电压窗口,阻碍了水系锌离子电池能量密度的提升。因此开发耐高压的水系电解液是提升水系锌离子电池能量密度以及推动其商业化的必经路径。
结合先进检测技术的快速发展,也使得我们对电极材料性能改善有了更多的了解。特别地,对于电极材料来说,微观结构的不同往往是影响电化学性能的关键,通过更为先进的表征技术有助于推进对电极材料构效关系的了解。近些年理论计算技术的发展,也使得材料学科领域有所受益。通过密度泛函理论、分子动力学模拟、蒙特卡洛方法等计算手段可以获得原子级别结构信息、模拟复杂系统、探索新材料等,结合不同多尺度的模拟方法可以给出材料结构与性能之间的理性关系,并进一步进行理性设计。从材料性能优化的角度,电极材料的设计应从以下几个方面考虑:具有高的电子导电性、有效的离子传输通道和优异的结构稳定性等。为了使新型电极材料的应用成为可能,针对电极材料存在的问题如不稳定的结构、电化学活性低等缺点,多种调控策略用于提升电极材料的电化学性能。例如通过掺杂、引入缺陷以获得更高的离子、电子导电性、稳定材料结构、改变电子结构等;通过纳米化、设计特殊形貌可以有效改善材料的结构稳定性、提高电化学活性等;通过表面包覆、表界面重构等可以实现界面处储能、获得更稳定的储能系统。尽管这些调控手段大大改善了电极材料的电化学性能,但从材料结构和未来电极材料的选择上,仍需要持续的探索与优化,从而提供更有效的解决方案。例如,在电极材料的形貌设计上,多种多样的独特结构在一定程度上大大改善了电化学性能,但高表面积也会导致不利的副反应增加,导致自放电等。同时,复杂的合成过程难以大规模制备,很难适用于商业化发展需求。此外,尽管我们在文献中看到很多体系的容量已达到商业化锂离子电池的2~10倍,但文献中的实验数据大多基于半电池体系的测试,即过量的电解液和金属负极等。因此在新的电极材料商业化之前仍有很多问题需要解决,例如简化材料的制备方法、开发特殊的压实方法等以实现高活性、快速质子扩散、高振实密度的电极材料大规模制备。基于资源丰富元素的低成本电池有望成为未来储能领域的重要组成部分,未来的电池技术也将是百花齐放的共存时代,以适用于不同的应用环境。但目前的多数二次电池系统在电极材料的选择、成本降低等方面仍存在诸多问题,因此对于研究人员来说,在改善电极材料性能的同时,有必要了解工业发展需求,以获得更有价值和可靠的数据。
REFERENCES
[1] LARCHER D, TARASCON J M. Towards greener and more sustainable batteries for electrical energy storage[J]. Nature Chemistry, 2015, 7(1): 19-29.
[2] DURMUS Y E, ZHANG H, BAAKES F, et al. Side by side battery technologies with lithium-ion based batteries[J]. Advanced Energy Materials, 2020, 10(24): 2000089.
[3] 梁叔全, 程一兵, 方国赵, 等. 能源光电转换与大规模储能二次电池关键材料的研究进展[J]. 中国有色金属学报, 2019, 29(9): 2064-2114.LIANG Shu-quan, CHENG Yi-bing, FANG Guo-zhao, et al. Research progress of key materials for energy photoelectric conversion and large-scale energy storage secondary batteries[J]. The Chinese Journal of Nonferrous Metals, 2019, 29(9): 2064-2114.
[4] REDDY T B, LINDEN D. Linden’s handbook of batteries[M]. 4 ed. McGraw-Hill: 2010: 188-829.
[5] LIANG Y, ZHAO C Z, YUAN H, et al. A review of rechargeable batteries for portable electronic devices[J]. InfoMat, 2019, 1(1): 6-32.
[6] LI M, LU J, CHEN Z, et al. 30 Years of lithium-ion batteries[J]. Advanced Materials, 2018, 30: 1800561.
[7] 黄云辉. 锂离子电池: 20世纪最重要的发明之一[J]. 科学通报, 2019, 64(36): 3811-3816.HUANG Yun-hui. Lithium-ion battery: One of the most important inventions in the 20th century[J]. Chinese science bulletin, 2019, 64(36): 3811-3816.
[8] LU S J, HE Z J, LI Y J, et al. Synthesis and properties of single-crystal Ni-rich cathode materials in Li-ion batteries[J]. Transactions of Nonferrous Metals Society of China, 2021, 31(4): 1074-1086.
[9] SHARMA S, MANTHIRAM A. Towards more environmentally and socially responsible batteries[J]. Energy & Environmental Science, 2020, 13(11): 4087-4097.
[10] WANG Y, CHEN R, CHEN T, et al. Emerging non-lithium ion batteries[J]. Energy Storage Materials, 2016, 4: 103-129.
[11] SONG K, LIU C, MI L, et al. Recent progress on the alloy-based anode for sodium-ion batteries and potassium- ion batteries[J]. Small, 2021, 17(9): 1903194.
[12] NEWMAN G H. Ambient temperature cycling of an Na-TiS2 cell[J]. Journal of the Electrochemical Society, 1980, 127(10): 2097.
[13] SHACKLETTE L W. Rechargeable electrodes from sodium cobalt bronzes[J]. Journal of the Electrochemical Society, 1988, 135(11): 2669.
[14] DELMAS C. Sodium and sodium-ion batteries: 50 years of research[J]. Advanced Energy Materials, 2018, 8(17): 1703137.
[15] LIU Y, MERINOV B V, GODDARD W A, 3RD. Origin of low sodium capacity in graphite and generally weak substrate binding of Na and Mg among alkali and alkaline earth metals[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(14): 3735-3739.
[16] JACHE B, ADELHELM P. Use of graphite as a highly reversible electrode with superior cycle life for sodium-ion batteries by making use of co-intercalation phenomena[J]. Angewandte Chemie International Edition, 2014, 53(38): 10169-10173.
[17] KIM H, HONG J, YOON G, et al. Sodium intercalation chemistry in graphite[J]. Energy & Environmental Science, 2015, 8(10): 2963-2969.
[18] 曹鑫鑫, 周 江, 潘安强, 等. 钠离子电池磷酸盐正极材料研究进展[J]. 物理化学学报, 2020, 36(5): 24-49.CAO Xin-xin, ZHOU Jiang, PAN An-qiang, et al. Recent advances in phosphate cathode materials for sodium-ion batteries[J]. Acta Physico-Chimica Sinica, 2020, 36(5): 24-49.
[19] CHAYAMBUKA K, MULDER G, DANILOV D L, et al. From Li-ion batteries toward Na-ion chemistries: Challenges and opportunities[J]. Advanced Energy Materials, 2020, 10(38): 2001310.
[20] ZHANG W, LIU Y, GUO Z. Approaching high-performance potassium-ion batteries via advanced design strategies and engineering[J]. Science Advances, 2019, 5(5): eaav7412.
[21] ZENG X, HAO J, WANG Z, et al. Recent progress and perspectives on aqueous Zn-based rechargeable batteries with mild aqueous electrolytes[J]. Energy Storage Materials, 2019, 20: 410-437.
[22] MELOT B C, TARASCON J M. Design and preparation of materials for advanced electrochemical storage[J]. Accounts of Chemical Research, 2013, 46(5): 1226-1238.
[23] LIANG Y, DONG H, AURBACH D, et al. Current status and future directions of multivalent metal-ion batteries[J]. Nature Energy, 2020, 5(9): 646-656.
[24] CANEPA P, GAUTAM G S, HANNAH D C, et al. Odyssey of multivalent cathode materials: Open questions and future challenges[J]. Chemical Review, 2017, 117(5): 4287-4341.
[25] RONG Z, MALIK R, CANEPA P, et al. Materials design rules for multivalent ion mobility in intercalation structures[J]. Chemistry of Materials, 2015, 27(17): 6016-6021.
[26] 周 江, 单路通, 唐博雅, 等. 水系可充锌电池的发展及挑战[J]. 科学通报, 2020, 65(32): 3562-3596.ZHOU Jiang, SHAN Lu-tong, TANG Bo-ya, et al. Development and challenges of aqueous rechargeable zinc batteries[J]. Chinese science bulletin, 2020, 65(32): 3562-3596.
[27] DUNN B, KAMATH H, TARASCON J M. Electrical energy storage for the grid: A battery of choices[J]. Science, 2011, 334(6058): 928-935.
[28] BRUCE P G, FREUNBERGER S A, HARDWICK L J, et al. Li-O-2 and Li-S batteries with high energy storage[J]. Nature Materials, 2012, 11(1): 19-29.
[29] YANG C, LI P, YU J, et al. Approaching energy-dense and cost-effective lithium–sulfur batteries: From materials chemistry and price considerations[J]. Energy, 2020, 201: 117718.
[30] WAN H, WENG W, HAN F, et al. Bio-inspired nanoscaled electronic/ionic conduction networks for room-temperature all-solid-state sodium-sulfur battery[J]. Nano Today, 2020, 33: 100860.
[31] WANG Z, TAM LY S, LU Y C. Flexible solid flow electrodes for high-energy scalable energy storage[J]. Joule, 2019, 3(7): 1677-1688.
[32] ARMAND M, TARASCON J M. Building better batteries[J]. Nature, 2008, 451(7179): 652-657.
[33] ZU C-X, LI H. Thermodynamic analysis on energy densities of batteries[J]. Energy & Environmental Science, 2011, 4(8): 2614.
[34] ARICO A S, BRUCE P, SCROSATI B, et al. Nanostructured materials for advanced energy conversion and storage devices[J]. Nature Materials, 2005, 4(5): 366-377.
[35] QIN R Z, WANG Y, ZHAO Q H, et al. EQCM for in-depth study of metal anodes for electrochemical energy storage[J]. Chinese Journal of Structural Chemistry, 2020, 39(4): 605-614.
[36] ZHUO Z Q, PAN F, YANG W L. A perspective on studying electronic structure of batteries through soft X-ray spectroscop[J]. Chinese Journal of Structural Chemistry, 2019, 11(38): 1909-1915.
[37] CHOI J W, AURBACH D. Promise and reality of post-lithium-ion batteries with high energy densities[J]. Nature Reviews Materials, 2016, 1(4): 16013.
[38] LIN Z, LIU T, AI X, et al. Aligning academia and industry for unified battery performance metrics[J]. Nature Communications, 2018, 9(1): 5262.
[39] LI H. Practical evaluation of Li-ion batteries[J]. Joule, 2019, 3(4): 911-914.
[40] 陈小波, 林永寿, 卢世刚, 等. 高安全高能量锂离子电池设计: 高电压层状正极材料[J]. 中国有色金属学报, 2020, 30(12): 2912-2919.CHEN Xiao-bo, LIN Yon-shou, LU Shi-gang, et al. Design of high-safety and high-energy density lithium ion battery: High voltage layered cathode materials[J]. The Chinese Journal of Nonferrous Metals, 2020, 30(12): 2912-2919.
[41] ROSA PALACIN M. Recent advances in rechargeable battery materials: A chemist’s perspective[J]. Chemical Society Reviews, 2009, 38(9): 2565-2575.
[42] 汤小辉, 李国希, 高桂红, 等. 锂离子电池正极材料LiCoO2-LiFePO4的性能[J]. 中国有色金属学报, 2012, 22(1): 139-143.TANG Xiao-hui, LI Guo-xi, GAO Gui-hong, et al. Performance of LiCoO2-LiFePO4 cathode materials for lithium-ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(1): 139-143.
[43] DELMAS C, COGNACA H, COCCIANTELLI J M, et al. The LixV2O5 system: An overview of the structure modifications induced by the lithium intercalation[J]. Solid State Ionics, 1994, 69: 257-264.
[44] GAUTAM G S, CANEPA P, MALIK R, et al. First-principles evaluation of multi-valent cation insertion into orthorhombic V2O5[J]. Chemical Communications, 2015, 51(71): 13619-13622.
[45] LIU D, LIU Z, LI X, et al. Group IVA element (Si, Ge, Sn)- based alloying/dealloying anodes as negative electrodes for full-cell lithium-ion batteries[J]. Small, 2017, 13(45): 1702000.
[46] ZHAO H, YUAN W, LIU G. Hierarchical electrode design of high-capacity alloy nanomaterials for lithium-ion batteries[J]. Nano Today, 2015, 10(2): 193-212.
[47] OBROVAC M N, CHRISTENSEN L. Structural changes in silicon anodes during lithium insertion/extraction[J]. Electrochemical and Solid State Letters, 2004, 7(5): A93-A96.
[48] WU H, CUI Y. Designing nanostructured Si anodes for high energy lithium ion batteries[J]. Nano Today, 2012, 7(5): 414-429.
[49] FENG T T, DAI S Y, WANG J C, et al. Microemulsion synthesis of ZnMn2O4/Mn3O4 sub-microrods for Li-ion batteries and their conversion reaction mechanism[J]. Transactions of Nonferrous Metals Society of China, 2021, 31(1): 265-276.
[50] POIZOT P, LARUELLE S, GRUGEON S, et al. Nano-sized transition-metaloxides as negative-electrode materials for lithium-ion batteries[J]. Nature, 2000, 407(6803): 496-499.
[51] GUO X, ZHOU J, BAI C, et al. Zn/MnO2 battery chemistry with dissolution-deposition mechanism[J]. Materials Today Energy, 2020, 16: 100396.
[52] FANG G, ZHU C, CHEN M, et al. Suppressing manganese dissolution in potassium manganate with rich oxygen defects engaged high-energy-density and durable aqueous zinc-ion battery[J]. Advanced Functional Materials, 2019, 29(15): 1808375.
[53] PAN H, SHAO Y, YAN P, et al. Reversible aqueous zinc/manganese oxide energy storage from conversion reactions[J]. Nature Energy, 2016, 1(5): 16039.
[54] LEE B, SEO H R, LEE H R, et al. Critical role of pH evolution of electrolyte in the reaction mechanism for rechargeable zinc batteries[J]. ChemSusChem, 2016, 9(20): 2948-2956.
[55] JIA X, LIU C, NEALE Z G, et al. Active materials for aqueous zinc ion batteries: Synthesis, crystal structure, morphology, and electrochemistry[J]. Chemical Review, 2020, 120(15): 7795-7866.
[56] ARMAND M, GRUGEON S, VEZIN H, et al. Conjugated dicarboxylate anodes for Li-ion batteries[J]. Nature Materials, 2009, 8(2): 120-125.
[57] CHEN H, ARMAND M, COURTY M, et al. Lithium salt of tetrahydroxybenzoquinone: toward the development of a sustainable Li-ion battery[J]. Journal of the American Chemical Society, 2009, 131(25): 8984-8988.
[58] LIANG Y, TAO Z, CHEN J. Organic electrode materials for rechargeable lithium batteries[J]. Advanced Energy Materials, 2012, 2(7): 742-769.
[59] ZHAO Q, LU Y, CHEN J. Advanced organic electrode materials for rechargeable sodium-ion batteries[J]. Advanced Energy Materials, 2017, 7(8): 1601792.
[60] ZHANG N, CHEN X, YU M, et al. Materials chemistry for rechargeable zinc-ion batteries[J]. Chemical Society Reviews, 2020, 49(13): 4203-4219.
[61] MASSé R C, UCHAKER E, CAO G. Beyond Li-ion: Electrode materials for sodium- and magnesium-ion batteries[J]. Science China Materials, 2015, 58(9): 715-766.
[62] LU Y, CHEN J. Prospects of organic electrode materials for practical lithium batteries[J]. Nature Reviews Chemistry, 2020, 4(3): 127-142.
[63] GAO J, SHI S Q, LI H. Brief overview of electrochemical potential in lithium ion batteries[J]. Chinese Physics B, 2016, 25(1): 115-138.
[64] JULIEN C, MAUGER A, ZAGHIB K, et al. Comparative issues of cathode materials for Li-ion batteries[J]. Inorganics, 2014, 2(1): 132-154.
[65] GOODENOUGH J B, KIM Y. Challenges for rechargeable Li batteries[J]. Chemistry of Materials, 2010, 22(3): 587-603.
[66] MANTHIRAM A, GOODENOUGH J B. Lithium insertion into Fe2(SO4)3 frameworks[J]. Journal of Power Sources, 1989, 26(3/4): 403-408.
[67] VAN DER VEN A, BHATTACHARYA J, BELAK A A. Understanding Li diffusion in Li-intercalation compounds[J]. Accounts of Chemical Research, 2013, 46(5): 1216-1225.
[68] CHEN R, LI Q, YU X, et al. Approaching practically accessible solid-state batteries: Stability issues related to solid electrolytes and interfaces[J]. Chem Rev, 2020, 120(14): 6820-6877.
[69] HE Q, YU B, LI Z H, et al. Density functional theory for battery materials[J]. Energy & Environmental Materials, 2019, 2(4): 264-279.
[70] GAO Y, NOLAN A M, DU P, et al. Classical and emerging characterization techniques for investigation of ion transport mechanisms in crystalline fast ionic conductors[J]. Chemical Review, 2020, 120(13): 5954-6008.
[71] KUTNER R. Chemical diffusion in the lattice gas of non-interacting particles[J]. Physical Letters A, 1981, 81(4): 239-240.
[72] VINEYARD G H. Frequency factors and isotope effects in solid state rate processes[J]. Journal of Physics and Chemistry of Solids, 1957, 3(1/2): 121-127.
[73] HE X, ZHU Y, MO Y. Origin of fast ion diffusion in super-ionic conductors[J]. Nature Communications, 2017, 8: 15893.
[74] ZHANG Y, TAO L, XIE C, et al. Defect engineering on electrode materials for rechargeable batteries[J]. Advanced Materials, 2020, 32(7): e1905923.
[75] ZHOU J, DONG A, DU L, et al. Mn-doped ZnO microspheres as cathode materials for aqueous zinc ion batteries with ultrastability up to 10 000 cycles at a large current density[J]. Chemical Engineering Journal, 2021, 421(2): 127770 .
[76] YANG Y, TANG Y, FANG G, et al. Li+ intercalated V2O5·nH2O with enlarged layer spacing and fast ion diffusion as an aqueous zinc-ion battery cathode[J]. Energy & Environmental Science, 2018, 11(11): 3157-3162.
[77] YANG Y, TANG Y, LIANG S, et al. Transition metal ion-preintercalated V2O5 as high-performance aqueous zinc- ion battery cathode with broad temperature adaptability[J]. Nano Energy, 2019, 61: 617-625.
[78] HU B, TAO G. Molecular dynamics simulations on lithium diffusion in LiFePO4: The effect of anti-site defects[J]. Journal of Materials Chemistry A, 2015, 3(40): 20399-20407.
[79] LI Z, REN Y, MO L, et al. Impacts of oxygen vacancies on zinc ion intercalation in VO2[J]. ACS Nano, 2020, 14(5): 5581-5589.
[80] YUAN Y, ZHAN C, HE K, et al. The influence of large cations on the electrochemical properties of tunnel-structured metal oxides[J]. Nature Communications, 2016, 7: 13374.
[81] WAN F, ZHANG Y, ZHANG L, et al. Reversible oxygen redox chemistry in aqueous zinc-ion batteries[J]. Angewandte Chemie International Edition, 2019, 58(21): 7062-7067.
[82] FANG G, LIANG S, CHEN Z, et al. Simultaneous cationic and anionic redox reactions mechanism enabling high-rate long-life aqueous zinc-ion battery[J]. Advanced Functional Materials, 2019, 29(44): 1905267.
[83] CAO X, PAN A, YIN B, et al. Nanoflake-constructed porous Na3V2(PO4)3/C hierarchical microspheres as a bicontinuous cathode for sodium-ion batteries applications[J]. Nano Energy, 2019, 60: 312-323.
[84] CAI Y, CAO X, LUO Z, et al. Caging Na3V2(PO4)2F3 microcubes in cross-linked graphene enabling ultrafast sodium storage and long-term cycling[J]. Advanced Science, 2018, 5(9): 1800680.
[85] LIANG S, CAO X, WANG Y, et al. Uniform 8LiFePO4center dot Li3V2(PO4)3/C nanoflakes for high-performance Li-ion batteries[J]. Nano Energy, 2016, 22: 48-58.
[86] HOU B H, WANG Y Y, LIU D S, et al. N-Doped Carbon-Coated Ni1.8Co1.2Se4nanoaggregates encapsulated in N-doped carbon nanoboxes as advanced anode with outstanding high-rate and low-temperature performance for sodium-ion half/full batteries[J]. Advanced Functional Materials, 2018, 28(47): 1805444.
[87] XU X, XIONG F, MENG J, et al. Vanadium-based nanomaterials: A promising family for emerging metal-ion batteries[J]. Advanced Functional Materials, 2020, 30(10): 1904398.
[88] QIN M, LIU W, SHAN L, et al. Construction of V2O5/NaV6O15 biphase composites as aqueous zinc-ion battery cathode[J]. Journal of Electroanalytical Chemistry, 2019, 847: 113246.
[89] ZHOU L, ZHUANG Z, ZHAO H, et al. Intricate hollow structures: controlled synthesis and applications in energy storage and conversion[J]. Advanced Materials, 2017, 29(20): 1602914.
[90] JI D, FAN L, TAO L, et al. The kirkendall effect for engineering oxygen vacancy of hollow Co3O4 nanoparticles toward high-performance portable zinc-air batteries[J]. Angewandte Chemie International Edition, 2019, 58(39): 13840-13844.
[91] WANG M, YANG Y, YANG Z, et al. Sodium-ion batteries: Improving the rate capability of 3d interconnected carbon nanofibers thin film by boron, nitrogen dual-doping[J]. Advanced Science, 2017, 4(4): 1600468.
[92] ZHOU W, ZHU D, HE J, et al. A scalable top-down strategy toward practical metrics of Ni-Zn aqueous batteries with total energy densities of 165 W·h/kg and 506 W·h/L[J]. Energy & Environmental Science, 2020, 13(11): 4157-4167.
[93] YANG L, YANG K, ZHENG J, et al. Harnessing the surface structure to enable high-performance cathode materials for lithium-ion batteries[J]. Chemical Society Reviews, 2020, 49(14): 4667-4680.
[94] GE P, ZHANG L, ZHAO W, et al. Interfacial bonding of metal-sulfides with double carbon for improving reversibility of advanced alkali-ion batteries[J]. Advanced Functional Materials, 2020, 30(16): 1910599.
[95] DUAN Y, ZHANG B, ZHENG J, et al. Excess Li-ion storage on reconstructed surfaces of nanocrystals to boost battery performance[J]. Nano Letters, 2017, 17(10): 6018-6026.
[96] WANG H, ZHAO N, SHI C, et al. Effect of interfacial lithium insertion on the stability and electronic structure of graphene/LiFePO4[J]. Electrochimical Acta, 2017, 247: 1030-1037.
[97] GAO B, JALEM R, MA Y, et al. Li+transport mechanism at the heterogeneous cathode/solid electrolyte interface in an all-solid-state battery via the first-principles structure prediction scheme[J]. Chemistry of Materials, 2020, 32(1): 85-96.
[98] YANG G, IVANOV I N, RUTHER R E, et al. Electrolyte solvation structure at solid-liquid interface probed by nanogap surface-enhanced raman spectroscopy[J]. ACS Nano, 2018, 12(10): 10159-10170.
[99] YAMADA H, OGA Y, SARUWATARI I, et al. Local structure and ionic conduction at interfaces of electrode and solid electrolytes[J]. Journal of the Electrochemical Society, 2012, 159(4): A380-A385.
[100] CUI C, FAN X, ZHOU X, et al. Structure and interface design enable stable li-rich cathode[J]. Journal of the American Chemical Society, 2020, 142(19): 8918-8927.
[101] MAKINO Y, KUSAGAYA T, SUZUKI K, et al. Electronic structure of the electrode/electrolyte interface: Large-scale tight-binding quantum chemical simulation[J]. Solid State Ionics, 2004, 175(1/4): 847-850.
[102] GUO S, LIANG S, ZHANG B, et al. Cathode interfacial layer formation via in situ electrochemically charging in aqueous zinc-ion battery[J]. ACS Nano, 2019, 13(11): 13456-13464.
[103] DENG C, XIE X, HAN J, et al. A sieve-functional and uniform-porous kaolin layer toward stable zinc metal anode[J]. Advanced Functional Materials, 2020, 30(21): 1910599.
[104] WANG A, KADAM S, LI H, et al. Review on modeling of the anode solid electrolyte interphase (SEI) for lithium-ion batteries[J]. NPJ Computational Materials, 2018, 4: 15-40.
[105] ZHAO J, LU Z, WANG H, et al. Artificial solid electrolyte interphase-protected LixSi nanoparticles: An efficient and stable prelithiation reagent for lithium-ion batteries[J]. Journal of the American Chemical Society, 2015, 137(26): 8372-8375.
[106] YU Z, MACKANIC D G, MICHAELS W, et al. A dynamic, electrolyte-blocking, and single-ion-conductive network for stable lithium-metal anodes[J]. Joule, 2019, 3(11): 2761-2776.
[107] MA X, CAO X, ZHOU Y, et al. Tuning crystal structure and redox potential of NASICON-type cathodes for sodium-ion batteries[J]. Nano Research, 2020, 13(12): 3330-3337.
[108] LIU S, CAO X, ZHANG Y, et al. Carbon quantum dot modified Na3V2(PO4)2F3 as a high-performance cathode material for sodium-ion batteries[J]. Journal of Materials Chemistry A, 2020, 8(36): 18872-18879.
[109] GUO J Z, WANG P F, WU X L, et al. High-energy/power and low-temperature cathode for sodium-ion batteries: In situ xrd study and superior full-cell performance[J]. Advanced Materials, 2017, 29(33): 1701968.
[110] GUO J Z, YANG Y, LIU D S, et al. A practicable Li/Na-ion hybrid full battery assembled by a high-voltage cathode and commercial graphite anode: Superior energy storage performance and working mechanism[J]. Advanced Energy Materials, 2018, 8(10): 1702504.
[111] FANG G, WANG Q, ZHOU J, et al. Metal organic framework-templated synthesis of bimetallic selenides with rich phase boundaries for sodium-ion storage and oxygen evolution reaction[J]. ACS Nano, 2019, 13(5): 5635-5645.
[112] WANG Y Y, HOU B H, WANG Y N, et al. Multiple heterointerfaces boosted de-/sodiation kinetics towards superior Na storage and Na-Ion full battery[J]. Journal of Materials Chemistry A, 2018, 6(15): 6578-6586.
[113] FANG G, WU Z, ZHOU J, et al. Observation of pseudocapacitive effect and fast ion diffusion in bimetallic sulfides as an advanced sodium-ion battery anode[J]. Advanced Energy Materials, 2018, 8(19): 1703155.
[114] XIE X, LIANG S, GAO J, et al. Manipulating the ion-transfer kinetics and interface stability for high- performance zinc metal anodes[J]. Energy & Environmental Science, 2020, 13(2): 503-510.
Electrochemical basis and regulation of electrode materials for secondary batteries
CHEN Yue1, TAN Xiao-ping1, FANG Guo-zhao1, 2, LIANG Shu-quan1, 2
(1. School of Materials Science and Engineering, Central South University, Changsha 410083, China;
2. Key Laboratory of Electronic Packaging and Advanced Functional Materials of Hunan Province, Central South University, Changsha 410083, China)
Abstract: The issue of energy and environmental security is one of the biggest challenges facing mankind in the 21st century. Since renewable energy is mostly geographically limited and intermittent, it is of great importance to find suitable energy storage systems. The electrode materials play an important role in improving the performance of secondary battery. Although there are many choices of secondary batteries and numerous kinds of electrode materials, the problems faced by secondary battery systems in the development process are always similar, such as collapse of electrode material structure, unstable interface, etc. This review summarized the development history of secondary batteries. The relationship between structure and performance from basis of thermodynamics and kinetics, the design principle of electrode materials and the optimization strategies were also summarized. Finally, aiming at the existence of advantage of optimization strategies and the technical barriers were discussed, which was hoped to open a new avenue for future secondary batteries.
Key words: secondary batteries; electrode materials; energy storage mechanism; electrochemistry; structural design
Foundation item: Projects(51932011, 52072411) supported by the National Natural Science Foundation of China
Received date: 2021-09-11; Accepted date: 2021-10-29
Corresponding authors: TAN Xiao-Ping; Tel: +86-731-88836375; E-mail: tanxiaoping_hn@163.com
FANG Guo-Zhao; Tel: +86-18390959147; E-mail: fg_zhao@csu.edu.cn
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(51932011,52072411)
收稿日期:2021-09-11;修订日期:2021-10-29
通信作者:谭小平,副教授,博士;电话:0731-88836375;E-mail:tanxiaoping_hn@163.com
方国赵,教授,博士;电话:18390959147;E-mail:fg_zhao@csu.edu.cn
摘 要:能源和环境安全是人类21世纪面临的最大难题之一,由于可再生能源大多受地域限制,且具有间歇性,寻找合适的储能系统显得至关重要。二次电池作为最主要的储能系统,电极材料在改善电池性能方面起着至关重要的作用。尽管二次电池的选择多种多样,电极材料的种类数不胜数,但二次电池系统在发展过程中面对的问题总是相似的,如易坍塌的电极材料结构、不稳定的界面等。本文综述了二次电池的发展历史,从电池热力学和动力学基础角度构建结构-性能关系,总结了电极材料的设计原则和目前常用的优化策略,最后针对调控手段的优势以及相应存在的技术障碍进行了讨论,希望为未来的电池研究开辟新途径、带来新机遇。

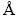 ; K+,1.39
; K+,1.39 
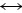 LiCoO2 (1)
LiCoO2 (1)
 和Zn2+反应生成ZSH。充电时,ZSH与Mn2+反应,生成层状水钠锰矿型MnO2(见图2(b))。目前,对于锰基材料在水系锌离子电池体系中的储能方式仍具有争议,如报道过的储锌机理有:锌离子嵌入、锌离子和氢离子共同嵌入、基于MnO2和MnOOH之间的转化反应、插层和转化共存以及沉积-溶解机制等[55]。对于α-MnO2在锌离子电池体系中的储能机理仍需要更深入的研究,特别是利用原位检测技术以排除非原位检测过程中对材料的干扰。随着理解的深入和先进表征技术的出现,科研人员逐渐揭示出电极材料更加复杂的储能行为。电极材料发展是循序渐进的,目前仍然需要加大对储能本质的研究力度,以更好地具有针对性地提升电池的电化学性能。
和Zn2+反应生成ZSH。充电时,ZSH与Mn2+反应,生成层状水钠锰矿型MnO2(见图2(b))。目前,对于锰基材料在水系锌离子电池体系中的储能方式仍具有争议,如报道过的储锌机理有:锌离子嵌入、锌离子和氢离子共同嵌入、基于MnO2和MnOOH之间的转化反应、插层和转化共存以及沉积-溶解机制等[55]。对于α-MnO2在锌离子电池体系中的储能机理仍需要更深入的研究,特别是利用原位检测技术以排除非原位检测过程中对材料的干扰。随着理解的深入和先进表征技术的出现,科研人员逐渐揭示出电极材料更加复杂的储能行为。电极材料发展是循序渐进的,目前仍然需要加大对储能本质的研究力度,以更好地具有针对性地提升电池的电化学性能。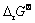 )可以由参与反应物质的标准吉布斯生成能(
)可以由参与反应物质的标准吉布斯生成能(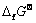 )计算得到:
)计算得到: (5)
(5)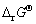 为负值,则说明该反应可以自发进行,可考虑将该反应用于电化学储能。进一步地可以由下式计算出该电池的电动势E:
为负值,则说明该反应可以自发进行,可考虑将该反应用于电化学储能。进一步地可以由下式计算出该电池的电动势E: (6)
(6) 和体积能量密度
和体积能量密度 分别为
分别为 (7)
(7) (8)
(8)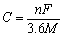 (9)
(9) (10)
(10) (11)
(11) (12)
(12)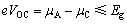 (13)
(13) )在Fe2(MoO4)3或者 Fe2(WO4)3中约为3.0 V,而在Fe2(SO4)3中
)在Fe2(MoO4)3或者 Fe2(WO4)3中约为3.0 V,而在Fe2(SO4)3中 基团的电负性增大,从而增加了Fe—O键的离子特性。当金属M与配体X之间的电负性相差较大时,M—X之间的离子键成分增强,成键轨道和反键轨道之间的分离减小,从而未占据电子空轨道σ*的能量降低[22]。相当于正极材料的费米能级μC降低,从而可以增加电池的电动势,如图3(d)所示。除了轨道能级的计算,电极材料的电子结构计算中还常采用能带结构(Band structures)、DOS图(Density of states,DOS)、电荷分布来分析材料的导电性、电子结构变化、原子间的键合情况等。
基团的电负性增大,从而增加了Fe—O键的离子特性。当金属M与配体X之间的电负性相差较大时,M—X之间的离子键成分增强,成键轨道和反键轨道之间的分离减小,从而未占据电子空轨道σ*的能量降低[22]。相当于正极材料的费米能级μC降低,从而可以增加电池的电动势,如图3(d)所示。除了轨道能级的计算,电极材料的电子结构计算中还常采用能带结构(Band structures)、DOS图(Density of states,DOS)、电荷分布来分析材料的导电性、电子结构变化、原子间的键合情况等。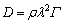 (14)
(14) (15)
(15)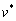 是振动因子;△E是迁移势垒。因此,在理想的嵌入化合物中(以锂离子电池为例),Li+的离子扩散系数随Li+浓度的任何变化都是由迁移势垒和振动因子对Li+平均浓度的依赖引起的。由于扩散系数对迁移势垒具有指数依赖性,所以,因材料化学成分、晶体结构变化引起的离子迁移势垒的小变化都会引起扩散系数的巨大变化。CEDER课题组[25]利用NEB模拟方法计算了不同离子(Li+,Mg2+,Zn2+,Ca2+和Al3+)在尖晶石Mn2O4,橄榄石FePO4,层状NiO2和正交晶系△-V2O5结构中的扩散路径,他们发现,与主体结构的扩散路径拓扑结构相匹配的插入位点是控制离子迁移速率的主要因素,这为寻找可供多价离子快速扩散的结构提供了实用的准则,如图3(f)所示。
是振动因子;△E是迁移势垒。因此,在理想的嵌入化合物中(以锂离子电池为例),Li+的离子扩散系数随Li+浓度的任何变化都是由迁移势垒和振动因子对Li+平均浓度的依赖引起的。由于扩散系数对迁移势垒具有指数依赖性,所以,因材料化学成分、晶体结构变化引起的离子迁移势垒的小变化都会引起扩散系数的巨大变化。CEDER课题组[25]利用NEB模拟方法计算了不同离子(Li+,Mg2+,Zn2+,Ca2+和Al3+)在尖晶石Mn2O4,橄榄石FePO4,层状NiO2和正交晶系△-V2O5结构中的扩散路径,他们发现,与主体结构的扩散路径拓扑结构相匹配的插入位点是控制离子迁移速率的主要因素,这为寻找可供多价离子快速扩散的结构提供了实用的准则,如图3(f)所示。
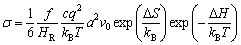 (16)
(16)



