文章编号:1004-0609(2015)-05-1370-08
用N235从富铁高酸度硫酸浸出液中萃取除铁
张魁芳,刘志强,曹洪杨,邱显扬
(广州有色金属研究院 广东省稀土开发及应用重点实验室,广州 510650)
摘 要:
对N235萃取除铁进行研究,考察H2O2用量、料液初始pH、萃取剂浓度、萃取剂组成、萃取时间对萃取的影响以及H2SO4浓度、反萃时间对反萃的影响,设计错流萃取过程并绘制反萃平衡等温线,对萃取剂转型条件进行研究。结果表明:H2O2用量为理论量3.85倍时可将Fe2+完全氧化成Fe3+,并采用有机相组成30%(体积分数)N235+10%(体积分数)TBP+磺化煤油作为萃取剂,料液初始pH为0.11,其最佳萃取条件如下:萃取温度25 ℃,萃取时间2 min,相比O/A为1:1。经过4级错流萃取,其Fe3+萃取率可达96.96%,Cu2+、Co2+、Ni2+损失率分别为3.04%、1.39%和3.84%,有机相负载采用0.3 mol/L硫酸可反萃得到纯度为98.87%的Fe2(SO4)3溶液,其最佳反萃条件为反萃温度25 ℃,反萃时间6 min,相比O/A=1:1。经两级逆流反萃,Fe3+反萃率达99.12%,反萃铁后的负载酸有机相经Na2CO3中和转型,返回使用。
关键字:N235;硫酸浸出液;萃取;除铁;反萃;转型
中图分类号:TF804.2 文献标志码:A
Removal of Fe3+ from iron rich and high acidity sulfuric acid leaching liquid by extraction of N235
ZHANG Kui-fang, LIU Zhi-qiang, CAO Hong-yang, QIU Xian-yang
(Guangdong Province Key Laboratory of Rare Earth Development and Application,
Guangzhou Research Institute of Non-ferrous Metals, Guangzhou 510650, China)
Abstract: The extraction of Fe3+ by N235 was studied based on the technology gap on the removal of Fe3+ from iron rich and high acidity sulfuric acid leaching liquid by extraction. The effects of H2O2 dosage, feed initial pH, extractant concentration, extractant composition and extraction time on the extraction, and the effects of H2SO4 concentration and tripping time on the stripping were investigated. The cross current extraction process was designed and the isotherms of stripping were plotted, and the conditions of extractant transformation were researched. The results show that, when 30% (mass fraction) H2O2 dosage is 3.85 times of theoretical one, Fe2+ can be oxidized into Fe3+ totally, and with 30% (volume fraction) N235 and10% (volume fraction) TBP in sulphonated kerosene as extractant, the extraction rate of Fe3+ from the solution with initial pH of 0.11 reaches 96.67% in four-stage cross current extraction with O/A ratio of 1:1 (volume ratio of oil phase to aqueous phase) at 25℃ for 2 min, and the loss rate of Cu2+, Co2+, Ni2+ are 3.04%, 1.39%, 3.84%, respectively. The Fe3+ in loaded organic can be stripped into Fe2(SO4)3 with purity of 98.87% using 0.3 mol/L H2SO4 solution and the stripping rate reaches 99.12% in two-stage counter current stripping with O/A ratio of 1:1 (volume ratio of oil phase to aqueous phase) at 25 ℃ for 6 min. After stripping, the acid in loaded organic phase can be neutralized using Na2CO3. The organic phase returns to extraction circularly.
Key words: N235; sulfuric acid leaching liquid; extraction; iron removal; stripping; transformation
由于铁储量大,不同矿物中铁均占有较大比例,在有色金属冶金湿法过程中,矿石中的铁不同程度地随主金属浸出进入浸出液中,对后续有价金属的提纯与富集产生很大的负面影响,是最主要的杂质元素。近年来,随着高品位矿的开采殆尽,低品位复杂共生矿的利用成为关键,为提高低品位复杂共生矿中有价金属浸出率,往往采用高浓度硫酸加压的浸出方式,其浸出液特点如下:1) 铁浓度很高,一般可高达25~50 g/L,而有价金属浓度相对较低,若不预先除铁,有价金属无法有效回收;2) 浸出液硫酸浓度高,游离酸度0.6~4.0 mol/L(pH<0.3)。
目前除铁的主要研究方法可分为沉淀法和萃取法两大类[1]:1) 沉淀法。如铁矾法、针铁矿法、赤铁矿法和中和沉淀法等[1-6],已实现工业化。沉淀法在较低酸度和铁浓度溶液中除铁具有优越性。但随着溶液中铁浓度和酸度的增加,这类方法弊端逐渐突显,普遍存在操作繁杂、过滤困难、有价金属损失大以及沉铁渣回收困难且易造成二次污染等问题[7],同时,过程温度需维持在70 ℃以上,且终点pH需控制在3.0以上,致使中和剂Na2CO3消耗大、热能耗高,尤其是富铁高酸度浸出液时,沉淀法除铁更为棘手。2) 萃取法。具有能耗低、污染少、操作简便、并可得到高纯铁产品便于回收等优点。萃取法虽已进行长时间研究工作,但仍处于实验阶段,未见工业化报道。目前,常见除铁的萃取剂包括酸性、中性磷(膦) 类、羧酸类以及胺类萃取剂[8-16],酸性磷(膦) 类如P204和P507等,选择性差且不易反萃,导致有价金属损失大,酸耗高,而中性磷(膦) 类如TBP等主要适用于盐酸、硝酸体系;羧酸类水溶性大,且适用较低酸度。相比之下,胺类萃取剂如N235具有选择性优良、有价金属损失小和易反萃等优点,具备较强工业化潜质。吴成友等[17]、刘铭等[18]、王福兴等[19]均对用N235从含铁的硫酸盐溶液中除铁进行了研究,通过3级逆流或错流萃取过程,可使铁去除率在98%以上,同时Ni、Co等有价金属损失率均小于5%,通过0.4~0.5 mol/L的稀硫酸处理,单级反萃率在95%以上,经2级错流或逆流过程可完全反萃进入有机相中的铁,使铁以硫酸铁溶液形式回收,可见采用N235萃取铁具有可行性。但目前N235萃取除铁研究体系集中在铁浓度14 g/L以下、pH为1.0左右,且反萃后均未对萃取剂转型条件、循环使用性能等进行研究。文献表明[17-19],随着酸度升高,初始pH<0.5后,萃取率急剧下降,在pH<0.4后,铁基本不被萃取,针对富铁高酸度溶液,初始pH≈0,无法直接进行萃取,同时铁浓度高达25~50 g/L时,加入碱性物质中和调酸,极易造成局部pH过高,形成Fe(OH)3胶体使萃取无法进行。另外,负载有机相N235反萃铁后仍负载有大量的酸,如不进行处理直接返回萃取,势必不断造成萃取过程平衡pH下降,萃取率降低,难以保持体系平衡。为此,实现用N235直接从富铁高酸度硫酸浸出液中萃取除铁,并探索萃取剂的转型回用条件,具有重要的工业价值。
本文作者采用N235作为萃取剂,以某复杂铂钯共生矿的氧压高浓度硫酸浸出液(pH=0.11,FeT 28.3 g/L)为研究对象,不需经过中和工序,利用N235可萃酸、萃铁的特点直接在高酸度下进行错流萃取调酸并除铁,并实现萃取剂的转型回用。实验考察了影响萃取、反萃和萃取剂转型的主要因素和条件,并模拟多级试验,对从富铁高酸度硫酸浸出液中萃取除铁进行了系统的研究,取得良好效果。
1 实验
1.1 实验试剂与设备
1) 实验试剂如下:N235、TBP、磺化煤油(上海莱雅仕化工有限公司生产);NaOH、Na2CO3(分析纯,南京化学试剂有限公司生产);30% H2O2(质量分数)、浓硫酸(广州化学试剂厂生产);料液为某复杂铂钯共生矿的氧压高浓度硫酸浸出液,pH=0.11,料液的化学成分见表1。
表1 料液的化学成分
Table 1 Chemical components of feed solution (g·L-1)

2) 实验设备如下:125 mL 梨型分液漏斗,250 mL梨型分液漏斗,SXL-70型恒温水浴振荡器(江苏麦普龙仪器制造有限公司生产),XSP型电感耦合等离子光谱发射仪(Thermo Electron Corporation,USA)。
1.2 实验方法
1) 料液预处理。量取一定体积料液,加入所需体积的30% H2O2,搅拌均匀,后放置4 h,用重铬酸钾法滴定其中的Fe2+含量,计算氧化率E1:
 (1)
(1)
式中:[Fe2+]为原料液中Fe2+浓度,g/L;[Fe2+]y为氧化后液中Fe2+浓度,g/L;V为原料液体积,mL;Vy为氧化后液体积,mL。
2) 有机相的配制。萃取剂和磺化煤油按所需体积比量取后置于烧杯中,充分搅拌混匀后备用。
3) 萃取实验。先量取一定体积的料液置于125 mL的分液漏斗中,再量取需要体积的配制好的有机相,加入装有水相的分液漏斗,置于恒温水浴振荡器中匀速振荡,根据实验所要的条件来控制振荡过程,振荡结束后,取出分液漏斗于萃取架上静置分相。分析萃余液中元素的浓度,并计算萃取率E2:
 (2)
(2)
式中:[Me]a1为萃余液中离子浓度,g/L;[Me]o1为料液中离子浓度,g/L;Va1为萃余液体积,mL;Vo1为加入的料液体积,mL。
4) 反萃实验。先量取一定体积的反萃剂溶液于125 mL的分液漏斗中,再量取需要体积的负载有机相,加入装有水相的分液漏斗,置于恒温水浴振荡器中匀速振荡,根据实验所要求的条件来控制振荡过程,振荡结束后,取出分液漏斗于萃取架上静置分相。分析反萃液中元素的浓度,并计算反萃率E3:
 (3)
(3)
式中:[Me]a2为反萃液中离子浓度,g/L;[Me]o2为负载有机相中离子浓度,g/L;Va2为反萃液体积,mL;Vo2为加入的负载有机相体积,mL。
5) 水相中金属离子采用XSP型电感耦合等离子光谱发射仪(Thermo electron corporation,USA)测定,有机相中的金属离子根据水相中相应离子的浓度差减法得到;水相中Fe2+含量采用重铬酸钾滴定法测定。
2 结果与讨论
2.1 萃取与反萃原理
萃取过程反应原理如式(4)~(6)所示:
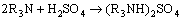 (4)
(4)
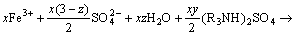
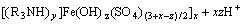 (5)
(5)
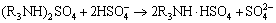 (6)
(6)
反萃过程反应原理如式(7)所示:

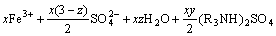 (7)
(7)
2.2 实验结果与讨论
2.2.1 H2O2用量对料液Fe2+氧化率的影响
料液成分如表1所示,取100 mL料液,分别加入0、0.5、1.0、1.5和2.0 mL 30% H2O2(质量分数),搅拌均匀后放置4 h,用重铬酸钾滴定法测定其中Fe2+含量,计算氧化率。H2O2用量对Fe2+氧化率的影响如图1所示。
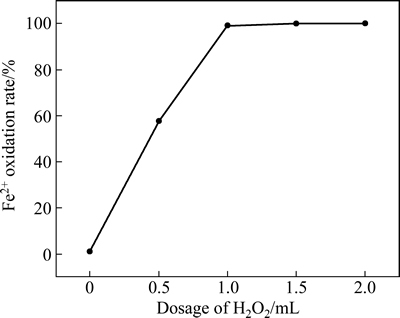
图1 H2O2用量对料液Fe2+氧化率的影响
Fig. 1 Effect of H2O2 dosage on Fe2+ oxidation rate of feed
由于N235能有效萃取Fe3+而基本不萃取Fe2+,为提高萃取除铁效果,通过加入H2O2方式将Fe2+氧化成Fe3+,根据反应式2Fe2++H2O2+2H+=2Fe3++2H2O,完全氧化100 mL浸出液中的Fe2+需消耗30%H2O2的用量为0.26 mL。从图1可以看出,随着H2O2加入量增加,Fe2+氧化率呈上升趋势,在加入量为1.0 mL,Fe2+氧化率接近100%,为此每100 mL料液所需的30% H2O2用量为1.0 mL,为理论量的3.85倍。充分氧化后液pH=0.11,各元素成分如表2所示。
表2 氧化后料液的成分
Table 2 Chemical components of oxidized solution (g·L-1)

2.2.2 料液初始pH及萃取剂浓度对Fe3+萃取率的影响
氧化后料液成分如表2所列。用浓硫酸和氢氧化钠调节料液初始pH。有机相组成如下:为20%、30%、40%(体积分数)N235+10%(体积分数)TBP+磺化煤油。在萃取条件:油水相比O/A为1:1、萃取时间为10 min、萃取温度为25 ℃时,研究了料液pH及萃取剂浓度对Fe3+萃取率的影响,其结果图2所示。
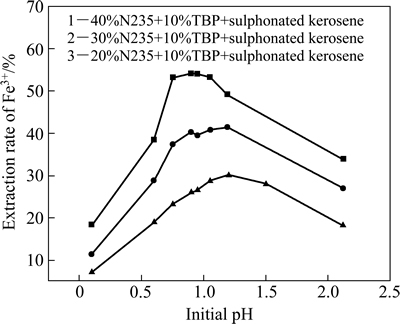
图2 料液初始pH及萃取剂浓度对Fe3+萃取率的影响
Fig. 2 Effect of initial pH and extractant concentration on extraction rate
从图2可以看出,随着料液初始pH的降低,萃取率呈现先上升后下降的趋势。这主要原因如下:由萃取反应原理式(5)可知,溶液中的Fe3+是以羟基铁的形式与胺的硫酸盐形成萃合物后被萃入有机相中。在初始pH较高阶段,随着pH下降,有利于式(4)向右进行,N235萃取H2SO4生成大量胺的硫酸盐,促使式(5)也向右进行,所以萃取率升高;然而,随着pH进一步下降,溶液中HSO4-浓度增加,胺的硫酸盐会进一步发生如式(6)反应,与HSO4-结合而成酸式硫酸盐,导致胺的硫酸盐减少,萃取率下降,为此,最佳pH范围为0.9~1.2之间。同时,随着萃取剂浓度增加,萃取率呈上升趋势,但当萃取剂浓度为40%时,有机相粘稠,分相困难且粘壁损失严重,综合考虑选择萃取剂体积分数为30%。为此,在实验中考察萃取时间、萃取剂组成最佳条件时选择pH=0.95、N235体积分数为30%。
2.2.3 萃取剂组成对Fe3+萃取率的影响
料液成分如表2所列,并调节pH=0.95。有机相为30%(体积分数)N235,改质剂TBP体积分数分别为0%、5%、10%、15%和20%,稀释剂均为磺化煤油。在萃取条件分别为油水相比O/A 1:1,萃取时间10 min,萃取温度25 ℃时,研究萃取剂组成对Fe3+萃取率的影响,实验结果如图3和表3所示。
从图3可以看出,随着改质剂TBP用量的增加,萃取率呈先上升后下降趋势,在体积分数为10%有最大值,但变化幅度不明显,萃取率维持在32%~40%之间。萃取率均较低是由于本实验条件下料液中Fe3+浓度很高(28.0 g/L),而30% N235的萃取饱和容量仅为12.6 g/L[18];从表3可以看出,开始阶段有三相生成,随着TBP的加入三相消失,且分相时间逐渐缩短,可见TBP对分相性能影响显著,其原因如下:由于N235萃取剂极性较强,易相互结合形成N—N键合作用,而稀释剂磺化煤油属于非极性溶剂,N235在其中溶解度较小,易形成第三相。开始阶段TBP的加入有利于破坏N235之间的键合,同时促进N235在煤油中的溶解,萃取及分相效果变好。但随着TBP过量后,其分子中P—O键也可与N235中的N形成键合,反而不利萃取的进行。综合考虑,选用TBP体积分数为10%为宜。
表3 TBP体积分数对分相时间的影响
Table 3 Effect of TBP volume fraction on split-phase time
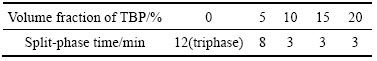
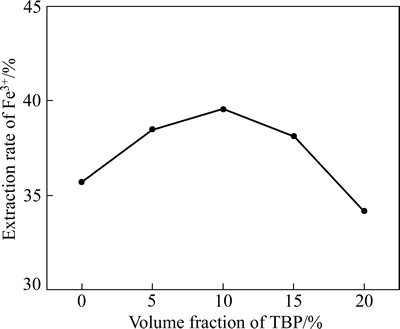
图3 萃取剂TBP体积分数对Fe3+萃取率的影响
Fig. 3 Effect of extractant volume fraction on extraction rate
2.2.4 萃取时间对Fe3+萃取率的影响
料液成分如表2所列。并调节pH=0.95。有机相组成如下:30%(体积分数)N235+10%(体积分数)TBP+磺化煤油。在萃取条件分别为油水相比:O/A 1:1、萃取温度25 ℃、萃取时间分别为1、2、4、6、8和10 min时,研究萃取时间对Fe3+萃取率的影响,实验结果如图4所示。
从图4可以看出,N235萃取铁的平衡时间较短,选用2 min即可。
2.2.5 模拟四级错流萃取实验
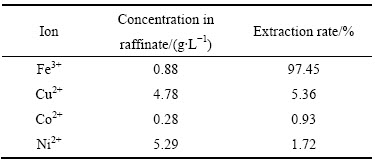
由于料液初始pH较低仅为0.11且Fe3+浓度是30%N235萃取饱和容量的2倍以上,其最佳条件单级萃取率仅为32%~40%,采用错流方式进行萃取,同时通过调整错流级数保证N235萃酸调酸效果和除铁效果。采用4支250 mL分液漏斗模拟四级错流萃取实验,操作示意图如图5所示。料液成分如表2所示,pH=0.11。有机相:30%N235(体积分数)+10% TBP(体积分数)+磺化煤油。在萃取条件如下:萃取油水相比为O/A=1:1,萃取时间为2 min,萃取温度为25 ℃,错流萃取实验结果如表4所列。
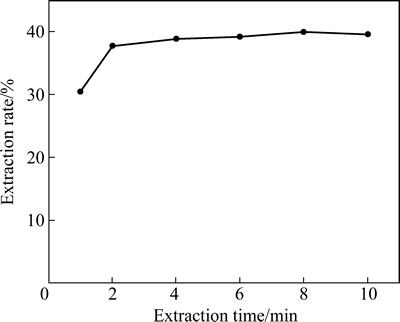
图4 萃取时间对Fe3+萃取率的影响
Fig. 4 Effect of extractant time on extraction rate
从表4可以看出,经过四级错流萃取铁的萃取率为96.96%,Cu2+、Co2+和Ni2+基本不被萃取,损失率分别为3.04%、1.39%和3.84%。
2.3 反萃方案的确定
模拟四级错流萃取后的负载有机相共414 mL中主要含Fe3+ 6.558、Cu2+ 0.030、Co2+ 0.0007和Ni2+ 0.041 g/L。根据反萃原理式(7)采用硫酸溶液进行反萃。
2.3.1 硫酸溶液浓度对Fe3+反萃率的反萃效果影响
负载有机相为模拟四级错流萃取过程中制备的负载有机相,Fe3+含量6.558 g/L,水相为硫酸溶液,浓度分别为0、20、30、40、50和60 g/L。在反萃条件分别为相比O/A 1:1、反萃温度25 ℃、反萃时间10 min时研究硫酸溶液浓度对Fe3+反萃率的影响,结果如图6所示。硫酸溶液浓度对平衡pH的影响如表5所列。
从图6和表5可看出,当H2SO4浓度小于30 g/L时,随着H2SO4浓度的增加,反萃率迅速增大,而相应的平衡pH值则迅速减小;当H2SO4浓度大于30 g/L后,Fe3+的反萃率变化趋于平缓,Fe3+反萃率均维持在95%以上,此时平衡pH小于0.72;而采用纯水作反萃剂时,Fe3+反萃率仅为22.01%,其平衡pH为1.83,为此选用0.3 mol/L的硫酸溶液作为反萃剂。根据萃取原理式(5)及反萃原理式(7),萃取与反萃过程实则为两可逆反应,而反应平衡程度主要受溶液H+浓度影响,即平衡pH值,通过实验发现,在实际反萃过程中,只需控制平衡pH在0.8以下,有机相中的Fe3+就能很好地被反萃下来。
2.3.2 反萃时间对Fe3+反萃率的影响
负载有机相为模拟四级错流萃取过程中制备的负载有机相,Fe3+含量为6.558 g/L,水相为硫酸溶液,浓度为0.3 mol/L。反萃取条件如下:相比O/A=1:1,反萃温度25 ℃,反萃时间分别为1、2、4、6、8和10 min。研究反萃时间对Fe3+反萃率的影响,结果如图7所示。
由图7可知,随着反萃时间的延长,Fe3+反萃率增大,2 min以后,Fe3+反萃率均在90%以上;同时在6 min时,达到平衡。
2.3.3 反萃平衡等温线的绘制
负载有机相为模拟四级错流萃取过程中制备的负载有机相,Fe3+含量6.558 g/L。水相为硫酸溶液,浓度为30 g/L。反萃条件如下:反萃温度25 ℃,反萃时间6 min。通过改变相比法绘制了反萃平衡等温线,结果如图8所示。图8中从左至右各点相比O/A分别为1:2、1:1、2:1和5:1。
依照逆流萃取原理,绘制McCable-Thiele图,按照相比O/A=1:1操作线,绘制铁反萃的操作曲线,结果如图8所示。从图8可以看出,通过理论级数2级逆流反萃,负载有机相中的Fe3+浓度可降至2 mg/L,即Fe3+反萃率达到99%以上,实际生产中,可通过增加硫酸浓度或改变相比使铁富集。
2.3.4 模拟两级逆流反萃
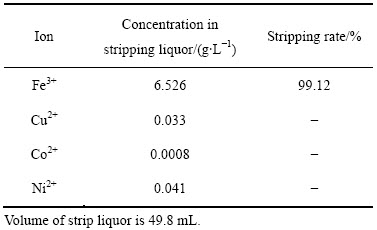
用3支分液漏斗模拟两级逆流反萃实验,负载有机相:模拟四级错流萃取过程中制备的负载有机相,含Fe3+ 6.558 g/L,水相:30 g/L硫酸溶液,反萃条件:反萃温度25 ℃,反萃时间6 min,O/A=1:1(50 mL:50 mL),取A5排进行测定,反萃液成分如表6所示。
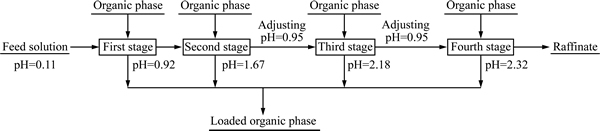
图5 四级错流萃取示意图
Fig. 5 Schematic diagram of four-stage cross current extraction
表4 萃余液的成分
Table 4 Components in raffinate

表5 硫酸溶液浓度对平衡pH的影响
Table 5 Effect of H2SO4 concentration on equilibrium pH
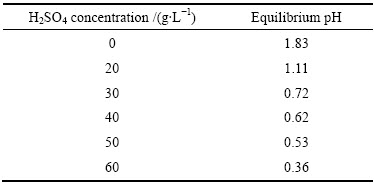
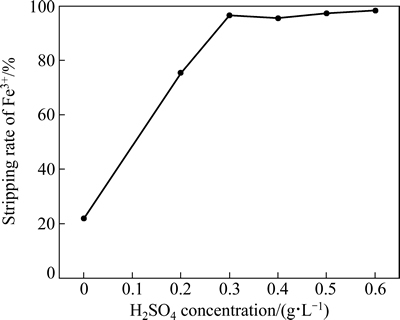
图6 硫酸溶液浓度对Fe3+反萃率的影响
Fig. 6 Effect of H2SO4 concentration on stripping rate of Fe3+
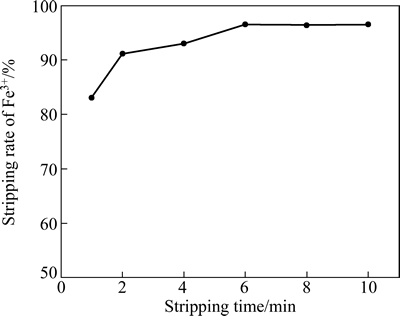
图7 反萃时间对Fe3+反萃率的影响
Fig. 7 Effect of stripping time on stripping rate of Fe3+
从表6中可以看出,经过两级逆流反萃,Fe3+的反萃率为99.12%,得到纯度98.87%的硫酸铁溶液。
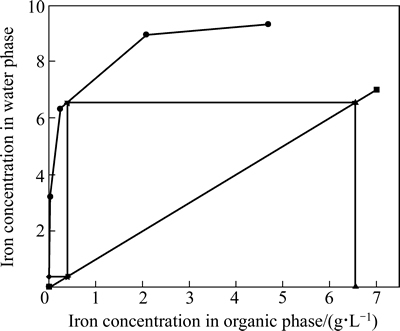
图8 Fe3+反萃平衡等温线
Fig. 8 Isotherm stripping curves of iron
表6 A5排反萃液的成分
Table 6 Components in stripping liquor of row A5
2.4 萃取剂转型
根据以上分析,本实验中用硫酸溶液反萃铁后的有机相含有仍萃取有大量H2SO4,而若不经处理直接返回萃取阶段,势必会造成萃取过程平衡pH下降,难以维持萃取体系的重复性,为此需通过反萃有机相中的酸至中性,达到转型目的。采用Na2CO3中和转型,具体步骤如下:取有机相与水按相比1:1混合,搅拌缓慢加入Na2CO3至水相pH为7.0~8.0,静置分相,将上述步骤得到转型有机相,返回萃取,按之前条件重复,其萃取实验结果如表7所列。
从表7中可以看出,萃取剂经碳酸钠中和后返回循环使用,且获得与表6相近的萃取效果,可用碳酸钠进行转型。
表7 萃取实验结果
Table 7 Results of extraction experiment
3 结论
1) N235可在富铁高酸度硫酸溶液中选择性萃取除铁,而其他杂质离子如Cu2+、Co2+、Ni2+基本不被萃取。
2) 有机相组成为30%(体积分数)N235+10%(体积分数)TBP+磺化煤油,按相比O/A=1:1,萃取时间2 min,经过四级错流萃取pH=0.11、含Fe3+ 28.0 g/L的氧压高浓度硫酸浸出液,Fe3+萃取率为96.96%,Cu2+、Co2+、Ni2+损失率分别为3.04%、1.39%和3.84%。
3) 用30 g/L的硫酸溶液,按相比O/A=1:1、反萃时间 6 min,经过两级逆流反萃,Fe3+反萃率为99.12%,得到纯度98.87%的硫酸铁溶液。反萃铁后得到的负载酸有机相,采用Na2CO3中和其中的酸,有机相可返回使用。
REFERENCES
[1] 袁芳沁, 吴克明, 丁倩倩, 柯 兴. 湿法炼锌除铁工艺的现状与展望[J]. 矿产综合利用, 2011, 4(2): 30-32.
YUAN Fang-xin, WU Ke-ming, DING Qian-qian, KE Xing. Status and prospect of technology for iron removal in zinc hydrometallurgy[J]. Multipurpose Utilization of Mineral Resources, 2011, 4(2): 30-32.
[2] 杨 凡, 邓志敢, 魏 昶, 李存兄, 李兴彬. 采用赤铁矿去除高铁闪锌矿浸出液中的铁[J]. 中国有色金属学报, 2014, 24(9): 2387-2392.
YANG Fan, DENG Zhi-gan,WEI Chang, LI Cun-xiong, LI Xing-bin. Iron-removal by hematite from leaching liquor of high iron sphalerite[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(9): 2387-2392.
[3] 王 平, 郭晓娜, 张亚莉. 锌冶炼渣浸出液除铁研究[J]. 有色金属(冶炼部分), 2012(10): 4-6.
WANG Ping, GUO Xiao-na, ZHANG Ya-li. Study on iron removal from lixivium of zinc hydrometallurgical residue[J]. Nonferrous Metals (Extractive Metallurgy), 2012(10): 4-6.
[4] 陈红彬. 用针铁矿法从钴白合金酸浸液中除铁研究[J]. 金属材料与冶金工程, 2012, 40(4): 27-29.
CHEN Hong-bin. Iron removal from acidic leaching solution of Co white alloy by goethite process[J]. Metal Materials and Metallurgy Engineering, 2012, 40(4): 27-29.
[5] 李海军, 杨洪英, 陈国宝, 周立杰, 刘媛媛. 中心复合设计针铁矿法从含钴生物浸出液中除铁[J]. 中国有色金属学报, 2013, 23(7): 2040-2046.
LI Hai jun, YANG Hong ying, CHEN Guo bao, ZHOU Li jie, LIU Yuan yuan. Goethitedeironizationprocess forcobaltiferous bioleaching solution by central composite design[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(7): 2040-2046.
[6] 何 静, 罗 超, 唐谟堂, 鲁君乐, 王小能, 王 涛. 采用铅黄铁矾去除硫酸体系中的铁[J]. 中国有色金属学报, 2012, 22(10): 2890-2895.
HE Jing, LUO Chao, TANG Mo-tang, LU Jun-yue, WANG Xiao-neng, WANG Tao. Technique of ferrum-removal by lead jarosite from sulfuric acid solution[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(10): 2890-2895.
[7] 陈国宝, 杨洪英, 周立杰, 李海军. 针铁矿法从铜钴矿生物浸出液中除铁的研究[J]. 有色金属(冶炼部分), 2013(3): 1-3.
CHEN Guo-bao, YANG Hong-ying, ZHOU Li-jie, LI Hai-jun. Study on goethite deironization from bioleaching solution of Cu-Co ore[J]. Nonferrous Metals (Extractive Metallurgy), 2013(3): 1-3.
[8] 森 维, 孙红燕, 李正永, 林大志, 宋兴诚, 杨继生. 锌冶炼过程中除铁方法的研究进展[J]. 矿冶, 2013, 22(3): 71-74.
SEN Wei, SUN Hong-yan, LI Zheng-yong, LIN Da-zhi, SONG Xing-cheng, YANG Ji-sheng. Research progress on methods of removing iron from zinc smelting process[J]. Mining and Metallurgy, 2013, 22(3): 71-74.
[9] 马 涌, 路殿坤, 金哲男, 李斌川. P204萃取含铜酸性废水中铁的研究[J]. 有色矿冶, 2010, 26(2): 24-27.
MA Yong, LU Dian-kun, JIN Zhe-nan, LI Bin-chuan. Research on the solvent extraction of iron from acidic waste water in copper hydrometallurgy[J]. Non-Ferrous Mining and Metallurgy, 2010, 26(2): 24-27.
[10] 伍静静, 李登新. P204-仲辛醇皂化萃取氰化尾渣酸浸液中铁的初步研究[J]. 矿冶工程, 2011, 31(1): 57-62.
WU Jing-jing, LI Deng-xi. Preliminary study of synergistic extraction iron from acid leaching solution of cyanidation tailings with P204 and 2-octanol[J]. Mining and Metallurgical Engineering, 2011, 31(1): 57-62.
[11] ASANO H, ITABASHI H, KAWAMOTO H. Separation of iron (Ⅲ) by di(2-ethylhexyl) phosphate/4-methyl-2-pentanone extraction[J]. Journal of the Iron and Steel Institute of Japan, 2001, 87(9): 623-625.
[12] 侯晓川, 肖连生, 高从堦, 黄怀国, 熊 明, 蔡创开. 废高温镍钴合金浸出液净化试验研究[J]. 有色金属(冶炼部分), 2010(4): 9-12.
HOU Xiao-chuan, XIAO Lian-sheng, GAO Cong-jie, HUANG Huai-guo, XIONG Ming, CAI Chuang-kai. Experimental study of purification on leaching solution from waste high-temperature Ni-Co alloys[J]. Nonferrous Metals (Extractive Metallurgy), 2010(4): 9-12.
[13] SUAREZ C, AHUMADA E, ORELLANA F. Extraction of iron (Ⅲ) from acidic sulfate solutions with bis(2-ethylhexyl) phosphoric acid in PENRECO 170 ES, a new friendly diluent[J]. Journal of Chemical Technology and Biotechnology, 2002, 77(2): 183-189.
[14] 王美琴, 徐卡秋, 叶 静. 萃取法去除硫酸氧钛液中杂质铁[J]. 应用化学, 2010, 27(12): 1462-1465.
WANG Mei-qin, XU Ka-qiu, YE Jing. Extractive removal of ironic impurity from the liquids of sulfuric acid oxygen titanium[J]. Chinese Journal of Applied Chemistry, 2010, 27(12): 1462-1465.
[15] 周 勇, 李登新. TBP-MIBK协同萃取高硫高砷金精矿浸出液中的铁[J]. 矿冶工程, 2009, 29(1): 74-77.
ZHOU Yong, LI Deng-xi. Extraction of Fe(Ⅲ) from gold concentrate leachate containing high arsenic and sulphur by TBP-MIBK synergetic extraction[J]. Mining and Metallurgical Engineering, 2009, 29(1): 74-77.
[16] 何朝晖, 易文武, 刘一平. 伯胺萃取法生产无铁硫酸铝工艺研究[J]. 无机盐工业, 2001, 33(6): 29-30.
HE Zhao-hui, YI Wen-wu, LIU Yi-ping. Study on manufacturing non- iron aluminum sulfate by primary amine extraction method[J]. Inorganic Chemicals Industry, 2001, 33(6): 29-30.
[17] 吴成友, 余发红. 用叔胺N235从硫酸铝溶液中萃取除铁[J]. 湿法冶金, 2012, 31(3): 160-164.
WU Cheng-you, YU Fa-hong. Solvent extraction of iron from aluminum sulfate with tertiary amine(N235)[J]. Hydrometallurgy of China, 2012, 31(3): 160-164.
[18] 刘 铭, 周雍茂. 用N235-TBP混合体系从硫酸盐溶液中协同萃取除铁[J]. 中国有色金属学报, 2005, 15(10): 1648-1654.
LIU Ming, ZHOU Yong-mao. Removal of Fe( Ⅲ) from sulphate solutions by synergistic extraction using N235-TBP mixed solvent systems[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(10): 1648-1654.
[19] 王福兴, 黄松涛, 罗 伟, 杨丽梅, 刘 学. 萃取法处理低镍钴浸出液的工艺研究[J]. 稀有金属, 2011, 35(5): 753-758.
WANG Fu-xing, HUANG Song-tao, LUO Wei, YANG Li-mei, LIU Xue. Extraction of leaching solution with low Ni and Co content[J]. Chinese Journal of Rare Metals, 2011, 35(5): 753-758.
(编辑 龙怀中)
基金项目:“十一五”国家科技支撑计划资助项目(2008BAB32B10)
收稿日期:2014-08-15;修订日期:2015-01-08
通信作者:邱显扬,教授级高工;电话:020-61086372;E-mail:qiuxygz@126.com
摘 要:对N235萃取除铁进行研究,考察H2O2用量、料液初始pH、萃取剂浓度、萃取剂组成、萃取时间对萃取的影响以及H2SO4浓度、反萃时间对反萃的影响,设计错流萃取过程并绘制反萃平衡等温线,对萃取剂转型条件进行研究。结果表明:H2O2用量为理论量3.85倍时可将Fe2+完全氧化成Fe3+,并采用有机相组成30%(体积分数)N235+10%(体积分数)TBP+磺化煤油作为萃取剂,料液初始pH为0.11,其最佳萃取条件如下:萃取温度25 ℃,萃取时间2 min,相比O/A为1:1。经过4级错流萃取,其Fe3+萃取率可达96.96%,Cu2+、Co2+、Ni2+损失率分别为3.04%、1.39%和3.84%,有机相负载采用0.3 mol/L硫酸可反萃得到纯度为98.87%的Fe2(SO4)3溶液,其最佳反萃条件为反萃温度25 ℃,反萃时间6 min,相比O/A=1:1。经两级逆流反萃,Fe3+反萃率达99.12%,反萃铁后的负载酸有机相经Na2CO3中和转型,返回使用。
[1] 袁芳沁, 吴克明, 丁倩倩, 柯 兴. 湿法炼锌除铁工艺的现状与展望[J]. 矿产综合利用, 2011, 4(2): 30-32.
[2] 杨 凡, 邓志敢, 魏 昶, 李存兄, 李兴彬. 采用赤铁矿去除高铁闪锌矿浸出液中的铁[J]. 中国有色金属学报, 2014, 24(9): 2387-2392.
[3] 王 平, 郭晓娜, 张亚莉. 锌冶炼渣浸出液除铁研究[J]. 有色金属(冶炼部分), 2012(10): 4-6.
[4] 陈红彬. 用针铁矿法从钴白合金酸浸液中除铁研究[J]. 金属材料与冶金工程, 2012, 40(4): 27-29.
[5] 李海军, 杨洪英, 陈国宝, 周立杰, 刘媛媛. 中心复合设计针铁矿法从含钴生物浸出液中除铁[J]. 中国有色金属学报, 2013, 23(7): 2040-2046.
[6] 何 静, 罗 超, 唐谟堂, 鲁君乐, 王小能, 王 涛. 采用铅黄铁矾去除硫酸体系中的铁[J]. 中国有色金属学报, 2012, 22(10): 2890-2895.
[7] 陈国宝, 杨洪英, 周立杰, 李海军. 针铁矿法从铜钴矿生物浸出液中除铁的研究[J]. 有色金属(冶炼部分), 2013(3): 1-3.
[8] 森 维, 孙红燕, 李正永, 林大志, 宋兴诚, 杨继生. 锌冶炼过程中除铁方法的研究进展[J]. 矿冶, 2013, 22(3): 71-74.
[9] 马 涌, 路殿坤, 金哲男, 李斌川. P204萃取含铜酸性废水中铁的研究[J]. 有色矿冶, 2010, 26(2): 24-27.
[10] 伍静静, 李登新. P204-仲辛醇皂化萃取氰化尾渣酸浸液中铁的初步研究[J]. 矿冶工程, 2011, 31(1): 57-62.
[12] 侯晓川, 肖连生, 高从堦, 黄怀国, 熊 明, 蔡创开. 废高温镍钴合金浸出液净化试验研究[J]. 有色金属(冶炼部分), 2010(4): 9-12.
[14] 王美琴, 徐卡秋, 叶 静. 萃取法去除硫酸氧钛液中杂质铁[J]. 应用化学, 2010, 27(12): 1462-1465.
[15] 周 勇, 李登新. TBP-MIBK协同萃取高硫高砷金精矿浸出液中的铁[J]. 矿冶工程, 2009, 29(1): 74-77.
[16] 何朝晖, 易文武, 刘一平. 伯胺萃取法生产无铁硫酸铝工艺研究[J]. 无机盐工业, 2001, 33(6): 29-30.
[17] 吴成友, 余发红. 用叔胺N235从硫酸铝溶液中萃取除铁[J]. 湿法冶金, 2012, 31(3): 160-164.
[18] 刘 铭, 周雍茂. 用N235-TBP混合体系从硫酸盐溶液中协同萃取除铁[J]. 中国有色金属学报, 2005, 15(10): 1648-1654.
[19] 王福兴, 黄松涛, 罗 伟, 杨丽梅, 刘 学. 萃取法处理低镍钴浸出液的工艺研究[J]. 稀有金属, 2011, 35(5): 753-758.


