锂离子电池正极材料LiNi0.5Mn0.5O2的循环性能
肖 劲, 曾雷英, 彭忠东, 赵 浩, 胡国荣
(中南大学 冶金科学与工程学院, 长沙 410083)
摘 要:
采用共沉淀法可以制备出首次放电容量高达210mA·h/g的LiNi0.5Mn0.5O2材料(2.8~4.5V, 电流密度30mA/g), 但材料循环性能受制备过程中的处理工艺影响很大, 处理不严格将导致材料循环性能严重下降。 围绕材料的循环性问题, 对其机理进行了分析并在此基础上对制备工艺进行了进一步改善: 分别从配锂方式, 烧结过程中的升降温速率以及烧结的保温制度进行了系统研究。 结果表明: 采用改进配锂方式, 缓慢升温速率(2℃/min), 高低温结合的烧结制度和快速风冷工艺所制备的材料首次放电容量达到188mA·h/g, 30个循环后仍保持在174mA·h/g, 循环效率有了明显的提高。
关键词: LiNi0.5Mn0.5O2; 锂离子电池; 正极材料; 循环性能 中图分类号: TM912.9
文献标识码: A
Cycle performance of LiNi0.5Mn0.5O2 as cathode material for lithium secondary batteries
XIAO Jin, ZENG Lei-ying, PENG Zhong-dong, ZHAO Hao, HU Guo-rong
(School of Metallurgical Science and Engineering,Central South University, Changsha 410083, China)
Abstract: LiNi0.5Mn0.5O2 was prepared by co-precipitation methode whose first discharge capicity can achieved 210mA·h/g(2.8-4.5V, current density: 30mA/g). But the materials cycle performance is seriously affected by the synthesis conditions.If the synthesis conditions were not seriously controlled the materials cycle performance would be bad. The inner cause to the cycle performance was studied and the preparation way was reformed. By improving the matched way of lithium, studing the affection of heating and cooling rates on the material and renewing the heat treatment, the materials cycle performance was improved. The materials first discharge capicity can achieve 180mA·h/g and after 30 cycles the discharge capicity remains 175mA·h/g.
Key words: LiNi0.5Mn0.5O2; lithium-ion battery; cathode material; cycle performance
锂离子电池正极材料LiNi0.5Mn0.5O2是新型Mn基层状固溶体体系材料的一个分支, 和三元材料LiNixMnyCozO2以及LiMnxCoyO2材料同属一个体系, 从结构上可以看作LiMO2(M=Ni, Co, Ni1/2Co1/2)和Li2MnO3的混合层状固溶结构。 据报道这类材料结合了层状LiMnO2和LiNiO2的优点, 同时也克服了上述两种材料的缺点, 无论在充放电容量还是在循环性能方面都有很大的提高[1-4], 特别是镍锰类材料, 不需要Co元素, 降低了制备成本且材料电化学性能优良, 是一种很有应用前景的研究方向。 作者对LiNi0.5Mn0.5O2的合成作了大量研究, 发现镍锰材料的电化学性能受材料的合成条件影响很大, 特别在循环性能方面, 对制备条件非常敏感。 采用共沉淀法制备的材料首次充放电容量非常高(在充放电范围2.8~4.5V、 电流密度30mA/g条件下最高放电容量可达到208mA·h/g, 但是如果制备过程中前驱体的组分和烧结方式控制不好, 材料的循环性能就会变得很差。 为了研究材料的循环性能问题, 作者分析了影响材料循环性能的机理并在此基础上对材料的合成工艺采取了系列改进措施, 改善了材料的循环性能。
1 实验
实验以NiSO4·6H2O(分析纯), MnSO4·H2O(分析纯), LiOH·H2O(分析纯)为原料, 以氢氧化钠和氨水作为沉淀剂, 将金属盐溶液和沉淀剂分别滴加入反应容器中并匀速搅拌, 控制反应过程中pH为11, 反应温度60℃, 搅拌速度800r/min, 氨水浓度0.36mol/L。 将制备出的共沉淀产物和相应量的LiOH配合混匀并在相应的烧结制度下烧结制得正极材料。
将制备出的极材料与石墨和聚偏氟乙烯 (PVDF)按质量比为8∶1∶1混合均匀并涂敷在铝箔上, 将涂膜铝铂置于真空干燥箱中干燥12h后取出即成正极片。 负极片为金属锂片, 隔膜为Celgand 2400聚丙烯微孔膜, 电解液为EC+DME(1∶1, 体积比)+LiPF6(1mol/L)。 在充满干燥氩气的自制手套箱中组装成模拟电池, 在武汉蓝电电子有限公司生产的Land-BTL10电化学测试仪上(电压范围为2.8~4.5V, 电流密度为30mA/g)进行充放电测试。 X射线衍射分析在Rigaku衍射仪上进行, Cu靶, 石墨单色器, 扫描范围为10°~90°, 扫描速度为0.04(°)/min, 管流、 管压分别为300mA和40kV。 扫描电镜观表征在HITACHIS-570电镜扫描仪上进行。
2 结果与讨论
2.1 不同配锂方式对材料循环性能的影响
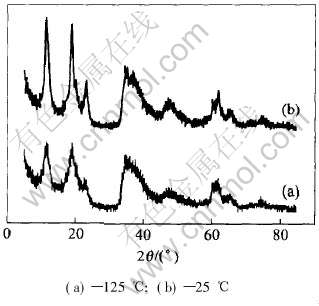
图1 不同温度下干燥得到前驱体的X射线衍射谱
Fig.1 XRD patterns of (Ni0.5Mn0.5)(OH)2 powder dried at different temperatures
传统的配锂方式是把共沉淀产物洗涤干燥后和相应量的LiOH混合研磨, 并烧结而成。 但由于共沉淀产物在干燥过程中Ni、 Mn沉淀物会发生氧化, 特别是Mn(OH)2在空气氛高温条件下容易生成锰氧化物[5], 这样不但影响了共沉淀物的设计组分, 还可能导致配锂量不准确, 从而最终影响了产物的循环性能。 作者对材料不同温度下干燥的沉淀产物作了X射线衍射分析, 结果如图1所示。 可以看出, 低温干燥的前驱体(图1(b))各衍射峰比较尖锐, 毛刺较少, 说明低温下干燥的产物基本保持了设计组分。 高温干燥的产物(图1(a))各衍射峰相对变得宽大, 毛刺较多。 说明在高温条件下干燥的材料发生了一定的氧化和脱水现象, 共沉淀产物已不再是纯洁的(Ni0.5Mn0.5)(OH)2成分。
通过以上分析, 对配锂方式做了改进: 首先称量好所需的LiOH, 然后将其混入洗涤后的共沉淀产物中, 以酒精作研磨介质混匀两种物质并在低温下(25℃)充分干燥后制备出前驱体。 为了证明前驱体制备方式对材料性能的影响, 分别作了不同配锂方式制得材料的充放电循环曲线。 图2所示为其它条件不变, 配锂方式改进前后所制备材料的放电循环比较。 可以看出, 采用改进的配锂方法, 材料的容量和循环性能都有了一定的提高, 说明预混配锂和低温干燥的方法一定程度上克服了共沉淀产物的氧化现象, 同时也保证了材料配锂量的准确, 对材料的电化学性能有着积极的意义。
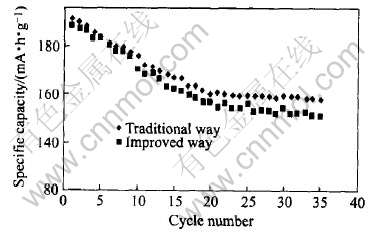
图2 不同配锂方式制得材料的循环曲线
Fig.2 Capacity vs cycle number for LiNi0.5Mn0.5O2 synthesized by different lithium matched ways
2.2 烧结方式对材料循环性能的影响
LiNi0.5Mn0.5O2从结构上来看是LiMO2(M=Ni, Ni1/2Co1/2)和Li2MnO3的混合固溶体体系, 在材料的烧结过程中, 首先分别生成中间过渡物LiMO2和Li2MnO3, 然后在高温条件下形成混合固溶体结构[6, 7]。 在此过程中, 烧结步骤和升降温速率对材料混合固溶体体系的形成有重要作用, 并直接影响了材料的电化学性能, 尤其是循环性能。
2.2.1 烧结步骤对材料循环性能的影响
曾采用的烧结方式是在850℃烧结10h得到产品。 在该条件下所制备的材料首次充放容量较高但首次效率较低(75%左右)且循环性能不好, 如图3所示。 为了解决这个问提, 作者从微观角度进行分析, 发现这与材料的离子无序度有很大关系[8-10]。 材料的无序度高, 首次放电效率就相对低。 在LiNi0.5Mn0.5O2层状结构中Li+占3a位置, Ni2+和Mn2+占3b位置, O2-占3c位置, 其中Li+半径(R=0.069nm)和Ni2+半径(R=0.076nm)相差不大, 在高温烧结中Li+和Ni2+容易获得能量脱离自己原有的位置并相互对换, 导致了离子的混排现象。 在材料充放电过程中, 那部分占据了3b位置的Li+, 在一定的充电电压下会与3a位置的Li+一同脱出, 从表观现象可以看到材料充电容量很高。 但在放电过程中, 占据3b位置的锂离子不具有可逆性, 不能回到原有位置, 这就造成了两个结果, 其一是材料的放电容量相对充电容量不高, 效率比较低; 其二是造成了材料的晶格缺陷, 从而在循环过程中材料结构发生变化导致了循环性能不好。 为此作者在烧结制度方面作了进一步改善。
处于3a位置的Li+如果要占据Ni2+的3b位置需要外界提供能量和一定反应时间, 因此在低温下烧结(≤800℃)Li+和Ni2+混排现象没有高温下严重。 但是材料必须经过高温烧结才能形成完善层状固溶体结构(X射线衍射谱证明了低温条件下烧结得到的材料层状结构峰不明显), 为此, 作者选择了高温分段烧结的合成方式, 即烧结过程中首先在750℃下保温6h, 以保证各中间相产物的形成(在热重-差热曲线中观察到在750℃附近有明显的吸热峰, 和材料各中间体的形成有很大关系)。 然后再升温到950℃保温3h, 以促进材料的层状固溶体结构发育完全。 将这种条件下烧结出的产物作充放电实验(见图4), 从循环性能来看, 采取该方式合成的材料与一次高温烧结方式相比, 首次效率和循环性能都有了明显的提高, 首次效率达到80%以上。 30次循环后放电容量基本保持在175mA·h/g左右。 说明采用改进后的烧结方法收到了比较好的效果。
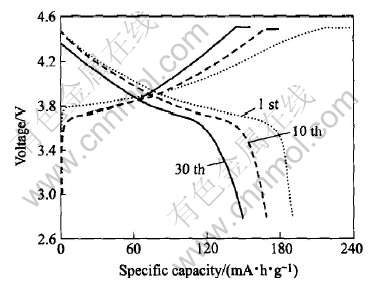
图3 850℃下烧结10h材料的充放电曲线
Fig.3 Relations between charge-discharge capacity and voltage for LiNi0.5Mn0.5O2 calcined at 850℃ for 10h
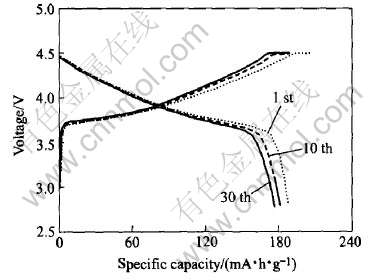
图4 采用高温分段烧结产品的充放电曲线
Fig.4 Relations between charge-discharge capacity and voltage for LiNi0.5Mn0.5O2 synthesized at stepped heating way
2.2.2 升降温速率对材料循环性能的影响
据报道烧结过程中升温速率快有助于材料的固溶体结构的形成: 原料在450℃烧结后直接放到预热950℃的炉子中烧结, 在此条件下, 能够促进中间过渡体向产物的转变, 减少中间过渡体最终产物中的残留量[11, 12]。 采用淬冷方式能够保持材料在高温时的结构和结晶形态。 体系在高温条件下形成的层状固溶体结构, 如果采用缓慢降温则可能在降温过程中发生一些结构上的转变从而造成材料的结构不完善电化学性能不好[13, 14]。 作者对这个问题也作了一定研究, 分别作了不同升降温速率的实验。
图5所示为不同升温速率不同时所合成材料的X射线衍射谱。 可以看出, 采用缓慢升温所合成材料的特征峰(Sample B)比采用快速升温合成材料的特征峰(Sample A)更为尖锐且(018)峰和(110)峰分叉相对较为明显, 说明缓慢加热能够使材料结晶更完善, 这样材料的性能应该相对较好。 同时根据X射线衍射数据计算出材料的晶格常数和I003/I004比值列于表1。
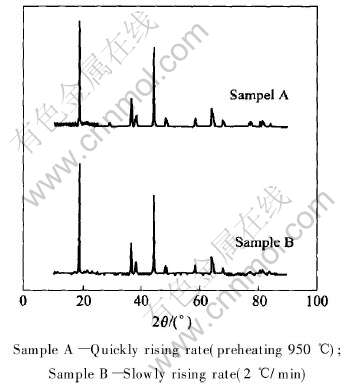
图5 不同升温速率产品的X射线衍射谱
Fig.5 XRD patterns of LiNi0.5Mn0.5O2 powders synthesized at defferent heating rates
表1 不同升温速率下制得材料的晶格常数和I003/I004值
Table 1 Lattice parameters obtained from Rietveld refinement of LiNi0.5Mn0.5O2 synthesized at different heating rates

从表1可看出两种烧结方式所制得的材料的晶格参数没有太大的区别。 说明两种升温方式烧结出的产品获得了基本相似的晶体结构, 说明烧结出的材料结构相似。 为此将急速升温的材料作充放电实验, 结果如图6所示。 可以看出, 材料无论是容量、 循环性能还是首次效率都非常低。 可见在急速升温处理方式下, 材料的电化学性能比较差。 作者认为这主要是由于材料升温过程也是一个反应的过程, 如果采用急速升温可能导致材料反应时间不够长, 中间体发育不完全结晶不完善。 目前关于材料升温速率对材料性能的影响研究结果差异很大, 升温速率对材料有怎样的影响以及其机理需要进一步研究。
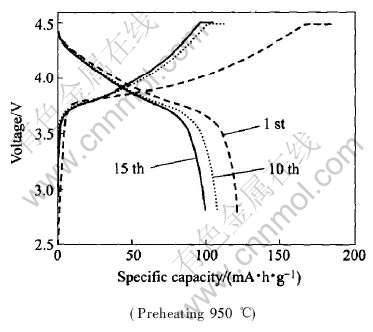
图6 急速升温(预热 950℃烧结)所制得产品的充放电循环图
Fig.6 Charge-discharge capacity vs voltage for LiNi0.5Mn0.5O2 synthesised at quickly heating rates
对于降温速率研究作者也进行了一些实验, 发现采用随炉冷却、 快速风冷(即材料烧结完成高温状态下取出, 鼓风冷却)和淬冷(物料烧结好后直接放到液氮里瞬间冷却)的效果相差不大, 相对而言快速风冷和淬冷的效果相对好些。 这和镍锰类材料前驱体制备和材料本身的锂镍锰比例有关, 对于采用共沉淀法制备氢氧化物前驱体, 并合成标准比例的LiNi0.5Mn0.5O2材料, 冷却方式对其电化学性能影响效果不大, 但采用其它类型的前驱物来制备镍锰类材料, 特别是富锂态镍锰材料(Li1+xNiy-MnzO2), 冷却速度对材料的影响却很大, 因为材料比例不同, 其中间体的转变也有所不同, 对冷却方式的要求也不同, 在这里不详细讨论, 可参见文献[15]。
表2列出4种不同的制备条件。 图7所示为在几种条件下制备出材料的循环性能对比。
通过表2 和图7可以看出, 在C条件下制备出的材料性能最好, 材料的循环性能有了明显的改善。
表2 4种不同的制备条件
Table 2 Four kinds of different synthesis conditions
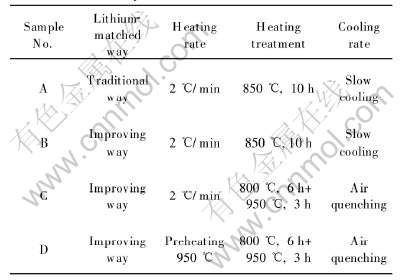
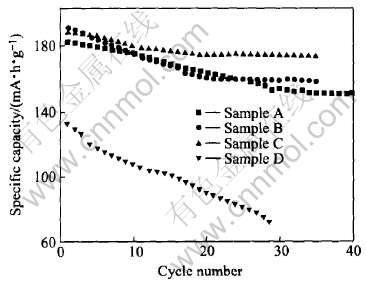
图7 不同烧结和处理方式下制备材料的循环曲线
Fig.7 Capacity vs cycle number for LiNi0.5Mn0.5O2 synthesized under different conditions
3 结论
1) 共沉淀产物的纯洁性和配锂的准确性对材料的循环性能有比较大的影响, 采用低温干燥和预混配锂的方式能有效保证共沉淀产物的纯洁性和配锂的准确性, 从而提高了材料的循环性能。
2) 材料内部锂离子和镍离子的无序度是导致材料循环性能不好的一个重要原因, 采用高温分段烧结的方法能一定程度上克服锂离子和镍离子的混排现象, 从而提高材料的循环性能。
3) 升降温速率对材料的合成过程有重要影响, 采用缓慢升温和快速风冷的处理方式得到的材料充放电性能和循环性能都比较好。
REFERENCES
[1]Sun Y K, Kang S H, Amine K. Synthesis and electrochemical behavior of layed Li(Ni0.5-xCo2xMn0.5-x)O2 (x=0 and 0.025) materials prepared by solid-state reaction method[J]. Matrials Research Bulletin, 2004, 39: 819-825.
[2]Wang G X, Steve B, Jane Y. Multiple-ion-doped lithium nickel oxides as cathod materials for lithium-ion batteries[J]. Journal of Power Sources, 2003, 119-121: 189-194.
[3]汤宏伟, 陈宗璋, 钟发平. LiNi1-xMxO2(M=Co3+, Al3+)的制备与性能[J]. 中国有色金属学报, 2003, 11(4): 859-862.
TANG Hong-wei, CHEN Zong-zhang, ZHONG Fa-ping. Synthesis and electrochemical behavior of LiNi1-xMxO2(M=Co3+, Al3+)[J]. The Chinese Journal of Nonferrous Metals, 2003, 11(4): 859-862.
[4]钟辉, 徐惠. 锂离子电池正极材料LiCo0.3Ni0.7-xSrxO2的合成及其电化学性能[J]. 中国有色金属学报, 2004, 14(2): 157-161.
ZHONG Hui, XU Hui. Preparation and electrochemical properties of LiCo0.3Ni0.7-xSrxO2 cathode material for lithium-ion batteries [J]. The Chinese Journal of Nonferrous Metals, 2004, 14(2): 157-161.
[5]马子川, 谢亚勃, 郑世君. Mn(OH)2空气氧化研究[J]. 河北师范大学学报(自然科学版), 2000, 24(3): 253-355.
MA Zi-chuan, XIE Ya-bo, ZHENG Shi-jun. Study of the air-oxidation of Mn(OH)2 [J]. Journal of Hebei Normal University(Natural Science), 2000, 24(3): 353-355.
[6]Kim J M, Chung H T. Role of transition metals in layered Li[Ni, Mn, Co]O2 under electrochemical operation[J]. Journal of Electrochemica Acta, 2004, 49: 3573-3580.
[7]Numata K, Sakaki C, Yamanaka S. Synthesis and characterizaton of layer structured solide solutions in the system of LiCoO2-Li2MnO3 [J]. Journal of Solid State Ionics, 1999, 117: 257-263.
[8]van der Ven A, Ceder G. Ordering in Lix(Ni1/2-Mn1/2)O2 and its relation to charge capacity and electrochemical behavior in rechargeable lithium battteries[J]. Journal of Electrochemistry Communicatons, 2004, 6: 1045-1050.
[9]Park K S, Cho M H, Jin S J, et al. Effect of Li ion in transsition metal sites on electrochemical behavior of layered lithium manganese oxide solid solution[J]. Journal of Solide State Ionics, 2004, 171: 141-146.
[10]Yong J P, Hong Y S, Wu X L, et al. Structure investigation and electrochemical behabviour of Li[NixLi(1/3-2x/3)Mn(2/3-x/3)]O2 compounds by a simple combustion method[J]. Journal of power Sources, 2004, 129: 288-295.
[11]Shlyakhtin O A, Young S Y, Sun H C, et al. Freeze drying synthesis of LiNi0.5Mn0.5O2 cathode materials[J]. Journal of Electrochemica Acta, 2004, 50: 505-509.
[12]Sun H C, Shlyakhtin O A, Kim J S, et al. Structural and electrochemical properties of Li1+xNi0.5Mn0.5-O2+δ(0≤x≤0.7) cathode materials for lithium-ion batteries[J]. Journalof Power Source, 2005, 140: 355-360.
[13]Shin S S, Sun Y K, Amine K. Synthesis and electrochemical properties of Li[Li(1-2x)NixMn(2-x)/3]O2 as cathode material for lithium secondary batteries[J]. Journal of Power Source, 2002, 112: 634-638.
[14]Kim J H, Park C W, Sun Y K. Synthesis and electrochemical behavior of Li[Li0.1Ni0.35-x/2Cox-Mn0.55-x/2]O2 cathode materials[J]. Solid State Ionics, 2003, 164: 43-49.
[15]LU Zhong-hua, Beaulieu L Y, Donaberger R A. Synthesis, structure, and electrochemical behav ior of Li[NixLi1/3-2x/3Mn2/3-x/3]O2[J]. Journal of the Electrochemical Society, 2002, 149(6): A778-A791.
基金项目: 湖南省自然科学基金资助项目(04JJ0388)
收稿日期: 2005-11-23; 修订日期: 2006-02-20
通讯作者: 肖 劲, 博士; 电话: 0731-8876454; E-mail: 136074451080@hnmcc.com


