文章编号:1004-0609(2016)-11-2420-06
常温常压下辉钼矿硝-硫酸浸出动力学
李 飞,张文娟,陈星宇
(中南大学 冶金与环境学院,长沙 410083)
摘 要:
研究辉钼矿硝-硫酸浸出过程的浸出动力学,考察反应温度、硝酸浓度、硫酸浓度对辉钼矿浸出速率的影响。结果表明:采用等浸出率法求得反应表观活化能为61.3 kJ/mol,辉钼矿硝-硫酸浸出过程受表面化学反应控制,浸出速率常数对温度的依赖程度高;硝酸和硫酸浓度的反应级数分别为1.4和0.54,硝酸浓度的变化严重影响浸出反应速度,提高硝酸浓度可加速矿物氧化并提高钼浸出率,而硫酸浓度的影响相对较小。
关键词:
中图分类号: TF111.31 文献标志码:A
钼作为一种重要的稀有金属被广泛用于钢铁、催化剂、颜料等工业领域[1]。钼的主要矿物是辉钼矿,世界99%的钼产量源于此矿。目前,工业上处理辉钼矿主要采用火法工艺,原则流程是硫化钼(辉钼矿)经氧化焙烧转化为易被氨水浸取的三氧化钼[2-4]。通用的钼冶炼火法设备在国外为多膛炉及沸腾焙烧炉,国内多为回转窑及反射炉。辉钼矿的火法工艺存在温度过高焙烧产物三氧化钼易升华损失,三氧化钼与伴生金属钼酸盐生成低共熔物使物料烧结而影响产品脱硫,低SO2浓度烟气难以有效制酸,伴生的铼元素挥发损失[5]等缺点。另外,对低品位和复杂矿,采用焙烧工艺处理存在一定的技术困难。
湿法冶金是一种有前景的钼冶炼工艺,它可避免火法存在的问题,还具有流程短、金属收率高、环境友好、适用于低品位矿等优点。辉钼矿具有极其稳定的化学性质,所以需使用较强的氧化剂及苛刻的浸出条件。已在工业上应用的湿法工艺主要有氧压酸浸[6-8]和氧压碱浸[9-10],这些工艺涉及的高温高压对设备材质要求非常高。另外,碱性氧压分解碱耗量大,产出的硫酸钠难利用,并加重后续萃取工作负担。因此,冶金学者试图开发低温常压酸浸出工艺。硝酸是一种较强的酸性氧化剂,常被用于矿物中有价金属的提取[11-12]。硝酸浸出法具有易操作,易与后续萃取分离相结合的优点。辉钼矿湿法浸出的理论研究在文献上已见报道,如李希明等[13]和李洪桂等[14]绘制Mo-S- H2O系的电位-pH图。从热力学分析可知,硝酸氧化辉钼矿进行的热力学趋势非常大,甚至以氧化电位更低的Fe3+氧化MoS2时,常温下其平衡常数达1×10100左右。但浸出反应进行的程度和速度与其动力学紧密相关,而相关动力学研究极少见报道。一定范围内硝酸的氧化性随溶液酸度升高而增强,硫酸可提高硝酸氧化效率[6]。本文作者以硝-硫混酸溶液处理辉钼矿,研究钼的浸出动力学,为常压硝酸浸出辉钼矿的工业实践提供一定的理论参考依据。
1 实验
1.1 实验原料
所用辉钼矿为金堆城钼业科技有限责任公司钼化学事业部的商业产品,二硫化钼含量大于99%,粒度小于48 μm的占90%以上。所用的硝酸,硫酸均为分析纯。
1.2 实验方法
在配有电动搅拌器的三颈烧瓶内,加入200 mL硝-硫混酸溶液。三颈烧瓶置于恒温水浴锅中,温度波动范围不超过±1 ℃,待酸液预热达到设定温度后,启动搅拌300 r/min,加入1 g辉钼矿的同时开始计时。每隔 5~15 min取1 mL浸出液,放入100 mL容量瓶稀释定容。以分光光度法分析溶液中钼浓度,计算钼浸出率。
2 结果与讨论
2.1 温度对浸出的影响
固定硝酸浓度为1.0 mol/L,硫酸浓度为0.9 mol/L,液固比200:1,考察了浸出温度对Mo浸出率及浸出速度的影响,结果如图1所示。
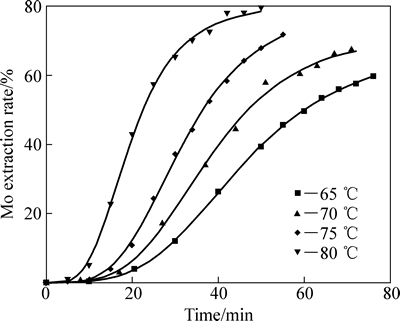
图1 不同温度下钼浸出率随时间的变化
Fig. 1 Change of Mo extraction rates with time at different temperatures
图1中曲线呈明显的“S”型,表明了一种自催化反应路径[15-16]。对所研究温度的动力学曲线a=f(t)进行微分,反应速率v对时间的变化曲线如图2所示。由图2可见,反应速率先缓慢增长,到达一个极大值最后回落,且随着温度升高,浸出的最大反应速率依次增大,出现最大速率的时间依次提前,诱导期逐渐缩短。

图2 不同温度下钼反应速率随时间的变化
Fig. 2 Change of Mo reaction rates with time at different temperatures
图3所示为反应不同时间后辉钼矿的SEM像。由图3(a)可见,浸出前,辉钼矿为扁平片状颗粒;经18 min氧化浸出后,如图3(b)所示,矿物颗粒扁平面积显著减小。据矿物学[17]研究已知,辉钼矿具有S-Mo-S三明治层状结构,且极具各向异性。层内S-Mo原子间以共价键结合,而层间S-S原子间以较弱的范德华力连接。外力作用下,容易产生层间相对滑移及层面破裂,由此而形成层片状解理面。这种面具非极性、疏水性、化学惰性为一体。化学反应主要发生在层面断裂的边缘,此处为由S-Mo离子键破裂而形成的晶棱,化学活性相对较高。
鉴于浸出颗粒非单一粒径,也非球形颗粒,无法用收缩核模型来描述辉钼矿的硝酸浸出。本文作者采用等浸出率法求取反应的表观活化能,方法见文献[18-19]。由图1读取浸出率为20%、40%、50%所耗时间列于表1。

图3 反应不同时间后辉钼矿的SEM像
Fig. 3 SEM images of molybdenite reacted for different time
由表1数据可作出阿仑尼乌斯图,如图4所示,求得表观活化能为61.3 kJ/mol,表明浸出过程受表面化学反应控制。由阿仑尼乌斯公式可知,活化能的大小反映速度常数对温度的依赖程度[20]。温度越高,能量超过反应能垒的活化分子含量越多,反应进行得越快。而湿法冶金反应中活化能61.3 kJ/mol是一个相当高的值,因此,对辉钼矿的硝-硫酸浸出来说,温度是一个至关重要的因素,反应温度越高,辉钼矿分解速度越快。
表1 不同温度下达到相同浸出率所需时间
Table 1 Time needed in same Mo extraction rate at different temperatures


图4 浸出反应的阿仑尼乌斯图
Fig. 4 Arrhenius plots for Mo leaching reaction
2.2 硝酸浓度对浸出的影响
固定硫酸浓度为0.9 mol/L,温度75 ℃,液固比200:1,考察了不同硝酸浓度下Mo浸出率随时间的变化,其结果如图5所示(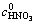 为初始硝酸浓度)。由图5可见,随着硝酸浓度升高,辉钼矿的氧化浸出的速度逐渐上升;诱导时间逐渐缩短。
为初始硝酸浓度)。由图5可见,随着硝酸浓度升高,辉钼矿的氧化浸出的速度逐渐上升;诱导时间逐渐缩短。
采用等浸出率法求取反应对硝酸浓度的反应级数[18],由图3读取浸出率为20%、40%、50%所耗时间,列于表2。
对于浸出这样的非基元反应,反应速率v随某反应物浓度c的相对变化率u可定义为u=dv/vdc,它可表示反应物浓度对反应速率的影响程度。如果反应对于氧化剂反应级数为n,则其反应速率可表示为v=kcn,经微分可得
dv/vdc=nc-1 (1)

在所研究的硝酸浓度范围内,c-1>0,u=dv/vdc是n的增函数。这表明反应级数越大,浓度对反应速率的影响程度越大。由上表数据可做出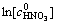 -lnt图如图6。求得反应对硝酸浓度的级数为1.4,大于1,这表明当增大硝酸浓度时可能发生由动力学区向扩散区的转移。
-lnt图如图6。求得反应对硝酸浓度的级数为1.4,大于1,这表明当增大硝酸浓度时可能发生由动力学区向扩散区的转移。
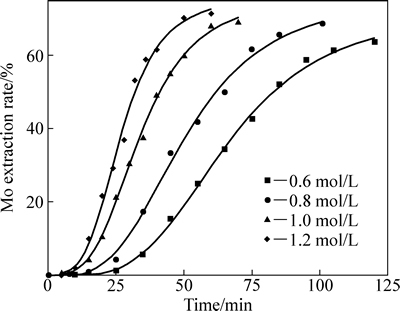
图5 不同初始硝酸浓度下钼浸出率随时间的变化
Fig. 5 Chang of Mo extraction rate with time at different initial nitric acid concentrations
表2 不同硝酸浓度下达到相同浸出率所需时间
Table 2 Time needed in same Mo exaction rate at different nitric acid concentrations
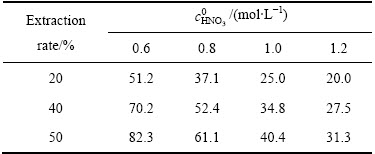

图6 初始硝酸浓度对反应级数的影响
Fig. 6 Effect of initial nitric acid concentration on reaction order
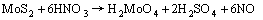 (3)
(3)
另外,由化学反应方程式(3)可知,辉钼矿的浸出直接依赖于硝酸的氧化。从反应平衡移动的角度来说,氧化剂浓度的升高有利于反应的正向进行。对所研究硝酸浓度的动力学曲线a=f(t)进行微分,从反应速率v对时间的变化图(为简单起见,未再列出)可见,随着硝酸浓度升高,浸出的最大反应速率依次增大,诱导期亦逐渐缩短。
2.3 硫酸浓度对浸出的影响
固定硝酸浓度为1.0 mol/L,温度75 ℃,液固比200:1,考察了硫酸浓度对Mo浸出率及浸出速度的影响,浸出率随时间的变化趋势如图7所示( 为初始硫酸浓度)。
为初始硫酸浓度)。
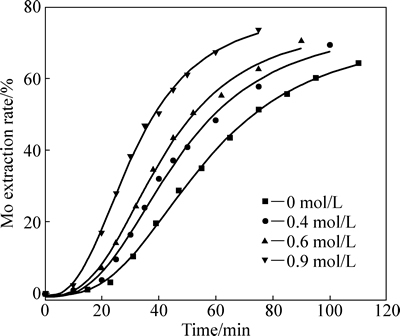
图7 不同初始硫酸浓度下钼浸出率随时间的变化
Fig. 7 Change of Mo extraction rate with time at different initial sulfur acid concentrations
由图7可见,不同硫酸浓度浸出曲线相距较近,相同反应时间对应的钼浸出率比较接近,这表明硫酸浓度的变化对浸出的影响相对较小。采用等浸出率法[18]求取反应对硫酸浓度的反应级数。由图7读取浸出率为20%、40%、50%时所耗时间,将结果列于表3。
表3 不同硫酸浓度下达到相同浸出率所需时间
Table 3 Time needed in same Mo extraction rate at different sulfur acid concentrations
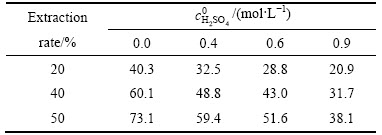
由上表数据可做出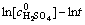 图,如图8所示,求得浸出对硫酸浓度的反应级数为0.54(其中,当硫酸浓度为0时,不能对浓度求对数)。0<n=0.54<1,浓度越大,反应速率越高,但浓度对反应速率的影响程度越小。浸出过程中,钼的一个大的走向是以钼酸和多钼酸的形态出现在分解产物中,其在精矿颗粒表面形成固体产物膜,阻碍了浸出剂向矿物粒子表面的内扩散。研究表明:钼酸在硫酸中的溶解度大于硝酸,硫酸还能与钼酸反应生成
图,如图8所示,求得浸出对硫酸浓度的反应级数为0.54(其中,当硫酸浓度为0时,不能对浓度求对数)。0<n=0.54<1,浓度越大,反应速率越高,但浓度对反应速率的影响程度越小。浸出过程中,钼的一个大的走向是以钼酸和多钼酸的形态出现在分解产物中,其在精矿颗粒表面形成固体产物膜,阻碍了浸出剂向矿物粒子表面的内扩散。研究表明:钼酸在硫酸中的溶解度大于硝酸,硫酸还能与钼酸反应生成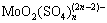 、
、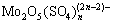 等进入溶液减小产物膜的阻碍。实践证明:硝酸浸出辉钼矿时硫酸的存在有利于提高反应速度[21]。故在不外加硫酸的情况下,将部分母液返回对于工业浸出实践是有利的。
等进入溶液减小产物膜的阻碍。实践证明:硝酸浸出辉钼矿时硫酸的存在有利于提高反应速度[21]。故在不外加硫酸的情况下,将部分母液返回对于工业浸出实践是有利的。

图8 初始硫酸浓度反应对级数的影响
Fig. 8 Effect of initial sulfur acid concentration on reaction order
研究中发现,硝酸浸出辉钼矿的浸出率-时间曲线都呈明显的“S”型,这表明了一种自催化反应路径,此类自催化反应也出现在黄铁矿、闪锌矿等硫化矿的硝酸浸出过程中[22]。研究发现催化是由吸附于辉钼矿颗粒表面上的NO和NO2所致,由于NO2可直接与水反应生成HNO3,NO2的催化效率可达NO的5.5倍左右[23]。具体的催化过程可从两方面解释:1) 硝酸被硫化矿物还原产生NO,NO 迅速被氧气氧化为NO2。NO2溶于水生成硝酸(φh=0.957V/(SHE))和另一种更强的氧化剂亚硝酸(φh=1.202 V/(SHE)),进一步氧化矿物,只是在开始时NO和NO2都极其稀少,故存在一段时间的诱导期;2) NO2可从还原剂(硫化矿)夺取电子生成亚硝酸根,从而使硫化矿被氧化浸出。硝酸与亚硝酸反应又生成NO2,如此循环下去直至矿物被氧化完全,循环过程中NO2起着电子载体的催化作用[22]。BARTECKI等[24]在研究溴酸钾浸出合成二硫化钼动力学时亦得到与本研究几乎一致的曲线规律,认为这种反应现象是由两个基本过程所控制:反应界面生成期(诱导期)及反应界面向反应剂的转移。换句话说,开始反应时,反应仅在有限的活性点进行,速率慢到难以观察。只有当活性点增长到足够多时(诱导末期),微反应区迅速扩张,反应速率逐渐加快。
3 结论
1) 采用等浸出率法求取反应的表观活化能61.3 kJ/mol,表明浸出受表面化学反应控制,温度对反应速度具有显著影响。从提高浸出速度的角度考虑,操作温度越高越好。
2) 硝酸浸出辉钼矿的浸出率-时间曲线都呈明显的“S”型,这表明了一种自催化反应路径。硝酸是对氧化浸出影响最大的因素之一,它的浓度直接决定了反应的速率和程度,分级数为1.4,表明浓度增大可能发生由动力学区向扩散区的转移。
3) 求得硫酸的分级数为0.54,硫酸的存在能提高浸出速度,有利于钼氧化物的溶解,至于硝-硫酸的促进作用还进一步研究。
REFERENCES
[1] 张启修, 赵秦生. 钨钼冶金学[M]. 北京: 冶金工业出版社, 2005: 42-61.
ZHANG Qi-xiu, ZHAO Qin-sheng. Metallurgy of tungsten and molybdenum[M]. Beijing: Metallurgical Industry Press, 2005: 42-61.
[2] 李洪桂. 有色提取冶金手册·稀有高熔点金属(上)[M]. 北京: 冶金工业出版社, 1999: 271-273.
LI Hong-gui. A handbook for extractive metallurgy of nonferrous metals-rare refractory metals: Part 1[M]. Beijing: Metallurgical Industry Press, 1999: 271-273.
[3] 甘 敏, 曾金林, 范晓慧, 张 麟. HNO3/NH4NO3预处理工艺强化低钼焙砂浸出[J]. 中国有色金属学报 2016, 26(2): 471-477.
GAN Min, ZENG Jin-lin, FAN Xiao-hui, ZHAN Lin. Strengthening leaching for low grade molybdenum calcine by HNO3/NH4NO3 pretreatment technology[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(2): 471-477.
[4] 甘 敏, 范晓慧, 张 麟, 姜 涛, 邱冠周, 王 勇. 低品位钼精矿氧化焙烧过程的反应行为[J]. 中国有色金属学报, 2014, 24(12): 3115-3122.
GAN Min, FAN Xiao-hui, ZHANG Lin, JIANG Tao, QIU Guan-zhou, WANG Yong. Reaction behavior of low grade molybdenum concentrates in oxidation roasting process[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(12): 3115-3122.
[5] 曹占芳, 钟 宏, 姜 涛, 刘广义, 王 帅. 德兴铜矿辉钼矿精矿的选择性电氧化浸出与分离过程[J]. 中国有色金属学报, 2013, 23(8): 2290-2295.
CAO Zhan fang, ZHONG Hong, JIANG Tao, LIU Guang-yi, WANG Shuai. Selective electric oxidation leaching and separation of Dexing molybdenite concentrates[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(8): 2290-2295.
[6] SMIRNOV K, RASPOPOV N, SHNEERSON Y M, LAPIN A Y, BITKOV G, MEN’SHIKOV Y A, PASKHIN P, KIRICHENKO V. Autoclave leaching of molybdenite concentrates with catalytic additives of nitric acid[J]. Russian Metallurgy (Metally), 2010(7): 588-595.
[7] KHOSHNEVISAN A, YOOZBASHIZADEH H, MOZAMMEL M, SADRNEZHAAD S K. Kinetics of pressure oxidative leaching of molybdenite concentrate by nitric acid[J]. Hydrometallurgy, 2012, 111: 52-57.
[8] WANG Si-fu, CHANG Wei, DENG Zhi-gan, LI Cun-xiong, LI Xin-bing, JUN Wu, WANG Ming-Shuang, ZHANG Fan. Extraction of molybdenum and nickel from Ni-Mo ore by pressure acid leaching[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(10): 3083-3088.
[9] 彭建蓉, 杨大锦, 陈加希, 阎江峰. 原生钼矿加压碱浸试验研究[J]. 稀有金属, 2007(S1): 110-113.
PENG Jian-rong, YANG Da-jin, CHEN Jia-xi, YAN Jiang-feng. Experimental study on alkaline leaching of crude molybdenite under pressure of oxygen[J]. Chinese Journal of Rare Metals, 2007(S1): 110-113.
[10] 蔡创开. 碱性介质氧压煮-萃取法回收某非标准钼精矿中的钼[J]. 矿产综合利用, 2010(4): 19-23.
CAI Chuang-kai. Recovery of molybdenum from a nonstandard molybdenum concentrate by autoclave leaching-solvent extraction process[J]. Multipurpose Utilization of Mineral Resources, 2010(4): 19-23.
[11] 李 梅, 张晓伟, 刘 佳, 柳召刚, 阳建平. HNO3-Al(NO3)3络合浸出包头稀土精矿中的氟元素及其络合机理[J]. 中国有色金属学报, 2015, 25(2): 508-514.
LI Mei, ZHANG Xiao-wei, LIU Jia, LIU Zhao-gang, YANG Jian-ping. Coordination leaching of fluorine element of Baotou rare earth concentrate by HNO3-Al(NO3)3 and its coordination mechanism[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(2): 508-514.
[12] 孙杨铖, 葛明敏, 于 聪, 王慧慧, 周全法. 无粉碎-硝酸浸出回收废 ITO 导电玻璃中的铟[J]. 环境工程, 2015, 33(S1): 541-544.
SUN Yang-cheng, GE Ming-min, YU Cong, WANG Hui-hui, ZHOU Quan-fa. Recycling of indium from waste indium tin oxide glass with no-smashed nitric acid leaching method[J]. Environmental Engineering, 2015, 33(S1): 541-544.
[13] 李希明, 柯家骏. 硫化钼矿浸取过程热力学分析[J]. 化工冶金, 1982, 4: 89-95.
LI Xi-ming, KE Jia-jun. The Thermodynamic analysis on the leaching process of molybdenite[J]. Journal of Chemical and Metallurgical, 1982. 4: 89-95.
[14] 李洪桂, 孙培梅. 辉钼精矿湿法浸出过程热力学探讨 [J]. 钼业经济技术, 1991(1): 27-33.
LI Hong-gui, SUN Pei-mei. The thermodynamic analysis on the leaching process of molybdenite[J]. China Molybdenum Industry, 1991(1): 27-33.
[15] FRANCESCO A, ROBERTO G, TERESA T, ANDREA V, ADOLFO P. Activity and resistance to leaching of Cu-based catalysts in the wet oxidation of phenol[J]. Applied Catalysis B: Environmental, 2003, 45(1): 51-62.
[16]  OPARA, OREL BORIS, ARICO ANTONINO S, KIM HASUCK. CWO of phenol on two differently prepared CuO-CeO2 catalysts[J]. Applied Catalysis B: Environmental, 2000, 28(2): 113-125.
OPARA, OREL BORIS, ARICO ANTONINO S, KIM HASUCK. CWO of phenol on two differently prepared CuO-CeO2 catalysts[J]. Applied Catalysis B: Environmental, 2000, 28(2): 113-125.
[17] 柯家骏. 辉钼矿晶面特性工艺矿物学的研究[J]. 化工冶金, 1981, 4(3): 35-41.
KE Jia-jun. The process mineralogy of crystal surface properties of molybdenite[J]. Journal of Chemical and Metallurgical, 1981, 4(3): 35-41.
[18] 赵中伟. 含金硫化矿的机械化学及其浸出工艺研究[D]. 长沙: 中南大学, 1995: 21-22.
ZHAO Zhong-wei. Study on the mechanochemistry and leaching of auriferous sulfide concentrates[D]. Changsha: Central South University, 1995: 21-22.
[19] 莫鼎成. 冶金动力学[M]. 长沙: 中南工业大学出版社, 1987.
MO Ding-cheng. Metallurgical kinetics[M]. Changsha: Central South University Press, 1987.
[20] 孙召明, 赵中伟. 冶金化学动力学研究中应注意的几个问题[J]. 稀有金属与硬质合金, 2001(3): 27-29.
SUN Zhao-ming, ZHAO Zhong-wei. Considerations to be given in the study of metallurgical reaction kinetics[J]. Rare Metals and Cemented Carbides, 2001(3): 27-29.
[21] 向铁根. 钼冶金[M]. 长沙: 中南大学出版社, 2002: 35-56.
XIANG Tie-gen. Molybdenum metallurgy[M]. Changsha: Central South University Press, 2002: 35-56.
[22] LUTSIK V, SOBOLEV A. the investigation of the kinetics of hydrochemical oxidation of metal sulphides with the aim of determination of the optimal conditions for the selective extraction of molybdenum from ores[J]. Journal of Mining and Metallurgy, 2005, 41B: 33-45.
[23] KHOLMOGOROV A, KONONOVA O, PASHKOV G, KACHIN S, PANCHENKO O, KALYAKINA O. Molybdenum recovery from mineral raw materials by hydrometallurgical methods[J]. European Journal of Mineral Processing and Environmental Protection, 2002, 2(2): 82-93.
[24] BARTECKI A, RYCERZ L. Kinetics and mechanism of dissolution of synthetic molybdenum disulphide MoS2 in bromate solutions Part: I: Kinetics of dissolution of molybdenum disulphide in the MoS2-KBrO3-H2O system[J]. Hydrometallurgy, 1988, 20(2): 235-248.
Kinetics of nitric-sulfuric acid leach molybdenite at room temperature and ambient pressure
LI Fei, ZHANG Wen-juan, CHEN Xing-yu
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: Kinetics of molybdenite leaching by nitric acid in sulfuric acid was studied. The effects of reaction temperature, concentration of nitric acid and sulfuric acid concentration on the leaching rate of molybdenite were investigated. The results show that, using the application of iso-leaching rate method, the apparent activation energy calculated is 61.3 kJ/mol. The reaction is chemically controlled and the leaching rate depends strongly on temperature. Also, the reaction order with respect to concentration of nitric acid and sulfuric acid are 1.4 and 0.54, respectively, the change in nitrate concentration affects the leaching reaction speed strongly, and increasing nitric acid concentration can accelerate the oxidation of the mineral and improve the leaching rate of molybdenum. But the effect of sulfuric acid concentration on leaching is not significant.
Key words: molybdenite; kinetics; iso-leaching rate method; relative change rate
Foundation item: Project(50974137) supported by the National Natural Science Foundation of China
Received date: 2016-05-24; Accepted date: 2016-10-11
Corresponding author: CHEN Xing-yu; Tel: +86-731-88830476; E-mail: xychen@csu.edu.cn
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(50974137)
收稿日期:2016-05-24;修订日期:2016-10-11
通信作者:陈星宇,副教授,博士;电话:0731-88830476;E-mail:xychen@csu.edu.cn
摘 要:研究辉钼矿硝-硫酸浸出过程的浸出动力学,考察反应温度、硝酸浓度、硫酸浓度对辉钼矿浸出速率的影响。结果表明:采用等浸出率法求得反应表观活化能为61.3 kJ/mol,辉钼矿硝-硫酸浸出过程受表面化学反应控制,浸出速率常数对温度的依赖程度高;硝酸和硫酸浓度的反应级数分别为1.4和0.54,硝酸浓度的变化严重影响浸出反应速度,提高硝酸浓度可加速矿物氧化并提高钼浸出率,而硫酸浓度的影响相对较小。
[1] 张启修, 赵秦生. 钨钼冶金学[M]. 北京: 冶金工业出版社, 2005: 42-61.
[2] 李洪桂. 有色提取冶金手册·稀有高熔点金属(上)[M]. 北京: 冶金工业出版社, 1999: 271-273.
[3] 甘 敏, 曾金林, 范晓慧, 张 麟. HNO3/NH4NO3预处理工艺强化低钼焙砂浸出[J]. 中国有色金属学报 2016, 26(2): 471-477.
[4] 甘 敏, 范晓慧, 张 麟, 姜 涛, 邱冠周, 王 勇. 低品位钼精矿氧化焙烧过程的反应行为[J]. 中国有色金属学报, 2014, 24(12): 3115-3122.
[5] 曹占芳, 钟 宏, 姜 涛, 刘广义, 王 帅. 德兴铜矿辉钼矿精矿的选择性电氧化浸出与分离过程[J]. 中国有色金属学报, 2013, 23(8): 2290-2295.
[9] 彭建蓉, 杨大锦, 陈加希, 阎江峰. 原生钼矿加压碱浸试验研究[J]. 稀有金属, 2007(S1): 110-113.
[10] 蔡创开. 碱性介质氧压煮-萃取法回收某非标准钼精矿中的钼[J]. 矿产综合利用, 2010(4): 19-23.
[11] 李 梅, 张晓伟, 刘 佳, 柳召刚, 阳建平. HNO3-Al(NO3)3络合浸出包头稀土精矿中的氟元素及其络合机理[J]. 中国有色金属学报, 2015, 25(2): 508-514.
[12] 孙杨铖, 葛明敏, 于 聪, 王慧慧, 周全法. 无粉碎-硝酸浸出回收废 ITO 导电玻璃中的铟[J]. 环境工程, 2015, 33(S1): 541-544.
[13] 李希明, 柯家骏. 硫化钼矿浸取过程热力学分析[J]. 化工冶金, 1982, 4: 89-95.
[14] 李洪桂, 孙培梅. 辉钼精矿湿法浸出过程热力学探讨 [J]. 钼业经济技术, 1991(1): 27-33.
[17] 柯家骏. 辉钼矿晶面特性工艺矿物学的研究[J]. 化工冶金, 1981, 4(3): 35-41.
[18] 赵中伟. 含金硫化矿的机械化学及其浸出工艺研究[D]. 长沙: 中南大学, 1995: 21-22.
[19] 莫鼎成. 冶金动力学[M]. 长沙: 中南工业大学出版社, 1987.
MO Ding-cheng. Metallurgical kinetics[M]. Changsha: Central South University Press, 1987.
[20] 孙召明, 赵中伟. 冶金化学动力学研究中应注意的几个问题[J]. 稀有金属与硬质合金, 2001(3): 27-29.
[21] 向铁根. 钼冶金[M]. 长沙: 中南大学出版社, 2002: 35-56.
XIANG Tie-gen. Molybdenum metallurgy[M]. Changsha: Central South University Press, 2002: 35-56.


