文章编号:1004-0609(2012)06-1659-08
孔道Al2O3/SiO2对NaAlH4-Tm2O3体系储氢性能的影响
马 俊1,李 洁1,唐仁英2,李文章1,陈启元1
(1. 中南大学 化学化工学院 有色金属资源化学教育部重点实验室,长沙 410083;
2. 湖南稀土金属材料研究院,长沙 410014)
摘 要:
以机械球磨法制备具有可逆吸放氢性能的NaAlH4-Tm2O3储氢材料体系。利用相同制备方法进一步研究两种不同孔道材料(大孔Al2O3与介孔SiO2)对NaAlH4-Tm2O3 体系储氢性能的影响,测试样品的循环吸放氢性能,并对样品吸放氢前后的结构进行表征。结果表明:大孔Al2O3材料的添加并不能明显改善NaAlH4-Tm2O3体系的放氢速率和放氢量,而介孔SiO2的加入使NaAlH4-Tm2O3体系在150 ℃条件下5 h内的首次放氢量(质量分数)达到4.61%, 高于NaAlH4-Tm2O3体系的4.27%,增加了约8.0%。此外,添加介孔SiO2的NaAlH4-Tm2O3体系放氢速率也有所提高。
关键词:
中图分类号:TG 139;TK 91 文献标志码:A
Effects of porous Al2O3/SiO2 on
hydrogen storage capacities of NaAlH4-Tm2O3 system
MA Jun1, LI Jie1, TANG Ren-ying2, LI Wen-zhang1, CHEN Qi-yuan1
(1. Key Laboratory of Resources Chemistry of Nonferrous Metals, Ministry of Education,
Central South University, Changsha 410083, China;
2. Hunan Rare Earth Metal & Material Institute, Changsha 410014, China)
Abstract: NaAlH4-Tm2O3 hydrogen storage system with reversible capacity was prepared by the ball milling method. The mixtures of two different porous materials (macroporous Al2O3 and mesoporous SiO2) and NaAlH4-Tm2O3 were prepared using the same method, and the influence of the two porous materials on NaAlH4-Tm2O3 was investigated. The hydrogen storage capacity and the structure of the samples before and after hydrogen desorption were characterized. The results show that the addition of macroporous Al2O3 can not improve the hydrogen release rate and capacity, but with the addition of mesoporous SiO2, NaAlH4-Tm2O3-SiO2 system has the maximum hydrogen release amount of 4.61% (mass fraction), about 8.0% higher than that of NaAlH4-Tm2O3. Furthermore, the hydrogen desorption rate of NaAlH4-Tm2O3 with mesoporous SiO2 is also improved.
Key words: NaAlH4; Tm2O3; macroporous Al2O3; mesoporous SiO2
氢能推广应用的关键在于氢的储存,开发一种性能优越的储氢材料是氢能研究的重要方向。目前针对储氢材料的研究主要集中于碳质储氢材料[1-2]、合 金[3-4]、金属氢化物[5-7]。以NaAlH4为代表的MAlH4型金属配位氢化物,因其质量储氢密度较高的优点,一直是储氢材料的研究热点。NaAlH4具有以下两步放氢反应过程[8]:
3NaAlH4![]() Na3AlH6+2Al+3H2 (1)
Na3AlH6+2Al+3H2 (1)
Na3AlH6![]() 3NaH+Al+1.5H2 (2)
3NaH+Al+1.5H2 (2)
式(1)和(2)中所放出H2的量分别为3.75%和1.85%(质量分数)。
在没有对材料进行改性或添加催化剂的情况下,以上两个反应分别发生在210和250 ℃,先后放出氢气的质量分数为3.75%和1.85%,放氢总量为5.6%。自1997年,BOGDANOVI?和SCHWICKARDI[8]发现掺杂Ti基催化剂后NaAlH4具有可逆吸放氢性能以来,如何对NaAlH4进行改性,使其能够在温和的条件下可逆地吸放氢,立即成为储氢材料的研究热点,很多学者对此进行大量研究[9-12]。
为了使NaAlH4能够在较低的温度下更快地放出氢气,并且在一定条件下使可逆吸氢反应能够发生,加入合适的添加剂是主要手段之一。目前研究主要集中于Ti基催化剂,如TiF3[13]、钛粉和TiO2等[12, 14-15],还有Zr基、Hf基[16]催化剂以及镧系氯化物,如LaCl3、SmCl3和ErCl3等[17]。添加镧系氯化物能够有效地改善体系的热力学性能和放氢速率,研究发现,添加SmCl3后NaAlH4能够在120 ℃条件下2 h内放出3.25%的氢气[18]。然而,镧系氯化物在放氢反应过程中会和NaAlH4反应生成副产物NaCl以致减小材料的总放氢量。同时,有报道镧系氧化物,如La2O3、CeO2、Sm2O3和Gd2O3同样能够提高NaAlH4的放氢速率,使NaAlH4能够在150 ℃条件下可逆吸放氢,并且这些镧系氧化物在吸放氢过程中保持稳定,不会和NaAlH4发生反应生成其它物质[19]。对于其它镧系氧化物,如Tm2O3、Er2O3和Yb2O3是否能够改善NaAlH4的吸放氢性能,尚未见报道。有学者研究发现,Tm2O3是一种具有催化活性的半导体材料[20-21],但其是否能降低NaAlH4的放氢温度,提高放氢速率,还未见有相关研究工作开展。
除了考虑加入添加剂对储氢材料进行改性外,有学者研究发现通过加入孔道材料,制备孔道材料与储氢材料的混合物也能改善储氢材料的吸放氢性能。主要原理是当储氢材料被限制在孔道材料中时,储氢材料的尺度会减小甚至纳米化,而纳米化可降低材料的形核激活能并缩短吸放氢过程的传质距离,从而改善吸放氢过程的动力学和循环性能。YU等[22]通过球磨法,制备了不同比例碳纳米管与LiBH4的混合物,使储氢材料分散更加均匀,降低了样品放氢温度,同时放氢量增加。ZHENG等[23]发现通过加入介孔氧化硅,可以将储氢材料限制在较小范围内,从而通过减小传质距离,提高了放氢速率,降低了放氢温度。制备孔道材料和金属氢化物的混合物目前主要有3种方法:熔融浸入法[24-25]、溶液浸渍法[23]和球磨法[22]。熔融浸入法需要高温环境,使金属氢化物熔融后通过毛细管作用进入孔道材料中,同时需要高氢压以防止氢化物高温分解。而溶液浸渍法需要提前制备干燥的有机溶剂,过程复杂,操作困难。球磨法的优点在于操作简单,省时,利于工业化。本文作者采用机械球磨为制备方法,在制备NaAlH4-Tm2O3储氢材料体系的基础上,进一步研究孔道材料SiO2/Al2O3对NaAlH4-Tm2O3体系储氢性能的影响。研究表明,NaAlH4-Tm2O3体系吸放氢可逆,介孔SiO2 的加入改善NaAlH4-Tm2O3体系的吸放氢性能。
1 实验
1.1 实验试剂
介孔SiO2的制备根据文献[26]完成的。先将2 g P123溶解于15 g去离子水,然后缓慢加入60 g浓度为2 mol/L的盐酸溶液并搅拌,溶液于40 ℃恒温搅拌1 h。之后,缓慢滴加4.25 g正硅酸乙酯(TEOS),并于40 ℃条件下搅拌20 h,然后将溶液置于水热反应釜100 ℃条件下晶化24 h。得到的产物经过滤、洗涤和干燥后,空气气氛中550 ℃煅烧4 h,即得白色粉末状的介孔SiO2材料。水热法制备的介孔SiO2表面会含有硅羟基,该硅羟基易与NaAlH4发生反应降低材料的储氢量,根据文献去除了介孔SiO2表面含有的硅羟基(Si—OH)[27]。
另外,大孔Al2O3(平均孔径200 nm,厚度60 μm,Whatman公司),NaAlH4(纯度为93%,Sigma-Aldrich公司)和Tm2O3(纯度>99%,湖南稀土金属材料研究院生产)为直接购买。所有操作在高纯氮气气氛的真空手套箱内完成。制样时,以NaAlH4粉末、Tm2O3粉末、孔道Al2O3/或SiO2按一定配比配制后,在高纯N2保护下进行球磨制备。球磨均在南京大学仪器厂生产的QM-1SP2行星式球磨机上进行,球磨罐为50 mL的不锈钢真空密封钢罐,磨球材质为不锈钢。磨球与粉末的质量比为25:1,球磨运作为单向间断运转,为防止球磨时罐内温度升高,每球磨30 min间歇6 min,主轴转速为300 r/min。
1.2 样品的放氢性能测试和结构性质表征
样品的吸放氢测试在湖南稀土研究院研制的PCT装置上进行。为了便于比较,在计算样品的放氢量时扣除了添加剂的质量。放氢温度为150 ℃,吸氢过程在150 ℃、9 MPa氢压条件下进行。XRD检测采用日本理学公司Rigaku-TTRⅢ型X射线衍射仪,Cu靶,Kα线(l=0.154 056 nm),石墨单色器,管电压40 kV,管电流250 mA,扫描范围10°~80°,扫描速度 10 (°)/min。样品检测前在高纯N2气氛的真空手套箱中用液体石蜡进行密封。采用JEOL JSM6700F型场发射扫描电子显微镜和TECNAI G2 20ST型透射电镜观察样品的微观形貌。
2 结果与讨论
2.1 材料吸放氢性能
图1所示为NaAlH4-Tm2O3 (10%)、NaAlH4-Tm2O3 (10%)-SiO2 (10%)和NaAlH4-Tm2O3 (10%)-Al2O3 (10%) (均为质量分数)体系在150 ℃条件下的放氢动力学曲线。加入Tm2O3能够使NaAlH4材料在150 ℃条件下放氢,5 h内NaAlH4-Tm2O3体系的放氢量为4.27%,高于已报道的添加稀土氧化物Sm2O3改性NaAlH4的最大放氢量3.7%[19]。放氢进行1 h时,添加介孔SiO2的NaAlH4- Tm2O3体系放氢量达到4.12%,表明此时NaAlH4的第一步分解已反应完全并且已经开始第二步分解反应。而添加大孔Al2O3的NaAlH4-Tm2O3体系和未添加任何孔道材料的NaAlH4-Tm2O3体系1 h时放氢量分别为3.71%和3.77%,表明此时样品的第一步分解反应接近完全,但第二步分解反应尚未发生。添加大孔Al2O3并没有使体系的放氢性能得到明显提高,而添加介孔SiO2的NaAlH4-Tm2O3体系,放氢速率提高,第一步分解反应提前完成。5 h内,NaAlH4- Tm2O3-SiO2体系放氢量为4.61%,高于NaAlH4-Tm2O3- Al2O3体系的4.25%。
样品在放氢后,于9 MPa氢气压力150 ℃条件下吸氢4 h,之后对样品进行了5次循环的放氢测试,结果如图2所示。对于3种不同体系,第1次放氢和2至5次循环放氢之间的放氢量均有明显减小,但是,添加介孔SiO2的体系总体放氢量仍然最大,其5次循环放氢量分别为:4.61%、1.87%、1.81%、1.77%和1.56%。对于添加大孔Al2O3和未添加孔道材料的体系,第2~5次循环放氢量均小于1.8%,推测是由反应1(如式1所示)的逆反应进行不完全所致。另外,添加大孔Al2O3的体系第2~5次的放氢量均小于NaAlH4- Tm2O3体系的,说明添加孔道材料并不一定有利于提高材料的放氢性能。
2.2 材料物相和微观形貌
为研究不同体系样品球磨后组成,对NaAlH4- Tm2O3、NaAlH4-Tm2O3-SiO2和NaAlH4-Tm2O3-Al2O3体系进行X射线衍射分析,检测结果如图3所示。其中,15°~25°的馒头峰为液体石蜡的衍射峰。由于介孔SiO2与大孔Al2O3为非晶态,因此,图谱中没有相应的衍射峰。NaAlH4-Tm2O3、NaAlH4-Tm2O3-SiO2和NaAlH4-Tm2O3- Al2O3体系经1 h球磨后,图谱中的衍射峰均与NaAlH4和Tm2O3相对应,没有测到NaAlH4分解的中间产物如Na3AlH6和Al等的衍射峰,说明3种体系中的NaAlH4与添加剂Tm2O3 在球磨过程中均保持稳定,未发生分解。同时可以看出,添加大孔Al2O3的体系相对于添加介孔SiO2 和仅添加Tm2O3的体系,衍射峰强度减弱,说明添加大孔Al2O3在一定程度上增加球磨过程中对晶粒的破坏,使晶粒完整性减小,而添加介孔SiO2材料,在球磨过程中对样品晶粒完整性的影响较小。同时,NaAlH4-Tm2O3-Al2O3体系样品衍射峰的强度弱于NaAlH4-Tm2O3-SiO2体系样品的衍射峰,也可能是由于大孔Al2O3的孔道比介孔SiO2的大,因此,更多的NaAlH4和Tm2O3进入了大孔Al2O3孔道中,有学者认为被限制在孔道内的NaAlH4是不定形态而X射线无法测出[23],因此,NaAlH4-Tm2O3- Al2O3体系样品衍射峰的强度比NaAlH4-Tm2O3-SiO2体系弱。另一方面,由于Al2O3孔径较大(约200 nm),即便更多NaAlH4进到了Al2O3孔内,相对于介孔SiO2,也不能够更好地将NaAlH4限制在一个较小的范围内从而减小材料间的传质距离,提高材料的吸放氢速度,因此,添加大孔Al2O3并没有提高材料的放氢性能。
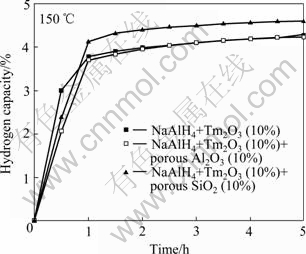
图1 NaAlH4-Tm2O3, NaAlH4-Tm2O3-SiO2和NaAlH4-Tm2O3- Al2O3体系150 ℃时的放氢曲线
Fig. 1 Desorption capacities of NaAlH4-Tm2O3, NaAlH4- Tm2O3-SiO2 and NaAlH4-Tm2O3-Al2O3 at 150 ℃
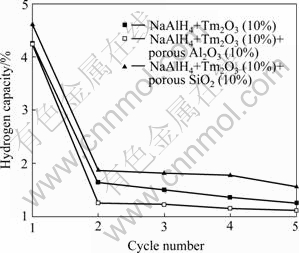
图2 3种体系样品5次循环放氢曲线
Fig. 2 Hydrogen desorption capacities of three systems in five cycles
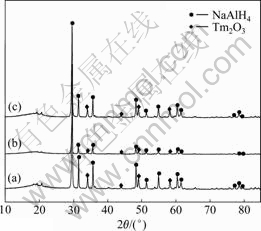
图3 球磨1 h后样品的XRD谱
Fig. 3 XRD patterns of samples milled for 1 h: (a) NaAlH4-Tm2O3(10%); (b) NaAlH4-Tm2O3(10%)-macroporous Al2O3(10%); (c) NaAlH4-Tm2O3(10%)-mesoporous SiO2(10%)
图4(a)所示为NaAlH4-Tm2O3体系球磨1 h后的微观形貌。图中样品呈不规则团状分布,有团聚产生,团聚会使材料的表面积减小,阻碍放出的氢气从材料内部向表面扩散,从而降低材料的放氢速率和循环放氢量。图4(b)所示为球磨前实验所采用的Al2O3孔道材料的微观形貌,可看出球磨前材料孔道分布均匀,孔径约200 nm。图4(c)所示为NaAlH4-Tm2O3-Al2O3体系经1 h球磨后的微观形貌,可看出球磨后Al2O3孔道材料的完整性和均匀性都受到较大程度破坏,NaAlH4呈片状和块状分布,和图4(a)相比材料分布更加不均匀,残余的孔道表面被NaAlH4覆盖,与图4(b)相比,孔道口都已被覆盖和填满,无图4(b)中观察到的空孔道,说明部分NaAlH4进到了孔道中。总体上看,NaAlH4和Tm2O3分散在完整和被破坏的Al2O3孔道材料的表面和内部,且有团聚现象,团聚会导致样品的循环放氢性能减弱。图4(d)所示为NaAlH4-Tm2O3-SiO2体系经1 h球磨后的形貌,可观察到样品表面总体相对更加均匀和光滑。对于添加大孔Al2O3体系,为了确定Tm2O3和NaAlH4在孔道材料中的分布,对样品进行元素面扫描分析,图4(e)~(h)分别为Tm、O、Na和Al的元素面扫描分析,可观察到NaAlH4-Tm2O3-Al2O3体系中Tm2O3和NaAlH4的分散局部不均匀。
因制备得到的SiO2为介孔材料,孔径较小,为进一步研究NaAlH4-Tm2O3-SiO2体系球磨后的微观形貌,对其进行HRTEM检测,结果列于图5。图5(a)所示为制备得到的介孔氧化硅材料,其中插图为孔道材料的横截面,可看出SiO2孔道分布均匀有序,呈近似六方形结构,孔径约10 nm。图5(b)所示为NaAlH4- Tm2O3-SiO2体系经1 h球磨后的形貌,图中仍可看到完整的孔道,没有条纹状的模糊部分是受损的孔道(如图5(b)中黑色箭头所示)。ZHENG等[23]认为制备介孔SiO2约束的NaAlH4时,介孔SiO2中部分区域颜色变深,表示该区域孔道内负载了NaAlH4。本文作者观察到了一些颜色较深的区域(如图5(b)中白色箭头所示),推测这些区域中部分NaAlH4进到了孔道中,但具体含量未知。为了确定Tm2O3和NaAlH4在SiO2中的分布,对样品进行元素面扫描分析,图5(c)~(f)所示分别对应元素Tm、O、Na和Al,可观察到Tm、O、Na和Al元素在NaAlH4- Tm2O3-SiO2体系中的分布比NaAlH4-Tm2O3-Al2O3中的更加均匀,说明Tm2O3和NaAlH4的分散总体更均匀。NaAlH4均匀地分散在介孔SiO2的表面和内部,没有观察到团聚现象,这也使得NaAlH4-Tm2O3-SiO2体系的循环放氢性能优于NaAlH4-Tm2O3 和 NaAlH4-Tm2O3-Al2O3体系的,后二者皆有较大团聚产生。另外,大孔Al2O3和介孔SiO2相比,虽然二者皆有孔道,但由于Al2O3孔径较大(约200 nm),即便更多NaAlH4进到了孔内,相对于介孔SiO2,也不能够更好地将NaAlH4限制在一个较小的范围内从而减小材料间的传质距离,因此,添加介孔SiO2的体系表现出更好的循环放氢性能。同时,由于加入大孔Al2O3未能使NaAlH4分散更加均匀,且产生了团聚,增大了材料的传质距离,因此,第2~5次的循环放氢性能NaAlH4-Tm2O3-Al2O3 甚至还弱于NaAlH4- Tm2O3体系。
为研究样品放氢后的物相组成和循环放氢量减小的原因,对NaAlH4-Tm2O3-SiO2体系放氢后的样品和再次吸氢后的样品进行了XRD检测,其结果如图6所示。图谱6(a)中样品的衍射峰属于NaH、Al和Tm2O3,没有检测到其他物质如NaAlH4或中间产物Na3AlH6的衍射峰,说明反应式(1)和(2)中的分解反应完全进行。再次吸氢的样品XRD谱如图6(b)所示,图中衍射峰属于NaAlH4、Na3AlH6、Al和Tm2O3,没有观察到NaH的衍射峰,说明反应第二步的逆反应完全进行,而Na3AlH6和Al衍射峰的出现说明了第一步分解反应的逆反应没有完全进行,这也导致了首次放氢和后续次数放氢之间放氢量的较大差异。需要注意的是,2θ角30°附近NaAlH4的衍射峰与此区域NaH和Tm2O3的衍射峰较难区分,NaAlH4(112)和(004)晶面对应的衍射峰2θ角的位置分别为29.659°和31.514°,而Tm2O3(222)晶面衍射峰2θ角的位置为29.474°,NaH(111)晶面衍射峰2θ角的位置为31.589°。如何使第一步分解反应的逆过程进行更加完全,减小首次放氢与后续放氢之间放氢量的差异,还需要进一步研究。

图4 样品的微观形貌及相应的元素面扫描分布
Fig. 4 Microphologies of samples ((a)-(d)) and corresponding element plane scanning distribution ((e)-(h)): (a) NaAlH4-Tm2O3, milled for 1 h; (b) Macroporous Al2O3, without milling; (c) NaAlH4-Tm2O3- Al2O3; (d) NaAlH4-Tm2O3-SiO2; (e) Tm; (f) O; (g) Na; (h) Al

图5 样品的HRTEM像
Fig. 5 HRTEM images of samples ((a)-(b)) and corresponding element plane scanning distribution ((c)-(f)): (a) Mesoporous SiO2 before milling; (b) NaAlH4-Tm2O3-SiO2 milled for 1 h; (c) Tm; (d) O; (e) Na; (f) Al
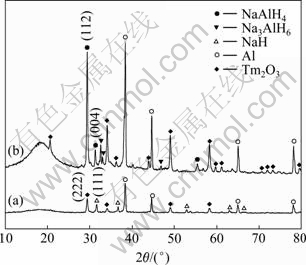
图6 NaAlH4-Tm2O3-SiO2体系放氢后样品的XRD谱
Fig. 6 XRD patterns of NaAlH4-Tm2O3-SiO2: (a) After desorption; (b) After hydrogen reabsorption
2.3 添加Tm2O3的可逆储氢反应机理
关于改性后NaAlH4的可逆储氢反应机理,目前人们的探讨主要以Ti基催化剂为背景,其中较有代表性的是BRINK等[28]以及WAN和JENSEN[29]提出的取代机理和THOMAS等[30]提出的氧化还原机理[30]。JENSEN推断掺杂量低于2%(摩尔分数)时Ti是以Ti4+的形式取代Na原子;而掺杂量高于2%(摩尔分数)时Ti以Ti2+的形式取代Na,他的这一推断经过结合实验结果和低价离子比高价离子半径大的实事得到了证实。而THOMAS等[30]结合材料的微观形貌和能谱分析,认为真正起催化作用的是生成的中间体TiAl3。
对于添加Tm2O3的NaAlH4可逆储氢反应机理,结合Tm和O的元素面扫描分析和样品球磨后、放氢后和重新吸氢后的XRD谱(如图3和6所示),Tm2O3的状态未发生变化,没有观察到其它Tm化合物的出现,但添加Tm2O3又能实现可逆吸放氢反应,因此,本文作者认为Tm2O3是以一种表面催化剂的形态来催化NaAlH4的可逆吸放氢反应,而非Ti基催化剂那样以其它价态取代Na原子或生成中间体来起催化作用。Tm2O3颗粒的均匀分布,可以为NaAlH4的放氢和吸氢提供更多的反应界面和扩散通道,从而提高NaAlH4的放氢速度。关于添加稀土氧化物改善NaAlH4的可逆吸放氢性能,详细的催化机理还需要更多的实验验证和分析支持。
3 结论
1) 稀土氧化物Tm2O3的添加使NaAlH4吸放氢可逆,NaAlH4-Tm2O3体系在150 ℃条件下5 h内的首次放氢量为4.27%,高于已报道的添加稀土氧化物Sm2O3改性NaAlH4的最大放氢量3.7%。
2) 添加大孔Al2O3不能明显改善NaAlH4-Tm2O3体系的放氢速率和放氢量,同时该体系在球磨过程中产生了团聚;而添加介孔SiO2使Tm2O3和NaAlH4在体系中分散更加均匀,无团聚产生,一定程度上减小传质距离,改善循环放氢量。5 h内的首次放氢量达到4.61%, 高于NaAlH4-Tm2O3体系的4.27%和NaAlH4- Tm2O3-Al2O3体系的4.25%,分别增加了约8.0%和8.5%。同时,体系的放氢速率也有所提高。
REFERENCES
[1] SIMONYAN V V, JOHNSON J K. Hydrogen storage in carbon nanotubes and graphitic nanofibers[J]. Journal of Alloys and Compounds, 2002, 330/332: 659-665.
[2] CHEN Chien-hung, HUANG Chen-chia. Hydrogen adsorption in defective carbon nanotubes[J]. Separation and Purification Technology, 2009, 65(3): 305-310.
[3] WILLIAMS M, LOTOTSKY M V, LINKOV V M, NECHAEV A N, SOLBERG J K, YARTYS V A. Nanostructured surface coatings for the improvement of AB5-type hydrogen storage intermetallics[J]. International Journal of Energy Research, 2009, 33(13): 1171-1179.
[4] VERMEULEN P, THIEL E F M J, NOTTEN P H L. Ternary MgTiX-alloys: A promising route towards low-temperature, high-capacity, hydrogen-storage materials[J]. Chemistry-A European Journal, 2007, 13(35): 9892-9898.
[5] GRAETZ J, REILLY J J. Kinetically stabilized hydrogen storage materials[J]. Scripta Materialia, 2007, 56(10): 835-839.
[6] GROSS A F, VAJO J J, ATTA S, OLSON G L. Enhanced hydrogen storage kinetics of LiBH4 in nanoporous carbon scaffolds[J]. The Journal of Physical Chemistry C, 2008, 112(14): 5651-5657.
[7] VALIENTE B L E, MAJER G, M?LLER K. Proton NMR studies of the NaAlH4 structure[J]. Journal of Magnetic Resonance, 2009, 200(1): 280-284.
[8] BOGDANOVI? B, SCHWICKARDI M. Ti-doped alkali metal aluminium hydrides as potential novel reversible hydrogen storage materials[J]. Journal of Alloys and Compounds, 1997, 253/254: 1-9.
[9] HERBERG J L, MAXWELL R S, MAJZOUB E H. 27Al and 1H MAS NMR and multiple quantum studies of Ti-doped NaAlH4[J]. Journal of Alloys and Compounds, 2006, 417(1/2): 39-44.
[10] KANG X D, WANG P, SONG X P, YAO X D, LU G Q, CHENG H M. Catalytic effect of Al3Ti on the reversible dehydrogenation of NaAlH4[J]. Journal of Alloys and Compounds, 2006, 424(1/2): 365-369.
[11] 庄鹏辉, 刘晓鹏, 李志念, 王树茂, 蒋利军, 李华玲. TiZr 氢化物掺杂 NaAlH4的储氢性能[J]. 中国有色金属学报, 2008, 18(4): 671-675.
ZHUANG Peng-hui, LIU Xiao-peng, LI Zhi-nian, WANG Shu-mai, JIANG Li-jun, LI Hua-ling. Hydrogen storage properties of NaAlH4 doped by Ti-Zr alloy hydride[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(4): 671-675.
[12] 王同涛, 王树茂, 黄 卓, 蒋利军, 刘晓鹏. 钛催化氢化铝钠的贮氢性能[J]. 中国有色金属学报, 2006, 16(8): 1429-1433.
WANG Tong-tao, WANG Shu-mao, HUANG Zhu, JIANG Li-jun, LIU Xiao-peng. Hydrogen storage properties of catalyzed sodium alanates[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(8): 1429-1433.
[13] KANG Xiang-dong, WANG Ping, CHENG Hui-ming. Advantage of TiF3 over TiCl3 as a dopant precursor to improve the thermodynamic property of Na3AlH6[J]. Scripta Materialia, 2007, 56(5): 361-364.
[14] SUTTISAWAT Y, RANGSUNVIGIT P, KITIYANAN B, KULPRATHIPANJA S. Effect of co-dopants on hydrogen desorption/absorption of HfCl4- and TiO2-doped NaAlH4[J]. International Journal of Hydrogen Energy, 2008, 33(21): 6195-6200.
[15] 肖学章, 陈立新, 王新华, 李寿权, 陈长聘. 络合氢化物 Ti-NaAlH4的制备与储氢特性[J]. 物理化学学报, 2006, 22(12): 1511-1515.
XIAO Xue-zhang, CHEN Li-xin, WANG Xin-hua, LI Shou-quan, CHEN Chang-pin. Preparation and hydrogen storage characteristics of Ti-NaAlH 4 complex hydride[J]. Acta Physico-Chimica Sinica, 2006, 22(12): 1511-1515.
[16] SUTTISAWAT Y, RANGSUNVIGIT P, KITIYANAN B, MUANGSIN N, KULPRATHIPANJA S. Catalytic effect of Zr and Hf on hydrogen desorption/absorption of NaAlH4 and LiAlH4[J]. International Journal of Hydrogen Energy, 2007, 32(9): 1277-1285.
[17] SUN T, ZHOU B, WANG H, ZHU M. Dehydrogenation properties of LaCl3 catalyzed NaAlH4 complex hydrides[J]. Journal of Alloys and Compounds, 2009, 467(1/2): 413-416.
[18] SUN T, ZHOU B, WANG H, ZHU M. The effect of doping rare-earth chloride dopant on the dehydrogenation properties of NaAlH4 and its catalytic mechanism[J]. International Journal of Hydrogen Energy, 2008, 33(9): 2260-2267.
[19] LEE G J, SHIM J H, CHO Y W, LEE K S. Reversible hydrogen storage in NaAlH4 catalyzed with lanthanide oxides[J]. International Journal of Hydrogen Energy, 2007, 32(12): 1911-1915.
[20] MU?OZ E L, DARRIBA G N, BIBILONI A G, ERRICO L A, RENTER?A M. Ionic exchange of Hf donor impurities in the wide-gap semiconductor Tm2O3[J]. Journal of Alloys and Compounds, 2010, 495(2): 532-536.
[21] SATO S, TAKAHASHI R, KOBUNE M, GOTOH H. Basic properties of rare earth oxides[J]. Applied Catalysis A: General, 2009, 356(1): 57-63.
[22] YU X B, WU Z, CHEN Q R, LI L Z, WENG B C, HUANG T S. Improved hydrogen storage properties of LiBH4 destabilized by carbon[J]. Applied Physics Letters, 2007, 90(3): 4106-4108.
[23] ZHENG Shi-you, FANG Fang, ZHOU Guang-you, CHEN Guo-rong, QUYANG Liu-zhang, ZHU Ming, SUN Da-lin. Hydrogen storage properties of space-confined NaAlH4 nanoparticles in ordered mesoporous silica[J]. Chemstry of Materials, 2008, 20(12): 3954-3958.
[24] LI Y, ZHOU G, FANG F, YU X, ZHANG Q, OUYANG L, ZHU M, SUN D. De-/re-hydrogenation features of NaAlH4 confined exclusively in nanopores[J]. Acta Materialia, 2011, 59(4): 1829-1838
[25] GAO J, ADELHELM P, VERKUIJLEN M H W, RONGEAT C, HERRICH M, RONGEAT C, BENTUM P J, GUTFLEISCH O, KENTGENS A, JONG K, JONGH P. Confinement of NaAlH4 in nanoporous carbon: impact on H2 release, reversibility, and thermodynamics[J]. The Journal of Physical Chemistry C, 2010, 114(10): 4675-4682.
[26] SCH?TH F. Non-siliceous mesostructured and mesoporous materials[J]. Chemstry of Materials, 2001, 13(10): 3184-3195.
[27] HSUEH H, YANG C, ZINK J, HUANG M H. Formation of titanium nitride nanoparticles within mesoporous silica SBA-15[J]. The Journal of Physical Chemistry B, 2005, 109(10): 4404-4409.
[28] BRINKS H, JENSEN C, SRINIVASAN S, HAUBACK B. Synchrotron X-ray and neutron diffraction studies of NaAlH4 containing Ti additives[J]. Journal of Alloys and Compounds, 2004, 376(1/2): 215-21.
[29] WANG P, JENSEN C. Method for preparing Ti-doped NaAlH4 using Ti powder: observation of an unusual reversible dehydrogenation behavior [J]. Journal of Alloys and Compounds, 2004, 379(1/2): 99-102.
[30] THOMAS G J, GROSS K J, YANG N Y C, JENSEN C. Microstructural characterization of catalyzed NaAlH4[J]. Journal of Alloys and Compounds, 2002, 330/332:702-707.
(编辑 李艳红)
基金项目:国家自然科学基金重点项目(20833009-3)
收稿日期:2011-01-21;修订日期:2012-03-08
通信作者:李 洁,教授,博士;电话:0731-88877364;E-mail: lijieliu@csu.edu.cn
摘 要:以机械球磨法制备具有可逆吸放氢性能的NaAlH4-Tm2O3储氢材料体系。利用相同制备方法进一步研究两种不同孔道材料(大孔Al2O3与介孔SiO2)对NaAlH4-Tm2O3 体系储氢性能的影响,测试样品的循环吸放氢性能,并对样品吸放氢前后的结构进行表征。结果表明:大孔Al2O3材料的添加并不能明显改善NaAlH4-Tm2O3体系的放氢速率和放氢量,而介孔SiO2的加入使NaAlH4-Tm2O3体系在150 ℃条件下5 h内的首次放氢量(质量分数)达到4.61%, 高于NaAlH4-Tm2O3体系的4.27%,增加了约8.0%。此外,添加介孔SiO2的NaAlH4-Tm2O3体系放氢速率也有所提高。


