文章编号: 1004-0609(2005)01-0133-08
锌蒸气高温气相氧化动力学
陈艺锋1, 2, 彭长宏2, 杨声海2, 唐谟堂2
(1. 湖南冶金职业技术学院 冶金系, 株洲 412000; 2. 中南大学 冶金科学与工程学院, 长沙 410083)
摘 要:
用热重法测定了锌蒸气在不同温度和气氛下的氧化动力学曲线, 用扫描电镜观察分析产物的结晶形貌。 结果表明: 氧化动力学遵守直线规律时, 产物的结晶形貌是无定形、 颗粒状和单针状; 氧化动力学曲线为抛物线规律时, 产物的结晶形貌是四针状和多针状。 氧化动力学转变规律的原因是锌蒸气中存在超细锌微粒与气态锌原子的动态平衡。 应用动力学理论和上述结果推断了相关条件下的动力学机理函数和动力学常数, 研究了锌微粒的氧化过程并求出了锌原子通过氧化膜层的扩散系数。
关键词: 锌蒸气; 锌微粒; 氧化动力学; 动力学机理函数; 氧化锌结晶形貌 中图分类号: TG172; TB323
文献标识码: A
Kinetics of oxidizing zinc vapor at elevated temperature
CHEN Yi-feng1, 2, PENG Chang-hong2, YANG Sheng-hai2, TANG Mo-tang2
(1. Department of Metallurgy, Hunan Metallurgical Institute of Professional Technology,Zhuzhou 412000, China;
2. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The kinetics of oxidizing zinc vapor in different atmosphere at elevated temperature was determined by thermalgravity apparatus and the morphologies of the oxidation products were examined by scanning electron microscopy. The results show that the products morphologies are amorphous, granular, needle-like when the kinetics advances linearly and the products of tetrapod and multipod-like ZnO appear as the kinetics proceeds parabolically. The change of the oxidation kinetics law is caused by tiny zinc particles formed in zinc vapor. The relative kinetic model functions and kinetics parameters of the title reaction were deduced from kinetic theories and the experimental data. The oxidation mechanism of the tiny zinc particles were investigated and the diffusion coefficient of Zn atoms through the oxidation scale were also deduced.
Key words: zinc vapor; zinc particles; oxidation kinetics; kinetic model functions; ZnO morphologies
锌蒸气在不同氧化气氛和温度下生成的ZnO有无定形、 颗粒状、 单针状、 四针状[1]、 多针状等五种典型的结晶形貌[2]。 那么, 生成这些不同结晶形貌时锌蒸气的氧化过程有什么不同呢?要解决这个问题, 就必需研究锌蒸气在不同条件下的氧化动力学。 只有如此, 才能把结晶形貌与晶体生长过程的物理化学环境由表及里地联系起来, 使晶体生长的微观反应和结晶形态的宏观表象得到统一的认识。
尽管对锌蒸气氧化产物结晶形貌的研究一直受到人们的关注[3-10], 但关于锌蒸气氧化动力学的研究却很少。 Kitano等[11]曾作过这方面的研究, 他们用锆探氧仪测定炉膛空间的氧含量随时间的变化, 由于通入炉膛的氧量是确定不变的, 因此, 这两者的差值就是锌蒸气氧化所消耗的氧量。 但是, 反应区的氧分压与炉膛的氧分压是不同的, 炉气中的氧必须通过对流、 扩散才能到达反应区, 探氧仪测得的含氧量必定高于反应区的实际含氧量, 同样, 锌蒸气主要集中在反应区而不会充满整个炉膛空间, 反应区内锌蒸气的分压也不等于锌在此温度下的饱和蒸气压, 并且, 这种差别与炉膛的空间大小成比例, 因此, 用这种方法来确定锌蒸气的氧化动力学规律是值得商榷的。
锌蒸气氧化是质量增加的过程, 在保证锌蒸气不溢出反应器的前提下, 可以采用在不同气氛条件下的热重法来研究锌蒸气的氧化行为, 这种方法避免了反应区间内锌、 氧分压都不能确定的困难, 因而, 用热重法得出的氧化动力学规律更能反映锌蒸气氧化过程的实质。
1 实验
1.1 试样
锌粉, 粒度≤76μm。 为了除去锌粉中的缓蚀剂, 锌粉先在250℃烘焙20min, 再用0.01mol/L稀HCl溶液浸泡5min, 用去离子水反复漂洗, 在90℃烘干24h, 研磨过筛, 取粒度在44~53μm的粉末为试样。 经测定, 试样ZnO含量为9.66%(质量分数), 相当于原料O含量为1.90%。
1.2 实验装置
实验装置是用自制的石英管和石英反应器按如图1所示构成。 实验的关键是反应器的尺寸, 必须保证试样在高温氧化时锌蒸气不从反应器中逸出, 通过摸索实验确定了反应器的尺寸。 管式炉(炉管尺寸d60mm×1000mm, 铁铬铝加热元件, 功率2kW); 电子天平用JA5103N; 观察产物形貌用日本产JSM-5600LV冷场发射扫描电镜。
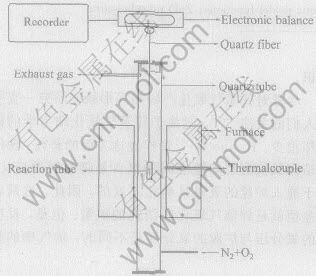
图1 氧化装置示意图
Fig.1 Scheme for oxidation device
1.3 实验方法
根据探索实验, 气体流量控制在10~80L/h, 竖式管状炉升温到预定温度, 保温1h, 通入按比例配备的混合气体, 每次取样品质量为550~600mg, 装入反应器内, 轻轻敲动反应器底部3~4次, 使每次样品的厚薄及装填密度都比较均匀。 试料装入反应管内, 石英丝挂在天平吊钩上, 每隔1min读数一次。 当读数在10min内不超过0.3mg时, 即认为反应结束, 并以这10min开始计时的时刻为反应的结束点, 若读数出现负值, 则以出现负值前一时刻作为反应的结束时刻。
1.4 数据处理
为了消除试样量的影响, 采用转化率α表示反应物Zn向产物ZnO的转化率, m0, m(Zn)分别表示Zn在反应开始时和反应进行到τ时刻的质量, 那么,
![]()
以Δm, R分别表示氧化过程的质量增量和质量增加率, 则:
![]()
从式(2)可得到任意时刻τ的质量增加率R, 再由式(1)和氧化反应的化学计量关系, 得到转化率与质量增加率的关系:
α=0.04086R(3)
2 实验结果
按式(3)可求得反应任意时刻的转化率α, 作出相应的TG曲线。 图2所示为锌蒸气在温度为850, 900, 950, 980℃时不同氧化气氛下的α-t曲线。 图中N线、 O线、 F线分别代表氧化气氛为5%O2(体积分数)+N2; 12%O2(体积分数)+N2; 空气, 下标1,2,3,4代表4个氧化温度。 图3所示为对应条件下观察到的产物的SEM结晶形貌。
图2中, 在反应的初期, 任何温度下, 随着气氛中氧含量的增高, 氧化速度也随之增大, 随着反应进行到一定阶段, O线、 N线和F线出现不同的规律。 所有O线和N线都类似于S形-自催化的α-t曲线, 具有一般气—固反应动力学的特点, SEM观察表明O线和N线的产物分别为四针状或多针状[1, 2, 10](见图3(a)和3(b))。
用空气作氧化气体的F线在不同温度下有较大的区别。 F1线为锌蒸气在850℃时的氧化曲线, 可见在反应开始阶段, 氧化速度很快, 按直线变化, 但随着反应的进行, 当转化率约为0.5时, 反应趋于停止, 原因是在金属熔体的表面形成了密实的氧化层, 阻碍了锌的蒸发, 同时, 气相中的氧难以通过氧化层扩散到熔体表面使其继续氧化。 SEM观察表明产物有分层的现象: 上层是粉状无定形的ZnO(图3(c)), 下层是颗粒状和针状体(图3(d)), 底部是凝固的锌熔体。 F2线、 F3线类似, 是直线变化, 完成反应的时间很短, 反应速度远大于O线和N线, 并且, 锌可以全部蒸发氧化完毕, 产物为均匀的颗粒状(图3(e))。 F4线为锌蒸气在980℃时的氧化曲线, 当反应进行到一定阶段时, 也出现了停滞的现象, 但经过3~5min后, 锌蒸气会突然 从反应器中喷出, 瞬间出现很大的质量损失, 原因是氧化层内的锌蒸气压力增高使氧化层破裂所致, 产物是短小的针状体(图3(f))。
3 讨论
3.1 最概然机理函数
如果不考虑F1线和F4线反应出现停滞的状态, 那么F1~F4线的共同特征是α-t按直线变化, 具有定温均相反应的性质。 在绝大多数的均相反应中, 反应的整个过程遵守一个动力学规律。 锌蒸气与O2分子反应, 反应速度取决于锌的蒸发速度, 锌在各种气氛下的蒸发速度是线性的。 它们的区别是F1线、 F4线的氧化速度大于蒸发速度, 氧化反应区迅速下降至熔体表面, 故在金属的液面上产生氧化膜, 妨碍了金属的进一步蒸发[2]; F2、 F3线反应速度与锌的蒸发速度相等, 氧化反应的位置较高, 锌液可顺利蒸发完全。
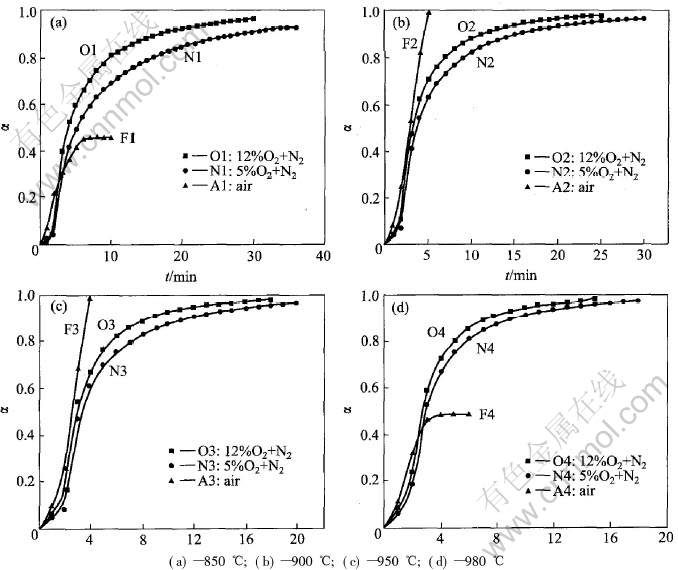
图2 锌蒸气在相同温度不同氧化气氛下的α-t曲线
Fig.2 α-t curves of zinc vapor oxidation at different conditions

图3 不同氧化条件下氧化锌的结晶形貌
Fig.3 Morphologies of ZnO obtained at different oxidation conditions
O线和N线的情况要复杂得多, 需要进一步分析, 才能确定过程的最概然机理函数。 由定温热分析曲线推断动力学机理函数的方法有约化时间图法和双对数lnln分析法[12]。 为了作图清晰, 下述分析过程作图用的数据全部采用O2线的数据, 所有O线和N线的分析结果则用表格表示。
3.1.1 约化时间图法
将实验数据所作的α-t/t0.5曲线视作实验曲线, 若实验曲线与理论曲线重叠, 则该理论曲线所对应的G(α)就是最概然的机理函数[12]。 由O2线的数据可作出约化时间图4中的实验点, 可以看到在反应前期(t/t0.5≤1.5)时, 实验数据与R3动力学模式函数的曲线吻合很好, 也就是说, 此时的反应是受相界面的结晶化学反应所控制。 随着反应的进行, 当t/t0.5>1.5时, 实验数据点偏离R3理论线, 趋向三维扩散(Ginstring-Brounshtein)模式D4的理论线, 表明反应的控制步骤发生了改变, 但是在约化时间曲线上, R3 和D4理论线之间, 尚有多条动力学函数的理论线, 区别很小, 难以准确判断实验点究竟属于哪条理论线。 对于复相反应过程来说, 并非某一个动力学方程就可以完全描述, 不同的反应阶段可能需要不同的动力学表达式, 只有通过对不同阶段的动力学数据分析, 才有可能发现在

图4 约化时间曲线
Fig.4 Sharp curves of kinetic analysis
每个阶段起主要作用的动力学规律的踪迹, 寻找到不同阶段的主要控制因素。 因此, 需要进一步分析反应后期的动力学行为。
3.1.2 lnln分析法
约化时间图有几个缺点: 一是要匹配曲线; 二是关系式不是直线; 三是有些机理的关系式的数值相差不大, 难以区分, 此外, 还容易受到时间刻度误差的影响。 lnln分析法正好克服了这些缺点, 得到的图像是具有不同斜率的直线, 时间标度是取对数的形式, 通过作ln[-ln(1-α)]—lnt函数关系曲线, 每一个动力学函数的理论表达式都会得到具有不同斜率的直线。 将从lnln图中得到的直线斜率与已知的一些固体反应动力学函数的m值作比较, 由此可以推断最概然机理函数G(α)[12]。 凡是具有等动力学过程的反应, 则实验数据点都会落在一条直线上, 因此, 对实验数据进行进一步处理, 可以判断t/t0.5>1.5时动力学的规律。
从图5可以看出, 实验点的连线是一条折线, 按照lnln分析法可知, 如果反应遵守某一种动力学规律, 那么, 所有的实验点应该是一条直线, 即全部实验点应在AB线上或者在CD线上, 显然, 图5中所反应的规律并不是如此。 这个事实表明在反应过程的不同阶段具有不同的动力学规律, 因而在lnln图上表现出实验数据点的连线是折线而不是一条直线, 转折点前后, 过程由各自不同的动力学规律所控制。 对图5中AO、 OC两直线段作线性回归, 得到的斜率分别为1.07 (置信度99.9%)和0.57 (置信度97.3%), 对照各种动力学规律的斜率, 可以判断AO段受收缩球状模式(R3)的动力学控制, 在反应后期, OC段的斜率是0.57, 但斜率为0.57的动力学函数有两个, 即D2 和D4, 因为反应前期AO段可以肯定是受收缩球状模式(R3)的动力学规律控制, 因此, 可以推断OC段应该是受三维扩散D4控制, 而不是受二维扩散的D2模式所支配。
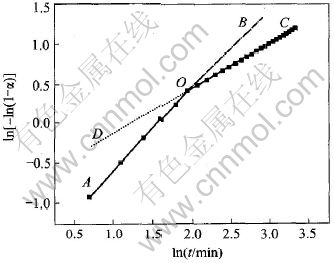
图5 动力学分析lnln图
Fig.5 Diagram of lnln method
对所有O线和N线重复上述分析过程所得的结论都是一致的, 即锌蒸气的氧化遵守多相反应的规律, 反应前期和后期分别由R3和D4模式控制, 结合产物的形态和SEM观察, 可以断定只有在反应体系中的锌蒸气中存在微粒的情况下, 才可能出现这种现象。 这个实验现象, 证实了作者以前的分析推测, 即在一定的温度和气相条件下, 锌蒸气中有凝聚生长的锌微粒形成[2]。
3.2 氧化动力学参数
根据图5中直线的转折点O所对应的时间, AO段按收缩球状函数作[1-(1-α)1/3]-t曲线, OC段按D4方程作[1-2α/3-(1-α)2/3]-t曲线(见图6), 按照两条直线的斜率, 可分别求出反应前期和后期的反应速度常数k1和k2。 从图6可以看出, 反应前期的线性关系良好, 而后期的线性关系略差于前期的, 其原因将在下节中分析。 按照上述方法得到的不同反应条件下的k1和k2值及线性拟合的相关度R列于表1。 图7和图8所示为由动力学曲线得到的Arrhenius关系lgk-1/T曲线, 按下列关系式:
![]()
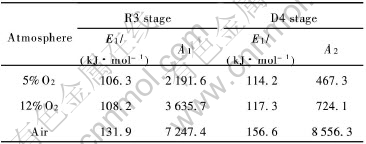
由直线的斜率求出活化能E, 再按式(4)关系式求出频率因子A, 为了便于比较, 直接用等高法求出F1、 F4直线段与F2、 F3线的平均活化能与频率因子, 作为E1和A1, 将F1、 F4停滞期的活化能与频率因子, 作为E2、 A2, 结果列于表2。
可见在相同温度下, 氧化气氛不同, 活化能E1和E2也不相同, 有如下的规律性, 随着氧化气氛O2含量的增高, 活化能E1和E2也同时增高, 并且O2含量为5%和12%的E1和E2彼此的差别不大, 约2~3kJ/mol, E1和E2之间的差别也不大, 约8~10kJ/mol, 但它们与空气气氛下的E1和E2的差别较大, 分别相差20~40kJ/mol, 并且, E1和E2之间的差别也增大到25kJ/mol。
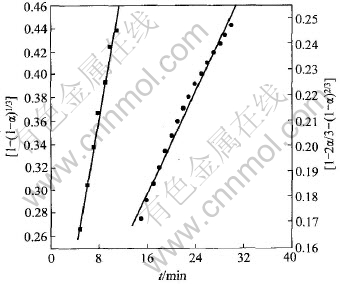
图6 动力学模式函数的斜率
Fig.6 Slope of lines corresponding to R3 and D4 model
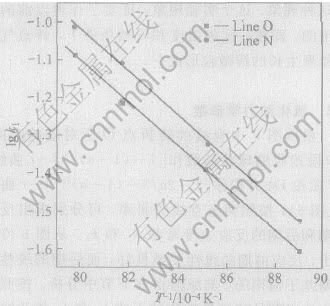
图7 反应前期的Arrhenius关系曲线
Fig.7 Arrhenius curves of early stage of reaction
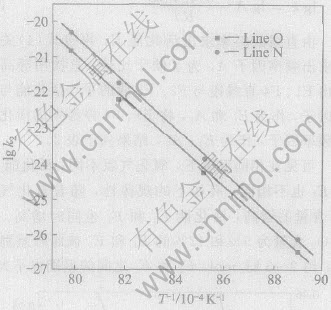
图8 反应后期的Arrhenius关系曲线
Fig.8 Arrhenius curves of late stage of reaction
3.3 金属微粒的氧化行为
锌蒸气在浓度较高时, 气态锌原子的由于布朗运动, 将会发生凝聚生长, 即在锌蒸气中同时存在气态的锌原子和凝聚生长成的锌微粒[2], 两者处于动态的平衡, 由于气态锌原子与O2的反应极快[13], 因此, 尽管在整个过程中都存在气态锌原子的氧化, 但它只会对表观的氧化速度有所贡献, 而不会影响控制步骤。
表1 不同氧化条件下得到的直线斜率
Table 1 Slope of linear fitting lines of experimental data
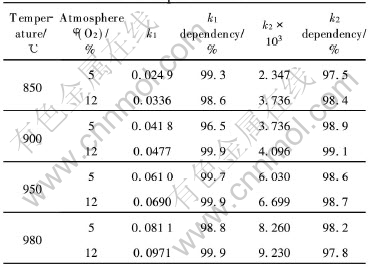
表2 不同条件下的动力学参数
Table 2 Kinetics parameters at different conditions
在反应前期, 锌蒸气中凝聚生成的细小颗粒, 新生成的表面具有较大的活性, O2分子在Zn颗粒表面被吸附, 进而发生Zn和O之间化学反应, 并在Zn颗粒表面发生ZnO非均匀成核, 因此, 这个阶段是结晶化学反应为限制环节, 即反应过程处于动力学控制区, 受收缩球状模式(R3)控制。 当进入反应后期, 由于ZnO在Zn颗粒表面的厚度增大, 加之ZnO层的致密性, 通过膜层的内扩散成为限制性环节, 反应进入到扩散控制区。 但由于整个氧化过程中都同时存在锌的蒸发—凝聚—氧化—结晶等几个过程, 因此, 在反应后期, 尽管多数的Zn颗粒表面形成了ZnO膜层, 反应属于扩散控制, 但与此同时, 仍然有新的Zn颗粒生成, 因此, 动力学控制的作用一直都存在, 只是由前期的主要控制步骤转变成一个次要的因素。 这也说明了前一节约化时间图和lnln的分析结果, 反应前期的线性关系很好, 说明受单独的动力学规律支配, 反应后期的线性关系稍差, 因为除了主要受扩散控制外, 动力学控制仍有轻微程度的影响, 结果使线性关系稍有偏离, 但却不能掩盖反应后期主要受扩散控制的规律。
由氧化动力学研究可知, 当氧化反应按三维扩散模式D4控制时, 动力学函数的速度常数k为[12]
![]()
式中 k为转化率表示的速度常数, 即表1中的k2; D为扩散速度常数, cm2/s; ρ0为氧化气氛中氧的浓度, g/cm3; r0为球形粒子的初始半径, cm; ρ为反应物粒子的密度, g/cm3。
假设一个四针状结晶体所含的全部锌都是由凝聚的锌微粒提供, 即不考虑气相沉积的部分, 就可得到锌蒸气中凝聚生长微粒的粒径r0。 为了计算简便, 针体部分按圆锥体, 中心体按正八面体计算,产物的平均针长l=80μm, 中心体边长a=5μm, 求得金属微粒的半径r=5μm, 再由气体成分和反应温度可知氧化气氛的密度ρ0, 因此, 按式(5)可以求得不同氧化条件下扩散控制步骤的扩散系数D, 列于表3。
表3 不同氧化条件下的扩散系数
Table 3 Diffusion coefficient of zinc at various conditions
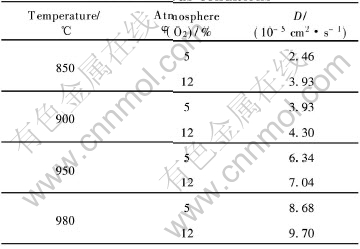
研究表明, 扩散速率与氧化物膜的结构有关, 锌氧化形成的保护膜是致密的。 此时, 气体O2向金属内部的扩散相当困难, 其扩散系数应该很小, 但计算得到的扩散系数却是很大的, 说明这个扩散系数主要是微粒内部的金属离子扩散[11]。 这就意味着锌微粒的氧化是按照Zn向外扩散的机制进行的。 Kitano等[7]把这个过程描述为: Zn2++2e+1/2O2→ ZnO, 据此, 推算了锌的扩散系数, D=(1.08~3.45)×10-4cm2/s, 该数据偏高, Kitano等[11]把此解释成是因为锌扩散时通过的“晶粒边界粗糙”[7]。 仔细分析其推算过程, 可以发现锌微粒直径是直接采用原料锌粉的直径, 这显然是错误的, 因为原料在此温度下已经熔化, 氧化过程不可能是对原料锌粉的直接氧化, 因此, 得到的扩散系数出现很大偏差。
Moore等[14]采用Zn65同位素蒸气通过氧化锌晶体扩散求得了锌的扩散系数为
D=1.3×10-5exp[-181.8±45.0/(RT)](6)
按式(6)计算, 在上述实验条件下, D=1.27cm2/s, 与本实验的数据非常接近。 从Moore等[14]的实验方法来看, 可以认为该数据有足够的可信度。
实验计算扩散系数的前提是四针状所包含的锌原子全部由锌微粒提供, 但是, 在金属蒸气中, 除了金属微粒外, 还存在气态的金属原子, 这一部分原子直接氧化成气态的ZnO分子再沉积在晶须表面。 如果按D=1.27cm2/s, 从式(5)可以求得实际形成的金属微粒的半径rp=3.5μm, 那么, 厚度为r-rp的球冠应是气相原子沉积所造成的, 因此, 半径为r的金属微粒中气相金属原子的质量分数wg=1-r3p/r3, 代入数据得wg=65%, 进而可以得到金属蒸气中凝聚微粒的质量分数为wg=35%, 在一定的条件下, 气相原子wg与凝聚微粒wp之间存在着动态平衡的关系, 正是这种动态平衡关系的存在, 才造成了氧化过程的不同氧化行为, 由此出现不同形貌的结晶产物。
4 结论
锌蒸气在不同温度气相成分和气体流量条件下, 具有不同的氧化动力学特征。 氧化动力学遵守直线规律时, 产物的结晶形貌为无定形、 颗粒状和单针状; 氧化动力学曲线为抛物线规律时, 产物的结晶形貌为四针状和多针状。
氧化动力学转变规律的原因是锌蒸气中存在超细锌微粒与气态锌原子动态的平衡。 在不同条件下, 锌蒸气的状态存在差异, 在较高和较低的反应温度和氧分压下, 锌蒸气不能发生金属微粒的凝聚生长, 氧化过程是气态锌原子直接与氧分子反应, 属于气相均相反应, 氧化速度取决于液态锌的挥发速度, 氧化过程表现出线性动力学的特征; 在适中和低的氧分压下, 锌蒸气中存在金属微粒的凝聚生长, 氧分子被吸附在颗粒的表面进而发生氧化反应, 氧化过程表现出多相反应动力学非线性的特点, 反应前期受R3动力学模式函数控制, 反应后期, 尽管还存在气态锌原子直接氧化反应, 但过程主要由D4扩散模式函数控制。 氧化过程的不同行为是产物产生不同结晶形貌的根本原因。
由动力学理论和实验数据得到了Zn的扩散系数为D=(2.46~9.70)×10-5cm2/s, 锌微粒的氧化过程实际是受Zn通过氧化膜层向外扩散的控制。
REFERENCES
[1]CHEN Yi-feng, TANG Mo-tang, YANG Sheng-hai, et al. Preparation of tetrapod-like ZnO whiskers from waste hot dipping zinc[J]. J Cent South Univ Tech-nol, 2004, 11(1): 51-54.
[2]陈艺锋, 唐谟堂, 张保平, 等. 气相氧化法制备氧化锌的结晶形貌研究[J].中国有色金属学报, 2004, 14(3): 504-508.
CHEN Yi-feng, TANG Mo-tang, ZHANG Bao-ping, et al. Crystal morphologies of ZnO obtained by oxidizing zinc vapor[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(3): 504-508.
[3]Suyama Y, Tomokiyo Y, Manabe T, et al. Shape and structure of zinc oxide particles prepared by vapor-phase oxidation of zinc vapor[J]. J Am Ceram Soc, 1988, 71: 381-383.
[4]Leung Y H, Djurisic A B, Gao J, et al. Changing the shape of ZnO nanostructures by controlling Zn vapor release: from tetrapod to bone-like nanorods[J]. Chemical Physics Letters, 2004, 385: 155-159.
[5]Park J, Choi H H, Siebein K, et al. Two-step evaporation process for formation of aligned zinc oxide nanowires[J]. J Cryst Growth, 2003, 258: 342-348.
[6]Hu J Q, Quan Li, Wong N B, et al. Synthesis of uniform hexagonal prismatic ZnO whiskers[J]. Chem Mater, 2002, 14: 1216-1219.
[7]WU Run, XIE Chang-sheng, XIA Hui, et al. The thermal physical formation of ZnO nanoparticles and their morphology[J]. J Crystal Growth, 2000, 217: 274.
[8]WANG Jin-min, GAO Lian. Synthesis of uniform rod-like, multi-pod-like ZnO whiskers and their photoluminescence properties[J]. J Crystal Growth, 2004, 262: 290-294.
[9]ZENG D W, XIE C S, ZHU B L, et al. Controlled growth of ZnO nanomaterials via doping Sb[J]. J Crystal Growth, 2004, 266: 511-518.
[10]YU W D, LI X M, GAO X D. Synthesis and structural characteristics of high-quality tetrapodlike ZnO nanocrystals on ZnO and NiO nanocrystal substrates[J]. J Crystal Growth, 2004, 270: 92-97.
[11]Kitano M, Hamabe T, Maeda S,et al. Growth of large tetrapod ZnO crystals(Ⅰ)[J]. J Crystal Growth, 1990, 102: 965-973.
[12]胡荣祖, 史启禎. 热分析动力学[M]. 北京: 科学出版社, 1985. 196.
HU Rong-zu, SHI Qi-zhen. Kinetics of Thermo-analysis[M]. Beijing: Science Press, 1985. 196.
[13]Chertihin G V, Andrews L. Reaction of laser-ablated Zn and Cd atoms with O2: infrared spectra of ZnO, OZnO, CdO and OCdO in solid argon[J]. J Chem Phys, 1997, 106(9): 3457-3465.
[14]Moore W J, Williams E L. Diffusion of zinc and oxygen in zinc oxide[A]. Crystal Imperfections and the Chemical Reactivity of Solids[C]. Scotland: The Aberdeen University Press Ltd, 1975. 86-93.
收稿日期: 2004-05-21; 修订日期: 2004-10-26
作者简介: 陈艺锋(1963-), 男, 副教授, 博士.
通讯作者: 陈艺锋, 博士; 电话: 0731-8830470; E-mail: yefengc63@sina.com


