文章编号:1004-0609(2011)12-3162-07
铬酸钠碱性液中加石灰除钒
赵东峰1, 2,田 侣1, 2,丁瑞锋1, 2,刘桂华1, 2,周秋生1, 2,李小斌1, 2,彭志宏1, 2
(1. 中南大学 冶金科学与工程学院,长沙 410083;
2. 中南大学 难冶有色金属资源高效利用国家工程实验室,长沙 410083)
摘 要:
通过计算反应Gibbs自由能和平衡溶解度对铬酸钠碱性液添加石灰除钒过程进行理论分析,结合红外光谱研究了含钒溶液的结构变化,研究添加石灰除钒时各因素的影响规律。结果表明:在298~373 K的范围内,体系中各离子与氧化钙生成相应钙盐的反应自由能绝对值由大到小的顺序为VO3-、CO32-、SO42-、VO43-、CrO42-;同时,各钙盐间可能存在相互转化,溶液中CO32-能分解CaCrO4和Ca3(VO4)2等钙盐,VO43-能分解CaCrO4。除钒过程中除生成Ca3(VO4)2和Ca2V2O7外,还能生成CaCO3、CaCrO4、CaSO4·nH2O等化合物,这是由于石灰加入量过多所致。溶液结构分析结果表明:随着pH值从13降到9左右,钒酸根由VO43-转化成VO43-和V2O74-共存的结构。除钒实验结果表明:提高溶液pH值、增大n(CaO)/n(V2O5)或加入高活性石灰乳均可提高除钒率,而溶液中CO32-的存在明显降低除钒率;加入理论用量3倍的石灰,溶液pH值降至10左右时,除钒率可达到85%,相对于工业除钒过程钒渣量减少88%左右。
关键词:
中图分类号:TF791 文献标志码:A
Vanadate removal from alkaline sodium chromate solution by adding lime
ZHAO Dong-feng1, 2, TIAN Lü1, 2, DING Rui-feng1, 2, LIU Gui-hua1, 2,
ZHOU Qiu-sheng1, 2, LI Xiao-bin1, 2, PENG Zhi-hong1, 2
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;
2. National Engineering Laboratory for Efficient Utilization of Refractory Nonferrous Metals Resources,
Central South University, Changsha 410083, China)
Abstract: The removal of vanadium from the alkaline sodium chromate solution with addition of lime was investigated based on the calculation of reaction Gibbs free energy and equilibrium solubility, and the removal rule of vanadate, as well as the structure of vanadate, was also studied by experiments. The thermodynamic calculation indicates that VO3-, CO32-, SO42-, VO43- and CrO42- can sequentially be precipitated by formation of compound containing calcium at 298-373 K. Meanwhile, the mutual transformation occurs between calcium salts. Ca3(VO4)2 and CaCrO4 can react with CO32-, and CaCrO4 can convert to Ca3(VO4)2 in the existence of VO43-. In addition, the formation of CaCO3, CaCrO4, CaSO4·nH2O as well as Ca3(VO4)2, Ca2V2O7 may account for the excess lime in the removal of vanadium. The structural studies with IR spectra on the pure vanadate solution indicate that some VO43- convert to V2O74- at pH decreasing from about 13 to 9. Experiment results show that increasing the solution pH value and the n(CaO)/n(V2O5) or adding active lime slurry can improve the removal rate of vanadium, but the presence of CO32- is unfavorable to the vanadate removal. The vanadate removal rate can reach 85% and the vanadium residue can be reduced by 88% with 3 times the amount of the theoretical lime required at pH of 10.
Key words: sodium chromate solution; lime; vanadate removal; Gibbs free energy; equilibrium solubility
我国是铬盐生产大国,产量占世界总产量的35%以上。目前,铬铁矿无钙焙烧法是铬盐生产技术发展的趋势。采用无钙焙烧生产工艺时,铬铁矿中钒矿物可生成可溶性的钒酸钠,在熟料浸出时钒酸钠随铬酸钠一并进入溶液中,造成铬酸钠碱性溶液(以Na2Cr2O7·2H2O计,浓度约300 g/L)中钒浓度(以V2O5计)达到1 g/L。若不除钒,将导致铬盐产品颜色发生变化,同时使铬盐的使用性能(如电镀、催化剂等)明显恶化[1-2],因此除钒已成为无钙法铬盐生产中必需的工序。
溶液中分离钒常用的的方法有离子交换法、溶剂萃取法、沉淀法等。ZENG等[3]采用弱碱性阴离子交换树脂D314从石煤硫酸浸出液中提取了钒,产品V2O5纯度在99%以上;采用胺类萃取剂、酸性或螯合萃取剂(如D2EHPA/TBP[4]、LIX 63[5]、PRIMENE 81R和ALAMINE 336[6-7]等)也能有效地从溶液中分离、富集钒,离子交换法和溶剂萃取法适用于酸性液(或弱碱性液)体系中,但如应用在近中性(pH为6~8)除铝后的高浓度铬酸钠溶液中,将因溶液中存在一定量重铬酸盐而导致有机物易被氧化而失效,并污染铬盐。孙健程等[8]采用化学沉淀法对碱性体系中铝-钒-钼的分离技术进行了研究,提出在碱性V-H2O体系中,加入CaO、CaCl2等沉淀除钒的技术方案,但CaCl2中Cl-与Cr2O74-反应而不能加入。目前,CaO沉淀法除钒是铬盐生产初步应用的方法,但主要问题是:1) 适用于强碱性溶液(pH>12),因而在中性液(pH为7)中加苛性碱调高pH,将排出更多的硫酸钠;2) 石灰加入量大(理论量十倍以上,即n(CaO)/n(V2O5)>30)[9-10],渣量大,造成铬酸钠附损多(>20%),且环境问题严重。针对上述问题,急需对高浓度铬酸钠溶液中钒酸根离子的结构及反应规律进行研究,为简化工艺、显著减少石灰加入量和资源化利用钒渣提供理论依据。
1 实验
1.1 实验原料
重铬酸钠、氢氧化钠、无水碳酸钠(西陇化工股份有限公司);偏钒酸钠(成都科龙化工试剂厂);氢氧化钙(科密欧化学试剂有限公司);硫酸(衡阳市凯信化工试剂有限公司)。上述试剂和检测用试剂均为分析纯,水为去离子水。
1.2 实验步骤
以重铬酸钠和氢氧化钠配置所需浓度的铬酸钠溶液(如无具体说明,本研究中的溶液及渣中铬均以Na2Cr2O7·2H2O计,钒以V2O5计),加入一定量的NaVO3·2H2O和无水碳酸钠等来模拟工业上含钒的铬酸钠溶液。
实验步骤是:在钢弹中加入一定量的氧化钙(分析纯氢氧化钙经850 ℃煅烧2.5 h)或石灰乳,并加入一定体积已知pH值的铬酸钠溶液,密封后放入DY-8低压反应群釜 (釜内加热介质为甘油,控温精度为 ±1 ℃,中南大学机械厂生产)中反应30 min后取出钢弹,抽滤。滤液稀释、定容后分析其中钒含量;滤饼用去离子水洗涤3次,经105 ℃烘干、称取质量并分析除钒渣中铬含量。
1.3 分析方法
溶液和固体中钒含量按钽试剂萃取光度法分 析[11](紫外可见分光光度计,上海光谱仪器有限公司生产),采用pH/mV Meter(上海理达仪器厂生产)测定溶液的pH值,不同pH值下钒的存在形式由傅里叶红外光谱仪(NICOLET 6700 FT-IR,美国Nicolet公司生产)分析确定,滤渣的物相组成由X射线衍射(D/MAX-RA,日本理学公司生产)分析确定。
2 结果与分析
2.1 添加石灰除钒的热力学分析
字典 - 查看字典详细内容
2.1.1 除钒过程可能发生的化学反应
采用无钙焙烧工艺时,工业生产中铬酸钠碱性液体系复杂,不仅铬酸钠浓度高(260~330g/L),而且含有碳酸钠(约20 g/L)、游离碱(约10 g/L)、钒酸钠(<1 g/L)及硫酸钠(>40 g/L)等物质。在pH>8时,铬酸钠溶液主要以CrO42-形式存在,因而采用钒酸钙沉淀法除钒时,均生成相应的钙盐,化学反应方程式如表1所列。
2.1.2 除钒过程热力学分析
铬酸钠碱性液加钙除钒过程涉及到离子反应,反应吉布斯自由能(![]() )计算采用公式:
)计算采用公式:
![]()
![]() (1)
(1)
式中:![]() 为298 K下反应吉布斯自由能;
为298 K下反应吉布斯自由能;![]() 为298 K下反应熵变;
为298 K下反应熵变;![]() 为等压热容差。
为等压热容差。
参与反应的各物质热力学数据见有关文献[12]及热力学数据手册[13-14]。确定有离子参与反应的![]()
时,![]() 以在298 K和T之间的平均值
以在298 K和T之间的平均值![]() 代入式(1)后进行积分来近似求解[15]。其中离子形态的反应组分
代入式(1)后进行积分来近似求解[15]。其中离子形态的反应组分![]() 根据下式计算:
根据下式计算:
![]() (2)
(2)
式中:![]() 和
和![]() 为T温度下离子的热容常数;
为T温度下离子的热容常数;![]()
为298 K和T之间i离子的热容平均值;![]() 为i离子在298 K时的标准绝对值。
为i离子在298 K时的标准绝对值。
由此计算式(1)~(9)在298~373 K下![]() —T关系式(表1),并绘制各反应
—T关系式(表1),并绘制各反应![]() —T关系,如图1和2所示。
—T关系,如图1和2所示。
表1 除钒过程中的化学反应及反应吉布斯自由能变化与温度的关系
Table 1 Possible chemical reactions in removal of vanadium and corresponding ![]() —T relationships
—T relationships


图1 表1中反应(1)~(5)的反应吉布斯自由能与温度的关系
Fig.1 Relationship between Gibbs free energy and temperature of reactions (1)-(5) shown in Table 1
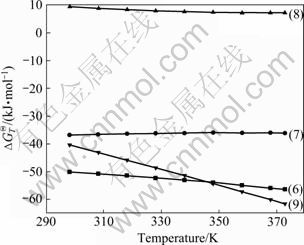
图2 表1中反应(6)~(9)的反应吉布斯自由能与温度的关系
Fig.2 Relationship between Gibbs free energy and temperature of reactions (6)-(9) shown in Table 1
由图1和2可看出,在298~373 K时,上述反应除反应式(8)偏钒酸钙与碳酸钠反应的吉布斯自由能大于零外,其余的化学反应自由能小于零,在热力学上均能发生,但反应吉布斯自由能随温度的变化趋势不同。图1中各种离子与氧化钙反应生成相应钙盐反应自由能绝对值由大到小的顺序为VO3-、CO32-、SO42-、VO43-、CrO42-。反应式(1)和(5)随温度的升高,![]() 变大,说明高温不利于CaCrO4和CaSO4的生成。各钙盐间的相互反应规律如图2所示。其中反应式(6)、(7)和(9)在298 K到373 K之间的
变大,说明高温不利于CaCrO4和CaSO4的生成。各钙盐间的相互反应规律如图2所示。其中反应式(6)、(7)和(9)在298 K到373 K之间的![]() 值较负,各转化反应在热力学上能进行,即溶液中CO32-能分解Ca3(VO4)2和CaCrO4,同时CaCrO4也可被VO43-分解。
值较负,各转化反应在热力学上能进行,即溶液中CO32-能分解Ca3(VO4)2和CaCrO4,同时CaCrO4也可被VO43-分解。
2.1.3 含钙化合物溶解度理论分析
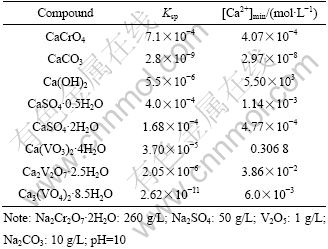
由钒酸钙的溶解度数据[16]计算得出体系中难溶物质在25 ℃溶度积(Ksp)列于表2,结合常见的工业溶液组成,在以浓度代替活度的条件下计算生成相应沉淀所需最小钙离子浓度值[Ca2+]min如表2所列。
以CaCrO4为例计算如下:
CaCrO4 ![]() CrO42- + Ca2+
CrO42- + Ca2+
[Ca2+]=Ksp/[CrO42-]
从溶度积大小比较来看,体系中沉淀生成的优先顺序依次为Ca3(VO4)2·8.5H2O、CaCO3、Ca2V2O7·2.5H2O、Ca(OH)2、Ca(VO3)2·4H2O、CaSO4·2H2O、CaSO4· 0.5H2O、CaCrO4。其中,正钒酸钙最易生成,焦钒酸钙次之,偏钒酸钙最难。根据生产实际中溶液组成,由此计算了生成相应钙盐沉淀时所需的最小钙离子浓度,计算结果(见表2)表明:体系中沉淀生成的优先顺序依次为CaCO3、CaCrO4、CaSO4·2H2O、CaSO4·0.5H2O、Ca3(VO4)2·8.5H2O、Ca2V2O7·2.5H2O、Ca(VO3)2·4H2O、Ca(OH)2。上述两种结果顺序不同,主要原因是溶液中铬酸钠、硫酸钠浓度高,而钒酸盐浓度低所致。在石灰过量的条件下,除钒渣应是混合渣,包含表2中的各种钙盐,这是工业上除钒需加过量石灰的主要原因。
表2 难溶物质溶度积及生成钙盐沉淀所需最小钙离子浓度值[Ca2+]min
Table 2 Solubility product of insoluble substances and minimal calcium concentration required for formation of calcium salts at 25 ℃
2.2 结果及分析
2.2.1 钒在溶液中的存在形式
钒在溶液中的存在形式随着溶液pH值及钒浓度的改变而改变,其初步变化规律已有研究[17],但在不同pH值的变化规律和铬酸钠体系中的变化特征尚无详细研究。本研究的纯偏钒酸钠(ρ(V2O5)=50g/L)在不同pH值的红外光谱图如图3所示。由图3可看出,当pH值为13.53时,有856 cm-1和711 cm-1两处特征峰,分属VO43-中V—O键的振动吸收峰和V2O74-中VO2和VO3的弯曲振动峰[18];随pH值的降低,711 cm-1处的峰向低波数处移动,当pH值为11.10时,711 cm-1处的峰移至686 cm-1处,并新增479 cm-1特征峰,479 cm-1处峰是V2O74-的V—O键键角的变形振动峰[19];当pH值继续下降到9.76时,856 cm-1处的特征峰消失,而在929 cm-1处出现一新特征峰,经实验验证,该峰随pH值的降低将继续向更高波数处转移(当pH值为3.80时,吸收峰出现在966 cm-1处)。929~1 007 cm-1的峰是V2O74-中VO2和VO3的对称振动峰;686 cm-1处峰随pH值的降低继续向更低波数处移动。628~665 cm-1处峰是由V2O74-结构中单一(VO3)n链或(VO3)n链与V—O—V的协同振动所引起[20-21]。

图3 纯NaVO3在不同pH值下的红外光谱
Fig.3 IR spectra of pure NaVO3 at different pH values (V2O5: 50 g/L): 1—pH=13.53; 2—pH=11.10; 3—pH=9.76; 4—pH= 7.56; 5—pH=3.80
综上所述,在pH>9的铬酸钠溶液里,钒主要以单核正四面体结构的正钒酸VO43-及四面体结构的焦钒酸V2O74-存在;当pH值下降到9左右时,V2O74-缩合成四聚体的偏钒酸根[22],并随pH的降低将进一步聚合成更为复杂的钒酸根离子。结合理论分析结 果,若在pH>9时,以石灰除钒可能生成Ca3(VO4)2和Ca2V2O7沉淀。
2.2.2 铬酸钠溶液pH值对除钒效果的影响
目前,铬酸钠碱性液经中和至pH约7后,加苛性碱调pH至12左右,再加石灰除钒。钒溶液结构研究结果表明,溶液pH降至9左右可满足钒酸钙的生成,也能达到除钒目标。铬酸钠溶液pH值对加石灰除钒效果的影响规律如表3所列。
表3 铬酸钠溶液pH值对除钒效果的影响
Table 3 Effect of solution pH value on vanadium removal rate
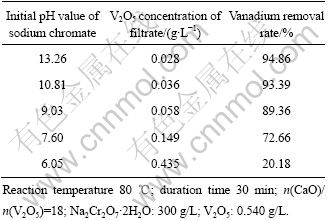
表3结果表明:铬酸钠溶液pH由13.26降至6.05,溶液除钒率由94.86%减至20.18%,说明碱性环境利于氧化钙沉淀法除钒,即使在pH为9的情况下脱钒率亦接近90%。这主要是因为在碱性溶液里,钒主要以VO43-及V2O74-离子存在,易于生成溶度积较小的Ca3(VO4)2和Ca2V2O7沉淀,因此利于除钒。考虑生产实际情况,本研究选取pH值为10进行除钒实验研究。
2.2.3 n(CaO)/n(V2O5)对除钒效果的影响
针对钙盐沉淀法除钒工业应用中氧化钙加入量大的问题,本文作者研究了氧化钙加入量对除钒效果的影响,其实验结果如表4所列。
由表4得出,当n(CaO)/n(V2O5)=18时,溶液中钒含量可脱除至0.042 g/L,基本上可以满足铬盐生产要求。此时,氧化钙加入量为反应液中钒酸钠生成Ca3(VO4)2的6倍理论用量,对比工业条件下加石灰除钒,除钒渣量可减少78%。
表4 n(CaO)/n(V2O5)对除钒效果的影响
Table 4 Effect of n(CaO)/n(V2O5) on vanadium removal rate

2.2.4 氧化钙加入方式对除钒效果的影响
工业生产中常加入石灰乳,而不是加入石灰。本文作者在铬酸钠溶液中加石灰和添加剂制得的高活性石灰乳。石灰和石灰乳对除钒效果的影响如图4所示。
由图4可以看出,在含钒铬酸钠溶液中加入高活性石灰乳,除钒率随溶液pH值的升高而增大(同加入氧化钙除钒规律一致)。pH=10时,n(CaO)/n(V2O5)在9左右(生成Ca3(VO4)2的3倍理论量)时,除钒率可达85%,远高于相同pH值下加氧化钙除钒时的除钒率。因而,加入高活性石灰乳可显著地减少石灰加入量。对比工业条件,石灰加入量减少了85%,渣量减少了88%。
2.2.5 CO32-浓度对除钒效果的影响
在无钙焙烧铬铁矿生产铬酸钠工艺中,纯碱转化率一般小于95%。理论研究结果表明,CO32-的存在将影响石灰除钒效果,本文作者探究了CO32-对体系加氧化钙除钒效果的影响,其结果如图5所示。
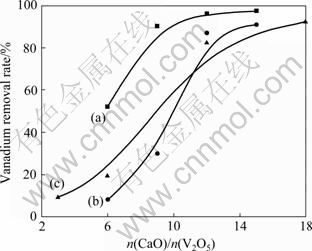
图4 不同pH值及氧化钙加入方式对除钒效果的影响
Fig.4 Effect of solution pH value and method of adding calcium oxide on vanadium removal rate: (a) pH=10, adding lime slurry; (b) pH=8, adding lime slurry; (c) pH=10, adding lime powder

图5 CO32-浓度对除钒率的影响
Fig.5 Effect of CO32- concentration on vanadium removal rate (Reaction temperature 80 ℃, duration time 30 min, n(CaO)/n(V2O5)=18, pH=10.00; Na2Cr2O7.2H2O: 300 g/L; Na2SO4: 100 g/L; V2O5: 0.50 g/L)
由图5可知,随着体系中CO32-浓度的增加,除钒率急速降低,说明氧化钙水化后优先与CO32-生成沉淀,结果与热力学分析一致。因此,当体系中含有CO32-时,氧化钙加入量应考虑碳酸钠消耗的部分,这是脱钒过程氧化钙需过量的一个重要原因。
2.2.6 除钒渣物相组成分析
图6所示为pH=10的不同组成反应液与氧化钙在80℃反应30min所得滤渣的XRD谱。
图6中,在纯钒酸钠溶液中加入氧化钙可生成钙的钒酸盐,如图6(b)所示;在CO32-存在的铬酸钠溶液中加入氧化钙能生成碳酸钙和铬酸钙,如图6(a)所示;在氧化钙过量的条件下,从含钒的铬酸钠溶液中得到的除钒渣应是混合渣,包含各种钙盐,如图6(c)所示。根据除钒渣的XRD谱可以确定,除钒渣为CaCO3、Ca(OH)2、Ca5(CrO4)3(OH)、Ca0.5V3O5[23]、 CaV3O7和Ca2V2O7等钙盐的混合物。但结合铬盐生产现状,在本研究条件下加入石灰除钒将显著减少渣,提高钒渣中钒含量,有利于钒渣铬钒分离、资源化利用,实现清洁化生产。

图6 溶液反应渣的XRD谱
Fig.6 XRD patterns of solution reaction residue: (a) Sodium chromate solution (Na2Cr2O7.2H2O: 300 g/L, ρ(Na2CO3)<5 g/L); (b) Pure NaVO3 solution (V2O5: 1 g/L); (c) Sodium chromate solution containing vanadium (Na2Cr2O7.2H2O: 300 g/L, V2O5: 1 g/L, Na2CO3: 1.41 g/L)
3 结论
1) 在298~373 K的温度范围内,铬酸钠溶液脱钒体系中各离子与氧化钙生成相应钙盐反应自由能绝对值由大到小的顺序为VO3-、CO32-、SO42-、VO43-、CrO42-;同时,各钙盐间可能存在相互转化。生产实践过程除钒渣是CaCO3、Ca(OH)2、CaCrO4、CaSO4·nH2O、Ca3(VO4)2等钙盐混合物,大量非钒酸钙盐的大量生成是石灰过量的原因。
2) pH大于9的铬酸钠溶液中,钒主要以VO43-及V2O74-离子形式存在;当pH值下降到9左右时,V2O74-缩合成四聚体的偏钒酸盐,并随pH值的降低进一步聚合成更为复杂的钒酸根离子,除钒应在pH>9条件下进行。
3) 含钒铬酸钠溶液除钒时,其pH值可以从大于12降至9左右。提高溶液pH值、增大n(CaO)/n(V2O5)或加入高活性石灰乳均可提高除钒率;而溶液中CO32-的存在不利于脱钒。pH值在10左右,加入6倍理论量石灰或3倍理论用量的高活性石灰乳,除钒率达85%,除钒渣量相应减少78%和88%。
REFERENCES
[1] 丁 翼. 铬化合物生产与应用[M]. 北京: 化学工业出版社, 2003: 86.
DING Yi. Production and application of chromium compound[M]. Beijing: Chemical Industry Press, 2003: 86.
[2] 冯其明, 何东升, 张国范, 欧乐明, 卢毅屏.石煤提钒过程中钒氧化和转化对钒浸出的影响[J]. 中国有色金属学报, 2007, 17(8): 1348-1352.
FENG Qi-ming, HE Dong-sheng, ZHANG Guo-fan, OU Le-ming, LU Yi-ping. Effect of vanadium oxidation and coversion on vanadium leaching in extraction process of vanadium from stone coal[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(8): 1348-1352.
[3] ZENG Li, LI Qing-gang, XIAO Lian-sheng. Extraction of vanadium from the leach solution of stone coal using ion exchange resin[J]. Hydrometallurgy, 2009, 97: 194-197.
[4] LI Xing-bin, WEI Chang, DENG Zhi-gan, LI Min-ting, LI Cun-xiong, FAN Gang. Selective solvent extraction of vanadium over iron from a stone coal/black shale acid leach solution by D2EHPA/TBP[J]. Hydrometallurgy, 2011, 105: 359-363.
[5] ZHANG P W, INOUE K, YOSHIZUKA K, TSUYAMA H. Extraction and selective stripping of molybdenum(VI) and vanadium(Ⅳ) from sulfuric acid solution containing aluminum(Ⅲ), cobalt(Ⅱ), nickel(Ⅱ) and iron(Ⅱ) by LIX 63 in Exxsol D80[J]. Hydrometallurgy, 1996, 41: 45-53.
[6] LOZANO L J, GODINEZ C. Comparative study of solvent extraction of vanadium from sulphate solutions by Primene 81R and Alamine 336[J]. Minerals Engineering, 2003, 16: 291-294.
[7] EI-NADI Y A, AWWAD N S, NAYI A A. A comparative study of vanadium extraction by Aliquat-336 from acidic and alkaline media with application to spent catalyst[J]. Int J Miner Process, 2009, 90: 115-120.
[8] 孙健程, 冯其明, 陈 云. 碱性体系中铝-钒-钼分离技术研究[J]. 稀有金属与硬质合金, 2008, 36(3): 19-23.
SUN Jian-cheng, FENG Qi-ming, CHEN Yun. Study on separation of Al-V-Mo from alkali system[J]. Rare Metals and Cemented Carbides, 2008, 36(3): 19-23.
[9] LONHOFF N, SPRECKELMEYER B, BLOCK H D, WEBER R. Process for the production of sodium dichromate. US 5250274[P]. 1993-10-05.
[10] WEBER R, BLOCK H D, BATZ M, HALSTENBERG J, LUMM M, ROTH R L, MERRE D V D. Process for the utilization of vanadium from chromium ore as vanadium (Ⅴ) oxide. US 7157063 B2[P]. 2007-01-02.
[11] 韦筱香, 余莉莉. 钽试剂萃取光度法测定合金钢中微量钒含量[J]. 化学工程与装备, 2010(3): 148-149.
WEI Xiao-xiang, YU Li-li. Tantalum extraction photometric was employed to determine trace vanadium in alloy steel[J]. Chemical Engineering and Equipment, 2010(3): 148-149.
[12] LEE Y M, NASSARALLA C L. Standard free energy of formation of calcium chromate[J]. Materials Science and Engineering A, 2006, 437: 334-339.
[13] 姚允斌, 解 涛, 高英敏. 物理化学手册[M]. 上海: 上海科学技术出版社, 1985: 838-912.
YAO Yun-bin, XIE Tao, GAO Ying-min. Handbook of physical chemistry[M]. Shanghai: Shanghai Science and Technology Press, 1985: 838-912.
[14] 叶大伦, 胡建华. 实用无机物热力学数据手册[M]. 北京: 冶金工业出版社, 2008: 207-249.
YE Da-lun, HU Jian-hua. Thermodynamic data of practical inorganic substance[M]. Beijing: Metallurgical Industry Press, 2008: 207-249.
[15] 傅崇说. 有色冶金原理[M]. 北京: 冶金工业出版社, 1984: 157-177.
FU Chong-yue. Principle of non-ferrous metallurgy[M]. Beijing: Metallurgical Industry Press, 1984: 157-177.
[16] 李国良. 钙的钒酸盐[J]. 国外钒钛, 1979(11): 35-45.
LI Guo-liang. Calcium vanadium salts[J]. Foreign Vanadium and Titanium, 1979(11): 35-45.
[17] CLARK R J H, BROWN D. The chemistry of vanadium, niobium and tantalum[M]. Oxford: Pergamon Press, 1975.
[18] HAYAKAWA S, YOKO T, SAKKA S. IR and NMR structural studies on lead vanadate glasses[J]. Journal of Non-Crystalline Solids, 1995, 183: 73-84.
[19] RADA S, NEUMANN M, CULEA E. Experimental and theoretical investigations on the structure of the lead-vanadate-tellurate unconventional glasses[J]. Solid State Ionics, 2010, 181: 1164-1169.
[20] SADDEEK Y B, SHAABAN E R, ALY K A, SAYED I M. Characterization of some lead vanadate glasses[J]. Journal of Alloys and Compounds, 2009, 478: 447-452.
[21] 谢勇平. 掺质Ca3(VO4)2晶体生长与光谱性质的研究[D]. 福州: 福州大学, 2004: 10-12.
XIE Yong-ping. The investigation of the growth and spectral properties about Ca3(VO4)2[D]. Fuzhou: Fuzhou University, 2004: 10-12.
[22] 廖世明,柏谈论. 国外钒冶金[M]. 北京: 冶金工业出版社, 1985: 62.
LIAO Shi-ming, BO Tan-lun. Foreign vanadium metallurgy[M]. Beijing: Metallurgical Industry Press, 1985: 62.
[23] JOUANNEAU S, VERBAERE A, GUYOMARD D. On a new calcium vanadate: synthesis, structure and Li insertion behavior[J]. Journal of Solid State Chemistry, 2003, 172: 116-122.
(编辑 李艳红)
基金项目:湖南省科技重大专项资助(2009FJ1009)
收稿日期:2010-12-09;修订日期:2011-05-19
通信作者:周秋生,副教授,博士;电话:0731-88830453;E-mail: qszhou@csu.edu.cn
摘 要:通过计算反应Gibbs自由能和平衡溶解度对铬酸钠碱性液添加石灰除钒过程进行理论分析,结合红外光谱研究了含钒溶液的结构变化,研究添加石灰除钒时各因素的影响规律。结果表明:在298~373 K的范围内,体系中各离子与氧化钙生成相应钙盐的反应自由能绝对值由大到小的顺序为VO3-、CO32-、SO42-、VO43-、CrO42-;同时,各钙盐间可能存在相互转化,溶液中CO32-能分解CaCrO4和Ca3(VO4)2等钙盐,VO43-能分解CaCrO4。除钒过程中除生成Ca3(VO4)2和Ca2V2O7外,还能生成CaCO3、CaCrO4、CaSO4·nH2O等化合物,这是由于石灰加入量过多所致。溶液结构分析结果表明:随着pH值从13降到9左右,钒酸根由VO43-转化成VO43-和V2O74-共存的结构。除钒实验结果表明:提高溶液pH值、增大n(CaO)/n(V2O5)或加入高活性石灰乳均可提高除钒率,而溶液中CO32-的存在明显降低除钒率;加入理论用量3倍的石灰,溶液pH值降至10左右时,除钒率可达到85%,相对于工业除钒过程钒渣量减少88%左右。


