中国有色金属学报 2004,(12),2137-2143 DOI:10.19476/j.ysxb.1004.0609.2004.12.028
自蔓延冶金法制备硼粉
摘 要:
提出了自蔓延冶金法制备硼粉的新工艺 ,由计算可知 ,B2 O3 Mg反应体系的绝热温度为 2 6 0 4K ,大于自蔓延判据温度 180 0K ,故采用自蔓延反应是可行的。分析了添加剂MgO和预热温度对反应体系绝热温度的影响 ,并对B2 O3 Mg体系的相关反应热力学数据进行了分析。由DTA分析可知 ,B2 O3 Mg反应体系在 112 3~12 0 3K时的放热峰表观活化能为 90 3.75kJ/mol,反应级数为 1。由XRD分析确定了燃烧产物以及各个阶段的浸出产物相组成 ,证实了三步浸出方案的可行性。考察了自蔓延反应初始条件对硼粉纯度的影响 ,硼粉纯度可达92 .4 3% ,平均粒度为 0 .5~ 0 .8μm。
关键词:
中图分类号: TF123.121
作者简介:豆志河(1978),男,博士研究生.;张廷安,教授;电话:02483687732;Email:zta2000@163.net;
收稿日期:2004-05-13
基金:辽宁省博士启动基金资助项目 ( 9910 3 0 0 40 2 );辽宁省重点学科带头人培养计划资助项目 ( 2 0 0 11712 42 0 6);
Preparation of boron powder by self-propagating high temperature synthesis metallurgy
Abstract:
The new self-propagating high temperature synthesis(SHS) metallurgy method used to prepare boron powder was studied, and the adiabatic temperature is 2 604 K through calculating, which is higher than the SHS criterion parameter of 1 800 K. So the SHS reaction is feasible. Influences of addition MgO and warm-up temperature on adiabatic temperature and the thermodynamic data of correlative reactions were analysed. Results of DTA indicate that the apparent activation energy of exothermic peak is 903.75 kJ/mol and reaction order n is 1. Phases of combustion and leached products were confirmed by XRD, which proves that the three-step leaching technic is feasible. The effects of the initial conditions of self-propagating high temperature synthesis on boron purity were studied. The purity of boron powders reach 92.43% and the average diameter of boron powders is (0.50.8 μm.)
Keyword:
self-propagating high temperature synthesis; adiabatic temperature; amorphous boron;
Received: 2004-05-13
随着科技的发展, 对无机硼粉的消耗越来越大。 而传统的制备无定形硼粉的方法, 如熔盐电解法、 乙硼烷裂解法、 卤化硼氢气还原法和金属镁热还原法等已无法满足现代科学发展对硼粉的大量需求
1热力学和动力学分析
将SHS技术与传统镁热还原法生产硼粉相结合, 提出了自蔓延冶金法制备硼粉的新工艺, 优化了硼粉的制备过程。 其化学反应方程式为: B2O3+3Mg=2B+3MgO。
1.1 绝热温度的计算
绝热温度(Tad)
A(s)+B(s)→AB(s)+ΔH (1)
以体系的焓作为状态函数, 反应放热量为:
ΔH=ΔH?+∫
式中 ΔH?为产物在298 K的标准生成焓; ΔCp为产物的热容。
当绝热时, 体系的热效应为ΔH=0, 则绝热温度Tad可根据式(2)进行计算。
反应式为
3Mg+B2O3=2B+3MgO (3)
ΔH?=-530.95 kJ/mol
ΔH?=∫
解其式得Tad=2 604 K, 且如此高的绝热温度说明该反应易于进行。
利用SHS反应的某产物相作为稀释剂加到原始混料中, 可以降低反应体系的绝热温度Tad。 图1所示为稀释剂MgO的添加量(n1(MgO))与生成量(n2(MgO))的摩尔比对绝热温度Tad的影响关系
1.2 相关反应的热力学分析
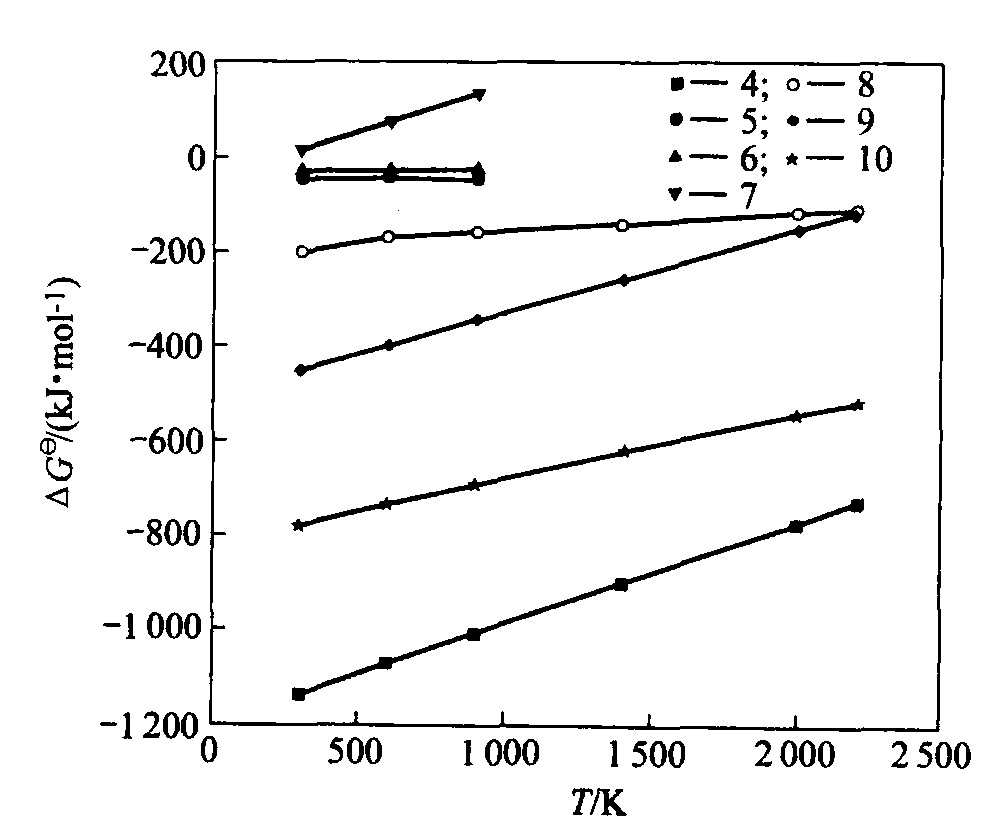
标态下的吉布斯自由能基本上体现了反应的可能性和反应趋势, 与B2O3-Mg体系有关的反应如式(4)~(10)所列, 其对应的吉布斯自由能与温度关系曲线
2Mg(s)+O2=2MgO(s) (4)
Mg(g)+2B(s)=MgB2(s) (5)
Mg(s)+4B(s)=MgB4(s) (6)
3Mg(s)+N2=Mg3N2 (7)
3Mg(s)+B2O3=2B(s)+3MgO(s) (8)
2B+N2=2BN(s) (9)
4B+3O2=2B2O3 (10)
由上述反应式可知: 1) 以金属镁作还原剂, 以B2O3为原料, 当温度低于1 000 K时, 其标态下的反应吉布斯自由能较负, 有利于反应进行, 产物主相为硼和MgO; 2)由于镁和硼易与氧气反应, 且BN和Mg3N2的吉布斯自由能较小, 形成趋势大, 故反应不能在空气介质中进行, 在配料时应注意原料的配比。
图1 MgO的添加量与生成量的摩尔比对绝热温度的影响
Fig.1 Effect of molar ratio of additive MgO and MgO product on Tad
图2 吉布斯自由能图
Fig.2 ΔG? curves of correlative reactions
1.3 动力学分析
图3所示为Mg-B2O3反应体系的差热曲线。 923 K附近有明显的吸热峰, 1 123 K附近有明显的放热峰。 吸热峰(峰值为923 K)为镁熔化吸热的结果; 1 123~1 203 K之间的放热峰表示镁和B2O3置换反应, 反应机制为液-液反应
运用Freeman-Carroll微分法
图3 B2O3+Mg体系的DTA曲线
Fig.3 DTA curve of B2O3-Mg system
2实验
将镁(分析纯, 质量分数大于98.5%), B2O3(分析纯, 质量分数大于98%)以及添加剂按化学计量比混合均匀, 压制成直径为15 mm, 高度为2 cm的柱状压坯。 氩气保护下分别采用点火模式和热爆模式进行自蔓延反应, 反应后继续通氩气冷却至室温。 用一定浓度的盐酸和NaOH溶液, 采用酸浸→碱浸→二次酸浸的三步浸出流程浸出燃烧产物。 用抽滤漏斗洗涤浸出产物, 用去离子水洗至中性, 真空烘干得到硼产品。
对燃烧产物和浸出产物进行XRD分析, 对硼粉进行光谱分析和元素分析。
3结果与讨论
3.1 反应现象分析
图4(a)所示为B2O3-Mg体系点火模式的燃烧产物的宏观形貌, 图4(b)和(c)所示分别为B2O3-Mg及B2O3-Mg-KCl体系的恒温起爆产物的宏观形貌, 图4(d)所示为B2O3-Mg-NaF体系直接起爆产物的宏观形貌。 从图中可看出, 不同反应模式的实验现象差别很大, 点火模式的燃烧产物有明显的宏观分层现象, 恒温起爆的燃烧产物可保持较好的完整性, 而直接起爆的燃烧产物完整性较差。
压样压力的增加引起恒温起爆时间的延长。 无论添加KCl或NaF都能使反应的起爆时间缩短, 起爆温度降低, 体系反应更易发生, 而反应前后其相没有发生变化。 因此, 这可能是由于KCl和NaF起催化剂的作用所致, 为SHS反应初始条件的控制提供理论依据。
图4 燃烧产物的照片
Fig.4 Photos of combustion products (a)—B2O3-Mg reaction system through ignition; (b)—B2O3-Mg reaction system through constant temperature explosion; (c)—B2O3-Mg-KCl reaction system through constant temperature explosion; (d)—B2O3-Mg-NaF reaction system through direct explosion
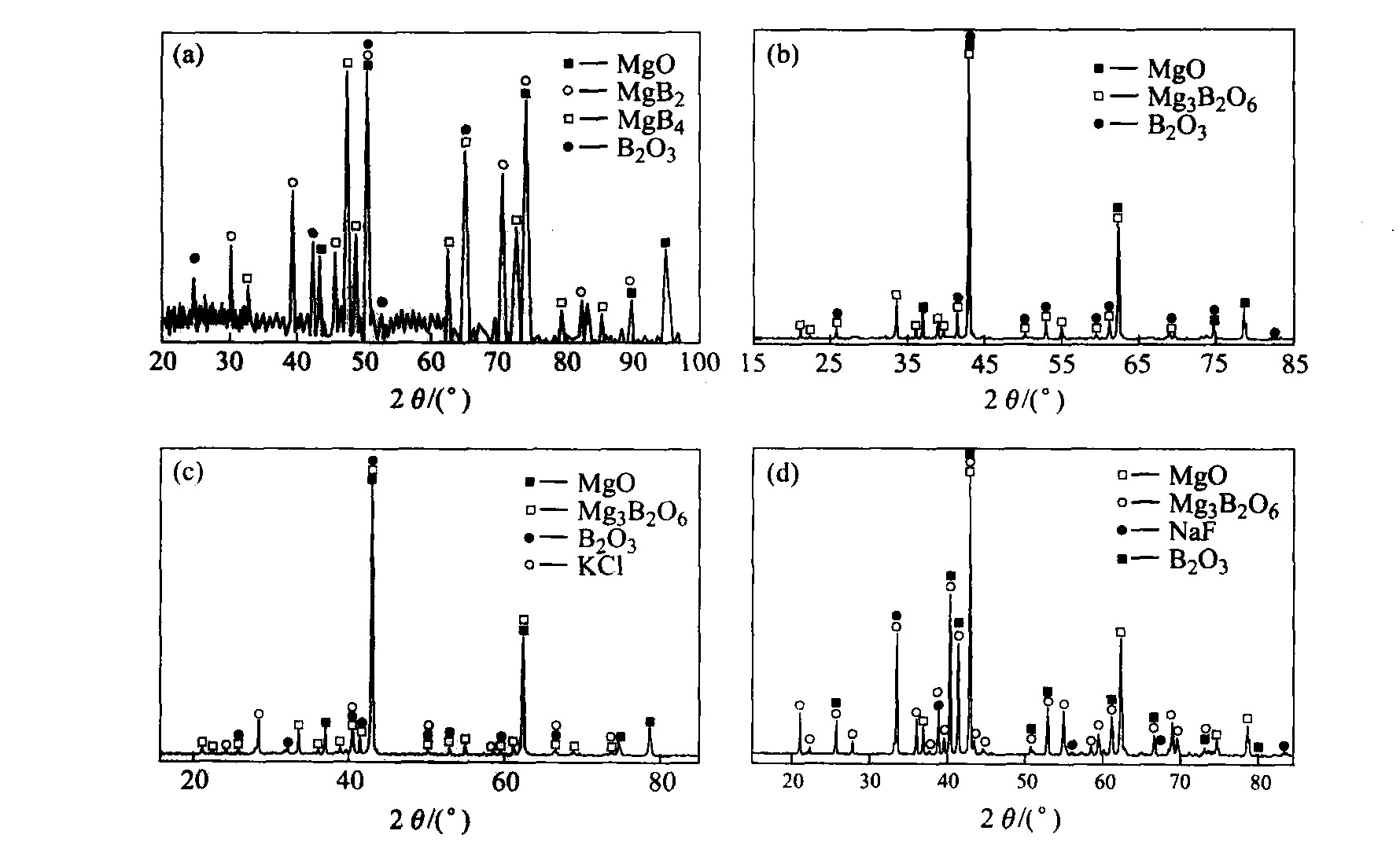
3.2 燃烧产物X射线衍射分析
图5(a)所示为点火SHS反应体系燃烧产物的X射线衍射谱。 由图可知燃烧产物主要由MgO、 B2O3、 MgB2和MgB4等相组成。 由此推测可能的反应机理为:
B2O3+Mg→B+MgB2+MgB4+MgO (11)
图5(b)~5(d)分别为Mg-B2O3体系、 Mg-B2O3-KCl体系和Mg-B2O3-NaF体系热爆法的燃烧产物的X射线衍射谱。 燃烧产物相主要为MgO、 Mg3B2O6和B2O3, 其中在图5(c)和(d)的燃烧产物相中分别发现了KCl和NaF, 这证实了前述对KCl和NaF起催化剂作用的推论。
生成Mg3B2O6的反应机理为:
3MgO+B2O3=Mg3B2O6 (12)
生成Mg3B2O6的原因可能为: 1) 由于传质差,当反应在SHS高温下以B2O3小液滴扩散到高温镁液并发生反应析出MgO时, 固化的MgO因表面能作用而收缩成团; 2) 随着SHS反应体系温度迅速上升至1 800 K以上, 低沸点的镁液便部分挥发逸出, 导致B2O3局部过剩, 且与MgO反应生成Mg3B2O
图5 燃烧产物的X射线衍射图
Fig.5 XRD of burned products (a)—B2O3-Mg reaction system through ignition; (b)—B2O3-Mg reaction system through thermally explosion; (c)—B2O3-Mg-KCl reaction system through thermally explosion; (d)—B2O3-Mg-NaF reaction system through thermally explosion
3.3 浸出产物的X射线衍射分析
图6(a)~6(c)所示分别为点火模式的燃烧产物经过一次酸浸→碱浸→二次酸浸后浸出产物的X射线衍射谱。 由图可看出, 一次酸洗后, MgO可以被完全除去, 大部分B2O3、 MgB2和MgB4也可被除去, 经过碱浸后, 产物中B2O3相也被完全除去, 但仍旧有一定量的MgB2和MgB4未能除去。 二次酸洗后, 产物中杂质被完全除去。 反应机理为:
B2O3+3H2O=2H3BO3 (13)
MgO+2HCl=MgCl2+H2O (14)
B2O3+6NaOH=2Na3BO3+3H2O (15)
图6(d)所示为热爆燃烧产物经过同样浸出处理后的最终产品的X射线衍射谱。 由图可知, 采用该浸出方案处理燃烧产物是成功的, 所得的硼粉是非晶态的。
从硼粉的光谱与化学分析结果(表1)可以看出, 燃烧产物经过三步浸出处理后所得硼粉中的主要杂质为镁和氧, 还有少量的硅、 钙和铁等杂质, 无定形硼粉纯度为92.43%。 采用激光粒度测试仪对无定形硼粉进行粒度分布测定, 其颗粒的平均粒径为0.5~0.8 μm。 这些指标很好地满足了固体火箭冲压发动机复合推进剂中的使用要求
表1 元素的光谱与化学分析结果
Table 1 Spectral and chemical analyses of elements
| Element | Mass fraction/% |
| B | 92.430 |
| Mg | 2.710 |
| O | 4.310 |
| Si | 0.010 |
| Ca | 0.030 |
| Fe | 0.003 |
3.4SHS反应初始条件对硼粉纯度的影响
3.4.1 反应物摩尔比的影响
图6 浸出产物的X射线衍射谱
Fig.6 XRD patterns of leaching products (a)—After firstly leaching by HCl for igniting combustion products; (b)—After leaching by NaOH for igniting combustion products; (c)—After secondly leaching by HCl for igniting combustion products; (d)—After three-step leaching for thermally exploding products
由表2知, 当按式(8)的理论量(镁和B2O3摩尔比)进行配料时, 产品含硼量为83.30%, 含镁量为9.36%。 随着镁和B2O3摩尔比的降低, 镁含量明显减少, 硼含量逐渐增加。 可能由于按照式(11)和(12)反应生成难溶化合物所致
表2 镁和B2O摩尔比对硼粉和镁粉含量的影响
Table 2 Effects of molar ratio of Mg andB2O3 on contents of B and Mg
| n(Mg)/n(B2O3) | Mass fraction/% | |
| B | Mg | |
| 3 | 83.30 | 9.36 |
| 2 | 86.54 | 5.84 |
| 1 | 88.06 | 2.31 |
3.4.2 物料粒度对硼粉纯度的影响
考查原料粒度对产品中硼粉纯度的影响。 反应物料愈细, 混合后互相之间接触良好, 反应速度愈快, 氧化物被还原得愈完全。 但由于物料变细, 金属镁粉由于氧化而活性降低和在反应过程中挥发很大, 因此完全还原反应过程受到很大影响。 过细的B2O3粉易迅速吸潮而不易被还原, 结果如表3所列。
表3 物料粒度对硼粉和镁粉含量的影响
Table 3 Effects of reactant particle sizeson contents of B and Mg
| Particle size of Mg/μm | Mass fraction/% | |
| B | Mg | |
| ≤45 | 90.73 | 5.39 |
| 45-38 | 87.17 | 4.56 |
| ≤38 | 83.74 | 3.02 |
| Particle size of B2O3/μm | Mass fraction/% | |
| B | Mg | |
| ≤80 | 89.43 | 5.17 |
| 315-80 | 86.02 | 7.91 |
| ≥315 | 84.62 | 8.49 |
由表3可看出, 随着B2O3和镁粉粒度的减小, 产品中含镁量均降低, 且随着镁粉粒度的减小, 产品中含硼量也逐渐降低。 由于粒度变细, 镁粉迅速消耗, 且被新生相硼包裹, 并与其生成难溶化合物的机会减少, 使得硼粉的中镁含量降低。 而B2O3的粒度愈细, 产品纯度就愈高。
3.4.3 添加剂对硼粉纯度的影响
对镁、 B2O3和KCl(NaF)的不同摩尔比对硼粉纯度的影响进行考察, 结果如表4和5所列。
表4 镁、 B2O3和KCl的摩尔比对硼粉和镁粉含量的影响
Table 4 Effects of molar ratio of Mg, B2O3and KCl on contents of B and Mg
| n(Mg)∶n(B2O3)∶n(KCl) | Mass fraction/% | |
| B | Mg | |
| 3∶1∶0.01 | 91.19 | 4.47 |
| 3∶1∶0.05 | 87.59 | 7.20 |
| 3∶1∶0.1 | 82.33 | 10.32 |
表5 镁、 B2O3和NaF的摩尔比对硼粉和镁粉含量的影响
Table 5 Effects of molar ratio of Mg, B2O3and NaF on contents of B and Mg
| n(Mg)∶n(B2O3)∶n(NaF) | Mass fraction/% | |
| B | Mg | |
| 3∶1∶0.01 | 90.93 | 4.85 |
| 3∶1∶0.05 | 84.79 | 8.81 |
| 3∶1∶0.1 | 80.61 | 12.30 |
由表4和5可看出, 随着KCl加入量的增加, 产品中硼含量逐渐降低; 随着NaF加入量的增加, 产品中的硼含量也明显降低。 这可能是由于随着KCl和NaF加入量的增加, 体系反应发生的时间逐渐缩短和反应发生的温度逐渐降低, 以至于还原反应不能彻底进行。
4结论
1) 提出了自蔓延冶金法制备硼粉的新工艺。 通过热力学计算得到B2O3+3Mg=2B+3MgO反应的绝热温度为2 604 K, 大于自蔓延绝热温度1 800 K, 因而, 该反应体系易于发生自蔓延反应。
2) 由差热分析可知B2O3+3Mg=2B+3MgO反应的起始温度为1 123 K, 反应的表观活化能为903.75 kJ/mol, 反应级数为1, 反应机制为液-液反应。
3) 通过XRD分析可知, 点火模式燃烧产物由MgO, B2O3, MgB2和MgB4等相组成; 热爆模式燃烧产物由MgO, Mg3B2O6和B2O3等相组成。
4) 浸出产物的XRD谱表明硼粉为非晶态, 纯度为92.43%, 平均粒度为0.5~0.8 μm。
5) 反应物摩尔比、 反应物粒度以及添加剂(KCl、 NaF)等对硼粉的纯度都有影响, 因此, 可通过控制SHS反应初始条件来获得高品位的硼粉。
参考文献