文章编号: 1004-0609(2006)07-1257-07
Li-Fe-P-H2O系热力学分析
赵中伟, 刘旭恒
(中南大学 冶金科学与工程学院, 长沙 410083)
摘 要:
运用同系线性规律对Li-Fe-P-H2O系中缺少的LiFePO4和Li3PO4的ΔG进行估算。 结合已有的热力学数据, 运用φ—pH图的绘制原理, 得到25℃时Li-Fe-P-H2O系在不同浓度下的φ—pH图。 结果表明, 在水溶液中, LiFePO4具有较大的热力学稳定区域, 这对湿法制备LiFePO4很有利。 根据所绘制的热力学平衡图, 详细讨论了各种LiFePO4软化学制备方法的可行性途径, 并就液相法制备LiFePO4可能的技术途径和条件进行分析, 为在水溶液中用软化学法制备LiFePO4提供理论依据。
关键词: Li-Fe-P-H2O系; 磷酸铁锂; 热力学
中图分类号: TQ021.2 文献标识码: A
Thermodynamic analysis of Li-Fe-P-H2O system
ZHAO Zhong-wei, LIU Xu-heng
(School of Metallurgical Science and Engineering, Central South University,
Changsha 410083, China)
Abstract: The ΔG of absent LiFePO4 and Li3PO4 in Li-Fe-P-H2O system were estimated by congeneric linearity rule. The potential—pH diagrams of Li-Fe-P-H2O system at the temperature of 25℃ and different ion concentration conditions were drawn through the basic potential—pH principle with a number of thermodynamic data. The potential—pH diagrams show that the predominant area of LiFePO4 in the Li-Fe-P-H2O systems is fairly large, which is beneficial to prepare the LiFePO4 by hydromethod. According to the potential—pH diagrams of Li-Fe-P-H2O system as well as published literatures, the potential processes and theoretical feasibility for synthesizing LiFePO4 using soft-chemical methods were discussed. The theoretical foundation for synthesizing LiFePO4 in the aqueous solution were provided by the potential—pH diagrams of Li-Fe-P-H2O system.
Key words: Li-Fe-P-H2O system; LiFePO4; thermodynamics
具有层状LiMO2和尖晶石型LiM2O4(M=Co、 Ni、 Mn、 V)结构的化合物一直是锂离子电池正极材料的研究热点。 LiCoO2是目前商品化的锂离子电池正极材料, 其理论比容量高、 循环性能好。 但钴在自然界的丰度低、 价格较贵, 而且钴的毒性相对较大; LiNiO2存在的问题更多, 除了合成困难、 热稳定性差之外, 还存在安全性问题[1]。 近年来, 人们对于尖晶石结构的LiMn2O4进行了大量研究, 以期解决安全性和价格问题, 但其在高温下的容量衰减长期以来难以克服。 因此, 性能优良、 廉价的正极材料一直是研究开发的重点。
橄榄石型磷酸亚铁锂具有热稳定性好、 充放电效率高、 环境友好及价格便宜的特点。 自1997年首次报道锂离子可在LiFePO4中可逆脱嵌后, 引起了人们极大关注, 被认为是极有应用潜力的锂离子电池, 特别是动力锂离子电池的正极材料。 LiFePO4的合成方法主要为高温固相反应法、 水热法和氧化还原法等。
高温固相反应将锂盐化合物、 铁盐化合物和磷盐化合物混合, 在惰性气氛中按一定的温度制度煅烧获得。 高温法工艺简单、 易于工业化, 但由于反应物不易混合均匀, 粒度粗, 分布不均, 形貌不规则。 使用高温手段的工艺在本质上属于“硬化学”方法, 随着科学技术的发展以及人们对环境意识的加强, 在温和的低温、 低压和可控条件下的“软化学”合成方法逐渐引起材料工作者的兴趣。 水溶液中的各种软化学方法合成LiFePO4的研究方兴未艾, 但是由于对Li-Fe-P-H2O系的化学性质特别是物理化学性质知之甚少, 使得有关研究缺乏理论的指导, 带有一定的盲目性, 大多需要通过实验探索其合成条件和路径。
合理的湿法合成方法的开发依赖于对锂、 铁、 磷等在水溶液中的物理化学性质的了解和认识。 本文作者通过热力学分析, 绘制出了Fe-P-H2O系和Li-Fe-P-H2O系的φ—pH图, 同时对LiFePO4的湿法合成问题进行了初步分析, 以期能深化认识, 对指导工艺实践有所裨益。
1 Li-Fe-P-H2O体系热力学分析
1.1 几个热力学数据的估算
在298.15K下, Li-Fe-P-H2O系中可以直接查得的稳定化合物或离子的热力学性质见表1。 而所涉及的Li3PO4和LiFePO4的吉布斯自由能函数至今未见报道, 只有文献[13]给出NaFePO4的ΔH为-1571.8kJ/mol, 文献[14]给出了Li3PO4的ΔH为-2095.8kJ/mol(表2)。 以这两个热力学参数为依据, 利用在化学中广泛应用的同系线性规律[15 ]估算了所缺的吉布斯自由能值。 估算时采用的其他热力学参数列于表2。
表1 Li-Fe-P-H2O系中各反应组分在298.15K下的热力学数据[2]
Table 1 Thermodynamic data of components in Li-Fe-P-H2O system at 298.15K
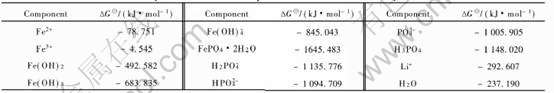
表2 Fe、 Li、 Na化合物的热力学数据
Table 2 Thermodynamic data of compounds containing Fe, Li and Na
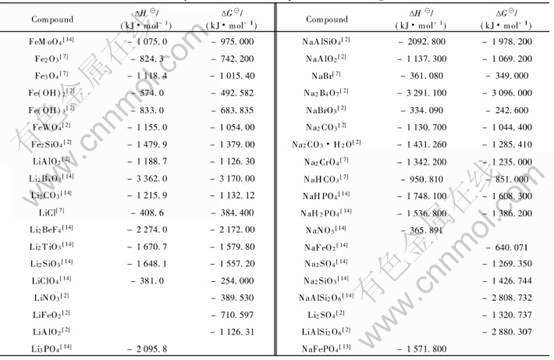
利用表中的热力学数据, 将各种锂化合物的ΔH对ΔG作图(图1), 可以看出数据点几乎完全落在一条直线上, 说明两函数间存在线性关系。 其直线方程为: ΔG=0.95227ΔH+42.69719, 其线性相关系数为r=0.9993467。 那么将Li3PO4的ΔH=-2095.8kJ/mol的数值代入该直线方程, 求得Li3PO4的ΔG=-1953.1kJ/mol。
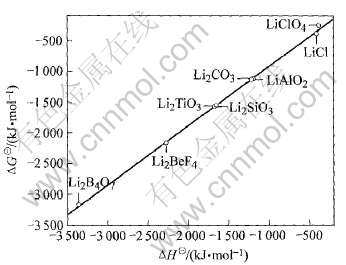
图1 各种锂盐的 ΔH与 ΔG之间的线性关系
Fig.1 Linearity relation between ΔH and ΔG of lithium compounds
至于LiFePO4的估算, 则稍微复杂。 由于已经有了NaFePO4的ΔH, 可先据此求出NaFePO4的ΔG。 如果将NaFePO4视为铁化合物, 则可以根据铁化合物间的直线规律估算。 那么按表2中所列铁盐的ΔH对ΔG作图(图2), 所得直线的方程为: ΔG=0.9878613ΔH+87.6151, 线性相关系数为r=0.9987105。 由于NaFePO4的ΔH=-1571.8kJ/mol, 相应得其ΔG=-1465.1kJ/mol。
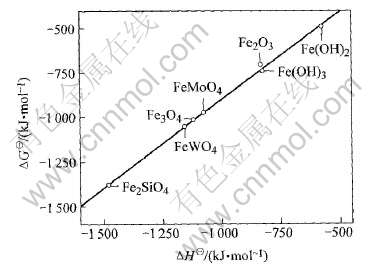
图2 各种铁化合物的ΔH与ΔG之间的线性关系
Fig.2 Linearity relation between ΔH and ΔG of iron compounds
现在已经求得NaFePO4的ΔG, 可再据此求出LiFePO4的ΔG。 为此将各种钠化合物与其对应的锂化合物的吉布斯自由能对应作图(图3), 其直线方程为ΔGLi=1.01238ΔGNa-40.46356, 再由上面估算出来的NaFePO4的ΔG值求出LiFePO4的ΔG=-1523.7kJ/mol。

图3 钠盐与锂盐的ΔG间的同系线性关系
Fig.3 Linearity relation of ΔG between lithium compounds and sodium compounds
考虑到这一数值是经过两步估算得到的, 为检验其精度, 本文作者又按另一条途径将NaFePO4视为钠化合物重新作了估算。
将各种钠化合物的ΔH对ΔG作图(图4), 如预料得到直线, 其方程为: ΔG=0.9519519×ΔH+43.00841, 线性相关系数为r=0.9993606, 按NaFePO4的ΔH=-1571.8kJ/mol的数值, 求得其ΔG=-1453.3kJ/mol。 再按图3 所得的直线关系求得LiFePO4的ΔG=-1511.7kJ/mol。 由此可看出, 二法估算所得数值误差很小, 其平均值为-1517.7kJ/mol, 本文中热力学计算取LiFePO4的ΔG=-1517.7kJ/mol。
1.2 热力学平衡计算
对于金属-水系中可能存在的反应, 可以分为以下3个类型:
Ⅰ 有电子得失的氧化-还原反应;
Ⅱ 水解-中和反应;
Ⅲ 氧化还原与水解中和反应共存。

基于上述3类反应计算方法以及Fe-P-H2O系与Li-Fe-P-H2O系中存在的反应, 得到体系在298.15K, O2和H2的分压均为101325Pa条件下各平衡反应的φ和pH表达式, 如表3所列。
1.3 Li-Fe-P-H2O体系与Fe-P-H2O体系的φ—pH图
根据表3中φ与pH的关系式, 可以绘制出相应的φ—pH图, 如图5~8所示。 图5所示为Fe-P-H2O系离子浓度为1mol/L的φ—pH图。 图7和8所示为Li-Fe-P-H2O系离子浓度分别为1mol/L和0.1mol/L时的φ—pH图。
表3 Fe-P-H2O系和Li-Fe-P-H2O系中的平衡反应在298.15K下的反应式与φ—pH计算式
Table 3 φ—pH formulas of equilibrium reaction in Fe-P-H2O and Li-Fe-P-H2O systems at 298.15K

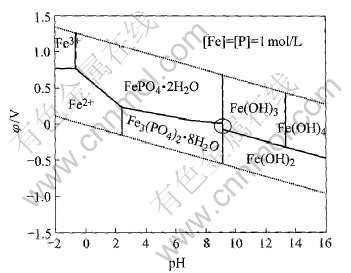
图5 Fe-P-H2O系的φ—pH图
Fig.5 φ—pH diagram of Fe-P-H2O system
图6 图5中局部放大图
Fig.6 Scale-up diagram in Fig.5
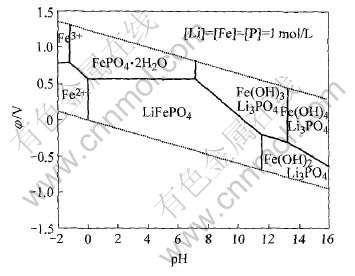
图7 Li-Fe-P-H2O系φ—pH图(离子浓度1mol/L)
Fig.7 φ—pH diagram of Li-Fe-P-H2O system
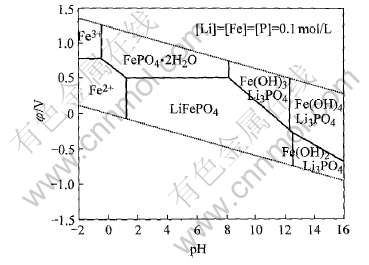
图8 Li-Fe-P-H2O系φ—pH图(离子浓度0.1mol/L)
Fig.8 φ—pH diagram of Li-Fe-P-H2O system
由图5可见, 在Fe-P-H2O体系中, 在水的稳定区内, 当pH为2.42~9.14时, 如果保持较低的氧化还原电势, 则Fe3(PO4)2·8H2O可稳定存在。 Masayoki等[12]在合成Fe3(PO4)2·8H2O时, 首先制备硫酸亚铁和磷酸的混合溶液(17℃, pH=1.6), 再滴入16%的NaOH水溶液, 使Fe3(PO4)2·8H2O析出(31℃, pH=6.7)。 对比图5可知, 这与所绘得的热力学平衡图完全吻合。 若电势升高, 则图中的稳定物质由Fe3(PO4)2·8H2O转为FePO4·2H2O。 而在较高的pH条件下, 稳定存在的固相分别为Fe(OH)3和Fe(OH)2。 在较低的pH条件下, 则分别为Fe3+、 Fe2+和磷的含氧酸根离子的稳定区域。
对比图5和7可以看出, 当引入Li+到Fe-P-H2O系后, 各物质的稳定区域发生较大的变化。 Fe3(PO4)2·8H2O在计算条件下不再稳定, 而代之以LiFePO4。 LiFePO4除完全吞噬了Fe3(PO4)2·8H2O的整个热力学区域之外, 还侵占了FePO4·2H2O、 Fe(OH)3、 Fe(OH)2和Fe2+的部分区域。 可见LiFePO4具有较大的热力学稳定性。 因此, 采用液相法在水溶液中制备磷酸铁锂在理论上是完全可能的。 比较图7和8可见, 体系中离子浓度有所降低, 由此可以看出磷酸铁锂的热力学稳定区域向pH高的方向移动。
2 分析和讨论
根据图7和8所示的Li-Fe-P-H2O系的φ—pH图可以看出, 在热力学上, 可以通过不同的途径合成LiFePO4。 如Arnold等[3]首先制备含铁、 磷和锂离子的酸性溶液, 通过加入碱调整溶液的pH值, 而生成LiFePO4沉淀。 也可以先制备含铁和磷的溶液, 再以LiOH溶液的形式将锂和碱加入, Park等[16]采用共沉淀法, 将(NH4)2Fe(SO4)2·6H2O和H3PO4溶液加入到LiOH溶液中而得到绿色的沉淀。 这两种情况下, 由于动力学上的原因, 所得沉淀结晶程度不佳或只是一种无定形的共沉淀化合物, 为此需要将沉淀在氮气气氛下高温煅烧才可得到结晶完整的LiFePO4。
Doeff等[4]采用以Fe(NO3)2、 CH3COOLi和H3PO4作为前驱体合成凝胶, 然后在氮气保护下高温烧结, 得到LiFePO4粉体。 陈亦可等[5]也采用溶胶-凝胶法合成前驱体,然后在500~600℃范围内煅烧, 得到粒径为0.2~0.4μm的LiFePO4颗粒。
以FePO4·2H2O为前驱体, 采用降低体系电势还原嵌锂的方法也可以制备LiFePO4。 但由于Li+和还原剂的固相扩散速度太慢, 采用这一方法需要较长的反应时间或较高的水热反应温度。 实际研究中这一还原嵌锂过程通常直接在更高温度下通过焙烧来实现, 如Scaccia等[6]将Fe2+氧化得到FePO4·2H2O, 将FePO4·2H2O脱去结晶水后, 再在有机溶剂如氰化甲烷中加入LiI进行锂化, 然后过滤、 洗涤, 沉淀在空气中干燥后, 在Ar+H2气氛下高温煅烧得到LiFePO4。
另一个可能的途径是使用Li3PO4作为前驱体合成LiFePO4。 但是Li3PO4在水溶液中溶解度很小, 以固态形式存在于体系中, 且在高pH条件下, 溶液中的铁源也呈固态存在。 这样, 在水溶液体系的工作温度范围内, 固/固反应进行得更慢, 因此目前尚未见到有关该方法的研究报道。 考虑到机械化学在强化过程方面的巨大作用, 借鉴热球磨的成功思路, 在水热条件下, 机械化学强化有可能强化固/固反应过程, 应该是很有前途的方法。 实际上, Liao等[8]利用铁粉和磷酸铁为铁源, 再与Li3PO4·0.5H2O混合, 然后将混合物加入到玛瑙容器中, 装入到行星球磨机中球磨即得到了LiFePO4。 但由于此过程是一个干法过程, 所需研磨时间长达24h, 如果采用湿法则有希望缩短时间。 而其他一些研究并未采用以上的机械化学技术思路, 则更需要高温焙烧以利于原子扩散形成LiFePO4, 但也需要混合、 焙烧、 再混合、 焙烧等多次操作方可, 如Kim等[9]就采用Li3PO4和FePO4·2H2O两种物质在Ar+5%H2的气氛中烧结得到前驱体,再将前驱体磨碎混碳,调匀后再压片,在管式炉中高温烧结得到了LiFePO4。
采用Fe(OH)2作为前驱体, 但Fe(OH)2在碱性条件下很不稳定, 容易氧化成为Fe(OH)3。
由于铁性质活泼, 其稳定区在图7和8中水稳定区域的下方。 在工业上有一种使铁在水溶液环境中发生微电池腐蚀而转为铁的氢氧化物的所谓锈蚀法[10]。 这一方法在钛的化工领域得到了应用, 由金属锰粉制备四氧化三锰本质上也是一种锈蚀法[11]。 借鉴锈蚀法的原理, 使金属铁粉与含锂、 磷的溶液接触, 同时控制pH范围处于LiFePO4的稳定区域内, 铁粉的存在可以保证溶液的电势维持较低, 则在热力学上使通过铁的锈蚀获得LiFePO4成为可能。
3 结论
1) 运用同系线性规律对Li3PO4和LiFePO4的进行了估算, 并绘制出了25℃时不同浓度下Li-Fe-P-H2O系的φ—pH图和Fe-P-H2O系的φ—pH图。
2) 对比Li-Fe-P-H2O系和Fe-P-H2O系的φ—pH图看出, 在计算条件下, 磷酸铁锂在水溶液中的热力学稳定区域比较大, 吞噬了Fe3(PO4)2·8H2O的整个热力学区域以及其周边物质的一部分区域, 这有利于湿法合成磷酸铁锂。
3) 从热力学理论上对液相法制备磷酸铁锂进行了分析, 为采用软化学法合成磷酸铁锂提供了方向指导和技术对策。
REFERENCES
[1]张海朗. 锂离子电池新型正极材料LiFePO4的研究评述[J]. 现代化工, 2005, 25(9): 18-20.
ZHANG Hai-lang. Review on study on LiFePO4 as novel cathode material for Li-ion battery[J]. Modern Chemical Industry, 2005, 25(9): 18-20.
[2]林传仙. 矿物及有关化合物热力学数据手册[M]. 北京: 科技出版社,1985.
LIN Chuan-xian. The Handbook of Mineral and The Related Compounds Thermodynamic Data[M]. Beijing: Science and Technology Press,1985.
[3]Arnold G, Garche J, Hemmer R. Fine-particle lithium iron phosphate LiFePO4 synthesized by a new low-cost aqueous precipitation technique[J]. Journal of Power Sources, 2003, 119-121: 247-248.
[4]张新龙, 胡国荣, 彭忠东, 等. 锂离子电池正极材料LiFePO4的研究进展[J]. 电池, 2003, 33(4): 252-254.
ZHANG Xin-long, HU Guo-rong, PENG Zhong-dong, et al. Development of LiFePO4 as cathode material of Li-ion battery[J]. Battery, 2003, 33(4): 252-254.
[5]陈亦可. 锂离子蓄电池正极材料LiFePO4的研究进展[J]. 电源技术, 2003, 27(5): 487-490.
CHEN Yi-ke. Progress in research of cathode material LiFePO4 in Li-ion batteries[J]. Chinese Journal of Power Sources, 2003, 27(5): 487-490.
[6]Scaccia S, Carewska M, Wisniewski P, et al. Morphological investigation of sub-micron FePO4 and LiFePO4 particles for rechargeable lithium batteries[J]. Materials Research Bulletin, 2003, 38(7): 1155-1156.
[7]钟竹前, 梅光贵. 化学位图在湿法冶金和废水净化中的应用[M]. 长沙: 中南工业大学出版社, 1986. 393-398.
ZHONG Zhu-qian, MEI Guang-gui. Application of Diagrams of Chemical Potential in Hydrometallurgy and Purification of Waste Water[M]. Changsha: Central South University of Technology Press, 1986. 393-398.
[8]LIAO Xiao-zhen, MA Zi-feng, WANG Liang, et al. A novel synthesis route for LiFePO4/C cathode materials for lithium-ion batteries[J]. Electrochemical and Solid-State Letters, 2004, 7(12): 522-523.
[9]Kim H S, Cho B W, Cho W Ⅱ. Cycling performance of LiFePO4 cathode material for lithium secondary batteries[J]. Journal of Power Sources, 2004, 132(1-2): 235-236.
[10]邓国珠, 黄北卫, 王雪飞. 制取人造金红石工艺技术的新进展[J]. 钢铁钒钛, 2004, 25(1): 44-50.
DENG Guo-zhu, HUANG Bei-wei, WANG Xue-fei. Recent achievements in preparing technology of synthetic rutile[J]. Iron Steel Vanadium Titanium, 2004, 25(1): 44-50.
[11]汤晓壮, 潘其经. 悬浮液氧化法制取四氧化三锰的反应速率[J]. 中国锰业, 2002, 20(1): 4-7.
TANG Xiao-zhuang, PAN Qi-jing. Reaction rate in the preparation of Mn3O4 by oxidation with suspension solution[J]. Chinas Manganese Industry, 2002, 20(1): 4-7.
[12]Masayoki K, Yasuhiro N, Nobuyuki Y, et al. 磷酸亚铁水合盐结晶、 其制造方法以及锂铁磷系复合氧化物的制造方法[P]. CN03102094.1. 2003-08-13.
Masayoki K, Yasuhiro N, Nobuyuki Y, et al. The preparing method for ferrous phosphate crystal and Li-Fe-P system composite oxide[P]. CN03102094.1. 2003-08-13.
[13]Tremaine P R, Xiao C B. Enthalpies of formation and heat capacity unctions for maricite, NaFePO4(cr), and sadium iron(Ⅲ) hydroxy phosphate, Na3Fe-(PO4)2·(Na4/3H2/3O)(cr)[J]. Chem Thermodynamics, 1999, 31: 1307-1320.
[14]Dean J A. 兰氏化学手册[M]. 尚久方, 译. 北京: 科学出版社,1991. 1467-1532.
Dean J A. Langes Handbook of Chemistry[M]. SHANG Jiu-fang, transl. Beijing: Science Press, 1991. 1467-1532.
[15]聂长明, 范明舫. 有机同系物性质的递变规律研究[J]. 有机化学, 2000, 20(1): 122-130.
NIE Chang-ming, FAN Ming-fang. Regularity of physicochemical properties for homologous organic compounds[J]. Chinese Journal of Organic Chemistry, 2000, 20(1): 122-130.
[16]Park K S, Kang K T, Lee S B. synthesis of LiFePO4 with fine particle by co-precipitation method[J]. Materials Research Bulletin, 2004, 39(12): 1803-1810.
(编辑李艳红)
收稿日期: 2006-01-04; 修订日期: 2006-03-31
通讯作者: 赵中伟, 教授, 博士; 电话: 0731-8830476; E-mail: Zhaozw@csu.edu.cn
[1]张海朗. 锂离子电池新型正极材料LiFePO4的研究评述[J]. 现代化工, 2005, 25(9): 18-20.
[2]林传仙. 矿物及有关化合物热力学数据手册[M]. 北京: 科技出版社,1985.
[4]张新龙, 胡国荣, 彭忠东, 等. 锂离子电池正极材料LiFePO4的研究进展[J]. 电池, 2003, 33(4): 252-254.
[5]陈亦可. 锂离子蓄电池正极材料LiFePO4的研究进展[J]. 电源技术, 2003, 27(5): 487-490.
[7]钟竹前, 梅光贵. 化学位图在湿法冶金和废水净化中的应用[M]. 长沙: 中南工业大学出版社, 1986. 393-398.
[10]邓国珠, 黄北卫, 王雪飞. 制取人造金红石工艺技术的新进展[J]. 钢铁钒钛, 2004, 25(1): 44-50.
[11]汤晓壮, 潘其经. 悬浮液氧化法制取四氧化三锰的反应速率[J]. 中国锰业, 2002, 20(1): 4-7.
[14]Dean J A. 兰氏化学手册[M]. 尚久方, 译. 北京: 科学出版社,1991. 1467-1532.
[15]聂长明, 范明舫. 有机同系物性质的递变规律研究[J]. 有机化学, 2000, 20(1): 122-130.


