文章编号:1004-0609(2010)08-1583-08
高活性TiO2薄膜电极的制备及其光电化学性能
钱清华1, 2,冯 新1,陆小华1
(1. 南京工业大学 化学化工学院,南京 210009;
2. 连云港职业技术学院 医药与化学工程学院,连云港 222006)
摘 要:
以Ti(n-OC4H9)4和CH3COOK为原料,采用溶胶-凝胶法在导电玻璃基底上制备K2Ti2O5薄膜,进一步以K2Ti2O5薄膜为前躯体,用离子交换法获得TiO2 纳米薄膜电极。利用X 射线衍射(XRD)和扫描电子显微镜(SEM)分析薄膜的组成和表面特征;以草酸为有机污染物代表,通过光电化学技术考察薄膜的光电化学活性。结果表明:TiO2 纳米薄膜具有锐钛矿晶型,其粒径随着K2Ti2O5薄膜制备温度的降低而减小,约为30~150 nm;TiO2 纳米薄膜在0.1 mol/LNa2SO4溶液中具有典型的光电化学活性以及较高的稳定性,比在含少量草酸的溶液中采用溶胶-凝胶法制备的TiO2薄膜具有更强的光激发和更稳定的光电流响应性能,TiO2薄膜电极的平带电位发生负移,负移值为0.140 V(vs SCE),饱和光电流密度为0.32 mA/cm2。
关键词:
中图分类号:O64 文献标志码:A
Preparation and photoelectrochemical properties of
TiO2 film electrode with high activity
QIAN Qing-hua1, 2, FENG Xin1, LU Xiao-hua1
(1. College of Chemistry and Chemical Engineering, Nanjing University of Technology, Nanjing 210009, China)
2. College of Pharmaceutical and Chemical Engineering, Lianyungang Technical College, Lianyungang 222006, China)
Abstract: The TiO2 nanofilm electrodes were obtained by ion-exchange method using K2Ti2O5 films as precursors which were prepared on tin-doped indium oxide (ITO) glass substrates by sol-gel process using Ti(n-OC4H9)4 and CH3COOK as raw materials. The structural composition and surface characteristics were characterized by X-ray diffractometry (XRD), scanning electron microscopy (SEM). The photoelectrochemical properties of the TiO2 films were assessed by electrochemical techniques using oxalic acid as organic pollutant. The results show that the crystalline state of the TiO2 nanofilm is anatase, its particle size is about 30-150 nm and decreases with the decrease of preparation temperature of K2Ti2O5 film. The TiO2 film electrode has typical photoelectrochemical activities and high stability in 0.1mol/L Na2SO4 solution. The photoelectrochemical activities of the TiO2 film electrode increase and its flat-band potentials shift negatively in electrolyte solution with small amount of H2C2O4 compared with those in the solution without H2C2O4. The film electrode has stronger photo-response and more stable photocurrent high stability than those of TiO2 film prepared by sol-gel method. The shift value of the flat-band potential of the TiO2 film electrode is 0.140 V(vs SCE)and the saturated photocurrent density is 0.32 mA/cm2.
Key words: TiO2 film electrode; photoelectrochemical properties; flat-band potential; ion-exchange
TiO2以其无毒、催化活性高、稳定性好及抗氧化能力强等优点,成为光催化反应、光降解空气和水中有机污染物等方面最有前途的光催化剂,而TiO2纳米薄膜由于具有较高的光电转换效率、较大的工作电流密度和合适的稳定性,在光催化、电化学、传感器、光电转换等领域受到人们更为广泛的关注[1-5]。然而,由于TiO2薄膜光激发产生的电子-空穴容易复合,光量子效率较低而限制其应用。薄膜的表面结构性质对光生载流子的收集起着决定性的作用,为提高TiO2薄膜的光电化学活性,研究者们采用许多制备方法,如溶胶-凝胶及其改进的方法[6]、掺杂或表面担载贵重金属方法[6-10]、模板法[11]、磁控溅射法[12-13]、与有机物藕合反应法[14]等,由于不同方法制备的薄膜组成和微结构不同,薄膜的性能存在显著的差异,其中,溶胶-凝胶法具有操作简单、成本低、可以大规模生产等优点,已被广泛应用,但仍然存在TiO2薄膜光电化学活性偏低的问题。本研究的前期工作已用溶胶-凝胶法制备出具有较高光催化活性和光电化学性能的K2Ti2O5薄膜[15],然而,由于K2Ti2O5在水中和酸性溶液中不稳定,只适合于气相光催化过程。本文作者采用溶胶-凝胶法通过旋转涂覆的方式在导电玻璃基底上制备较厚的K2Ti2O5薄膜(以薄膜A表示),进一步采用离子交换法从K2Ti2O5薄膜制备了TiO2纳米薄膜(以薄膜B表示)及其电极,使制备的固定TiO2薄膜含有较多的TiO2晶粒,以便形成更多的光学活性中心,并利用XRD和SEM等技术对薄膜进行表征,测试其光电化学性能,以H2C2O4为有机污染代表物,研究TiO2薄膜对有机物的光电氧化活性,并与溶胶-凝胶法制备的平整TiO2薄膜[16](以薄膜C表示)相比较。
1 实验
所需试剂为钛酸四丁酯、乙醇、去离子水、浓硝酸和乙酰丙酮(AcAc),所用试剂为分析纯,未经过净化处理。其摩尔比为n(Ti(OC4H9)4)? n(C2H5OH)? n(H2O)?n(HNO3)?n(AcAc)=1?30?2?0.12?015。在室温下,将钛酸四丁酯和所需乙醇溶液体积的2 /3混合,搅拌30 min。然后将剩余的1 /3乙醇、水和浓硝酸的混合溶液滴加到上述处于搅拌状态下的钛酸丁酯和乙醇混合液中,最后滴加稳定剂乙酰丙酮。所得混合液继续搅拌2 h,室温陈化2 d,得到稳定的TiO2 溶胶。将铟锡氧化物导电玻璃(ITO)片(电阻约15Ω/ cm2,深圳南玻集团)先用丙酮超声清洗10 min,再用乙醇各超声清洗10 min后,然后将其浸渍到溶胶中,以3.5 cm/min的速度向上匀速提拉取出,取出后在100 ℃下干燥10 min,如此反复拉膜6次后放入马弗炉中以3 ℃/min的速度升温至500 ℃,保温90 min后随炉冷却,制得TiO2薄膜。
将一定量的醋酸钾溶于冰醋酸中,按配比滴加钛酸四丁酯,加入95%乙醇调节溶胶浓度,形成均一、稳定、透明的淡黄色溶胶,滴加少量乙酰丙酮以保持溶胶的稳定性。原料配比为n(Ti(OC4H9)4)? n(CH3COOK)?n(CH3COOH)?n(AcAc)=1.0?1.0?5.0?0.05 (摩尔比)。采用离心旋转涂膜方法(TC100旋转涂膜机,沈阳科晶)在预处理过的洁净ITO基片上涂膜,以旋转速度为300 r/min匀胶、时间为10 s;以旋转速度为 2 000 r/min甩胶、时间为20 s,即可涂出与ITO基底粘附很好的薄膜;湿膜在100 W红外灯下(70 ℃)干燥10~15 min,然后在300 ℃烘3 min,重复以上操作,获得一定厚度的薄膜;最后置入马弗炉内以5 ℃/min升温到指定温度,并保温2 h。然后自然冷却至室温,即制得不同厚度的K2Ti2O5薄膜。
在K2Ti2O5薄膜上加少量水润湿,室温下放置一周进行水合反应,然后在pH=3的盐酸溶液中进行离子交换反应,用新鲜的盐酸溶液反复交换3次,每一次反应时间为6 h。最后放入马弗炉中以5 ℃/min升至500 ℃,保温2 h;冷却后用AB胶密封,得到表观面积为1.0 cm2 的TiO2薄膜电极。
用 D8 Advance X射线衍射仪(德国Bruker,电压40 kV,电流30 mA, 扫描速率0.05 (?)/s,Cu Kα 辐射源)测薄膜的晶相组成;使用扫描电子显微镜(SEM, Quanta 200, Philips, Japan) 观测不同温度制备的K2Ti2O5样品在离子交换前后的表面形貌。
采用带石英窗口的三电极电解池(自制)测试薄膜的光电化学性能,工作电极为TiO2薄膜,对电极为Pt片,参比电极为饱和甘汞电极(SCE),电解质溶液为0.1 mol/LNa2SO4溶液。采用EG&G PRAC Verstart 恒电位仪(日本)测定工作电极的伏安曲线,扫描速度为10 mV/s,紫外灯(254 nm,8 W)为外照光源,光强为2.5 mW/cm2;所有电化学实验均在室温下进行。
2 结果与讨论
不同温度制备的K2Ti2O5薄膜,晶粒大小不同,晶粒较大时,容易从基底上脱落,在600 ℃热处理2 h制备的K2Ti2O5薄膜晶粒比较大,本研究选取600 ℃作为制备K2Ti2O5薄膜的最高温度。图1(a)所示为经过600 ℃、500 ℃、400 ℃热处理2h制备的不同K2Ti2O5薄膜(分别记为A-6、A-5、A-4)的XRD谱。由图1(a)可以看出,随着制备温度的升高,K2Ti2O5的(111)晶面特征衍射峰强度增加,说明薄膜上K2Ti2O5晶粒随着热处理温度的升高逐渐长大。图1(b)所示为薄膜A-6、A-5和A-4在离子交换后,再于500 ℃热处理2 h得到的TiO2薄膜分别薄膜B-6、B-5和B-4的XRD谱。由图1(b)可以看出,3个衍射峰都是锐钛矿型TiO2的,说明从K2Ti2O5薄膜制备的都是锐钛矿型的TiO2薄膜,在B-6、B-5和B-4中,B-6的TiO2主衍射峰最强,B-5和B-4主衍射峰强度相当。
K2Ti2O5是层状晶体[17],是由TiO5的三角双锥体相互连接形成的层状结构,钾离子居于层间,当加入少量水进行分散时,水分子进入晶体层间,并与K+结合成为K(H2O)+水化离子,晶体层间发生膨胀,形成K2Ti2O5?nH2O分子。当K+不被交换时,将会以饱和KOH?n H2O液相的形式在微小的孔道内存在,并不断富集周围的KOH?nH2O分子,逐渐形成纳米级的KOH?n H2O晶粒,当遇到酸时,发生如式(1)所示的反应,生成TiO2?n H2O。TiO2?n H2O经过400~600℃的热处理得到锐钛矿型的TiO2,同时产生纳米孔道[18]。因此,K2Ti2O5薄膜经过水化、离子交换反应和热处理,得到TiO2薄膜。
![]() →
→![]() →
→
![]() →
→![]() (1)
(1)
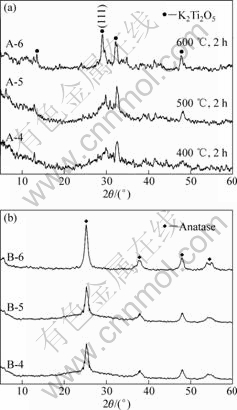
图1 K2Ti2O5薄膜(a)和相应的TiO2薄膜的XRD谱(b)
Fig.1 XRD patterns of K2Ti2O5 films (a) and corresponding TiO2 films (b)
图2所示为薄膜A-4、A-5和A-6及其相应薄膜B-4、B-5和B-6的SEM像。由图2可以看出,薄膜上TiO2晶粒大小与K2Ti2O5薄膜有直接的关系。不同温度制备的K2Ti2O5薄膜形貌相差较大,所得到的TiO2薄膜上晶粒大小也不同。K2Ti2O5晶粒较大时,制备的TiO2薄膜晶粒也比较大。离子交换前,膜中K2Ti2O5晶粒团聚,大小不一,表面粗糙不平;经过一周水化和离子交换反应制备的TiO2薄膜晶粒大小均匀,团聚现象不明显,膜致密、均匀;600 ℃制备的K2Ti2O5薄膜(A-6)中K2Ti2O5晶粒边界模糊,但是得到的TiO2晶粒(B-6)就有明显的边界,粒径约为80~150 nm,膜平整、无裂缝;500 ℃制备的K2Ti2O5薄膜(A-5)中K2Ti2O5晶粒边界比较明显,膜上晶粒大小不同,而得到的TiO2薄膜晶粒(B-5)边界更明显,粒径约为40~50 nm,膜也很平整、致密;400 ℃制备的K2Ti2O5薄膜(A-4)中K2Ti2O5晶粒非常小,TiO2晶粒(B-4)更小,约为30~40 nm。
TiO2薄膜晶粒大小与其光电化学性质有着一定的内在关系,粒径的减小使表面原子数目迅速增加,光吸收效率高,较小的粒径也减小了光的漫反射,提高了对光的吸收量。在通过离子交换反应制备的TiO2薄膜中,B-6表面由粒径为80~150 nm的晶粒组成,TiO2粒径大,比表面积小,存在较少的结构缺陷来俘获电子,导致电子-空穴对复合的几率比较大,光电化学活性低,因而B-6薄膜电极在0.1 mol/L Na2SO4溶液中的光电流比较小,光电性能差。因此,本文作者主要研究B-5和B-4薄膜的光电化学活性。

图2 薄膜A-6、A-5和A-4以及相应薄膜B-6、B-5和B-4的SEM像
Fig.2 SEM images of films A-6 (a), A-5 (b), A-4 (c) and corresponding films B-6 (a′), B-5 (b′) and B-4 (c′)
2.3.1 TiO2薄膜的光电响应
为考察TiO2薄膜的光激发以确定其光电活性,测定了TiO2薄膜的瞬态光电流。图3所示为0.1 mol/LNa2SO4溶液中TiO2/ITO薄膜电极零偏压连续瞬间电流-时间曲线。由图3可以看出, TiO2薄膜电极在开光瞬间,价带电子被激发到导带产生阳极光电流,薄膜B-5和B-4的瞬间阳极光电流密度与薄膜C的光电流密度相近,表明 B-5和B-4薄膜电极内光生电荷的传输性良好。随后,由于光生电子和空穴的产生和复合达到平衡而使光电流饱和。闭光后,导带中的光生电子重新回到价带与空穴复合而无光电流产生。
瞬态光电压—时间曲线也反映薄膜上电子的光激发。图4所示为0.1 mol/ L Na2SO4溶液中TiO2薄膜电极连续瞬间光电压—时间曲线。由图4可知,TiO2薄膜电极在开光的瞬间由于光生电子-空穴的产生,光电压迅速下降,随后由于光生电子和空穴的产生和复合达到平衡状态而使光电压趋于稳定。光电压降低到负值是由于跃迁到导带的电子由于缺乏电子受主而滞留在导带。闭光后,光生电子与空穴复合而使光电压回到原来的状态。B-5和B-4薄膜瞬间光电压与C薄膜电极相近,与瞬间光电流结果一致。
图5所示为不同的TiO2薄膜电极在扫描范围为-0.5 V~0.5 V的伏安曲线,电解液分别为(m)0.1 mol/L Na2SO4和(n)0.1 mol/L Na2SO4+0.025 mol/L H2C2O4溶液。由图5可看出,制备的TiO2薄膜电极在施加的电压范围内、在光照下产生阳极光电流,随着电压的增大,光电流也逐渐增大,而不同TiO2薄膜电极的光电流变化有所不同。B-5和B-4在0.1 mol/LNa2SO4溶液中,光电流比溶胶-凝胶法制备的薄膜C光电流小,与瞬态光电流和瞬态光电压的测定结果一致。这是由于薄膜C的致密性高、粒径小(约为15 nm),TiO2薄膜颗粒之间连接性更完善,电子-空穴对分离后,电子的迁移阻力小、传输速率快,而且增加电压可以得到更多的电子与空穴,所以光电流也没有饱和的迹象。由于B-5和B-4薄膜中KOH的溶出,薄膜出现网络结构,电子的传输受到较大的阻力,导致光电流比较小。
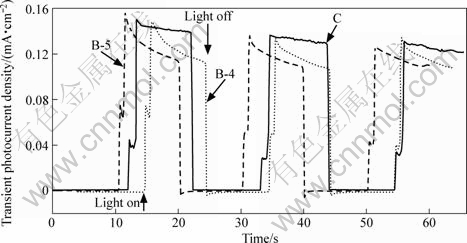
图3 TiO2薄膜电极的光电流—时间曲线
Fig.3 Photocurrent density—time curves of TiO2 films electrodes
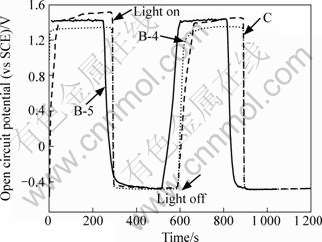
图4 TiO2薄膜电极的光电压—时间曲线
Fig.4 Photopotential—time curves of TiO2 film electrodes
从图5还可以看出,薄膜B-5和B-454))在0.1 mol/LNa2SO4+0.025 mol/L H2C2O4溶液中的伏安曲线与薄膜C有较大不同,薄膜B-5和B-4光电流比在0.1 mol/L Na2SO4溶液中大很多,也比薄膜C的大。这是因为薄膜B-5和B-4是由薄膜A-5和A-4制备的,由于KOH的溶出,在薄膜B-5和B-4中留下微孔,使薄膜B-5和B-4电极的比表面积增加,在有机污染物浓度较低时,电极的光电流是受扩散控制,在扩散控制条件下,假设到达电极表面的有机物分子被计量矿化,在光催化氧化中产生的光生电子都被收集,饱和光电流可以由半经验公式(2)表示[19]:
![]() (2)
(2)
式中:n为有机化合物完全矿化传输的电子数;F是法拉第常数;A是电极的有效表面积;D是化合物的扩散系数;d是能斯特扩散层的厚度;C是化合物的体相浓度。由于薄膜B-5和B-4的比表面积比薄膜C的大,能吸附更多的有机污染物分子,进而发生氧化反应,不断消耗电子和空穴,所以薄膜B-5和B-4电极的光电流也大,说明薄膜B-5和B-4对有机污染物的光电氧化活性远大于C的。另外,TiO2在含有可溶性有机污染物的电解液中存在污染物与水分子竞争的光氧化机理,当紫外光照射到TiO2上产生的电子空穴对到达晶粒表面被分离后,表面态空穴的存在和发生在半导体/电解液界面上的空穴转移对水溶液中的有机物起直接的光氧化作用[20],即溶液中的C2O42-或OH-易捕捉光生空穴,减少光生电子和空穴的复合,由于空穴的快速消耗,也使电子与空穴迁移过程加快,导致在含有微量H2C2O4的电解液中光电流迅速增加,但是增加电压并不能得到更多的电子与空穴,所以光电流呈饱和趋势。
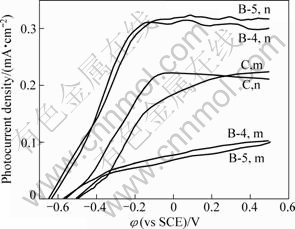
图5 不同TiO2薄膜在0.1 mol/LNa2SO4(m)和0.1 mol/L Na2SO4+0.025 mol/L H2C2O4(n)中的伏安曲线
Fig.5 Voltammograms of different TiO2 films in 0.1 mol/L Na2SO4 (m) and 0.1 mol/LNa2SO4+0.025 mol/L H2C2O4 (n)
2.3.2 TiO2薄膜的平带电位
在含H2C2O4溶液中,薄膜B-5的饱和光电流密度为0.32 mA/cm2。薄膜B-4的光电流和薄膜B-5的比较接近,饱和光电流密度为0.31 mA/cm2。薄膜B-5和B-4表面 TiO2粒径分别约为40~50 nm和30~40 nm,虽然薄膜B-5的TiO2粒径比薄膜B-4的大,但由于薄膜A-5是在500 ℃制备的,比薄膜A-4具有更完善的层状结构,所以由薄膜A-5制备的B-5由于KOH?nH2O的溶出比薄膜B-4的易产生纳米孔道,从而使薄膜B-5比薄膜B-4的比表面积大;而薄膜B-4由于TiO2粒径较小,也具有较大比表面积,所以薄膜B-5和薄膜B-4光电化学活性都比较好。另外,薄膜B-5和薄膜B-4的表面平整、致密,也避免ITO基底与溶液的接触,排除了基底对TiO2薄膜性能的干扰。
根据Gartner-Buttler理论,半导体的平带电位φfb可由式(3)得到[21]:
J2=Cα2dsc2(φ-φfb) (3)
式中:J为光电流密度;φ为扫描电位;C为常数;α为吸收系数;dsc为德拜长度。表1所列为不同TiO2薄膜的平带电位。由表1可见,在0.1 mol/LNa2SO4溶液中,薄膜B-5和B-4的平带电位比薄膜C的更负;在含 H2C2O4溶液中,TiO2薄膜平带电位又发生负移,薄膜C、B-5和B-4的负移幅度分别为0.08、0.140和0.08 V。平带电位的负移是活性提高的主要因素,意味着导带上被激发的电子具有更强的还原能力,也更容易将电子转移给H+生成H2。薄膜B-5平带电位负移的幅度最大,所以对H2C2O4溶液氧化活性最强。
表1 不同溶液中不同TiO2薄膜的平带电位
Table 1 Flat-band potentials of different TiO2 films in different solutions
2.3.3 TiO2薄膜电极的循环伏安曲线
为进一步研究离子交换制备的TiO2薄膜电极的光电化学性能,测量了其在-0.8 V~1.0 V的伏安曲线。图6(a)所示为薄膜B-5在0.1 mol/LNa2SO4+0.025 mol/L H2C2O4溶液中暗态和光照时的循环伏安曲线。图6(a)可见,薄膜B-5对H2C2O4具有较强的氧化活性。图6(b)所示为薄膜B-5光照时在0.1 mol/Na2SO4+0.025 mol/L H2C2O4溶液中的连续扫描循环伏安曲线,曲线1是开始扫描时的曲线,曲线2是在光照30 min后连续扫描曲线。由图6(b)可见,开始时,溶液中的H2C2O4浓度比较大,光电流较大;光照30 min后,由于H2C2O4被氧化,浓度降低,致使光电流减小。随着扫描次数的增加,连续扫描曲线并没有太大变化,说明光照30 min后,溶液中H2C2O4几乎被完全氧化,也表明薄膜B-5非常稳定。图6(c)所示为薄膜B-4在暗态和光照连续扫描的循环伏安曲线。由图6(c)可见,光照时光电流增加,和薄膜B-5的光电性能相近;薄膜B-4和B-5的电极析氢电位相同,也是稳定的电极,在不同的扫描范围内都具有较高的光电化学活性。
JIANG等[22]认为有机物在TiO2表面的吸附遵循Langmuir 吸附模型,H2C2O4在TiO2表面的吸附是2种不同的相互作用:含有化学键的特性吸附和H2C2O4与TiO2之间不同形式的静电作用。H2C2O4首先在TiO2表面发生吸附,光生电子-空穴的分离主要发生在纳米薄膜电极与电解液的界面上,薄膜B-5和B-4晶粒小,与电解质溶液接触充分,并带有微孔网络结构,比表面积比薄膜C的大,有利于吸附H2C2O4分子,空穴迅速把吸附在TiO2表面的H2C2O4氧化而消耗,减少电子-空穴在表面的复合,同时也促进光生电子-空穴对的产生,这些都导致薄膜B-5和B-4光电流比薄膜C的大。电极反应为
阴极:
2H++2e→H2 (4)
阳极:
H2C2O4-2e→2CO2+2H+ (5)
2H2O-4e→O2+4H+ (6)
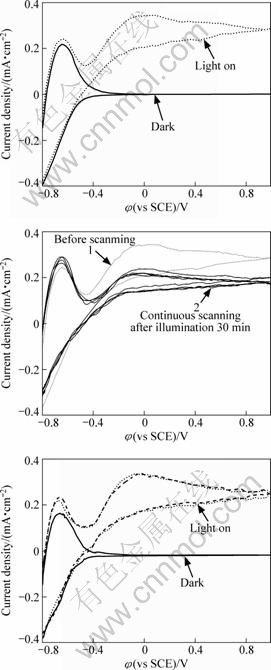
图6 TiO2薄膜在0.1 mol/LNa2SO4+0.025 mol/L H2C2O4溶液中的循环伏安曲线
Fig.6 Cyclic voltammograms of TiO2 film in 0.1 mol/LNa2SO4+0.025 mol/L H2C2O4 solution: (a) Film B-5; (b) Film B-5; (c) Film B-4
由于TiO2电极对氧析出反应具有较高的过电位,式(6)被抑制,式(5)成为阳极主要反应, 因而大大提高H2C2O4氧化的电流效率;TiO2电极对氢析出反应有较低的过电位和较高的活性,式(4)成为阴极主要反应。经反复扫描,电极的活性保持不变,表明这种原位生成的纳米TiO2薄膜与基体结合牢固,在电解液中性能稳定。
3 结论
1) 应用溶胶-凝胶和离子交换相结合的方法在ITO基底上制备的TiO2薄膜电极表面平整、致密,与基体结合牢固,光电化学活性比溶胶-凝胶法制备的TiO2薄膜高,经反复扫描活性不变,在电解液中性能稳定。
2) 以H2C2O4为有机污染物代表,研究TiO2薄膜电极对H2C2O4的光电氧化行为,离子交换得到的TiO2薄膜比溶胶-凝胶法制备的TiO2薄膜电极氧化能力强,薄膜B-5平带电位负移值为0.140 V (vs SCE),光电活性最强。有机污染物为电子给体,实现光催化同步消除污染物和制氢的双重目标。
REFERENCES
[1] KAVAN L, GR?TZEL M, GILBERT S E, KLEMENZ C, SCHEEL H J. Electrochemical and photoelectrochemical investigation of single-crystal anatase[J]. J Am Chem Soc, 1996, 118: 6716-6723.
[2] GR?TZEL M. Photoelectrochemical cells[J]. Nature, 2001, 414: 338-344.
[3] JUAN B. Physical electrochemistry of nanostructured devices[J]. Phys Chem Chem Phys, 2008, 10: 49-72.
[4] SAITO R, UENO H, NEMOTO J, FUJII Y. Photoelectrochemical conversion of NO3- to N2 by using a photoelectrochemical cell composed of a nanoporous TiO2 film photo anode and an O2 reducing cathode[J]. Chem Commun, 2009: 3231-3233.
[5] MATSUOKA M, KAMEGAWA T, RAKHMAWATY D, KITANO M, WADA K, ANPO M. Photocatalytic decomposition of lactic acid in water on a photoelectrochemical circuit system consisting of a rod-type TiO2 electrode and silicon solar cell[J]. Top Catal, 2008, 47: 162-165.
[6] RANDENIYA L K, MURPHY A B, PLUMB I C. A study of S-doped TiO2 for photoelectrochemical hydrogen generation from water[J]. J Mater Sci, 2008, 43: 1389-1399.
[7] ZENG Z Y, TU J P, HUANG X L, WANG, X. B, ZHAO X L, LI K F. Electrochemical properties of a mesoporous SiO2-TiO2 nanocomposite film anode for lithium-ion batteries[J]. Electrochemical and Solid-State Letters, 2008, 11(6): A105-A107.
[8] ICHIRO T, KAZUKI M, STACEY D S, EMIKO K, LANCE KELLY K, SAKAIA N, TATSUMA T. Photocatalytic growth and plasmon resonance-assisted photoelectrochemical toppling of upright Ag nanoplates on a nanoparticulate TiO2 film[J]. Chem Commun, 2009: 3621-3623.
[9] LI Y, HWANG D S, LEE N H, KIM S J. Synthesis and characterization of carbon-doped titania as an artificial solar light sensitive photocatalyst[J]. Chem Phys Lett, 2005, 404: 25-29.
[10] CHU S Z, INOUE S, WADA K, LI D, SUZUKI J. Fabrication and photocatalytic characterizations of ordered nanoporous X-doped (X) N, C, S, Ru, Te, and Si) TiO2/Al2O3 films on ITO/glass[J]. Langmuir, 2005, 21(17): 8035-8041.
[11] NEUMANN B, BOGDANOFF P. TRIBUTSCH H, SAKTHIVEL S, KISCH H. Electrochemical mass spectroscopic and surface photovoltage studies of catalytic water photooxidation by undoped and carbon-doped titania[J]. J Phys Chem B, 2005, 109(35): 16579-16586.
[12] KIKUCHI H, KITANO M, TAKEUCHI M, MATSUOKA M, ANPO M, KAMAT P V. Extending the photoresponse of TiO2 to the visible light region: photoelectrochemical behavior of TiO2 thin films prepared by the radio frequency magnetron sputtering deposition method[J]. J Phys Chem B, 2006, 110(11): 5537-5541.
[13] WU Su-juan, HAN Hong-wei, TAI Qi-dong. Improvement in dye-sensitized solar cells employing TiO2 electrodes coated with Al2O3 by reactive direct current magnetron sputtering[J]. Journal of Power Sources, 2008, 182: 119-123.
[14] ZHONG Z, ANG T P, LUO J, GAN H C, GEDANKEN A. Synthesis of one-dimensional and porous TiO2 nanostructures by controlled hydrolysis of titanium alkoxide via coupling with an esterification reaction[J]. Chem Mater., 2005, 17(26): 814-6818.
[15] 钱清华, 胡煜艳, 文高飞, 冯 新, 陆小华. 平整二钛酸钾薄膜的制备及其气相光催化活性[J]. 功能材料, 2007, 38(7): 1067-1070.
QIAN Qing-hua, HU Yu-yan, WEN Gao-fei, FENG Xin, LU Xiao-hua. Preparation and gaseous photocatalytic activity of smooth potassium dititanate film[J]. Journal of Functional Materials, 2007, 38(7): 1067-1070.
[16] 周雪锋, 钱清华, 胡煜艳, 陆小华. 溶胶-凝胶法制备平整TiO2薄膜及其表征[J]. 南京工业大学学报, 2006, 28(1): 22-26.
ZHOU Xue-feng; QIAN Qing-hua; HU Yu-yan; LU Xiao-hua. Preparation and characterization of smooth titanium oxide films by sol-gel method[J]. Journal of Nanjing University of Technology, 2006, 28(1): 22-26.
[17] LIU C, HE M, LU X H, ZHANG Q T, XU Z Z. Reaction and crystallization mechanism of potassium dititanate fibers synthesized by low-temperature calcination[J]. Cystal Growth & Design, 2005, 5(4): 1399-1404.
[18] HE M, LU X H, FENG X, YU L, YANG Z H. A simple approach to mesoporous fibrous titania from potassium dititanate[J]. Chem Commun, 2004: 2203-2204.
[19] GAN W Y, LEE M W, AMAL R, ZHAO H, CHIANG K. Photoelectrocatalytic activity of mesoporous TiO2 films prepared using the sol–gel method with tri-block copolymer as structure directing agent[J]. J Appl Electrochem, 2008, 38: 703-712.
[20] IVAN M,VILLARREAL T L, BISQUERT J, PITARCH A, GOMEZ R, SALVADOR P. Photoelectrochemical behavior of nanostructured TiO2 thin-film electrodes in contact with aqueous electrolytes containing dissolved pollutants: A model for distinguishing between direct and indirect interfacial hole transfer from photocurrent measurements[J]. J Phys Chem B, 2005, 109(8): 3371-3380.
[21] AKIKUSA J, KHAN S M. Photoresponse and AC impedance characterization of n-TiO2 film during hydrogen and oxygen evolution reactions in an electrochemical cell[J].Int J Hydrogen Energy, 1997, 22(9): 875-882.
[22] JIANG D, ZHAO H, ZHANG S, JOHN R, WILL G D. Photoelectrochemical measurement of phthalic acid adsorption on porous TiO2 film electrodes[J]. J Photochem Photobiol A, 2003, 156: 201-206.
基金项目:国家自然科学海外青年学者合作研究基金资助项目(20428606);国家自然科学基金重点资助项目(20236010);国家自然科学基金资助项目(20676062, 20676029);国家重点基础研究发展计划资助项目(2003CB615700);国家高技术研究发展计划资助项目(2006AA03Z455);江苏省高校科研成果产业化推进资助项目(JHZD08-49)
收稿日期:2009-08-25;修订日期:2010-01-05
通信作者:陆小华,教授,博士;电话/传真:025-83588063;E-mail:xhlu @njut.edu.cn


