文章编号:1004-0609(2012)1-0039-06
Mg-6%Zn-10%(β-Ca3(PO4)2)复合材料的制备及腐蚀降解行为
陈福文1, 2,余 琨1, 2,陈良建2, 3,裴赛敏3,汪瑞芳3,李少君1,胡亚男1
(1. 中南大学 材料科学与工程学院,长沙 410083;
2. 中南大学 粉末冶金国家重点实验室,长沙 410083;
2. 中南大学 湘雅三医院,长沙 410013)
摘 要:
以Mg-6%Zn合金为基体、β-Ca3(PO4)2为强化相,采用粉末冶金工艺制备Mg-6%Zn-10%(β-Ca3(PO4)2)复合材料。利用光学显微镜观察复合材料的显微组织,采用X射线衍射仪分析相组成,采用压缩试验评估复合材料力学性能,采用动电位极化法和浸泡实验研究复合材料在模拟体液(SBF)中的腐蚀行为。结果表明:β-Ca3(PO4)2在烧结过程中与基体合金没有发生明显反应;复合材料密度为1.936 g/cm3,压缩强度为339 MPa,弹性模量为24 GPa;添加β-Ca3(PO4)2可降低Mg-6%Zn在SBF中的腐蚀速度;Mg-6%Zn-10%(β-Ca3(PO4)2)复合材料在SBF中的电化学腐蚀速度为2.277 mm/y,浸泡30 d的浸泡腐蚀速度为2.133 mm/y,SBF的 pH值随着浸泡时间的延长而上升,最终稳定在10。
关键词:
Mg-6%Zn-10%(β-Ca3(PO)4);复合材料;腐蚀;力学性能;生物降解;
中图分类号:TG146.22 文献标志码:A
Fabrication and corrosion properties of Mg-6%Zn-10%(β-Ca3(PO4)2) composite
CHEN Fu-wen1, 2, YU Kun1, 2, CHEN Liang-jian2, 3,
PEI Sai-min3, WANG Rui-fang3, LI Shao-jun1, HU Ya-nan1
(1. School of Materials Science and Engineering, Central South University, Changsha 410083, China;
2. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China;
3. The Third Xiangya Hospital, Central South University, Changsha 410013, China)
Abstract: Using Mg-6%Zn as the matrix and β-Ca3(PO4)2 as reinforcement, the Mg-6%Zn-10%(β-Ca3(PO4)2) bio- composite was fabricated by the powder metallurgy method. The microstructure of Mg-6%Zn-10%(β- Ca3(PO4)2) biocomposite was observed by optical microscopy and the phases were analyzed by X-ray diffractometry. The mechanical properties were evaluated by compression tests. The corrosion behavior of the bio-composite in simulated body fluid (SBF) was studied by potentiodynamic polarization and immersion tests. The results show that the reaction between β-Ca3(PO4)2 particles and Mg-6%Zn matrix during sintering is not observed. The density of the biocomposite is 1.936 g/cm3, the compression strength is 339 MPa and the elastic modulus is 24 GPa. The additive of β-Ca3(PO4)2 reduces the corrosion rate of Mg-6%Zn. The electrochemical corrosion rate of Mg-6%Zn-10%(β-Ca3(PO4)2) is 2.277 mm/y, and the calculated corrosion rate of the biocomposite immersed in SBF for 30 d is 2.133 mm/y. During the immersion test, the pH value of SBF increases gradually, and at last stabilizes at 10.
Key words: Mg-6%Zn-10%(β-Ca3(PO4)2); biocomposite; corrosion; mechanical property; biodegradation
金属植入材料是临床中广泛应用的一类外科植入材料。镁具有良好的生物相容性[1],可以作为医用植入材料来使用。相比于传统的植入金属材料,镁具有不可替代的优点:1)镁可以在体内获得降解[2],使患者解除了第二次手术的痛苦;2)生成的Mg2+能被人体吸收,可促进钙的沉积,促进骨细胞的形成,加速骨的愈合[3]等;3)镁合金的弹性模量与骨接近,植入人体后不会产生应力屏蔽效应。然而,由于镁合金在pH值为7.4~7.6,含有Cl-的生理环境中腐蚀速度过快[4],在新骨生长完好之前会失去机械完整性[4]。因此,改善和调控其腐蚀速度,是镁及镁合金作为骨修复材料,特别是承重骨替代材料能否应用于临床的关键。
许多研究者通过合金化来降低镁合金腐蚀速度,研究得最多的合金元素为Al和稀土元素。尽管Al和稀土元素能够提高镁合金的耐蚀性,但是Al对造骨细胞和神经元有害[5],而部分稀土元素(Pr,Ce,Y等)会导致肝中毒[6]。如合金WE43植入体内后,Nd和Y留在了骨内植入的位置[7], 这意味着稀土元素在人体内不易吸收或排泄。基于这些合金元素对人体不利的影响,近年来研究者开始转向新合金的开发,研究集中在Zn、Ca等几种对人体无毒的合金元素。实验证明,Zn和Ca能够降低合金在模拟体液中的腐蚀速 度[8-10]。WITTE等[11]指出,为满足人体的降解速度以及体内机械完整性的需要,镁基复合材料是潜在的可用医用植入材料。强化相羟基磷灰石(HA)的加入能够降低镁合金的生物降解速度[11],目前镁基复合生物材料的研究多以HA为强化相,但HA在体内难以降解,对镁合金作为可降解植入材料不利。Zn是人体所需的元素,ZHANG等[10]中指出Mg-6%Zn合金具有很好的生物相容性,Zn能提高镁合金的耐蚀性。β-Ca3(PO4)2 (简写为β-TCP)具有良好的生物相容性,在人体内能够降解,并且对骨的再生有利[12] 。因此,本实验选用Mg-6%Zn为基体合金,β-TCP为强化相来制备Mg-6%Zn-10%(β-TCP)复合材料,并且对所制复合材料的生物腐蚀降解行为进行研究。
1 实验
采用粉末冶金方法制备Mg-6%Zn-10%(β-TCP)复合材料:将Mg粉(质量分数为99.9%)、Zn粉(质量分数为99.9%)以及β-TCP粉末(粉末颗粒平均直径约8 μm)用混料机混合均匀后,在680~700 ℃烧结,烧结时间为30 min。
采用POLYVAR-MET宽视野金相显微镜对试样中β-TCP相的形貌及分布状态进行观察,采用DMAX-2500X型X射线衍射仪确定其物相,采用GLEEBLE 1500型材料热模拟试验机进行压缩试验以确定复合材料的压缩强度和弹性模量。
采用浸泡实验和电化学实验来研究Mg-6%Zn- 10%(β-TCP)复合材料的腐蚀行为。测试所用溶液为模拟体液(简称SBF,其组分浓度分别为NaCl 8.035 g/L,NaHCO3 0.335 g/L,KCl 0.225 g/L,K2HPO4·3H2O 0.231 g/L,MgCl2·6H2O 0.311 g/L,CaCl2 0.292 g/L,Na2SO4 0.072 g/L,Tris(HOCH2)3CNH2 6.228 g/L)[13],实验前用HCl和NaOH调节SBF的pH为7.4。
采用CHI660C型电化学工作站测试动电位极化曲线,扫描速度为10 mV/s。
浸泡实验过程中对浸泡不同时间后的试样进行拍照观察,干燥后称量质量。通过测量浸泡不同时间后的质量损失来计算腐蚀速度。用pHS-3C酸度计测量溶液在浸泡过程中的pH值。采用JSM-5600Lv型扫面电镜观察锻造试样腐蚀表面形貌,采用EDS 测试腐蚀表面的元素组成。
试样的体密度采用阿基米德排水法在精度为0.001 g的电子天平上精确测量。测量前将试样表面用丙酮擦洗干净,测量值取3个试样的平均值。密度的计算公式为
![]() (1)
(1)
式中:m1为试样在空气中的质量,m2为试样在蒸馏水中的质量;ρ0为室温(25 ℃)时试样的密度,0.998 g/cm3。
电化学实验腐蚀速度(ve, mm/y)的计算公式为[14]
![]() (2)
(2)
式中:M为参加反应的物质的相对原子质量;n为电化学腐蚀反应中转移的电子数;ρ为密度; J为腐蚀电流密度。
浸泡实验腐蚀速度(vi, mm/y)的计算公式为[15]
![]() (3)
(3)
式中:W为质量的损失,g;A为浸泡面积,cm2;t为浸泡时间,h;ρ为密度,g/cm3。
2 结果和讨论
2.1 Mg-6%Zn-10%(β-TCP)复合材料组织、结构和力学性能
图1所示为Mg-6%Zn-10%(β-TCP)复合材料的显微组织。由图1可以看出,试样主要由镁合金基体以及弥散分布在基体中的β-TCP组成,试样局部存在β-TCP团聚现象,但没有明显的孔隙。Mg-6%Zn-10% (β-TCP)复合材料表面XRD谱显示,Mg-6%Zn-10% (β-TCP)复合材料主要由β-TCP,Mg和MgZn三相组成,添加 β-TCP后复合材料并没有生成新的相,如图2所示。
Mg-6%Zn的密度为1.801 g/cm3,复合材料密度为1.936 g/cm3,这表明试样密度接近自然骨的密度[4]。复合材料的压缩强度为339 MPa,弹性模量为24 GPa,而文献[14]中指出,自然骨的弹性模量为3~20 GPa,这表明试样的弹性模量接近自然骨的弹性模量。
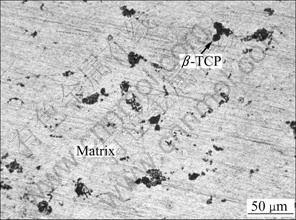
图1 Mg-6%Zn-10%(β-TCP)复合材料的显微组织
Fig. 1 Microstructure of Mg-6%Zn-10%(β-TCP) composite
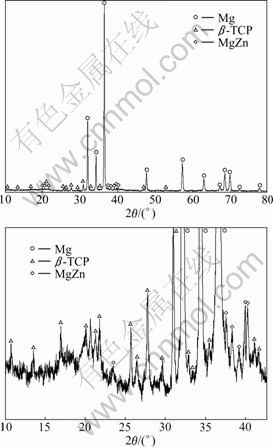
图2 Mg-6%Zn-10%(β-TCP)复合材料的XRD谱
Fig. 2 XRD patterns of Mg-6%Zn-10%(β-TCP) composite
2.2 β-TCP对Mg-6%Zn腐蚀速度的影响
Mg-6%Zn和复合材料Mg-6%Zn-10%(β-TCP)在SBF中的腐蚀是电化学腐蚀的过程。图3所示为试样在SBF中的极化曲线。由图3可见,Mg-6%Zn在SBF中的自腐蚀电位为-1.618 V,腐蚀电流密度为0.143 mA/cm2,其电化学腐蚀速度为3.126 mm/y,而添加了β-TCP的复合材料在SBF中的自腐蚀电位正移至-1.592 V,腐蚀电流密度降为0.112 m A/cm2,其电化学腐蚀速度也减小到2.277 mm/y。
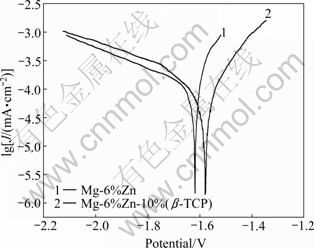
图3 试样在SBF中的极化曲线
Fig. 3 Tafel curves of samples in SBF
浸泡不同时间后的试样按质量损失率来计算腐蚀速度,结果如图4所示。由图4可以看出,Mg-6%Zn和Mg-6%Zn-10%(β-TCP)的腐蚀速度均随时间的增加呈持续下降的趋势,Mg-6%Zn的腐蚀速度从浸泡2 d后的8.571 mm/y降到30 d后的3.074 mm/y,而Mg-6%Zn-10%(β-TCP)的腐蚀速度从浸泡2 d后的7.342 mm/y降到30 d后的2.133 mm/y。这主要是因为该复合材料在浸泡的过程中产生的腐蚀产物能够阻碍腐蚀的进一步进行。Mg-6%Zn-10%(β-TCP)不同时期的腐蚀速度均高于Mg-6%Zn的,这说明β-TCP的添加能够对基体合金在SBF溶液中的腐蚀起到一定的阻碍作用。对比电化学腐蚀速度和浸泡腐蚀速度可以看出,在浸泡早期的腐蚀速度要高于电化学腐蚀速度,这主要是因为镁合金在腐蚀介质中阳极溶解时,可能会直接产生低价态离子(Mg+),而低价态离子再通过化学反应的途径氧化成高价态的离子(Mg2+)成为最终产物。法拉第定律是按最终产物的价态Mg2+来计算阳极溶解速率,这样换算得到的质量损失就会小于实际质量损失。在浸泡的过程中,试样中的β-TCP强化相会随着基体金属一起溶解,而β-TCP的溶解不会产生电流,试样在溶解的时候,除了阳极溶解外,还同时有未溶解的微小粒子的脱落,在这种情况下实际溶解质量要大于用法拉第定律换算出的质量损失,因而浸泡腐蚀速度大于电化学腐蚀速度。
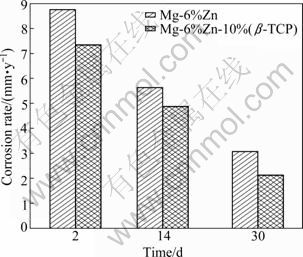
图4 试样浸泡不同时间的腐蚀速度
Fig. 4 Corrosion rates of immersed samples with different times
2.3 Mg-6%Zn/10%(β-TCP)的腐蚀行为
图5所示为Mg-6%Zn-10%(β-TCP)复合材料在SBF中浸泡不同时间后溶液pH值的变化。从图5可以看出,在整个浸泡过程中,SBF的pH值是呈上升的趋势,并且最终稳定在10。SONG等[16]指 出,镁在水溶液中的溶解遵循如下反应。
阳极反应:
Mg→Mg2++2e (4)
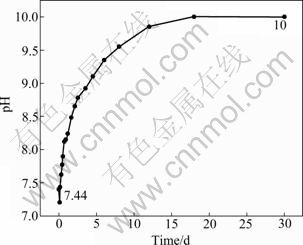
图5 浸泡复合材料的SBF的pH值变化
Fig. 5 Variation of pH value of SBF immersed with composite
阴极反应:
2H2O+2e→H2+2OH- (5)
Mg+2H2O→Mg(OH)2+H2 (6)
因此,试样在浸泡过程中释放的气体为氢气。溶液中的Cl-将Mg(OH)2转为MgCl2[17],导致溶液中OH-增加,从而使得pH值增大。
图6所示为试样在SBF溶液中浸泡不同时间的质量变化,图7所示为对应于图6中所示的浸泡时间的宏观腐蚀形貌。浸泡前,观察到试样表面光亮且有金属光泽。浸泡后,试样开始腐蚀,质量减少,浸泡6 d后,相比于未腐蚀前,试样质量降为最低,试样表面可以观察到很明显的腐蚀坑。随着浸泡时间的增加,质量开始增加,浸泡16 d后质量达到了最大。试样表面可以观察到很明显的白色颗粒状物质的沉积,腐蚀产物的沉积对腐蚀的进一步进行起到了一定的阻碍作用。试样浸泡20 d后,试样表面沉积的白色颗粒状物质脱落,质量减轻,浸泡26 d后,质量增加,试样表面覆盖一层白色的腐蚀产物。浸泡30 d后,质量出现降低的情况,试样表面覆盖一层白色的腐蚀产物并且比浸泡26 d时的腐蚀产物更厚更致密,局部可以看到腐蚀穿透白色的腐蚀产物进一步向内深入所形成的黑色坑。从图6和7可以看出,在浸泡过程中腐蚀产物是一个沉积和脱落相交替的过程。腐蚀产物对腐蚀能起到阻碍作用,腐蚀产物不够致密,Cl-可以穿透腐蚀产物层进一步腐蚀试样。
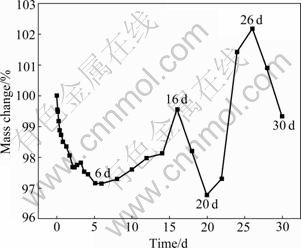
图6 浸泡在SBF中的Mg-6%Zn-10%(β-TCP)试样的质量变化
Fig. 6 Mass changes of Mg-6%Zn-10%(β-TCP) samples immersed in SBF
为进一步研究试样在SBF中的微观腐蚀形貌,利用SEM对腐蚀试样进行了观察。图8所示为试样的微观腐蚀形貌,图8(a)所示为浸泡6 d后试样的腐蚀截面图。从图8(a)可以看出,试样的腐蚀过程为不均匀的腐蚀过程,腐蚀可以穿过表面覆盖物向内部深入,从而使得被腐蚀的部分物质被腐蚀产物包裹而分离开来。图8(b)所示为浸泡2 d后试样的表面形貌。从图8(b)可以看出,试样浸泡2 d后,表面覆盖腐蚀产物。由图8(c)可知,这些腐蚀产物为富含O、Mg、P、Ca的物质。ZHANG等[10]指出,浸泡在SBF中的Mg-6%Zn表面检测到了HA的存在,而WITTE等[11]将以AZ91D为基体、HA为强化相的金属基复合材料在人工海水中浸泡24 h和72 h后,在其表面均检测到了CaCO3的存在。KUWAHARA等[2]指出,镁在Hank’s溶液中表面沉积的腐蚀产物很可能是无定形的(Ca0.86Mg0.14)10(PO4)6(OH)2,还可能有含有磷酸盐的非晶镁/钙的存在。在浸泡的过程中,随着基体金属的溶解,强化相β-TCP也会溶解,Mg2+、Ca2+、(PO4)3-溶于溶液中,与溶液中的离子作用生成复杂的磷酸盐或者是碳酸盐紧紧地附着在试样的表面上,对腐蚀起到阻碍作用。

图7 Mg-6%Zn-10%(β-TCP)试样在SBF中浸泡不同时间的宏观腐蚀形貌
Fig. 7 Surface morphologies of Mg-6%Zn-10%(β-TCP) samples immersed in SBF for different times: (a) Before corrosion; (b) 6 d; (c) 16 d; (d) 20 d; (e) 26 d;(f) 30 d

图8 Mg-6%Zn-10%(β-TCP)试样在SBF中浸泡后的SEM像和EDS谱
Fig. 8 SEM images and EDS spectra of Mg-6%Zn-10%(β-TCP) samples immersed in SBF: (a) Section image, 6 d; (b) Surface morphology, 2 d; (c) EDS spectra of rectangle area shown in Fig. 8(b)
3 结论
1) β-TCP与基体合金在烧结的过程中没有发生明显反应。复合材料密度为1.936 g/cm3,压缩强度为339 MPa,弹性模量为24 GPa。
2) β-TCP的添加能够提高Mg-6%Zn的耐蚀性。Mg-6%Zn-10%(β-TCP)复合材料在SBF中的自腐蚀电位为-1.592 V,腐蚀电流密度为0.112 mA/cm2,腐蚀速度为2.277 mm/y。复合材料浸泡2 d后的腐蚀速度为7.342 mm/y,浸泡30 d后的腐蚀速度为2.133 mm/y。
3) 浸泡了Mg-6%Zn-10%(β-TCP)复合材料的SBF的 pH值随着浸泡时间的增加而上升,最终稳定在10。复合材料表面覆盖的腐蚀产物为富含O、Mg、P、Ca的物质,对腐蚀起到了阻碍作用。
REFERENCES
[1] SERRE C M, PAPILLARD M, CHAVASSIEUX P, VOEGEL J C, BOIVIN G. Influence of magnesium substitution on a collagen–apatite biomaterial on the production of a calcifying matrix by human osteoblasts[J]. Journal of Biomedical Materials Research, 1998, 42(4): 626-633.
[2] KUWAHARA H, AL-ABDULLAT Y, MAZAKI N, TSUTSUMI S, AIZAWA T. Precipitation of magnesium apatite on pure magnesium surface during immersing in Hank’s solution[J]. Material Transactions, 2001, 42(7): 1317-1321.
[3] 戴尅戎. 骨折内固定与应力遮挡效应[J]. 医用生物力学, 2000, 15(2): 69-71.
DAI Ke-rong. Fracture fixation and stress shielding effect[J]. Journal of Medical Biomechanics, 2000, 15(2): 69-71.
[4] STAIGER M P, PIETAK A M, HUADMAI J, DIAS G. Magnesium and its alloys as orthopedic biomaterials: A review[J]. Biomaterials 2006, 27(9): 1728-1734.
[5] EL-RAHMAN S S A. Neuropathology of aluminum toxicity in rats (glutamate and GABA impairment)[J]. Pharmacological Research, 2003, 47(3): 189-194.
[6] NAKAMURA Y, TSUMURA Y, TONOGAI Y, SHIBAYA T, ITO Y. Differences in behavior among the chlorides of seven rare earth elements administered intravenously to rats[J]. Fundamental and Applied Toxicology, 1997, 37(2): 106-116.
[7] WITTE F, KAESE V, HAFERKAMP H, SWITZER E, MEYER-LINDENBERG A, WIRTH C J, WINDHAGEN H. In vivo corrosion of four magnesium alloys and the associated bone response[J]. Biomaterials, 2005, 26(17): 3557-3653.
[8] SONG G L. Control of biodegradation of biocompatible magnesium alloys[J]. Corrosion Science, 2007, 49(4): 1696- 1701.
[9] ZHENG Y F, GU X N, XI Y L, CHAI D L. In vitro degradation and cytotoxicity of Mg/Ca composites produced by powder metallurgy[J]. Acta Biomaterialia, 2010, 6(5): 1783-1791.
[10] ZHANG S X, ZHANG X N, ZHAO C L, LI J N, SONG Y, XIE C Y, TAO H R, ZHANG Y, HE Y H, JIANG Y, BIAN Y J. Research on an Mg-Zn alloy as a degradable biomaterial[J]. Acta Biomaterialia, 2009, 6(2): 626--640.
[11] WITTE F, FEYERABEND F, MAIER P, FISCHER J, st ?RMER M, BLAWERT C, DIETZEL W, HORT N. Biodegradable magnesium–hydroxyapatite metal matrix composites[J]. Biomaterials, 2007, 28(13): 2163-2174.
[12] COELHO P G, COIMBRA M E, RIBEIRO C, FANCIO E, HIGA O, SUZUKI M, MARINCOLA M. Physico/chemical characterization and preliminary human histology assessment of a β-TCP particulate material for bone augmentation[J]. Materials Science and Engineering C, 2009, 29(7): 2085-2091.
[13] KOKUBO T, TAKADAMA H. How useful is SBF in predicting in vivo bone bioactivity?[J]. Biomaterials, 2006, 27(15): 2907-2915.
[14] American Society for Testing and Materials. Annual Book of ASTM Standards[M]. Philadelphia, PA: American Society for Testing and Materials, 2004.
[15] ZHOU W, SHEN T, AUNG N N. Effect of heat treatment on corrosion behaviour of magnesium alloy AZ91D in simulated body fluid[J]. Corrosion Science, 2010, 52(3): 1035-1041.
[16] SONG G L, ATRENS A, STJOHN D H, NAIRN J, LI Y. The electrochemical corrosion of pure magnesium in 1 N NaCl[J]. Corrosion Science, 1997, 39(5): 855-875.
[17] LI Z J, GU X N, LOU S Q, ZHENG Y F. The development of binary Mg-Ca alloys for use as biodegradable materials within bone[J]. Biomaterials, 2008, 29(10): 1329-1344.
(编辑 何学锋)
基金项目:粉末冶金国家重点实验室开放课题资金项目
收稿日期:2010-12-22;修订日期:2011-05-11
通信作者:余 琨,副教授,博士;电话: 0731-88879341;传真:0731-88876692; E-mail: kunyugroup@163.com
摘 要:以Mg-6%Zn合金为基体、β-Ca3(PO4)2为强化相,采用粉末冶金工艺制备Mg-6%Zn-10%(β-Ca3(PO4)2)复合材料。利用光学显微镜观察复合材料的显微组织,采用X射线衍射仪分析相组成,采用压缩试验评估复合材料力学性能,采用动电位极化法和浸泡实验研究复合材料在模拟体液(SBF)中的腐蚀行为。结果表明:β-Ca3(PO4)2在烧结过程中与基体合金没有发生明显反应;复合材料密度为1.936 g/cm3,压缩强度为339 MPa,弹性模量为24 GPa;添加β-Ca3(PO4)2可降低Mg-6%Zn在SBF中的腐蚀速度;Mg-6%Zn-10%(β-Ca3(PO4)2)复合材料在SBF中的电化学腐蚀速度为2.277 mm/y,浸泡30 d的浸泡腐蚀速度为2.133 mm/y,SBF的 pH值随着浸泡时间的延长而上升,最终稳定在10。


