文章编号: 1004-0609(2004)09-1525-05
富锂尖晶石Li1+xMn2-xO4的合成与性能
王志兴, 张宝, 李新海, 万智勇, 郭华军, 彭文杰
(中南大学 冶金科学与工程学院, 长沙 410083)
摘 要: 将MnO2和Li2CO3通过固相反应法合成了化学计量比的LiMn2O4和富锂型Li1+xMn2-xO4(x=0.02, 0.04, 0.06, 0.08, 0.1)。 研究表明, 所合成的样品均具有尖晶石结构, 无杂相存在, 样品的晶格常数随x值的增大而减小。 用SEM分析了样品的表面形貌, 发现掺锂可明显改善LiMn2O4一次颗粒表面的结构, 抑制表面裂纹的产生。 电化学性能测试表明, 随着掺锂量的提高, 电极的循环性能变好。 通过研究发现, Li1.04Mn1.96O4具有较高的初始容量和良好的循环性能, 因而, Li1.04Mn1.96O4是一种比较理想的锂离子电池正极材料。
关键词: 锂离子电池; 锰酸锂; 尖晶石; 掺杂; 电化学 中图分类号: TM912.2
文献标识码: A
Synthesis and performance of lithium-rich spinels Li1+xMn2-xO4
WANG Zhi-xing, ZHANG Bao, LI Xin-hai, WAN Zhi-yong, GUO Hua-jun, PENG Wen-jie
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: Stoichiometric and lithium-rich spinels Li1+xMn2-xO4(x=0, 0.02, 0.04, 0.06, 0.08, 0.1) were synthesized with MnO2 and Li2CO3 through solid-state reaction. The results show that the samples synthesized have spinel structure, and there are not other phases in samples. The microstructures of the samples were measured by scanning electron microscope. It shows that the surface structure of the primary particles is clearly improved, with less crack after lithium-doping. The measurement of electrochemical properties shows that the cycle ability and rate capability are also improved with the doping of lithium, which show that lithium-rich spinel Li1.04Mn1.96O4 is a promising cathode material for lithium ion batteries with good cycle ability and rate capability.
Key words: Li-ion batteries; lithium manganese oxide; spinel; doping; electrochemistry
锂离子电池是一种高性能的二次电池。 在众多的正极材料中, LiCoO2已被广泛用于商品化的锂离子电池[1]。 作为锂离子电池的正极材料, LiNiO2与LiCoO2具有相同的结构, 均为层状α-NaFeO2结构[2], 且容量比LiCoO2高, 但LiNiO2由于安全性等问题很难应用于实际生产[1]。 而LiMn2O4安全性好, 成本低廉, 资源丰富, 无毒性, 因此, 近10年来尖晶石结构锰酸锂的研究和应用越来越受到人们的关注。
然而, 阻碍尖晶石LiMn2O4作为正极被广泛应用的主要问题是LiMn2O4循环性能差[3-5]。 掺杂是改变其循环性能的一种较为有效的手段[6-8]。 钴、 镍和铬等离子的掺杂能够获得较好的循环性能, 但由于固相反应制备的尖晶石存在着掺杂离子分布不均匀的问题, 虽然采用Penchini法[9]进行湿化学反应可以获得较为均匀的产物, 但成本高, 难以工业化应用。 本文作者选择的掺杂离子为锂离子, 合成方法采用二次固相反应焙烧法。 锂掺杂可以在很宽范围内形成固溶体, 以保证产品良好的均匀性与单一相结构, 同时可以抑制Jahn-Teller效应[10], 改善循环性能。
1 实验
将Li2CO3和MnO2粉末按照组成Li1+xMn2-x-O4(x=0, 0.02, 0.04, 0.06, 0.08, 0.10)的化学计量比混合, 充分过筛混合, 然后将反应物送入马弗炉进行第一次焙烧, 在750℃下反应10h, 得到初次焙烧样品。 将第一次烧结的样品过筛, 于750℃下再反应10h, 冷却至700℃时保温5h, 然后自然降温。 根据样品合成条件的不同, 将其中一个样品冷却到650℃保温10h, 再自然降温。
将合成的正极活性物质Li1+xMn2-xO4(86g)、 AB(乙炔黑, 5g)和溶解于NMP(n-甲基吡咯烷酮)的PVDF(聚偏二氟乙烯)(9g)调成浆料。 将浆料用极片涂布机涂敷在铝箔上制成正极片。 用于测试的电池为063048方型电池, 以石墨作为负极, 正负极之间用多孔聚丙稀和聚乙烯复合隔膜(型号为Celgard 2400)隔开。 电解液是溶于体积分数为1∶1∶1的EC/DMC/EMC混合溶剂的LiPF6溶液, 其浓度为1mol/L。
采用日本Rigaku公司的X射线衍射仪对样品进行物相分析和晶格常数测量, 采用JEOL公司的JSM-5600LV扫描电镜观察样品的表面形貌, 采用BTS-51800型电化学测试系统(深圳市嵩和实业有限公司)对电池的电化学性能进行测试。 充电采用恒流/恒压相结合的方法, 放电则采用恒流的方法进行。 在(20±5)℃下, 以1C充电至4.2V后, 改为恒压(4.2V)充电, 直至充电电流小于10mA。 在放电速率特性测试中, 分别以0.2C、 1C和3C对电池进行放电, 终止电压为2.75V。 在循环性能测试中, 以1C对电池进行充放电, 反复50次。
2 结果与讨论
图1所示为不同掺锂量样品的XRD图。 与PDF标准卡片对照, 可看出合成的样品为LiMn2O4尖晶石结构, 无其它杂相存在, 且具有不同x值样品的衍射峰强度有较大变化, 主要是由于尖晶石中的锰离子被锂离子取代所致。 锂和锰的原子散射因子分别为2.2和22.1[11], 从而引起了衍射强度的降低, 锰被取代得越多, 晶面衍射强度就越小。

图1 富锂尖晶石Li1+xMn2-xO4样品的XRD图谱
Fig.1 XRD patterns of Li1+xMn2-xO4
图2所示为晶格常数随掺锂量的变化。 可以看出, 随着x的增大, 晶格常数变小, 当x从0增大到0.06时, 晶格常数变化呈线性下降趋势。 晶格常数的变化是由于阳离子在四面体和八面体位置的分配造成的, 由于Li+具有很强的四面体配位能力, 优先占据四面体位置(8a), 当8a位置被占满后, 多余的Li+占据八面体位置(16d), 从而引起了锰的平均化合价随x的增大而增大, 即Mn4+浓度增大。 由于Mn4+的半径(0.52)[9]比Mn3+的半径(0.70)[10]小, 从而导致晶格常数减小。

图2 富锂尖晶石Li1+xMn2-xO4晶格常数与x的关系
Fig.2 Relation between lattice parameters of Li1+xMn2-xO4 and x
从图2中还可以看出, 对于x=0.1的样品, 在第二次焙烧过程中, 采用较低的温度(650℃)处理, 可以获得较小的晶格常数。 Endres等[12]研究认为, 富锂尖晶石的晶格常数与锂和锰比呈线性关系。 但是, 图2中x=0.1的两个样品的晶格常数明显偏离该直线, 可能是由于在合成富锂尖晶石Li1+xMn2-xO4的过程中生成了氧缺陷尖晶石, 且随着x值的增大, 产生氧缺陷所需的最低温度也就越低, 因此, 在图中出现了x=0.10时的晶格常数偏离直线的现象。 当x=0.10时, 本实验中所选择的合成温度可能高于Li1.10Mn1.90O4产生氧缺陷的最低温度。 采取较低的热处理温度(650℃), 样品的晶格常数变小, Li1.10Mn1.90O4中的氧缺陷程度就减少, 从而使晶格常数靠近线性关系。
图3所示为所合成样品的SEM图像。 可以发现掺锂对样品的一次颗粒表面形貌有明显的影响。 不掺杂的锰酸锂晶粒表面存在明显的裂纹, 而掺锂后的锰酸锂晶粒表面裂纹消失, 同时, 晶粒边界的棱角也变得圆滑了。 形貌的变化可能与过量的锂对颗粒表面的熔合作用有关, 锂越过量, 熔合作用就越强。
图4所示为掺锂后锰酸锂的初次放电容量随x变化的关系。 由图4可以看出, 电池的初次放电容量随x的增大而减小。 但图4中存在一个异常情况, 即x=0的锰酸锂电极的初次放电容量明显低于x=0.02的锰酸锂的容量。 为了解释这一异常现象, 本文作者根据Ahn[13]等的研究方法, 引入一种研究样品结晶度的指数。 结晶度可以通过XRD衍射峰的锋利程度来表征, 而由Imax/β可计算峰的锋利度, 其中Imax是某一晶面上XRD衍射峰强度的最大值, β为峰半高宽(FWHM), 且这两个数据均可由XRD数据获得。 以(440)面为准, 分别计算了x=0, 0.02, 0.06和0.1时样品的结晶度Imax/β, 结果如图5所示。 比较图4和5可以发现, x=0.02样品的结晶度均比其他样品大, 而x=0样品的结晶度最小。 纯锰酸锂的容量低于x=0.02的样品的容量是由于纯锰酸锂的结晶度比较低造成的。
对不同样品的大电流放电性能进行了研究。 图6(a)和(b)分别为x=0和0.04的Li1+xMn2-xO4样品在0.2C、 1C和3C下的放电曲线。 对比图6中两个样品的0.2C放电曲线可以看出, 在4V左右有两个放电平台, 但这两个平台不十分明显。 当放电电流大于1C后, 这两个平台基本上区分不开。 比较两个样品的1C放电曲线可以看出, 未掺锂(x=0)样品的1C放电特性比掺锂的要差, 主要表现在1C倍率下的放电容量降低比0.2C倍率下的放电容量降低明显。 且从3C放电特性曲线可以看出, 掺锂后, 3C倍率下的放电平台平缓, 放电容量比未掺杂时高许多。 由此可以认为, 掺锂对尖晶石电极的放电特性, 尤其是高倍率下的放电特性有明显改善。

图3 富锂尖晶石Li1+xMn2-xO4的SEM像
Fig.3 SEM micrographs of Li1+xMn2-xO4

图4 富锂尖晶石Li1+xMn2-xO4初次放电容量与x的关系
Fig.4 Relation between initial discharge capacity of Li1+xMn2-xO4 and x
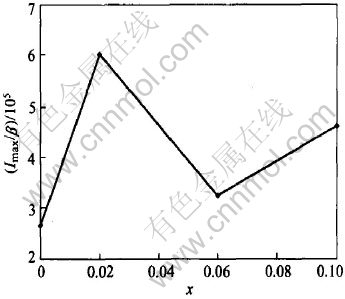
图5 富锂尖晶石Li1+xMn2-xO4样品结晶度(Imax/β)与x的关系
Fig.5 Relation between crystallizability (Imax/β) of Li1+xMn2-xO4 and x
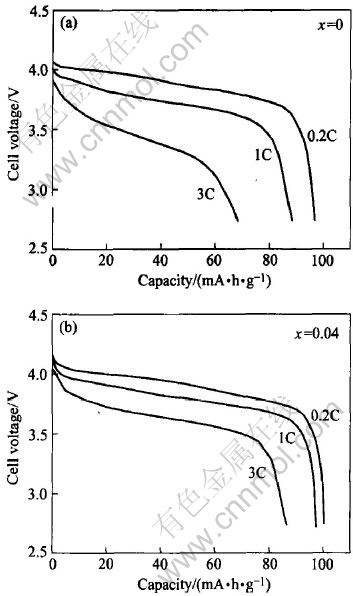
图6 富锂尖晶石Li1+xMn2-xO4样品在不同放电倍率下放电性能的比较
Fig.6 Comparison of discharge capability of Li1+xMn2-xO4 at different discharge rates
图7所示为掺锂量x为0~0.10时的富锂尖晶石Li1+xMn2-xO4样品的50次循环寿命和50次循环后的衰减率与锰平均化合价的关系。 从图7可以看出, 未掺锂(x=0)的尖晶石电极容量衰减大, 掺锂后其循环寿命有非常明显的改善。 当0≤x≤[CM(22]0.04时, 随着x的增大, 循环性能越好; 而当0.04≤x≤0.10时, 循环性能随着x的变化不是很明显。 因此, x=0.04是掺锂量的最佳值。
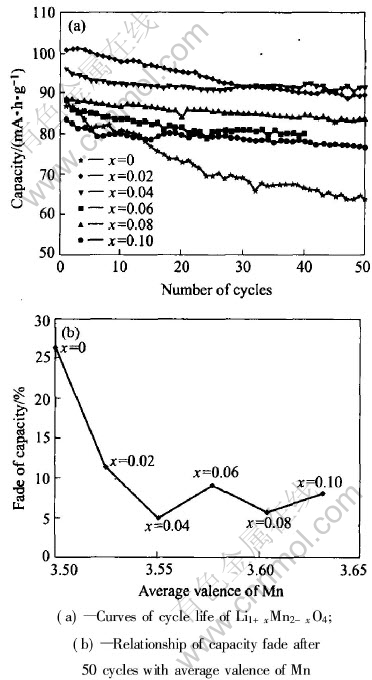
图7 掺杂量x对Li1+xMn2-xO4循环性能的影响
Fig.7 Effect of doped amount x on cycleability of Li1+xMn2-xO4
从容量衰减率与锰平均化合价的关系(图7(b))可以看出, 容量衰减基本上随着锰平均化合价的增大而减小。 由于Mn3+(d4)是一个有较强Jahn-Teller效应的离子, 在一定条件下尖晶石结构中的Mn3+-O6八面体发生变形, 而Mn3+配位体的形变必然影响锂离子的正常四面体配位结构, 变成不规则四面体, 因此, 不利于锂离子通过16c空位嵌入和嵌出, 从而使Li-Mn-O系正极材料容量衰减。 通过合成富锂尖晶石型Li1+xMn2-xO4可以降低Mn3+的浓度, 从而有效地抑制Jahn-Teller效应的发生。 由于富锂尖晶石Li1+xMn2-xO4可改善循环寿命, 因而, 尖晶石样品的容量衰减随锰平均化合价的增大而减小。 另一方面, 随着锰的平均化合价的提高, Mn-O6八面体中Mn—O的平均距离减小, 作用力增大[14], 尖晶石结构更加稳定, 因而, 有利于锂离子的嵌入和脱出, 改善了Li1+xMn2-xO4的循环性能。
3 结论
1) Li+部分取代Mn3+时, 取代量x从0增大到0.1时形成无杂相的尖晶石结构, Li1+xMn2-xO4的晶格常数在x〈0.06时, 随x的增大而呈线性减小, 但随着x值的进一步增大偏离线性关系。
2) 掺锂对LiMn2O4一次颗粒表面形貌有明显改善, 抑制了表面裂纹的产生。
3) 掺锂明显改善了LiMn2O4的大电流放电特性和循环性能, x=0.04是掺锂量的最佳值, 不仅有较高的比容量, 而且很好地改善了循环性能。
REFERENCES
[1]Pasquier A D, Blyr A, Courjal P. Mechanism for limited 55℃ storage performance of Li1.05Mn1.95O4 electrodes[J]. J Electrochem Soc, 1999, 146(2): 428-436.
[2]Tabuchi M, Masquelier C, Kobayashi H, et al. Characterization of Li1-δMn2-2δO4 defect spinel materials by their phase transition, magnetic and electrochemical properties[J]. J Power Source, 1997, 68(1/2): 623-628.
[3]Pistoia G, Antonini A, Rosati R, et al. Storage characteristics of cathodes for Li-ion batteries[J]. Electrochem Acta, 1996, 41(17): 2683-2689.
[4]Xia Y, Yoshio M. Studies on Li-Mn-O spinel system (obtained from melt-impregnation method) as a cathode for 4V lithium batteries. Part IV. High and low temperature performance of LiMn2O4[J]. J Power Source, 1997, 66(1/2): 129-133.
[5]Xia Y, Zhou Y, Yoshio M. Capacity fading on cycling of 4V Li/LiMn2O4 cells[J]. J Electrochem Soc, 1997, 144(8): 2593-2600.
[6]Song D, Ikuta H, Uchida T, et al. The spinel phases LiAlyMn2-yO4 (y=0, 1/12, 1/9, 1/6, 1/3) and Li-(Al, M)1/6Mn11/6O4(M=Cr, Co) as the cathode for rechargeable lithium batteries[J]. Solid State Ionics, 1999, 117(1/2): 151-156.
[7]Veluchamy A, Ikuta H, Wakihara M. Boron-substituted manganese spinel oxide cathode for lithium ion battery[J]. Solid State Ionics, 2001, 143(2): 161-171.
[8]Wakihara M. Recent developments in lithium ion batteries[J]. Materials Science and Engineering, 2001, 33(4): 109-134.
[9]Liu W, Kowal K, Farringtong C. Mechanism of the electrochemical insertion into LiMn2O4 spinel[J]. J Electrochem Soc, 1998, 145(2): 459-465.
[10]钱逸泰. 结晶化学[M]. 合肥: 中国科学技术大学出版社, 1988. 314-328.
QIAN Yi-tai. Crystalline Chemistry[M]. Hefei: Science and Technology of China Press, 1988. 314-328.
[11]李树棠. 晶体X射线衍射学基础[M]. 北京: 冶金工业出版社, 1999. 222-225.
LI Shu-tang. Basic X-Ray Diffraction of Crystal[M]. Beijing: Metallurgical Industry Press, 1999. 222-225.
[12]Endres P, Fuchs B, Sack S K, et al. Influence of processing on the Li∶Mn ratio in spinel phase of the system Li1+xMn2-xO4-δ[J]. Solid State Ionics, 1996, 89(3/4): 221-231.
[13]Ahn D S, Song M Y. Variations of the electrochemical properties of LiMn2O4 with synthesis conditions[J]. J Electrochem Soc, 2000, 147(3): 874-879.
[14]Nakai I, Shiraishi Y, Nishikaw F. Development of a new in suit cell for X-ray absorption fine structure analysis of the electrochemical reaction in a rechargeable battery and its application to lithium battery material Li1+yMn2-yO4[J]. Spectrochemica Acta(Part B), 1999, 54(1): 143-149.
基金项目: 教育部留学回国人员科研启动基金资助项目
收稿日期: 2003-09-26; 修订日期: 2004-05-08
作者简介: 王志兴(1970-), 男, 副教授, 博士.
通讯作者: 王志兴, 副教授; 电话: 0731-8836633; E-mail: zxwang@mail.csu.edu.cn


