文章编号:1004-0609(2013)12-3430-10
湿法炼锌窑渣铁精矿的浸出热力学分析
何仕超,刘志宏,刘智勇,李玉虎,李启厚
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:
为实现湿法炼锌窑渣磁选铁精矿(以下简称窑渣铁精矿)中银、铜、铁等有价元素的综合回收,提出一种基于盐酸浸出的新工艺,从理论和实验两方面开展研究。在本研究中介绍新工艺研究的理论部分——浸出热力学分析。物相分析表明:窑渣铁精矿中主要含铁物相为Fe、FeO、FeS、Fe2O3、Fe3O4和FeSiO3。计算绘制了Fe-Cl--H2O系φ—pH优势区图以及FeS、FeO、FeSiO3-H2O系和FeS、FeO、FeSiO3-Cl--H2O系的lg c —pH图,分析窑渣铁精矿盐酸浸出的热力学可行性。结果表明:各含铁物相在盐酸浸出中均能溶解,[Cl-]T越高,其溶解度就越大,由于不同阴离子在体系中溶解性质的差异,因此,Cl-影响FeO、FeS和FeSiO3溶解的pH范围不同,分别为4.2~10.8、0.4~10.8和0~10.8。
关键词:
窑渣铁精矿;浸出;热力学;电势(φ)—pH优势区图;浓度对数—pH图;
中图分类号:TF801.2 文献标志码:A
Thermodynamic analysis of leaching of iron concentrate separated from kiln slag in zinc hydrometallurgy
HE Shi-chao, LIU Zhi-hong, LIU Zhi-yong, LI Yu-hu, LI Qi-hou
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: For the propose of recovering valuable metals, such as Ag, Cu and Fe comprehensively, in the iron concentrate separated magnetically from kiln slag in zinc hydrometallurgy (hereinafter referred to as kiln slag iron concentrate), a new process of comprehensively utilizing kiln slag iron concentrate was proposed and investigated thermodynamically and experimentally. The first part of the research, i.e., thermodynamic analysis of leaching, was introduced. The phase analysis shows that the main iron containing phases in kiln slag iron concentrate are Fe, FeO, FeS, Fe2O3, Fe3O4 and FeSiO3. The φ—pH predominance diagram of Fe-Cl--H2O system, as well as the lg c —pH diagrams of FeS, FeO, FeSiO3-H2O system and FeS, FeO, FeSiO3-Cl--H2O system were calculated and plotted, aimed at analyzing the thermodynamic feasibility of hydrochloric acid leaching kiln slag iron concentrate. The analysis results show that all of iron phases in the kiln slag iron concentrate are able to dissolve in hydrochloric acid leaching, and the higher the [Cl-]T, the greater the solubility. Due to different natures of anions in the system, the effects of Cl- on the solubility of FeO, FeS and FeSiO3 are not the same, the pH value ranges valid in Cl- effect are 4.2-10.8 for FeO, 0.4-10.8 for FeS and 0-10.8 for FeSiO3.
Key words: kiln slag iron concentrate; leaching; thermodynamic analysis; φ—pH predominance diagram; lg c—pH diagram
我国2011年金属锌产量达446万t,其中约85%采用湿法生产。湿法炼锌有常规浸出、高温高酸浸出、常压及高压氧浸[1]等多种工艺,在我国均得到应用,其中常规浸出工艺产量约占我国湿法炼锌总产量的50%[2]。在常规浸出工艺中,焙烧矿经中性及低酸两段逆流浸出,所含Pb、Au、Ag、In、Ge、Ga及60%Cu、30%Cd和15%Zn进入浸出渣中[3]。浸出渣采用威尔兹法[4]进行处理,即干燥后配入45%~55%的焦粉,混合后送入回转窑,在1 100~1 300 ℃高温下,Zn、Pb和Cd等还原挥发产出次氧化锌,半熔融状态的炉渣从窑尾排出水淬成窑渣。
窑渣主要有价元素成分[5](质量分数)如下:0.7%~ 1.2% Cu、35%~40% Fe、15%~18% C、0.1~0.3 g/t Au、250~300 g/t Ag、100~250 g/t In和100~300 g/t Ge。采用常规湿法炼锌工艺,生产1 t电锌约产出浸出渣1.05 t,窑渣0.8 t。我国每年约产出窑渣150万t。窑渣的硬度高、粒度细,其成分、物相及其嵌布状态复杂,历经数十年研究,其综合回收工艺仍未取得突破,以往一般进行堆存处理,造成资源浪费及环境污染。近年来,国内部分企业采用重选和磁选相结合的方法处理窑渣,分别得到焦粉、铁精矿和尾矿等产物。焦粉作为燃料利用,尾矿用于水泥生产。铁精矿富集了Cu、Ag和In等有价金属,Fe含量达65%(质量分数)左右,可作为炼铅熔剂利用,Cu、Ag和In等有价金属能得到部分回收,随着烧结-鼓风炉炼铅工艺的淘汰,这一方面的应用日渐减少;也可用作炼铁原料,但由于其S、Zn和As等的含量较高只能少量掺用,同时,其中所含Cu、Ag和In也未得到利用[6-9]。为有效利用窑渣铁精矿资源,提出一种基于盐酸浸出处理窑渣铁精矿的新工艺,从浸出、溶液净化和有价元素综合回收等方面开展研究。
1 窑渣铁精矿的主要成分及含铁物相
实验所用窑渣铁精矿由国内某企业提供,采用化学分析方法检测其主要化学成分及含铁物相组成,结果如表1和2所列。窑渣铁精矿中,回收利用价值较大的主要元素为Fe、Cu和Ag。含铁物相有Fe3O4、Fe、FeS、FeSiO3、Fe2O3和FeSO4。
表1 窑渣铁精矿的主要化学成分
Table 1 Main chemical composition of kiln slag iron concentrate (mass fraction, %)

表2 窑渣铁精矿中铁的物相组成
Table 2 Iron phase composition of kiln slag iron concentrate (mass fraction, %)

2 窑渣铁精矿综合利用工艺流程
窑渣铁精矿综合利用工艺流程如图1所示,由盐酸浸出、银与铜回收、溶液净化及FeCl2溶液喷雾热分解4步主要工序组成,可实现Ag、Cu和Fe等有价元素的综合回收及盐酸的循环利用。
3 窑渣铁精矿盐酸浸出热力学
窑渣铁精矿中主要含铁物相为Fe3O4、Fe、FeSiO3和FeS,计算绘制Fe-Cl--H2O系φ—pH优势区图以及FeS、FeO、FeSiO3-H2O系和FeS、FeO、FeSiO3-Cl--H2O系的lg c —pH图,以分析窑渣铁精矿盐酸浸出的热力学可行性。
3.1 Fe-Cl--H2O系φ—pH优势区图
利用软件FactSage[10]计算绘制Fe-Cl--H2O系φ—pH优势区图,如图2所示。由图2可见,盐酸浸出中,窑渣铁精矿中的Fe、FeO、Fe3O4和Fe2O3均可能溶解,溶液中铁离子的存在形态,取决于铁精矿中Fe和Fe(Ⅲ)的相对含量。金属Fe及其氧化物浸出的主要反应为
Fe+2HCl=Fe2++H2↑+2Cl- (1)
FeO+2HCl=Fe2++H2O+2Cl- (2)
Fe3O4+8HCl=Fe2++2FeCl2++4H2O+4Cl- (3)
Fe2O3+6HCl=2FeCl2++3H2O+2Cl- (4)
2FeCl2++Fe=3Fe2++4Cl- (5)
2FeCl2++H2=2Fe2++2HCl+2Cl- (6)
由表2可知,窑渣中金属Fe含量(质量分数)为16.63%,而根据Fe3O4和Fe2O3含量计算确定其Fe(Ⅲ)含量为34.4%,高于金属Fe的含量。因此,浸出液中除Fe2+外,还有部分(FeCl2)+存在。
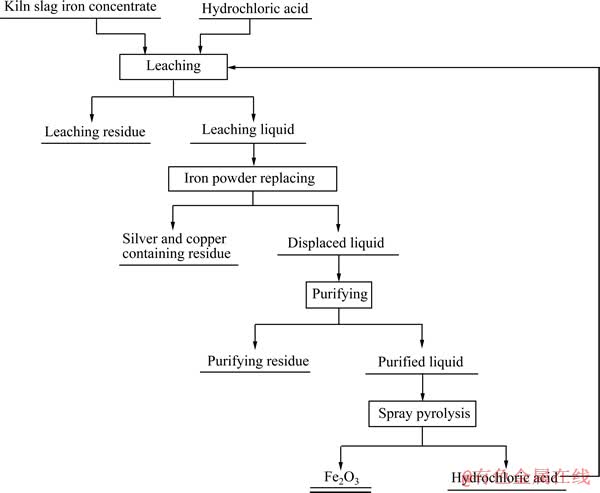
图1 窑渣铁精矿综合利用工艺流程
Fig. 1 Flow sheet of comprehensive utilization of kiln slag iron concentrate
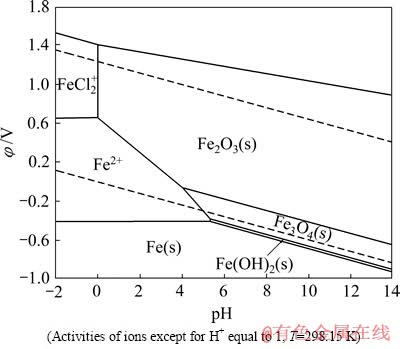
图2 Fe-Cl--H2O系的φ—pH优势区图
Fig. 2 φ—pH predominance diagram of Fe-Cl--H2O system
3.2 FeO、FeS、FeSiO3-Cl--H2O系的lg c—pH图
3.2.1 模型的建立和热力学数据
1) 主要反应及其平衡常数计算式
FeO、FeS、FeSiO3-Cl--H2O系是比较复杂的体系,其中包括难溶铁化合物的离解、Fe2+与Cl-形成配合物、Fe2+以及离解出的弱酸根离子的水解反应等。主要反应及其平衡常数计算如式(7)~(14)所示。
FeO+2H+=Fe2++H2O
 ,K=[Fe2+]/[H+]2 (7)
,K=[Fe2+]/[H+]2 (7)
FeS=Fe2++S2-
Ksp=[Fe2+][S2-],pKsp=17.2 (8)
H2S=H++HS-
Ka1=[HS-][ H+]/[ H2S],pKa1=6.92 (9)
HS-=H++S2-
Ka2=[H+][S2-]/[HS-],pKa2=12.90 (10)
FeSiO3=Fe2++SiO32-
Ksp=[Fe2+][SiO32-],pKsp=25.554 (11)
H2SiO3(aq)=H++HSiO3-
Ka3=[HSiO3-][ H+]/[H2SiO3(aq)],pKa3=9.77 (12)
HSiO3-=H++SiO32-
Ka4=[SiO32-][H+]/[HSiO3- ],pKa4=11.8 (13)
Fe2++iH2O=Fe(OH)i(2-i)+iH+,i=1, 2, 3, 4 (14)
2) 计算数学模型
根据同时平衡和电中性原理[11-13],由式(7)~(14)可得各化合物溶解平衡时,各离子浓度的质量平衡方程式:
① 体系中Fe(II)离子总浓度([Fe2+]T)
[Fe2+]T = [Fe2+] + (15)
(15)
② 体系中含Cl-离子总浓度([Cl-]T)
[Cl-]T = [Cl-] + [FeCl+] + 2[FeCl2(aq)] (16)
③ FeS-Cl--H2O系含S2-离子总浓度([S2-]T)
[S2-]T = [S2-] + [HS-] + [H2S(aq)] (17)
④ FeS-Cl--H2O系中[Fe2+]T与[S2-]T相等
[Fe2+]T = [S2-]T (18)
⑤ FeSiO3-Cl--H2O系含Si(Ⅳ)离子总浓度([Si]T)
[Si]T = [SiO32-] + [HSiO3-] + [H2SiO3(aq)] (19)
⑥ FeSiO3-Cl--H2O系中[Fe2+]T与[Si]T相等
[Fe2+]T=[Si]T (20)
⑦ FeO-Cl--H2O系电荷平衡方程
2[Fe2+]T + [H+] =[Cl-]T + [OH-] (21)
⑧ FeS-Cl--H2O系电荷平衡方程
2[Fe2+]T + [H+] =[Cl-]T + 2[S2-] + [HS-]+ [OH-] (22)
⑨ FeSiO3-Cl--H2O系电荷平衡方程
2[Fe2+]T + [H+] =[Cl-]T + 2[SiO32-] + [HSiO3-] + [OH-] (23)
联立式(15)、(16)和(21)计算FeO-Cl--H2O系;联立式(15)~(18)和(22)计算FeS-Cl--H2O系;联立式(15)、(16)、(19)、(20)和(23)计算FeSiO3-Cl--H2O系。
3) 热力学数据
计算所用各物质热力学数据及其出处列于表3[14]和表4[14]。
3.2.2 FeO、FeS、FeSiO3-H2O系
FeO、FeS、FeSiO3-H2O系lg[Fe2+]T—pH曲线如图3所示。由图3可知,在强酸性水溶液中,FeO和FeS的溶解度较大,而FeSiO3也有一定量的溶解。FeSiO3和FeS的溶解度曲线分别在pH值等于a和b处,即0.73和2.32处,出现明显转折,原因是当pH值小于0.73时,FeSiO3的溶解使得H2SiO3(aq)达到饱和,析出无定型SiO2[15];而当pH值小于2.32时,FeS的溶解使得H2S(aq)达到饱和,溢出H2S气体[16]。 FeO、FeS和FeSiO3溶解度大小顺序在c点(pH值为9.38)发生改变,当pH值小于9.38时,溶解度由大到小的顺序为FeO、FeS、FeSiO3;当pH值大于9.38时,溶解度由大到小的顺序改变为 FeS、FeO、FeSiO3。
3.2.3 FeO-Cl--H2O系
图4所示为FeO-Cl--H2O系的lg[Fe2+]T—pH图。曲线1~6分别对应于[Cl-]T为 0、0.01、0.1、1、3和6 mol/L。由图4可见,当[Cl-]T较低时,Cl-的存在几乎不会对FeO的溶解度产生影响,但随着[Cl-]T的增大,FeO的溶解度逐渐增大。当pH值大于10.5时,[Cl-]T又几乎不再对FeO的溶解度产生影响,因为在此pH值范围内,溶解于水溶液中的FeO主要以Fe(OH)2(aq)和少量的Fe(OH)+存在,而FeCl+几乎消失,如图5所示。因此,当pH值大于10.5,Cl-不再对FeO的溶解度产生影响。
表3 体系中相关物种的标准吉布斯自由能(T=298.15 K)[14]
Table 3 Standard Gibbs free energies of related species in systems (T=298.15 K)[14]

表4 Fe(Ⅱ)离子配位平衡及其稳定常数 (T=298.15 K)[14]
Table 4 Stability constants in Fe(Ⅱ) ion coordination equilibrium (T=298.15 K)[14]


图3 FeO、FeS和FeSiO3-H2O系lg[Fe2+]T—pH图
Fig. 3 lg[Fe2+]T—pH diagrams of FeO, FeS and FeSiO3-H2O systems
图5所示为FeO-Cl--H2O系含铁组元分布图。从图5(a)可以看出,当体系中不存在Cl-时,酸性溶液中主要以Fe2+存在,当pH 值为6时,出现Fe(OH)+;随pH值升高,其所占比例逐渐上升,在pH值为9左右达到最大,Fe(OH)2(aq)在pH值为8左右时开始出现,在pH值达12左右,水溶液中溶解的FeO几乎全部以Fe(OH)2(aq)形式存在,pH值继续增加,溶液中依次出现Fe(OH)3-和Fe(OH)42-。

图4 FeO-Cl--H2O系的lg[Fe2+]T—pH图
Fig. 4 lg[Fe2+]T—pH diagram of FeO-Cl--H2O system

图5 FeO-Cl--H2O系含铁组元分布图
Fig. 5 Distribution diagrams of species containing iron in FeO-Cl--H2O system
图5(b)~(f)表明,随着[Cl-]T浓度增加,Fe2+、FeCl+、FeCl2(aq)和Fe(OH)+的分布变化明显。pH值小于4.2为Fe2+的优势区域;pH值在4.2~10.8的范围内,Fe2+和Fe(OH)+的优势区域随着[Cl-]T的增加而被FeCl+和FeCl2(aq)所取代,随着[Cl-]T的继续增加,FeCl+的优势区域进一步被FeCl2(aq)所取代,最终FeCl2(aq)为在此 pH值范围内的优势组元。而Fe(OH)2(aq)、Fe(OH)3-和Fe(OH)42-形成的pH值范围及其摩尔分数基本没有变化。
3.2.4 FeS-Cl--H2O系
图6(a)和(b)所示分别为FeS-Cl--H2O系的lg[Fe2+]T—pH和lg[S2-]T—pH图。曲线1~6分别对应于[Cl-]T为 0、0.01、0.1、1、3和6 mol/L。由图6(a)可见,当[Cl-]T浓度比较低时,Cl-不会对FeS在水溶液中的溶解度产生明显影响;随着[Cl-]T浓度不断增大,FeS在水溶液中的溶解度明显增大。当pH值大于11时,[Cl-]T又几乎不再对FeS的溶解度产生影响,因为此时溶解的Fe(II)离子主要以Fe(OH)2(aq)和少量的Fe(OH)+形式存在,FeCl+离子几乎消失,如图7所示。
此外,曲线1~6分别在pH值为2.318、2.322、2.356、2.566、2.760和2.899处出现转折,溶解度曲线随pH值增大变化趋于平缓。这是因为当pH值低于这些点时,体系中会有H2S气体溢出,反应式为H2S(aq)= H2S(g)[17],这些点即为H2S气体逸出的临界pH值。
由图6(b)可见,在临界pH值之前,溶液中的[H2S(aq)]达到饱和,而在此之后,[H2S(aq)]未饱和。
图7所示为FeS-Cl--H2O系含铁组元分布图。从图7(a)可以看出,在不含Cl-的水溶液中,FeS的溶解行为与FeO相似。由图7(b)~(f)可见,随着[Cl-]T浓度增加,Fe2+、FeCl+、FeCl2(aq)和Fe(OH)+分布变化明显。当pH值小于4时,含铁组元主要为Fe2+。pH值在0.4~10.8范围内,随着[Cl-]T的增加,Fe2+和Fe(OH)+的优势区域逐渐由FeCl+和FeCl2(aq)取代,同时随着[Cl-]T的进一步增加,FeCl+又被FeCl2(aq)所取代,最终FeCl2(aq)成为这一pH范围内的优势组元。Fe(OH)2(aq)、Fe(OH)3-和Fe(OH)42-形成的pH范围基本没有变化,其所占摩尔分数也基本未改变。
3.2.5 FeSiO3-Cl--H2O系
图8(a)和(b)所示分别为FeSiO3-Cl--H2O系lg[Fe2+]T—pH和lg[Si]T—pH图。曲线1~6分别对应于[Cl-]T为 0、0.01、0.1、1、3和6 mol/L。

图6 FeS-Cl--H2O系的lg[Fe2+]T—pH和lg[S2-]T—pH图
Fig. 6 lg[Fe2+]T—pH(a) and lg[S2-]T—pH(b) diagrams of FeS-Cl--H2O system
由图8(a)可见,当[Cl-]T较低时,Cl-不会对FeSiO3的溶解度产生明显影响;随着[Cl-]T不断增大,FeSiO3的溶解度明显增大。当pH值大于10时,[Cl-]T几乎不对FeSiO3的溶解度产生影响,这是因为在此pH值范围内,溶液中Fe(Ⅱ)主要以Fe(OH)2(aq)和Fe(OH)+形式存在,FeCl+几乎消失,如图9所示。
此外,曲线1~6分别在pH值为0.728、0.733、0.773、0.986、1.176和1.312处发生转折,溶解度曲线随pH值增大变化趋于平缓,这是因为当pH值小于这些点时,体系中会伴随无定型SiO2析出。反应式为SiO2(amorph)+H2O=H2SiO3(aq)[18-19],Ks=1.99×10-3。这些点即为无定形SiO2过饱和析出的临界pH值。
由图8(b)可见,在临界pH值前,溶液中溶解的[Si]T保持不变,因为在这个pH范围内,H2SiO3(aq)溶解达到饱和,无定型SiO2从水溶液中析出。达到临界pH值之后,溶解的H2SiO3(aq)未达到饱和。
图9所示为FeSiO3-Cl--H2O系含铁组元分布图。从图9(a)可以看出,FeSiO3在不含Cl-的水溶液溶解,溶液含铁组元分布图与前面讨论过的FeO和FeS的相似。随着[Cl-]T增加,Fe2+、FeCl+和FeCl2(aq)在形成的pH范围没有出现明显的变化,Fe2+、FeCl+和FeCl2(aq)几乎出现在同一pH值范围,即0~10.8。随着[Cl-]T浓度的增加,Fe2+、FeCl+、FeCl2(aq)和Fe(OH)+的分布变化最为明显。在pH值0~10.8范围内,Fe2+和Fe(OH)+的优势区域随着[Cl-]T的增加而被FeCl+和FeCl2(aq)所取代。同时,随着[Cl-]T的继续增加,FeCl+的优势区域进一步被FeCl2(aq)所取代,最终FeCl2(aq)为这一pH范围内的优势组元。Fe(OH)2(aq)、Fe(OH)3-和Fe(OH)42-存在的pH范围基本没有变化,其摩尔分数也几乎无改变。

图7 FeS-Cl--H2O系含铁组元分布图
Fig. 7 Distribution diagrams of species containing iron in FeS-Cl--H2O system

图8 FeSiO3-Cl--H2O系的lg[Fe2+]T—pH和lg[Si]T—pH图
Fig. 8 lg[Fe2+]T—pH (a) and lg[Si]T—pH (b) diagrams of FeSiO3-Cl--H2O system

图9 FeSiO3-Cl--H2O系含铁组元分布图
Fig. 9 Distribution diagrams of species containing iron in FeSiO3-Cl--H2O system
4 结论
1) 绘制了Fe-Cl--H2O系φ—pH优势区图。由图可知,窑渣铁精矿采用盐酸水溶液浸出,其中的含铁物相均能溶解。同时,由于窑渣铁精矿中金属Fe含量低于Fe(Ⅲ)的含量,在酸性较强的条件下,溶液中含铁组元主要为Fe2+和FeCl2+。
2) FeO和FeS在酸性条件下有较大的溶解度,FeSiO3-在酸性较强的条件下,也有一定量的溶解。
3) 弱电解质阴离子S2-、HS-以及SiO32-、HSiO3-在水溶液中水解, H2S(aq)和H2SiO3(aq)溶解饱和并分别以H2S气体和无定型SiO2固体的形式析出,从而使其溶解度曲线在一定pH值下发生转折,随着水溶液中的[Cl-]T浓度的增加,转折点沿pH值增大的方向移 动。
4) Cl-对FeO、FeS和FeSiO3在酸性水溶液中的溶解度有一定影响,在一定pH范围内,[Cl-]T越高,三者的溶解度就越大,由于不同阴离子在体系中溶解性质的差异,因此,Cl-对FeO、FeS和FeSiO3溶解影响的pH范围也不相同,分别为4.2~10.8、0.4~10.8和0~10.8。
REFERENCES
[1] 彭容秋. 锌冶金[M]. 长沙: 中南大学出版社, 2005.
PENG Rong-qiu. Zinc metallurgy[M]. Changsha: Central South University Press, 2005.
[2] 梅光贵, 王德润, 周敬元, 王 辉. 湿法炼锌学[M]. 长沙: 中南大学出版社, 2001.
MEI Guang-gui, WANG De-run, ZHOU Jing-yuan, WANG Hui. Hydrometallurgy of zinc[M]. Changsha: Central South University Press, 2001.
[3] 王 辉. 湿法炼锌工业挥发窑窑渣资源化综合循环利用[J]. 中国有色冶金, 2007(6): 46-50.
WANG Hui. Intergraded cycling utilization of volatilizing kiln slag during zinc hydrometallurgy[J]. China Nonferrous Metallurgy, 2007(6): 46-50.
[4] 李 静, 牛 皓, 彭金辉, 张世敏, 张利波, 魏 昶, 范兴祥, 黄孟阳. 锌窑渣综合回收利用研究现状及展望[J]. 矿产综合利用, 2008(6): 44-48.
LI Jing, NIU Hao, PENG Jing-hui, ZHANG Shi-min, ZHANG Li-bo, WEI Chang, FAN Xing-yang, HUANG Meng-yang. Present situation and prospect about comprehensive utilization of zinc kiln slags[J]. Multipurpose Utilization of Mineral Resources, 2008(6): 44-48.
[5] 王 辉. 锌挥发窑渣物理分选回收工艺研究[J]. 稀有金属与硬质合金, 2007, 35(1): 31-35.
WANG Hui. Study of recovery of value metals from waelz clinker by physical separation[J]. Rare Metals and Cemented Carbides, 2007, 35(1): 31-35.
[6] 刘洪萍. 锌浸出渣处理工艺简述[J]. 云南冶金, 2009, 38(4): 34-37.
LIU Hong-ping. Surveying the disposal process of zinc leaching-slag[J]. Yunnan Metallurgy, 2009, 38(4): 34-37.
[7] 胡天觉, 曾光明, 袁兴中. 湿法炼锌废渣中硫脲浸出银的动力学[J]. 中国有色金属学报, 2001, 11(5): 933-937.
HU Tian-jue, ZENG Guang-ming, YUAN Xing-zhong. Leaching kinetics of silver extracted by thiourea from residue in hydrometallurgy of zinc[J]. The Chinese Journal of Nonferrous Metals, 2001, 11(5): 933-937.
[8] 黄柱成, 蔡江松, 杨永斌, 邓国芳, 郭宇峰, 李光辉, 张登凯. 浸锌渣中有价元素的综合利用[J]. 矿产综合利用, 2002(3): 46-49.
HUANG Zhu-cheng, CAI Jiang-song, YANG Yong-bin, DENG Guo-fang, GUO Yu-feng, LI Guang-hui, ZHANG Deng-kai. Comprehensive recovery of valuable elements from zinc- leaching residue[J]. Multipurpose Utilization of Mineral Resources, 2002(3): 46-49.
[9] BIAN Xue, YIN Shao-hua, LUO Yao, WU Wen-yuan. Leaching kinetics of bastnaesite concentrate in HCl solution[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(10): 2306-2310.
[10] 曹战民, 宋晓艳, 乔芝郁. 热力学模拟计算软件FactSage及其应用[J]. 稀有金属, 2008, 32(4): 216-219.
CAO Zhan-min, SONG Xiao-yan, QIAO Zhi-yu. Thermodynamic modeling software FactSage and it application[J]. Chinese Journal of Rare Metals, 2008, 32(4): 216-219.
[11] 秦毅红, 王云燕. Bi3+-Cl--H2O系热力学平衡[J]. 中国有色金属学报, 2000, 10(2): 243-249.
QIN Yi-hong, WANG Yun-yan. Thermodynamics equilibrium of Bi3+-Cl--H2O system[J]. The Chinese Journal of Nonferrous Metals, 2000, 10(2): 243-249.
[12] 王瑞祥, 唐谟堂, 杨建广, 杨声海, 张文海, 唐朝波, 何 静. Zn(Ⅱ)-NH3-Cl--CO32--H2O体系中Zn(Ⅱ)配合平衡[J]. 中国有色金属学报, 2008, 18(S1): s192-s198.
WANG Rui-xiang, TANG Mo-tang, YANG Jian-guang, YANG Sheng-hai, ZHANG Wen-hai, TANG Chao-bo, HE Jing. Thermodynamics of Zn(Ⅱ) complex equilibrium in system of Zn(Ⅱ)-NH3-Cl--CO32--H2O[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(S1): s192-s198.
[13] 张传福, 姚永林, 湛 青. Fe2+-Ni2+-NH3-NH4+-C2O42--H2O体系的沉淀-配合平衡热力学[J]. 中国有色金属学报, 2012, 22(12): 2938-2943.
ZHANG Chuan-fu, YAO Yong-lin, ZHAN Jing. Thermodynamics of precipitation–coordination equilibrium in Fe2+-Ni2+-NH3- NH4+-C2O42--H2O system[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(12): 2938-2943.
[14] DEAN J A. 兰氏化学手册[M]. 2版. 北京: 科学出版社, 2003.
DEAN J A. Lange’s handbook of chemistry[M]. 2nd ed. Beijing: Science Press, 2003.
[15] 熊 瑶, 李 春, 梁 斌, 谢 军. 盐酸浸出自然冷却含钛高炉渣[J]. 中国有色金属学报, 2008, 18(3): 558-563.
XIONG Yao, LI Chun, LIANG Bin, XIE Jun. Leaching behavior of air cooled Ti-bearing blast-furnace slag in hydrochloric acid[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(3): 558-563.
[16] 大连理工大学无机化学教研室. 无机化学[M]. 4版. 北京: 高等教育出版社, 2000.
Department of Inorganic Chemistry in Dalian University of Technology. Inorganic chemistry[M]. 4th ed. Beijing: Higher Education Press, 2000.
[17] 牟望重, 张廷安, 吕国志, 古 岩, 豆志河. 硫化锌氧压浸出过程的φ—pH图[J]. 中国有色金属学报, 2010, 20(8): 1636-1644.
MU Wang-zhong, ZHANG Ting-an,  Guo-zhi, GU Yan, DOU Zhi-he. φ—pH figure during oxidative pressure leaching of zinc sulfide[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(8): 1636-1644.
Guo-zhi, GU Yan, DOU Zhi-he. φ—pH figure during oxidative pressure leaching of zinc sulfide[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(8): 1636-1644.
[18] 刘智勇, 刘志宏, 曹志阎, 李启厚, 杨天足. 硅锌矿在(NH4)2SO4-NH3-H2O体系中的浸出机理[J]. 中国有色金属学报, 2011, 21(11): 2929-2935.
LIU Zhi-yong, LIU Zhi-hong, CAO Zhi-yan, LI Qi-hou, YANG Tian-zu. Leaching mechanism of willemite in (NH4)2SO4- NH3-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(11): 2929-2935.
[19] ILER R K. The chemistry of silica (Ⅰ)—Solubility, polymerization, colloid and surface properties, and biochemistry [M]. New York: Wiley-Interscience, 1979.
(编辑 陈卫萍)
基金项目:教育部新世纪优秀人才计划资助项目(NCET-11-0517);中国博士后科学基金面上项目(2012M521544)
收稿日期:2013-01-03;修订日期:2013-05-20
通信作者:刘志宏,教授,博士;电话:0731-88830478;E-mail: zhliu@csu.edu.cn
摘 要:为实现湿法炼锌窑渣磁选铁精矿(以下简称窑渣铁精矿)中银、铜、铁等有价元素的综合回收,提出一种基于盐酸浸出的新工艺,从理论和实验两方面开展研究。在本研究中介绍新工艺研究的理论部分——浸出热力学分析。物相分析表明:窑渣铁精矿中主要含铁物相为Fe、FeO、FeS、Fe2O3、Fe3O4和FeSiO3。计算绘制了Fe-Cl--H2O系φ—pH优势区图以及FeS、FeO、FeSiO3-H2O系和FeS、FeO、FeSiO3-Cl--H2O系的lg c —pH图,分析窑渣铁精矿盐酸浸出的热力学可行性。结果表明:各含铁物相在盐酸浸出中均能溶解,[Cl-]T越高,其溶解度就越大,由于不同阴离子在体系中溶解性质的差异,因此,Cl-影响FeO、FeS和FeSiO3溶解的pH范围不同,分别为4.2~10.8、0.4~10.8和0~10.8。
[1] 彭容秋. 锌冶金[M]. 长沙: 中南大学出版社, 2005.
PENG Rong-qiu. Zinc metallurgy[M]. Changsha: Central South University Press, 2005.
[2] 梅光贵, 王德润, 周敬元, 王 辉. 湿法炼锌学[M]. 长沙: 中南大学出版社, 2001.
[3] 王 辉. 湿法炼锌工业挥发窑窑渣资源化综合循环利用[J]. 中国有色冶金, 2007(6): 46-50.
[4] 李 静, 牛 皓, 彭金辉, 张世敏, 张利波, 魏 昶, 范兴祥, 黄孟阳. 锌窑渣综合回收利用研究现状及展望[J]. 矿产综合利用, 2008(6): 44-48.
[5] 王 辉. 锌挥发窑渣物理分选回收工艺研究[J]. 稀有金属与硬质合金, 2007, 35(1): 31-35.
[6] 刘洪萍. 锌浸出渣处理工艺简述[J]. 云南冶金, 2009, 38(4): 34-37.
[7] 胡天觉, 曾光明, 袁兴中. 湿法炼锌废渣中硫脲浸出银的动力学[J]. 中国有色金属学报, 2001, 11(5): 933-937.
[8] 黄柱成, 蔡江松, 杨永斌, 邓国芳, 郭宇峰, 李光辉, 张登凯. 浸锌渣中有价元素的综合利用[J]. 矿产综合利用, 2002(3): 46-49.
[10] 曹战民, 宋晓艳, 乔芝郁. 热力学模拟计算软件FactSage及其应用[J]. 稀有金属, 2008, 32(4): 216-219.
[11] 秦毅红, 王云燕. Bi3+-Cl--H2O系热力学平衡[J]. 中国有色金属学报, 2000, 10(2): 243-249.
[14] DEAN J A. 兰氏化学手册[M]. 2版. 北京: 科学出版社, 2003.
DEAN J A. Lange’s handbook of chemistry[M]. 2nd ed. Beijing: Science Press, 2003.
[15] 熊 瑶, 李 春, 梁 斌, 谢 军. 盐酸浸出自然冷却含钛高炉渣[J]. 中国有色金属学报, 2008, 18(3): 558-563.
[16] 大连理工大学无机化学教研室. 无机化学[M]. 4版. 北京: 高等教育出版社, 2000.
[17] 牟望重, 张廷安, 吕国志, 古 岩, 豆志河. 硫化锌氧压浸出过程的φ—pH图[J]. 中国有色金属学报, 2010, 20(8): 1636-1644.
[18] 刘智勇, 刘志宏, 曹志阎, 李启厚, 杨天足. 硅锌矿在(NH4)2SO4-NH3-H2O体系中的浸出机理[J]. 中国有色金属学报, 2011, 21(11): 2929-2935.


