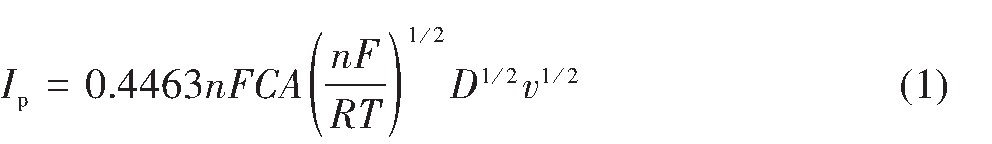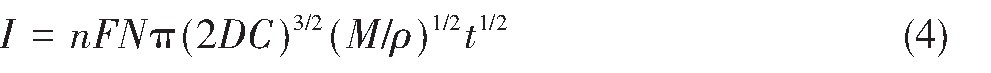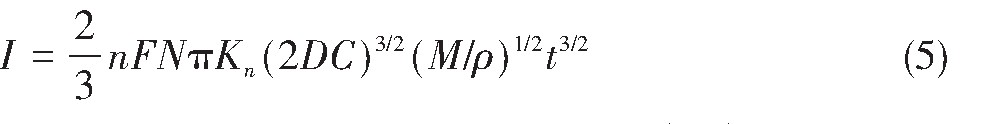网络首发时间: 2019-05-07 16:59
NaCl-KCl-K2TiF6熔盐Ti4+在钨电极上的电化学还原机制
江西理工大学冶金与化学工程学院
摘 要:
采用钨丝作为工作电极,钨棒作为辅助电极,铂丝作为参比电极的三电极体系,以NaCl-KCl为电解质,以氟钛酸钾为原料,通过循环伏安法(CV)、线性扫描伏安法(LSV)、计时电位法(CP)以及计时电流法(CA)4种电化学测试方法,分别研究了1073 K时在42.62%NaCl-54.38%KCl-3%K2TiF6熔盐中Ti4+在钨电极上的电化学还原过程,以及熔盐中Ti4+在钨电极上的电化学结晶成核方式。循环伏安测试结果表明:1073 K时在42.62%NaCl-54.38%KCl-3%K2TiF6熔盐中Ti4+在钨电极上的电化学还原为4步反应过程,每步反应均转移1个电子,且电极反应受扩散控制,电极反应方程式为:Ti4++e-→Ti3+,Ti3++e-→Ti2+,Ti2++e-→Ti+,Ti++e-→Ti。线性扫描伏安测试结果与循环伏安测试结果一致,并且进一步通过计时电位测试结果验证了循环伏安测试与线性扫描伏安测试结果的正确性。通过对计时电流测试数据拟合得出:1073 K时在42.62%NaCl-54.38%KCl-3%K2TiF6熔盐中Ti4+的扩散系数为3.692×10-5cm2·s-1,以及熔盐中Ti4+在钨电极上的电结晶成核方式为瞬时成核。
关键词:
中图分类号: TG146.23
作者简介:田亚斌(1993-),男,陕西兴平人,硕士研究生,研究方向:熔盐电化学,E-mail:1224724941@qq.com;;*杨少华,教授,电话:0797-8316980,E-mail:xizi527@163.com;
收稿日期:2019-03-28
基金:国家自然科学基金项目(51664022)资助;
Electrochemical Reduction Mechanism of Ti4+ on Tungsten Electrode in NaCl-KCl-K2TiF6 Molten Salt
Tian Yabin Huang Jingming Ye Changmei Dong Quan Wang Zhaowen Yang Shaohua
School of Metallurgy and Chemical Engineering,Jiangxi University of Science and Technology
Abstract:
Electrochemical reduction mechanism of Ti4+on the tungsten electrode in 42.62%NaCl-54.38%KCl-3%K2 TiF6 molten salt at 1073 K was studied by cyclic voltammetry(CV),linear sweep voltammetry(LSV),chronopotentiometry(CP)and chronoamperometry(CA)in addition to the electrochemical crystallization nucleation mode of Ti4+on tungsten electrode,using tungsten wire as working electrode,tungsten rod as auxiliary electrode,platinum wire as reference electrode,NaCl-KCl as electrolyte and K2 TiF6 as raw material. Cyclic voltammetry results displayed that electrochemical reduction process of Ti4+on tungsten electrode in 42.62%NaCl-54.38%KCl-3%K2 TiF6 molten salt at 1073 K was a 4-step reaction process,an electron transfered in every step reaction and the electrode reaction was controlled by diffusion,the electrode reaction equation:Ti4++e-→Ti3+,Ti3++e-→Ti2+,Ti2++e-→Ti+,Ti++e-→Ti. The results of linear sweep voltammetry test were entirely consistent with the results of cyclic voltammetry test,the correctness of the results of cyclic voltammetry test and linear sweep voltammetry test was further verified by the results of chronopotentiometry test. The diffusion coefficient of Ti4+in 42.62%NaCl-54.38%KCl-3%K2 TiF6 molten salt was estimated to be 3.692×10-5 cm2·s-1 at 1073 K. In addition,the electrochemical crystallization nucleation mode of Ti4+on the tungsten electrode in 42.62%NaCl-54.38%KCl-3%K2 TiF6 molten salt at 1073 K was instantaneous nucleation.
Keyword:
NaCl-KCl molten salt; potassium fluorotitanate; titanium ion; diffusion control;
Received: 2019-03-28
钛具有密度小、熔沸点高、机械强度大等优良特性。液态的钛能与多种金属形成合金。而钛合金具有质轻,抗腐蚀性强,以及生物相容性较好等特点,被广泛应用于航空航天
本课题组当前已对Ta进行了初步的研究
虽然当前对熔盐电解法制备Ti合金的工艺有了一定的研究基础,但学术界对高价钛的还原机制仍存在疑惑。氟化物体系高价钛的研究成果已有相关报道,其中早期的研究者Clayton等
由于氯化物体系可能会存在歧化反应,而添加氟化物可以有效消除歧化反应的发生,因此本文在Na Cl-KCl熔盐电解质体系中,以K2Ti F6为原料,通过多种电化学测试方法对钛进行研究,期望解析钛的电化学还原机制。
1 实验
1.1 耗材及装置
实验药品如下所列:氯化钠(99.5%,AR(分析纯)),氯化钾(99.5%,AR),氟钛酸钾(99.5%,AR)均购于上海麦克林生化科技有限公司;无水乙醇(≥99.7%,AR)购于西陇化工股份有限公司。
三电极规格参数如下所列:工作电极采用直径为1 mm,纯度为99.95%的钨丝;辅助电极采用直径为12 mm,纯度为99.99%的钨棒;参比电极采用直径为1 mm,纯度为99.99%的铂丝。
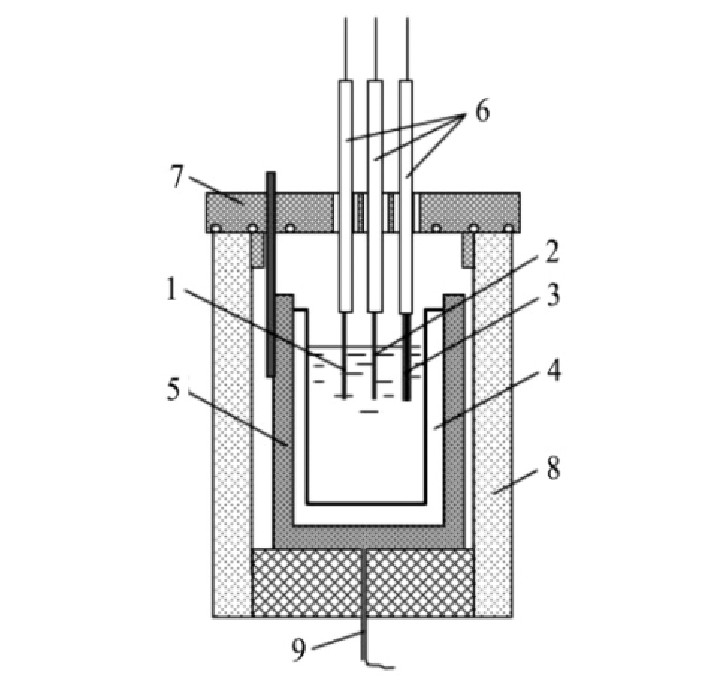
实验简易装置示意图如图1所示。
1.2 实验过程
首先电解质体系按照43.94%Na Cl-56.06%KCl(质量分数,文中所有涉及到百分含量的均为质量分数)混合均匀,然后置于鼓风干燥箱内于160℃条件下烘48 h。实验前用砂纸将三电极表面打磨至镜面,然后用无水乙醇清洗电极表面,再将工作电极与参比电极外套刚玉管与钨棒固定组成三电极系统待用。迅速准确称取质量分数为3%的K2Ti F6与混合均匀的氯化钠与氯化钾电解质一并装于刚玉坩埚内,置于电阻炉内加热至1073 K,保温30 min后使用熔盐提拉炉控制系统精准控制三电极系统进入熔盐中的深度。最后通过电化学工作站进行电化学测试以及数据的存储。
图1 电化学测试装置示意图
Fig.1 Schematic of electrochemical test device
1-Working electrode;2-Reference electrode;3-Auxiliaryelectrode;4-Corundum crucible;5-Iron crucible;6-Corun‐dum pipe;7-Insulation cover;8-Resistance furnace;9-Heatelectric couple
2 结果与讨论
2.1 伏安法
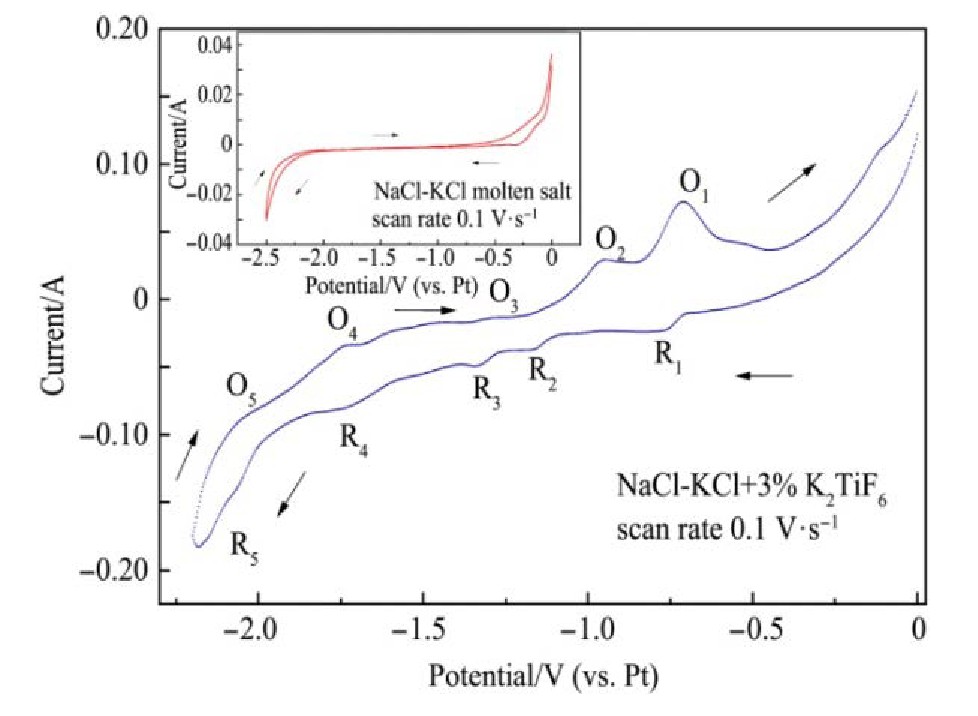
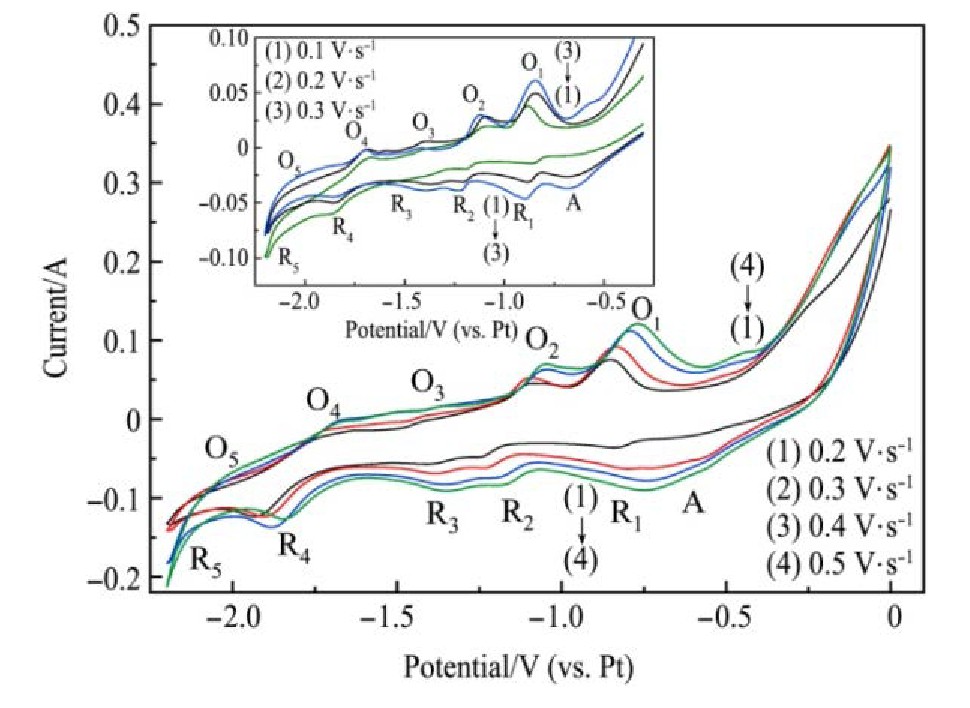
从图2可以看出,在Na Cl-KCl电解质体系当中添加质量分数为3%的K2Ti F6后进行循环伏安测试时出现R1/O1,R2/O2,R3/O3,R4/O4,R5/O5五对氧化还原峰,初步断定还原峰R1处发生的反应:Ti4++e-→Ti3+;还原峰R2处发生的反应:Ti3++e-→Ti2+;还原峰R3处发生的反应:Ti2++e-→Ti+;还原峰R4处发生的反应为:Ti++e-→Ti。还原峰R5处发生的反应对应于电解质体系当中钠离子与钾离子的得电子析出反应。
图3为不同扫描速率下的线性扫描伏安测试结果。从图3中可以看出在-0.8 V附近、-1.2 V附近、-1.3 V附近以及-1.8 V附近均存在一个还原峰,对应循环伏安测试曲线中R1~R4四组还原峰。线性扫描伏安曲线中的R5峰对应循环伏安测试曲线中的R5峰,均对应电解质体系当中钠离子与钾离子的得电子析出,同时发现随着扫描速率的增大,在-0.6 V附近出现的还原峰A更加明显,结合W-Ti二元系合金相图分析其原因为形成(β-Ti,W)固溶体。
图2 1073 K时43.94%Na Cl-56.06%KCl电解质与42.62%Na Cl-54.38%KCl-3%K2Ti F6(0.192 mol·L-1)循环伏安曲线(工作电极面积S=0.322 cm2)
Fig.2 Cyclic voltammetry curve of 43.94%Na Cl-56.06%KCl and 42.62%Na Cl-54.38%KCl-3%K2Ti F6(0.192 mol·L-1)at 1073 K(working electrode area S=0.322 cm2)
图3 1073 K时42.62%Na Cl-54.38%KCl-3%K2Ti F6(0.192mol·L-1)熔盐不同扫描速率下的线性扫描伏安曲线(工作电极面积S=0.322 cm2)
Fig.3 Linear sweep voltammetry curve of 42.62%Na Cl-54.38%KCl-3%K2Ti F6(0.192 mol·L-1) molten salt at different scanning rates at 1073 K(working electrode area S=0.322 cm2)
根据Randles-Sevick方程
式中,Ip为阴极还原峰的峰值电流,A;n为传递电子数;F为法拉第常数,96485 C·mol-1;C为离子浓度,mol·cm-3;A为工作电极面积,cm2;R为气体常数8.314 J·mol-1·K-1;T为温度,K;D为离子扩散系数,cm2·s-1;v为扫描速率,V·s-1。
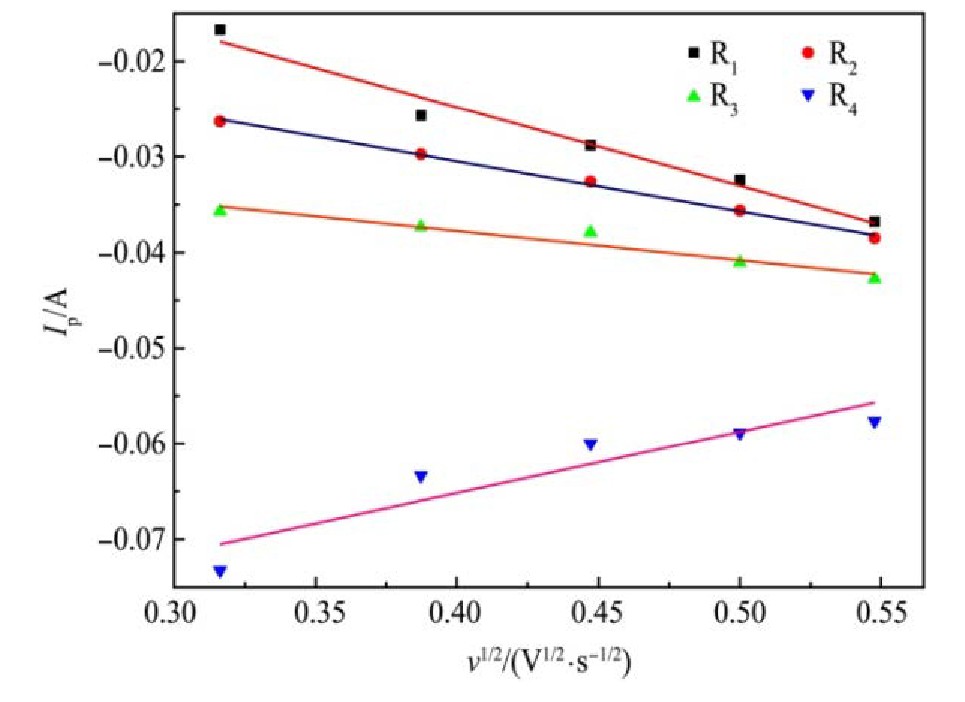
对不同扫描速率下的线性扫描伏安测试结果数据作Ip-v1/2关系曲线,结果如图4所示。
从图4可以看出,4组还原峰的峰值电流与对应扫描速率平方根之间呈现良好的线性关系,符合Randles-Sevick方程,表明:1073 K时42.62%Na‐Cl-54.38%KCl-3%K2Ti F6熔盐中Ti4+在钨电极上的四步电化学还原反应均受扩散控制。
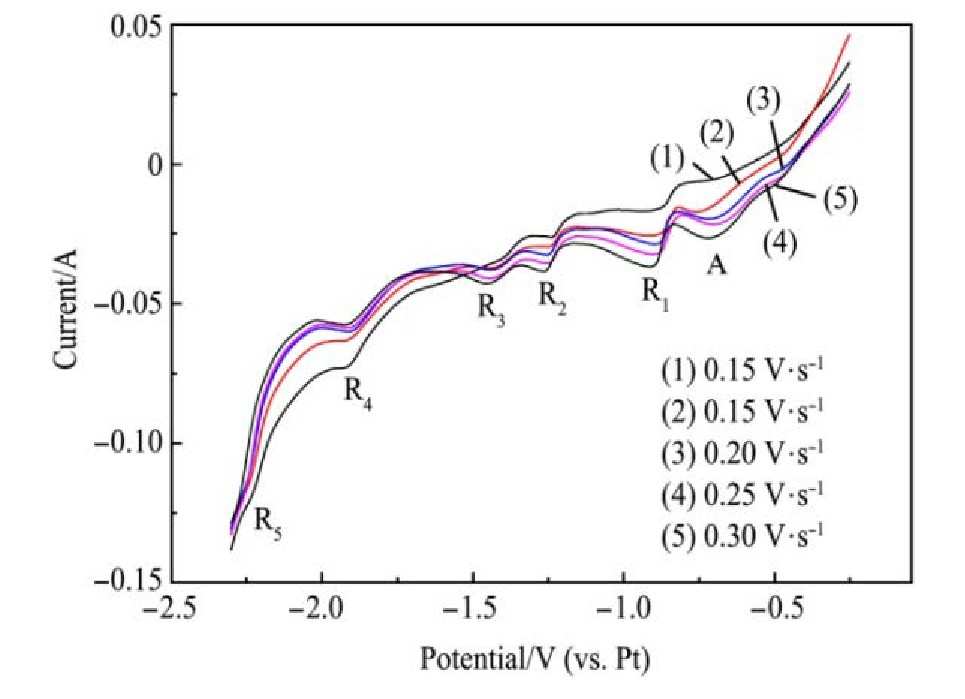
对-2.3~0 V之间测试不同扫描速率下的循环伏安曲线,测试结果如图5所示。从图5中可以看出随着扫描速率的增大,阴极还原峰的峰值电位基本稳定。但在-0.6 V附近出现的较小的还原峰A,随着扫描速率的增大逐渐明显,结合W-Ti二元合金相图分析得出:还原峰A对应(β-Ti,W)固溶体的形成,阴极还原过程与线性扫描结果一致。
根据方程
式中,R为气体常数,8.314 J?mol-1?K-1;T为温度,K;n为转移电子数;F为法拉第常数,96485C·mol-1;Ip为阴极还原峰值电流,A;I为实时电流值,A;B为一个常数。
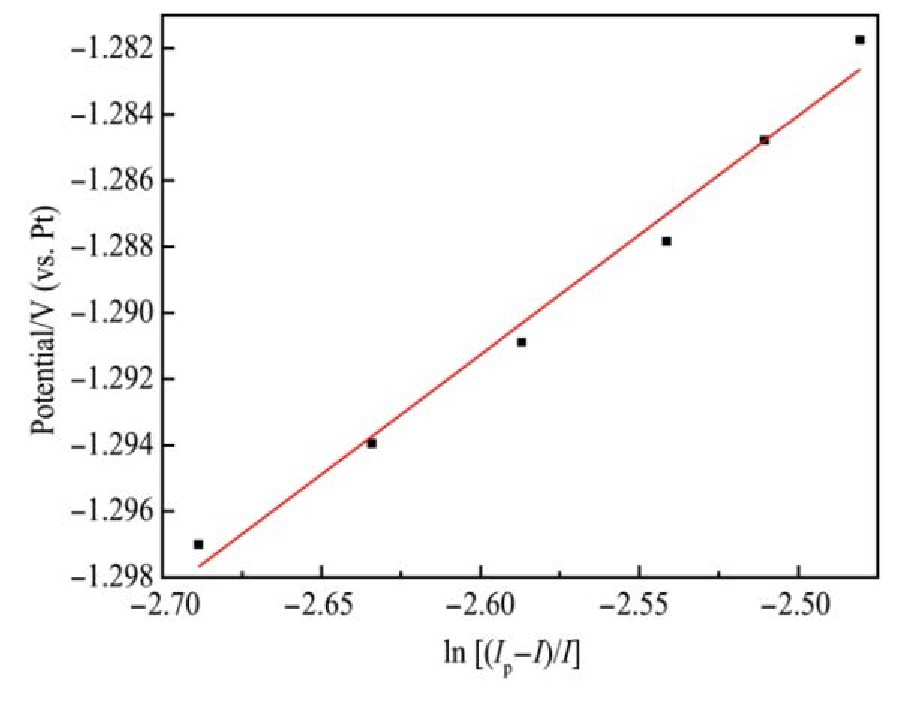
对0.1 V?s-1的循环伏安测试数据作E-ln[(Ip–I)/I]关系,结果如图6所示。
图4 1073 K时还原峰电流与不同扫描速率平方根的关系曲线
Fig.4 Relationship between reduction peak current and square root of different scanning rates at 1073 K
图5 1073 K时42.62%Na Cl-54.38%KCl-3%K2Ti F6(0.192mol·L-1)熔盐不同扫描速率下的循环伏安曲线(工作电极面积S=0.322 cm2)
Fig.5 Cyclic voltammetry curve of 42.62%Na Cl-54.38%KCl-3%K2Ti F6(0.192 mol·L-1)molten salt at different scan‐ningratesat1073K(workingelectrodearea S=0.322cm2)
图6 1073 K时E-ln[(Ip–I)/I]
Fig.6 Relationship between E and ln[(Ip–I)/I]at 1073 K
由拟合直线方程求得:斜率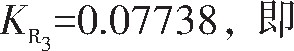
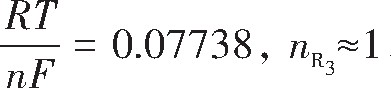
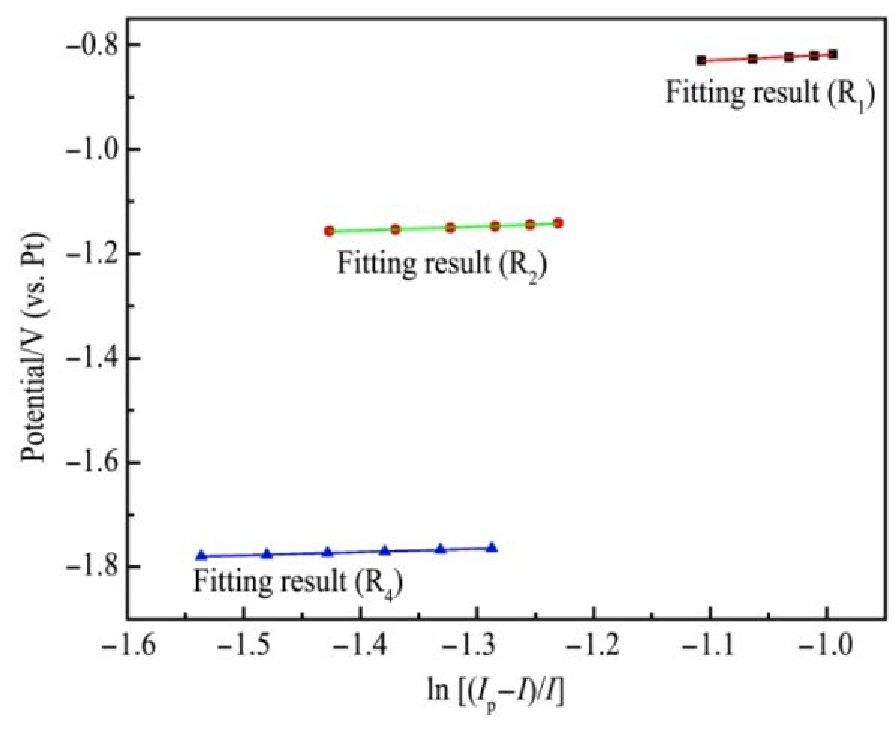
对0.1 V·s-1的循环伏安测试结果中的还原峰R1,R2,R4处数据作E-ln[(Ip–I)/I]关系,结果如图7所示。
由R1拟合直线方程求得: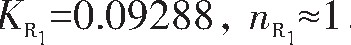
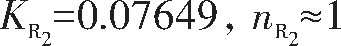
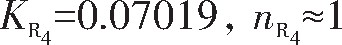
图7 E-ln[(Ip–I)/I]
Fig.7 Relationship between E and ln[(Ip–I)/I]
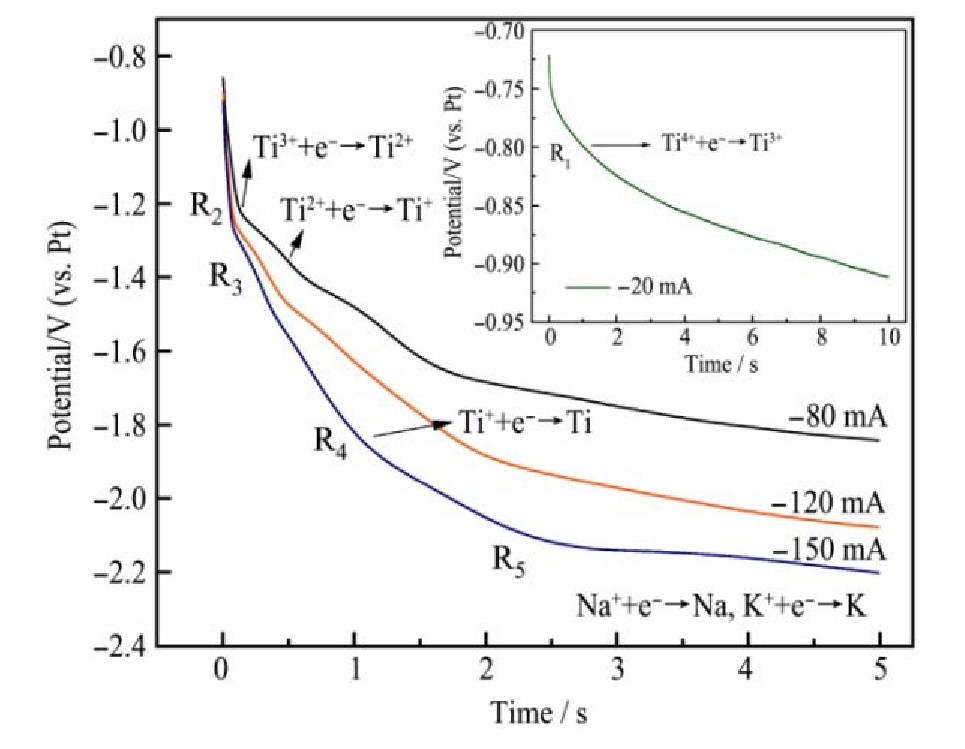
2.2 计时电位法
图8为对工作电极分别施加-20,-80,-120,-150 m A不同恒电流条件下测试的1073 K时在42.62%Na Cl-54.38%KCl-3%K2Ti F6熔盐钨电极上的计时电位曲线,从图8中可以看出:给工作电极施加-20 m A测试的计时电位曲线在-0.8 V附近存在一个平台,平台电位在循环伏安测试与线性扫描伏安测试的还原峰R1的电位范围内,对应Ti4++e-→Ti3+;同时在-1.2 V附近、-1.3 V附近以及在-1.8 V附近均存在一个平台,且平台电位均与循环伏安测试与线性伏安测试的还原峰电位相对应,在-2.2 V附近存在的大平台电位对应电解质体系当中钠离子与钾离子的得电子析出电位。计时电位测试结果验证了循环伏安与线性扫描伏安测试结果的正确性。
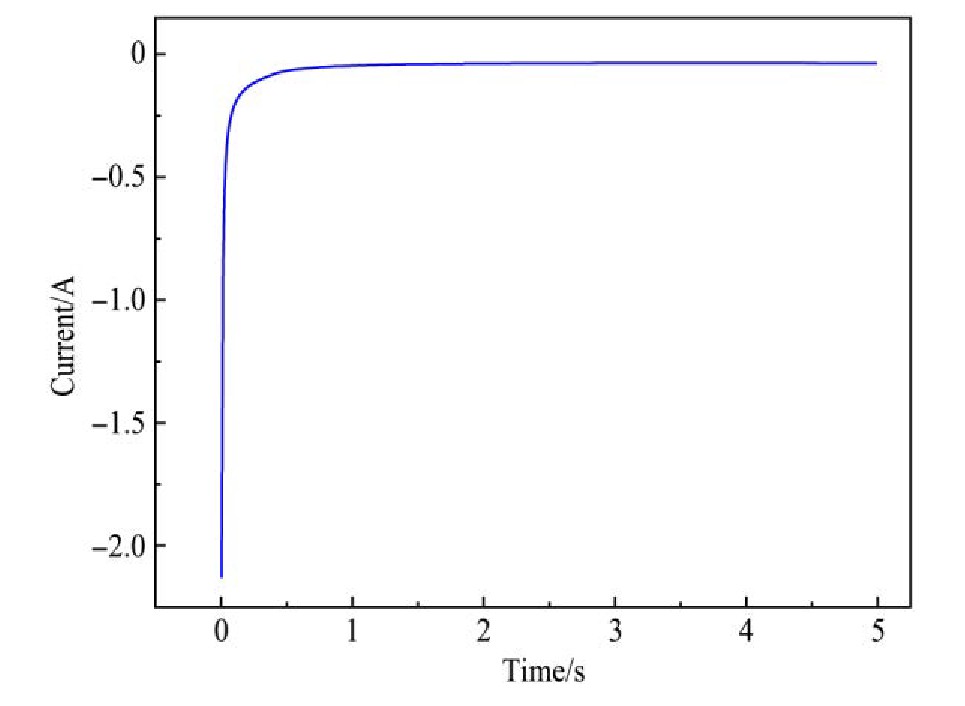
2.3 计时电流法
图9为给工作电极施加一个-1.85 V恒电位条件下测试的1073 K时42.62%Na Cl-54.38%KCl-3%K2Ti F6熔盐中Ti4+在钨电极上的计时电流曲线,当给工作电极施加-1.85 V恒电位时,在电极附近形成环形电场,熔盐中阴阳离子在电场力的作用下定向迁移,其中Ti4+,K+,Na+阳离子向工作电极迁移,引起工作电极与参比电极间阴阳离子浓度减小,随着Ti4+在工作电极表面得电子析出导致工作电极附近Ti4+浓度减小,熔盐电解质内阻增大,导致电流减小,对应计时电流测试曲线中一开始电流值从一个极大值迅速减小阶段。工作电极附近与熔盐本体中存在Ti4+浓度差,在浓度梯度以及电场力作用下,熔盐中Ti4+向工作电极表面扩散,由于电子在导体中的移动速率大于熔盐中离子的扩散速率,导致电极表面反应受熔盐中Ti4+向工作电极表面扩散控制。在一段时间后扩散速率与电极表面得电子析出速率会近似维持一个动态平衡,即对应计时电流测试曲线上电流信号的稳定阶段。
图8 1073 K时不同恒电流条件下钨电极上的计时电位曲线
Fig.8 Chronopotentiometric on tungsten electrode under dif‐ferent constant current conditions at 1073 K
图9 1073 K时-1.85 V恒电位条件下钨电极上的计时电流曲线
Fig.9 Chronoamperometry on tungsten electrode under-1.85V constant potential conditions at 1073 K
为了确定熔盐中Ti4+的扩散系数,引入Cottrel方程通过对图9中计时电流曲线上升阶段数据拟合,从而确定出Ti4+的扩散系数。
式中,n为转移电子数;F为法拉第常数,96485C·mol-1;S为工作电极面积,cm2;D为离子扩散系数,cm2·s-1;C为离子浓度,mol·cm-3;π为圆周率,3.14。
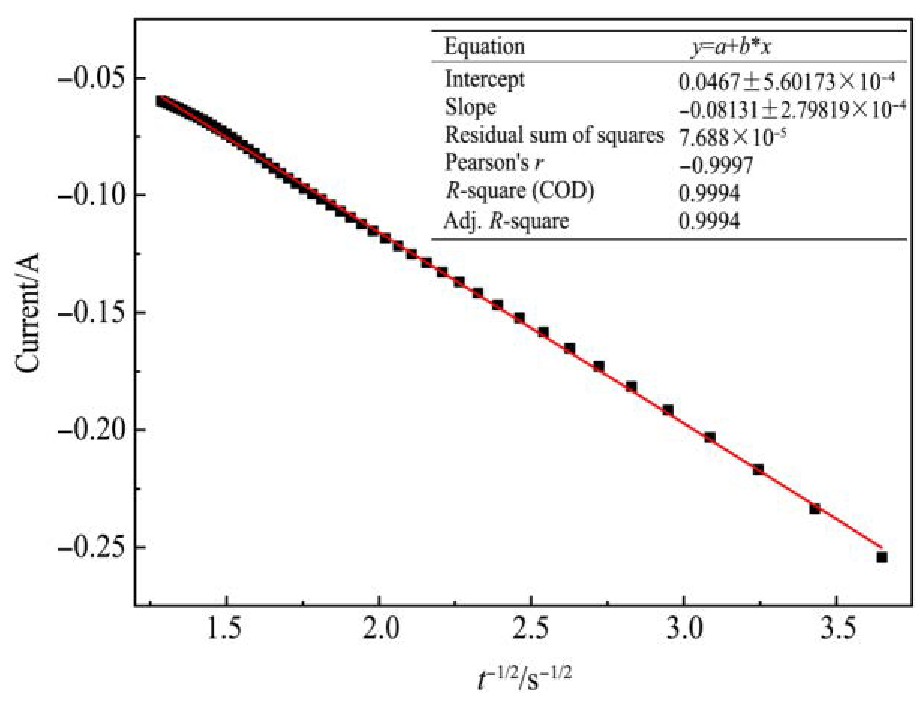
取恒电位-1.85 V时的计时电流曲线上升阶段的数据作I-t-1/2关系,结果如图10所示。根据方程(3)得出扩散系数为3.692×10-5cm2·s-1。
1073 K时熔盐中Ti4+在钨电极上的电结晶成核方式存在两种成核理论
瞬时成核方程:
渐进成核方程:
式中,n为转移电子数;F为法拉第常数,96485C·mol-1;N为最大晶核密度;D为离子扩散系数,cm2·s-1;C为离子浓度,mol·cm-3;M为电沉积原子量,g·mol-1;ρ为电沉积物质密度,g·cm-3。
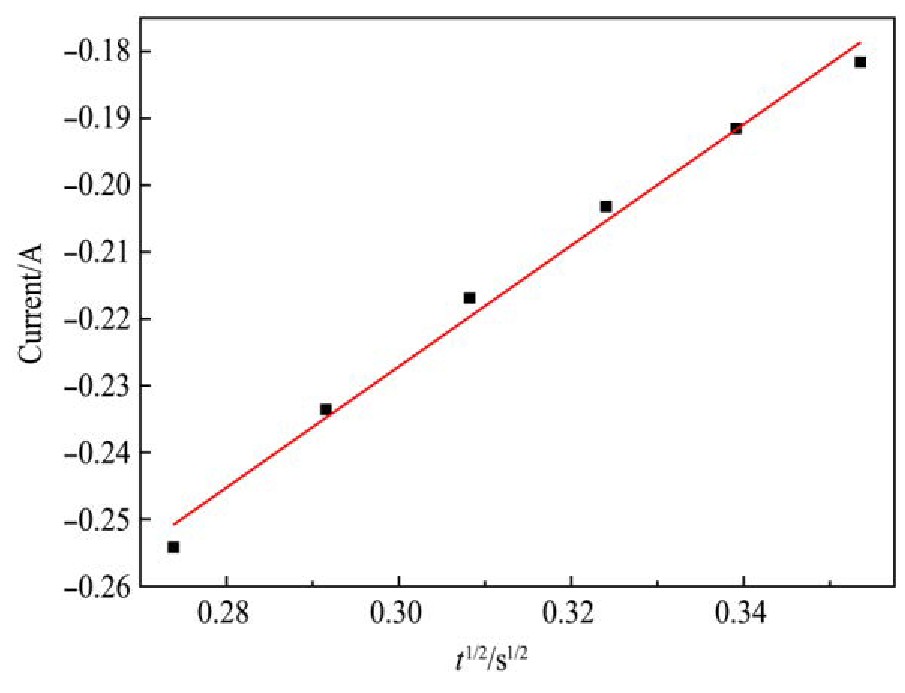
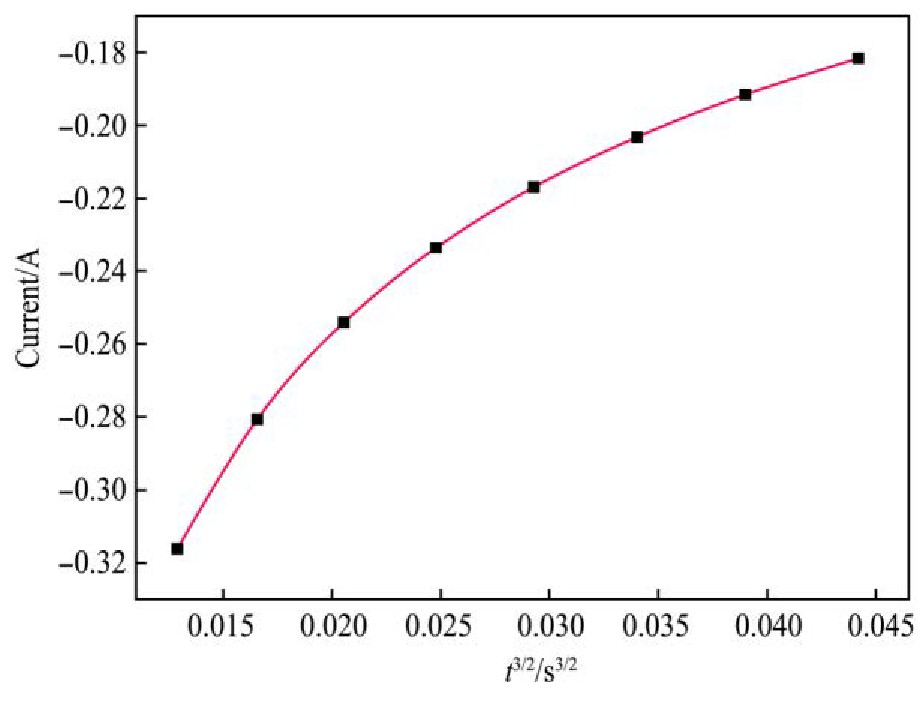
图11与12分别为1073 K时在恒电位-1.85 V条件下,极化电流I-t1/2与I-t3/2的关系曲线。分析图11与12得出:I-t1/2呈良好线性关系,符合瞬时成核方程,表明:1073 K时熔盐中Ti4+在钨电极上的电结晶属于瞬时成核方式。
3 结论
通过循环伏安法、线性扫描伏安法、计时电位法、计时电流法4种电化学暂态测试方法分别研究了1073 K时42.62%Na Cl-54.38%KCl-3%K2Ti F6熔盐中Ti4+在钨电极上的电化学还原过程,得出如下结论:
图1 0 I与t-1/2的关系图
Fig.10 Relationship between I and t-1/2
图1 1 I-t1/2关系图
Fig.11 Relationship between I and t1/2
图1 2 I-t3/2关系图
Fig.12 Relationship between I and t3/2
1.循环伏安测试结果与线性扫描伏安测试结果均表明:1073 K时熔盐中Ti4+在钨电极上的电化学还原是受扩散控制的4步反应过程,每步反应均转移1个电子,电极反应方程式为:Ti4++e-→Ti3+,Ti3++3e-→Ti2+,Ti2++e-→Ti+,Ti++e-→Ti。
2.根据Cottrel方程计算出1073 K时熔盐中Ti4+的扩散系数为3.692×10-5cm2·s-1。1073 K时熔盐中Ti4+在钨电极上的电结晶成核方式为瞬时成核。
参考文献