γ-环糊精-达旦黄包合物与鲱鱼精DNA的作用机理
费 丹1,王兴明1,阮开敏1,于婷婷1,欧阳昌伟1,
赵学全1,刘胜男1,戴亚堂1,董发勤1,丁立生2
(1. 西南科技大学 材料科学与工程学院,四川 绵阳,621010;
2. 中国科学院 成都生物研究所,四川 成都,610041)
摘 要:
摘 要:在生理pH=7.4环境下,用摩尔比法测定γ-环糊精(γ-CD)与达旦黄(TY)的包合比(摩尔比)nγ-CD?nTY =1?1,直线法测定包合常数Kf = 495.23 L/mol。以中性红(NR)作分子探针,用紫外光谱法、荧光光谱法、电化学法、化学热力学法和黏度法等研究包合物γ-CD-TY与鲱鱼精DNA的作用,得到γ-CD-TY包合物与鲱鱼精DNA作用的结合比nγ-CD-TY?nDNA=6?1,结合常数为![]() =1.12×105 L/mol,
=1.12×105 L/mol,![]() =2.72×105 L/mol。热力学函数
=2.72×105 L/mol。热力学函数![]() =-2.82×104 J/mol,
=-2.82×104 J/mol,![]() =5.67×104 J/mol,
=5.67×104 J/mol,![]() =284.78 J/(mol·K),说明γ-CD-TY包合物与DNA作用为熵驱动。确定γ-CD-TY与鲱鱼精DNA的作用方式为混合作用,同时存在部分嵌插和非嵌插作用方式。
=284.78 J/(mol·K),说明γ-CD-TY包合物与DNA作用为熵驱动。确定γ-CD-TY与鲱鱼精DNA的作用方式为混合作用,同时存在部分嵌插和非嵌插作用方式。
关键词:
中图分类号:O629.74 文献标识码:A 文章编号:1672-7207(2009)02-0367-08
Functionary mechanism between inclusion complex of titan yellow with γ-cyclodextrin and herring sperm DNA
FEI Dan1, WANG Xing-ming1, RUAN Kai-min1, YU Ting-ting1, OUYANG Chang-wei1,
ZHAO Xue-quan1, LIU Sheng-nan1, DAI Ya-tang1, DONG Fa-qin1, DING Li-sheng2
(1. School of Materials Science and Engineering, Southwest University of Science and Technology,
Mianyang 621010, China;
2. Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China)
Abstract: Under the condition of physiological environment pH 7.4, the binding ratio nγ-CD?nTY=1?1 and binding constant Kf = 495.23 L/mol were confirmed by mole ratio method and linear method. NR was used as molecule probe, and the interaction between γ-CD-TY and herring-sperm DNA was studied by UV spectra, fluorescence spectra, electrochemistry, thermodynamic method and viscosity method, etc. A series of thermodynamic functions such as ![]() =-2.82×104 J/mol,
=-2.82×104 J/mol, ![]() =5.67×104 J/mol,
=5.67×104 J/mol, ![]() =284.78 J/(mol·K) were obtained, and
=284.78 J/(mol·K) were obtained, and ![]() is the primary driven power of this interaction, the binding ratio is nγ-CD-TY?nDNA=6?1, the binding constants are
is the primary driven power of this interaction, the binding ratio is nγ-CD-TY?nDNA=6?1, the binding constants are ![]() =1.12×105 L/mol,
=1.12×105 L/mol, ![]() = 2.72×105 L/mol. The interaction mode between γ-CD-TY and herring-sperm DNA is a mixed binding, consisting of partly intercalation and dis-intercalation.
= 2.72×105 L/mol. The interaction mode between γ-CD-TY and herring-sperm DNA is a mixed binding, consisting of partly intercalation and dis-intercalation.
Key words: γ- cyclodextrin; titan yellow; inclusion complex; herring-sperm DNA; interaction mode
超分子化学是一门迅速发展起来的新兴学科,超分子作用是一种具有分子识别能力的非共价键分子间作用力。环糊精(Cyclodextrin,简称CD),是一种重要的超分子主体,是由环糊精葡萄糖基转移酶(CGT)作用于淀粉所产生的,由D(+)-葡萄糖单元通过α-(1, 4)糖苷键连接起来的环状寡糖。环糊精分子中包含众多化学反应性相同的羟基,这些可修饰和可生成氢键的基团与邻近的疏水空腔共存,可以包合各种有机、无机客体,还可以表现出特殊的吸附性能[1],因而可以进行各种模型设计。这种包合作用能明显改善客体分子的状态、稳定性、溶解度等理化特性[2-3]。在医药方面,环糊精可促进药物稳定性,增加药物溶解度,提高药物生物利用度,作为药物缓释剂[4]。目前,有关金属配合物用于抗肿瘤药物、DNA探针、荧光免疫分析等领域的研究较多[5],而关于环糊精超分子包合物与DNA之间作用机理的研究还比较少。本实验模拟人体生理pH值,用γ-环糊精包合一种常用的血液离子诊断用药——达旦黄(Titan yellow,简称TY)。用UV-Vis、荧光光谱和热力学等多种方法研究γ-环糊精-达旦黄二元包合物与鲱鱼精DNA的相互作用,探讨其作用方式,得到了一系列有价值信息。此外,传统的光谱探针EB具有强烈的致癌性,且放置不稳定,实验废水难处理,易污染环境。本实验中采用相对环保,弱毒性,且对DNA有专一嵌插作用[6-7]的新一代光谱探针中性红(Natrure red,简称NR)进行相关研究。
1 实 验
1.1 试剂和仪器
试剂为:鲱鱼精DNA (A.R,Sigma公司生产);达旦黄(TY,A.R,上海化学试剂厂生产);γ-环糊精(γ-CD,A.R,成都科龙化工试剂厂生产);中性红(NR,A.R,成都科龙化工试剂厂生产);三羟甲基氨基甲烷(A.R,天津科密欧化学试剂开发中心生产);Tris (0.05 mol/L)-HCl 缓冲溶液,为临时配制;其他试剂均为分析纯,水为二次重蒸水。
仪器为:UV-3400分光光度计(日本日立);RF-540 荧光仪(日本岛津);CHI 760C型电化学工作站(CH Instruments, USA);三电极系统:以玻碳电极(GCE,d 0.03 cm)为工作电极,Ag/AgCl电极为参比电极,铂片电极作对电极;pHS-2C型酸度计(成都方舟科技开发公司制造);恒温水浴槽(成都方舟科技开发公司制造);乌贝路德黏度计。
1.2 实验方法
1.2.1 紫外光谱法
使用Tris-HCl缓冲溶液(pH=7.4)为作用介质,配制好待测包合物溶液,静置5 min。用1 cm比色皿,在参比池加入3.00 mL 空白试剂,在样品池中加入3.00 mL待测溶液,以试剂空白作参比,扫描吸收光谱。然后,向两池中每次分别依次加入0.01 mL DNA溶液,充分搅拌,混合均匀,使DNA和包合物的浓度比不断增加,同时,扫描吸收光谱。
1.2.2 荧光光谱法
在1 cm比色皿中加入3.00 mL待测包合物溶液,放入样品池中,扫描发射光谱。然后,向样品池每次加入0.01 mL DNA溶液,充分搅拌,使DNA和包合物的浓度比不断增加,扫描发射光谱。荧光激发波长为412 nm。
1.2.3 电化学法
对电极进行预处理。将玻碳电极在麂皮上依次用Al2O3的悬浊液抛光,然后,用蒸馏水在超声波清洗仪中清洗干净。配制不同摩尔比的DNA和γ-CD-TY包合物溶液,定容,摇匀,在CHI 760C型电化学工作站上以0.05 V/s的扫描速度记录-0.1~0.8 V的循环伏安曲线。
三电极系统:工作电极为碳纳米管修饰玻碳电极(GCE);参比电极为饱和甘汞电极(SCE);对电极为铂丝电极。
1.2.4 黏度法
用Tris-HCl缓冲溶液配制NR-DNA 和γ-CD-TY包合物-DNA溶液,放置 24 h,在297.15 K恒温水浴槽中用乌贝路德黏度计测其黏度。
2 结果与讨论
2.1 γ-环糊精与达旦黄的包合作用及包合比的确定
γ-环糊精结构如同一个中空的圆台面,内径为0.78~0.83 nm,高为0.79 nm。内侧的糖苷键上的氧原子处于—CH键屏蔽下,有疏水作用,而外腔却具有很多亲水作用的羟基。从TY分子(如图1所示)结构看,TY分子是有3个苯环结构的化合物,形成3个p-π共轭体系,理论上这类基团易被CD环包合。紫外光谱法是研究环糊精与有机客体之间相互作用最常用的方法。当客体与环糊精的包合物形成时,由于其富电子基团会全部或部分嵌入环糊精分子空腔中,环糊精分子腔中的高电子密度诱导客体分子电子发生转移,所以,最大吸收峰的位置、强度或者峰形会发生某些变化[8]。单独的TY分别在波长为322 nm和400 nm处存在紫外吸收峰,随着 γ-CD 的不断加入,在低浓度时(图2(a)),体系的紫外吸收强度呈规律性地上升;在高浓度时(图2(b)),体系的紫外吸收强度呈规律性地下降;而这2种情况都同时伴随着紫外吸收峰的红移,由400 nm移至410 nm。该现象说明TY客体所在的化学微环境随着主体γ-CD 的加入而发生变化,即由极性环境进入到环糊精疏水空腔的非极性环境而形成了包合物。

图1 达旦黄分子结构
Fig.1 Molecule structure of titan yellow
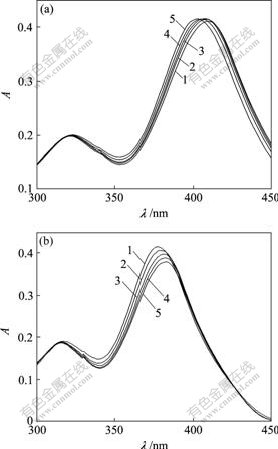
cTY = 1.00×10-5 mol/L
(a) 1—cγ-CD=0; 2—cγ-CD=0.50×10-5 mol/L;
3—cγ-CD=1.00×10-5 mol/L; 4—cγ-CD=1.50×10-5 mol/L;
5—cγ-CD=2.00×10-5 mol/L
(b) 1—cγ-CD=0; 2—cγ-CD=1.00×10-5 mol/L;
3—cγ-CD=2.00×10-5 mol/L; 4—cγ-CD=3.00×10-5 mol/L;
5—cγ-CD=4.00×10-5 mol/L
图2 γ-CD对TY吸收光谱的影响
Fig.2 Effects of γ-CD on absorption spectra of TY
固定TY浓度,改变γ-CD浓度,在波长为412 nm时平行测定吸光度,根据摩尔比法作图,结果如图3 所示。测得γ-CD与TY的包合比(摩尔比)为 nγ-CD?nTY=1?1。根据Benesi-Hildebrand观点[9],如果γ-CD与TY形成摩尔比为1?1包合物,在[CD]>[TY]的情况下,TY吸收强度的变化值ΔA与γ-CD浓度的关系式为1/ΔA = 1/(A0-A) = [1/(α·Kf)]·(1/cγ-CD)+(1/α)·cTY
式中:A0和A分别为γ-CD存在和不存在时溶液的吸光强度;α为常数;cγ-CD为 γ-CD的浓度;Kf为包合常数。
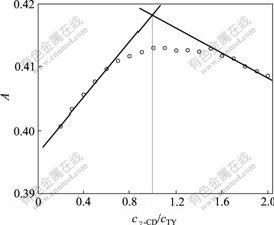
cTY = 1.00×10-5 mol/L
图3 在波长为412 nm时TY-γ-CD的浓度比
Fig.3 Mole ratio plots of TY-γ-CD at 412 nm
因此,若以1/cγ-CD对1/ΔA作图为直线,表明主、客体形成1?1包合物。由图4可见,1/cγ-CD与1/ΔA呈线性关系,表明γ-CD与TY形成1?1包合物。由上式和图4计算得到包合常数Kf = 495.23 L/mol。
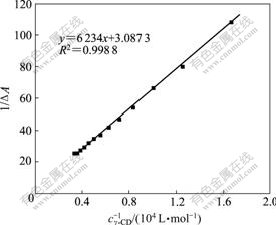
cTY = 1.00×10-5 mol/L
图4 γ-CD-TY的双倒数曲线(405 nm)
Fig.4 Double reciprocal curve of γ-CD-TY
2.2 包合物与DNA的相互作用
2.2.1 紫外-可见光谱法
向γ-CD-TY包合物溶液中等量滴加DNA溶液,扫描γ-CD-TY与DNA体系的紫外光谱。通过实验发现,单独的DNA溶液在波长为400~800 nm的可见区吸光度为0,但当DNA加入到γ-CD-TY溶液中后,却使得γ-CD-TY的吸光度在350~500 nm范围内有规律地逐渐上升。此现象表明,包合物与DNA之间不是发生简单的吸光度加合现象,而是生成了新物质。根据文献报道[10],当小分子以嵌入方式结合于DNA双螺旋碱基对之间时,其吸收光谱表现出减色效应;当小分子以静电方式结合于DNA时,其吸收光谱表现出增色效应。因此,γ-CD-TY与DNA之间存在一定的静电作用。为了进一步定量分析包合物与DNA作用,通过摩尔比法在410 nm处作图(图5)得到包合物与DNA的结合比:nγ-CD-TY?nDNA=6?1。根据Lambert-Beer 定律:
![]()
得到包合物-DNA 的摩尔吸光系数:
ε = A/(bc)=2.53×105 L/(mol?cm)。
式中:A为包合物与DNA结合达饱和后的吸光度;ε为包合物-DNA 的摩尔吸光系数;c为包合物-DNA浓度;即结合形成此复合物的DNA 的浓度;b为比色皿厚度。

cγ-CD-TY =1.00×10-5 mol/L
图5 在波长为410 nm时DNA-γ-CD-TY包合物的浓度比
Fig.5 Molar ratio plots of DNA-γ-CD-TY at 410 nm
采用热力学方法分析γ-CD-TY与DNA的相互作用,可以更深刻地理解它们的作用方式。分别在298.15 K和人体温度310.15 K下测定DNA对γ-CD-TY包合物的作用,并作出双倒数图(图6)。根据双倒数公式[11]:
![]()
得到γ-CD-TY与DNA结合常数为![]() =1.12×105 L/mol,
=1.12×105 L/mol,![]() =2.72×105 L/mol。式中:A0和A分别为加入DNA前后包合物的吸光度;K为结合常数。再联用公式:
=2.72×105 L/mol。式中:A0和A分别为加入DNA前后包合物的吸光度;K为结合常数。再联用公式:
![]() ; (1)
; (1)
![]() ; (2)
; (2)
![]() 。 (3)
。 (3)
得到![]() =5.67×104 J/mol,
=5.67×104 J/mol,![]() 为正值,说明反应吸热,温度升高有利于反应的进行;
为正值,说明反应吸热,温度升高有利于反应的进行;![]() =-2.82×104 J/mol,推测γ-CD-TY包合物与DNA的相互作用有自发进行的可能;
=-2.82×104 J/mol,推测γ-CD-TY包合物与DNA的相互作用有自发进行的可能;![]() =284.78 J/(mol?K),由此可知,γ-CD-TY包合物与DNA的相互作用为熵所驱动。
=284.78 J/(mol?K),由此可知,γ-CD-TY包合物与DNA的相互作用为熵所驱动。
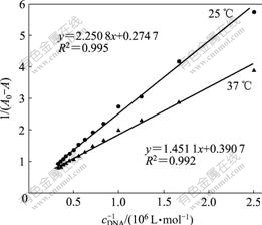
cγ-CD-TY =1.00×10-5 mol/L
图6 波长为260 nm时DNA对γ-CD-TY的双倒数曲线
Fig.6 Double reciprocal curves of DNA to γ-CD-TY at 260 nm
吩嗪染料中性红(NR)可与DNA发生嵌插作用,因此,可用作分子探针研究包合物与 DNA的作用方式。向NR中加入DNA溶液的电子吸收光谱表明,NR 与DNA 的嵌插作用对应于NR 在453 nm 的吸光度降低和537 nm吸光度升高并红移(图7)。按照1?1的比例配制NR-DNA的混合溶液,静置,待反应完全,在NR-DNA的混合溶液系统中滴加γ-CD-TY包合物溶液(图8),随着γ-CD-TY的加入,NR 在407 nm 的吸光度明显升高,弱峰变强峰。造成这种变化的原因,一方面是γ-CD-TY在该波长范围内与NR-DNA混合体系出现吸光度加合作用;另一方面,也可能是γ-CD-TY与NR之间嵌插竞争作用,使得一部分NR小分子从DNA 中游离出来,而引起该波长范围内吸光度增加。同时,原本在553 nm处无吸收的γ-CD-TY包合物,却引起NR-DNA混合溶液系统在该波长范围内吸光度有规律性地微量增加,这证明了嵌插竞争作用的存在。不过该增加值相当微弱,这是由于γ-CD的超分子包裹作用,使得客体分子TY与DNA间的嵌插作用相当微弱。
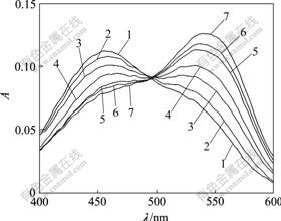
cNR =1.00×10-5 mol/L
1—cDNA=0; 2—cDNA=0.20×10-5 mol/L;
3—cDNA=0.40×10-5 mol/L; 4—cDNA=0.60×10-5 mol/L;
5—cDNA=0.80×10-5 mol/L; 6—cDNA=1.00×10-5 mol/L;
7—cDNA=1.20×10-5 mol/L
图7 DNA对NR吸收光谱的影响
Fig.7 Effects of absorption spectra of DNA on NR
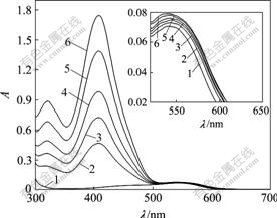
cDNA-NR=0.20×10-6 mol/L
1—cγ-CD-TY=0; 2—cγ-CD-TY=0.10×10-5 mol/L;
3—cγ-CD-TY=0.20×10-5 mol/L; 4—cγ-CD-TY=0.30×10-5 mol/L;
5—cγ-CD-TY=0.40×10-5 mol/L; 6—cγ-CD-TY=0.50×10-5 mol/L;
7—cγ-CD-TY=1.20×10-5 mol/L
图8 γ-CD-TY对DNA-NR吸收光谱的影响
Fig.8 Effects of absorption spectra of γ-CD-TY on DNA-NR
2.2.2 荧光光谱法
向γ-CD-TY包合物中等量滴加DNA溶液,通过扫描得到的荧光发射光谱如图9所示。结果表明,随着 DNA的加入γ-CD-TY包合物的发射峰发生了部分猝灭,并且在526 nm处出现了1个等荧光强度点。这是因为包合物与DNA作用后,包合物与DNA之间可能存在微弱的嵌插作用,部分插入DNA碱基对中,因而受到DNA的保护,使之免受水分子的猝灭,因此,一部分荧光强度增加。同时,环糊精包合物中的疏水基团受到了DNA分子中疏水基团的吸附,通过氢键或疏水作用结合在 DNA 的沟面,因此,包合物受DNA保护程度不大,出现了部分猝灭现象[12]。以上荧光强度的改变,证实包合物与DNA之间存在相互作用,但作用程度不大,因此,推测包合物与DNA之间的作用是一种混合作用。

cγ-CD-TY =0.10×10-6 mol/L
1—cDNA= 0; 2—cDNA= 0.20×10-7 mol/L;
3—cDNA= 0.40×10-7 mol/L
图9 DNA对γ-CD-TY荧光光谱的影响
Fig.9 Effects of emission spectra of DNA on γ-CD-TY
同样,也可用中性红作为荧光探针分子研究γ-CD-TY包合物与DNA的作用方式。当有DNA和γ-CD-TY包合物存在时,NR的荧光强度会大大增强,当加入同样对DNA具有嵌插作用的药物分子时,会使DNA-NR混合溶液发生荧光猝灭现象[6]。而向NR-DNA的混合溶液系统中加入γ-CD-TY包合物溶液,并没有观察到荧光猝灭现象,说明包合物与DNA之间的嵌插作用不存在或十分微弱,包合物与DNA之间可能存在静电方式或沟结合等非嵌插作用方式。
用经典的Scatchard 法研究γ-CD-TY包合物与DNA的作用方式, γ-CD-TY与 NR-DNA相互作用的 Scatchard 图如图10所示。NR与DNA作用的特点可用Scatchard方程阐述[13]:
r/c=K(n-r)。
式中:r为每个核苷酸结合NR的分子数;c为NR游离浓度;n为r的最大值;K为单个位点固有的结合 常数。
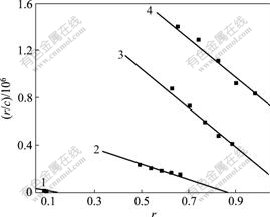
Rt=cγ-CD-TY/cDNA
Rt: 1—0; 2—2; 3—4; 4—6
图10 γ-CD-TY与 NR-DNA作用的 Scatchard 曲线
Fig.10 Scatchard plots of interaction between γ-CD-TY and NR-DNA
γ-CD-TY包合物与NR-DNA 混合溶液的Scatchard方程如表1所示。若包合物存在与不存在时NR的Scatchard图有相同的n,则包合物与DNA的作用方式为嵌插方式;若与NR的Scatchard图有相同的K,则包合物与DNA的作用为非嵌插方式;若该直线与NR的Scatchard图中的K和n均不同,则包合物与DNA的作用为混合方式[14]。表1中,γ-CD-TY与DNA作用的K和n均不同,表明它们之间为混合作用方式,即同时存在嵌插作用和非嵌插作用。
表1 包合物γ-CD-TY与鲱鱼精DNA的相互作用的Scatchard方程
Table 1 Data of Scatchard Equation of interaction between γ-CD-TYand DNA

2.3 电化学方法
天然DNA分子,其碱基的电还原活性位点深藏于双螺旋中,一般不能参与电极过程。而变性后的单链DNA分子的碱基虽然能发生化学还原和氧化,但还原电位较负(<-1.20 V (vs.SCE))[15]。采用循环伏安法研究了小分子与DNA的作用方式,认为峰电位正移则表明小分子与DNA为疏水的相互作用即嵌入结合,而峰电位负移时小分子与DNA之间的作用为静电作用[16]。以玻碳电极为工作电极,以pH=7.40的Tris-HCl缓冲溶液为支持电解质,在-0.50~-1.20 V电位窗口内以0.05 V/s的扫描速度对γ-CD-TY在有或无DNA存在时进行循环伏安(CV)测试,得到其循环伏安曲线,见图11。可见,在不存在DNA时,包合物的还原峰为-0.993 V,为不可逆电化学还原过程。由于峰电位易受到空气中氧气峰电流位置(约为-0.800 V)
的影响,在实验过程中每次测试均先通入10 min氮气。实验结果表明,当体系中加入DNA后,峰电流增加,峰电位负移至-0.998 V,证明DNA与包合物之间存在静电作用。同样,在-0.90~-1.10 V电位窗口范围进行微分脉冲伏安(DPV)测试,得到其微分脉冲伏安曲线,见图12。得到的结果与采用循环伏安法所得结果相同,包合物的峰电流增加,峰电位负移了0.022 V,由-0.958 V移动到-0.980 V。
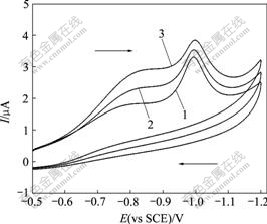
cγ-CD-TY=1.00×10-4 mol/L
1—cDNA=0; 2—cDNA=0.05×10-4 mol/L;
3—cDNA=0.10×10-4 mol/L
图11 DNA对γ-CD-TY循环伏安曲线的影响
Fig.11 Effects of cyclic voltammograms of DNA on γ-CD-TY
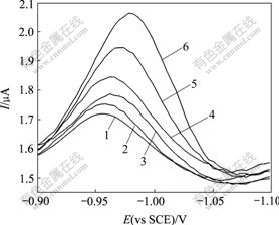
cγ-CD-TY=0.50×10-4 mol/L
1—cDNA=0; 2—cDNA=0.25×10-6 mol/L;
3—cDNA=0.50×10-6 mol/L; 4—cDNA=0.75×10-6 mol/L;
5—cDNA=1.00×10-6 mol/L; 6—cDNA=1.25×10-6 mol/L
图12 DNA对γ-CD-TY微分脉冲伏安曲线的影响
Fig.12 Effects of differential pulse voltammograms of DNA on γ-CD-TY
2.4 黏度法
黏度法是一种对DNA长度变化敏感的流体力学方法。一般来讲,当小分子配合物以插入模式与DNA作用时,DNA的相邻碱基对的距离会变大以容纳插入配体,因而导致DNA 双螺旋伸长,DNA 溶液的黏度增加;当配合物以静电或沟面结合等非插入模式与DNA作用时,DNA溶液的黏度无明显变化;而以部分插入方式与DNA作用时,则可能使DNA的双螺旋扭结,使其黏度减小[12]。γ-CD-TY对DNA黏度的影响如图13所示,可见,由于γ-CD的包合作用阻碍了TY的插入,使γ-CD-TY与DNA只有部分插入作用,而且这种嵌插作用是微弱的,因此,表现出黏度减小的现象。

cDNA=2.00×10-4 mol/L
图13 γ-CD-TY对DNA 黏度的影响
Fig.13 Effect of viscosity of γ-CD-TY on DNA
3 结 论
a. 通过摩尔比法和直线法,测得γ-CD与TY在生理pH=7.40时形成1?1包合物,结合常数为Kf = 495.23 L/mol。
b. 由热力学实验测定和计算得到γ-CD-TY包合物与鲱鱼精DNA相互作用的结合比(摩尔比)为nγ-CD-TY?nDNA= 6?1,结合常数为![]() =1.12×105 L/mol,
=1.12×105 L/mol,![]() = 2.72×105 L/mol,
= 2.72×105 L/mol,![]() =-2.82×104 J/mol,
=-2.82×104 J/mol,![]() = 5.67×104 J/mol,
= 5.67×104 J/mol,![]() =284.78 J/(mol?K),说明γ-CD-TY包合物与鲱鱼精DNA的相互作用为吸热反应,可自发进行,并为
=284.78 J/(mol?K),说明γ-CD-TY包合物与鲱鱼精DNA的相互作用为吸热反应,可自发进行,并为![]() 所驱动。
所驱动。
c. 荧光光谱、紫外光谱和电化学等多种方法的研究结果表明,该包合物γ-CD-TY与鲱鱼精DNA之间的作用方式是一种以沟槽作用和静电作用为主,嵌插作用为辅的混合作用方式。由于γ-CD通过疏水作用对达旦黄的包合,以及TY分子相对较长(约为21.26×10-10 m),使得γ-CD-TY包合物中只有处于γ-CD圆筒外的TY分子的端基部分与DNA才有插入作用,即嵌插作用十分微弱。
参考文献:
[1] 陈晓青, 喻红竹, 曹佐英. 化学修饰β-环糊精接枝壳聚糖及其对水溶液中酚的吸附[J]. 中南大学学报: 自然科学版, 2007, 38(1): 112-115.
CHEN Xiao-qing, YU Hong-zhu, CAO Zuo-ying. Chemical modification of β-cyclodextrin chitosan and its adsorption on phenol, n-Nonylphenol and resorcinol[J]. Journal of Central South University: Science and Technology, 2007, 38(1): 112-115.
[2] Masson M, Loftsson T, Masson G, et al. Cyclodextrins as permeation enhancers: Some theoretical evaluations and in vitro testing[J]. J Control Release, 1999, 59(1): 107-118.
[3] 何 华, 汤 瑶, 孙 成, 等. 光谱法及热动力学法研究环糊精与三氟氯氰菊酯的包合作用[J]. 化学学报, 2006, 64(2): 175-181.
HE Hua, TANG Yao, SUN Cheng, et al. Study on inclusion complexes of β-cyclodextrins with cyhalothrin by spectral analysis and thermodynamics[J]. Acta Chimica Sinica, 2006, 64(2): 175-181.
[4] 龙 琪, 陈昌云, 马美华, 等. β-环糊精与左氧氟沙星超分子配合物的合成表征及其与DNA的结合性质[J]. 光谱实验室, 2007, 24(1): 23-27.
LONG Qi, CHEN Chang-yun, MA Mei-hua, et al. Synthesis, characterization and DNA affinity of the supermolecule between β-cyclodextrin and levoofloxacin[J]. Chin J Spectroscopy Laboratory, 2007, 24(1): 23-27.
[5] 杨 青, 赵 强, 魏琦峰, 等. 吡啶-2, 6-二甲酰胺衍生物及其Tb(Ⅲ)和Eu(Ⅲ)配合物的合成与荧光性质[J]. 中南大学学报: 自然科学版, 2007, 38(4): 696-700.
YANG Qing, ZHAO Qiang, WEI Qi-feng, et al. Synthesis of Eu(Ⅲ) and Tb(Ⅲ) complexes with novel pyridine dicarboxylic acid derivatives and their fluorescence properties[J]. Journal of Central South University: Science and Technology, 2007, 38(4): 696-700.
[6] 曹 瑛, 李一峻, 何锡文. 中性红作为DNA作用方式光谱探针的研究[J]. 高等学校化学学报, 1999, 20(5): 709-712.
CAO Ying, LI Yi-jun, HE Xi-wen. Studies on neutral red as interacting mode spectroscopic probe of DNA[J]. Chem J Chinese Universities, 1999, 20(5): 709-712.
[7] 叶芳贵, 谢增鸿, 林旭聪, 等. DNA 荧光探针-荧光素-中性红体系的研究[J]. 分析测试技术与仪器, 2003, 9(2): 74-79.
YE Fang-gui, XIE Zeng-hong, LIN Xu-cong, et al. Fluorescein-neutral red-pair as a new donor acceptor set for fluorescence energy transfer study of DNA[J]. Anal Test Tecnol Instrum, 2003, 9(2): 74-79.
[8] 陈小燕, 刘万毅, 张 境. β-环糊精-双二茂铁基烯酮包合物的特征及微环境效应研究[J]. 光谱学与光谱分析, 2006, 26(7): 1265-1263.
CHEN Xiao-yan, LIU Wan-yi, ZHANG Jing. Study on the characterization of β-cyclodextrin-diferrocenylenone inclusion complex and micro-environmental effects[J]. Chin J Spectroscopy Laboratory, 2006, 26(7): 1265-1263.
[9] Botsi A, Yannakopoulou K, Hadjoudis, et al. Calculations on inclusion complexes of cyclomaltoheptaose (β-cyclodextrin) with 1, 7-dioxaspiro [5, 5] undecane and nonanal[J]. J Carbohydr Res, 1996, 283: 1.
[10] Widom J, Baldwin R L. Cation-induced toroidal condensation of DNA: Studies with Co3+(NH3)6[J]. J Mol Biol, 1980, 144: 431-434.
[11] Purcell M, Neault J F, Riahi T. Interaction of taxol with human serum albumin[J]. Biochem Biophys Acta, 2000, 1478(1): 61.
[12] 张黔玲, 刘剑洪, 任祥忠, 等. 新型双核配合物的形成及荧光性质研究[J]. 高等学校化学学报, 2006, 27(10): 1805-1810.
ZHANG Qian-ling, LIU Jian-hong, REN Xiang-zhong, et al. Formation and luminescent properties of new heterobimetallic complexes[J]. Chem J Chinese Universities, 2006, 27(10): 1805-1810.
[13] Lepecq J B, Paoletti C J. A fluorescent complex between ethidium bromide and nucleic acids[J]. J Mol Biol, 1967, 27: 87-106.
[14] 王兴明, 黎泓波, 胡亚敏, 等. 苏木素与 DNA 相互作用的光谱研究[J]. 化学学报, 2007, 65(2): 140-146.
WANG Xing-ming, LI Hong-bo, HU Ya-ming, et al. Study on the interaction between hematoxylin and DNA by spectrometry [J]. Acta Chimica Sinica, 2007, 65(2): 140-146.
[15] 沈鹤柏, 康玉专, 杨海峰, 等. 稀土离子对DNA作用的循环伏安法和光谱法研究[J]. 电化学, 1998, 4(4): 400-405.
SHEN Hei-bai, KANG Yu-zhuan, YANG Hai-feng, et al. Study of the effect of rare earth ions on DNA using cyclic voltammetry and spectroscopy[J]. Electrochemistry, 1998, 4(4): 400-405.
[16] 彭 娟, 高作宁. 多巴胺-Al(Ⅲ)配合物DNA相互作用的电化学和光谱学研究[J]. 化学研究与应用, 2007, 19(6): 615-621.
PENG Juan, GAO Zuo-ning. Studies on interaction between dopamine-Al (Ⅲ) complex and DNA by electrochemistry and spectroscopy[J]. Chem Res Application, 2007, 19(6): 615-621.
收稿日期:2008-02-18;修回日期:2008-06-18
基金项目:国家自然科学基金资助项目(30572254)
通信作者:王兴明(1955-),男,四川广汉人,教授,从事化学生物学研究;电话:0816-6089371;E-mail: xmwang_xkd@126.com


