钯-氢体系的物理化学性质
中国工程物理研究院,中国工程物理研究院 四川绵阳621900 ,四川绵阳621900
摘 要:
对钯 氢体系的物理化学性质进行了综合评述。钯是一种面心立方 (fcc) 结构的吸氢金属 , 氢原子溶解在晶格中 , 占据八面体间隙位 (O) , 形成fcc的子晶格 , 吸氢时晶格发生等方性膨胀 ;氢在钯中的扩散路径为O T O跃迁 , 存在反同位素效应 ;钯氢化物的氢同位素分离因子较大 , 并受到温度、氢浓度等因数的影响 ;钯 氢体系的p c等温线表现出良好的坪台性 , Pd H和Pd D均存在临界点 , 尚未确定Pd T有无临界点 ;单晶钯 氢反应动力学与不同的晶面有关 ;钯 氚体系存在氚老化效应
关键词:
中图分类号: O614
收稿日期:2002-01-21
Physical and Chemical Properties for Palladium-Hydrogen System
Abstract:
The physical and chemical properties for Pd H system were reviewed. The crystal structure of pure Pd is of face centered cubic ( fcc ) and it is a hydrogen absorbing metal. The hydrogen atom dissolves in lattice and occupies octahedral interstitial position, and then forms hydrogen sublattice (fcc ) . Upon hydrogen absorption the lattice undergoes an isotropic expansion while retaining its fcc structure. The defects in lattice are mainly extended type. The diffusion path of hydrogen is O T O jumping and there is reverse isotopic effect accompanying with quantum effect. The separation factor of palladium hydride is relatively larger than other common metal hydride and is affected by temperature and hydrogen concentration. The pressure composition isotherm in palladium hydrogen system exhibits good plateau. Pd H and Pd D systems have their own critical point respectively, but it has not been in agreement about the critical point of Pd T system. The dynamical property for single crystal Pd H reaction associates with the specific crystal face exposured to hydrogen. Tritium aging effect exists in Pd T system.
Keyword:
palladium; hydrogen isotope; metal hydride;
Received: 2002-01-21
对金属中氢的研究已有很长的历史。 早在1866年Graham就已发现大量氢气可溶解于过渡金属钯并于1868年首次开发出钯半透膜以净化氢气。 金属Pd及其一些合金, 如Pd-Ag, Pd-Al等, 由于其氢化物的同位素效应显著, 在氚工艺与氢同位素生产中占据重要的地位, 常被用作氢同位素分离、 纯化处理工艺的首选材料, 因此了解钯氢化物的物理化学性质对基础研究和工程应用研究具有重要意义。 钯-氢体系除具有金属-氢体系的一般性质外, 还具有其独特的物理化学性质, 如氢的渗透性高、 易氢化以及分离因子大等性质。 本文重点评述了钯-氢体系的晶体结构、 氢的扩散、 氢的溶解热动力学、 同位素效应等物化性质的研究现状。
1 Pd氢化物的结构及结合状态
1.1 Pd氢化物的结构
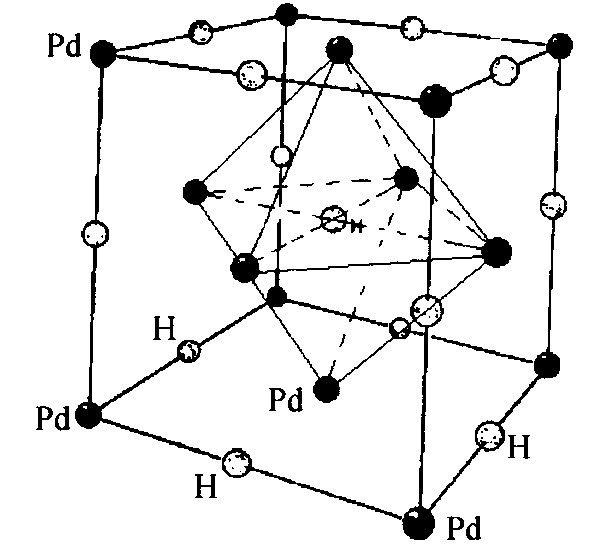
Pd晶体属面心立方 (fcc) 结构, 每个单胞含4个Pd原子, 4个八面体填隙位以及8个四面体填隙位 (T) 。 晶格参数a0为0.3890 nm (298 K) , 吸氢时晶格发生等方性膨胀, 但始终保持fcc结构。 在稀释相 (α相) 区域, 298 K时PdHx的a0为0.3894 nm, 对应的氢含量H/Pd≈0.015。 氕化物中α与β相共存区的a0是0.4025 nm, 当pH2=0.1 MPa, H/Pd≈0.7时, a0=0.4040 nm。 在单一β相氕化物中的晶格膨胀将更大
后来发现体系中存在有序低温相, 因此相图比简单的气-液型相图更复杂
1.2 Pd-H结合状态
总能计算的结果给出了Pd-H体系中相当完整的结合图象。 (1) 氢加入Pd时, 少量的电荷从相邻Pd原子区域传输到相邻Pd和H原子区域。 由于H的1s轨道和Pd的4d轨道之间的相互作用产生了新的结合状态 (比s-d结合低几个eV) 。 Pd原子周围的电荷是象d电子, 而H原子周围的电荷则象s电子, 两个位置周围的电荷数量相当; (2) Pd-H间的有效作用是短距离的, 几乎不超过最近邻的Pd原子; (3) 与H电子的杂化改变了4d电子的状态密度, 使之变窄, 包含的电子态变少, 并且它的重心向高结合能方向移动 (即增加了d 带填充) , 以致于损失了结合力; (4) 随着Fermi能级的电子态密度减小, Fermi能增加;。 (5) 严格的能带近似是无效的, 因为只有一小部分由额外H原子提供的电子位于导带顶部。
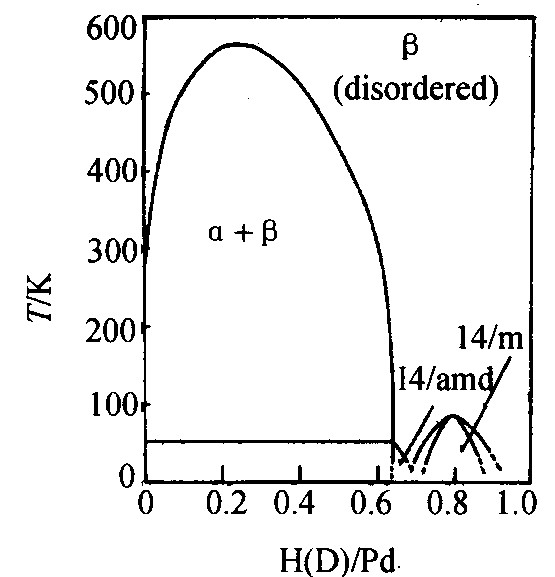
图1 Pd-H (D) 体系相图
Fig.1 Phase diagram of Pd-H (D) system
图2 H (或D) 原子在β相Pd-H (或Pd-D) 中的位置模型
Fig.2 Position modeling of H and D atoms in Pd lattice for β-phase Pd-H (D)
1.3 氢在β相钯氢化物中的位置
钯-氢体系多年来一直引起人们的兴趣, 主要是因为气体原子在金属中非同寻常的扩散特性。 Davis
2 氢在钯中的溶解
2.1 氢在钯中溶解的理论概述
在金属中氢的不同物理性质中, 溶解度是一个极其重要的性质。 氢同位素 (H, D, T) 在钯中的溶解行为是类似的, 均表现为解离吸附溶解。 但是由于H, D, T在气相与Pd晶格中的零点能和振动能不同, 它们在钯中的溶解度表现出明显的同位素效应。 L
2.2 氢在钯中的溶解度的影响因素
2.2.1 应力对氢溶解度的影响
流体静力学应力对填隙溶解度的影响已由Li等
对单轴向应力, 方程还原成ΔμH=1/3VHσx。 此方程也可作为获得VH的替代方法。 VH为H在浓缩相的偏摩尔体积
2.2.2 缺陷的作用
在充分退火的Pd中, 最初稀释相氢的溶解度遵守Sieverts定律, 即p1/2-r图是线性的, 且当r趋于0时具有切线与原点相交的特征。 实际的偏差必然是由于缺陷的存在。 对氢溶解度存在影响的缺陷类型是普遍存在于金属中的缺陷, 例如点缺陷 (空位和杂质原子) 和扩展缺陷 (位错, 晶界, 外表面) 。
氢在α相Pd中的溶解度增加类似于冷处理使得位错应力场增加
Kirchheim
3 氢在钯金属中的扩散
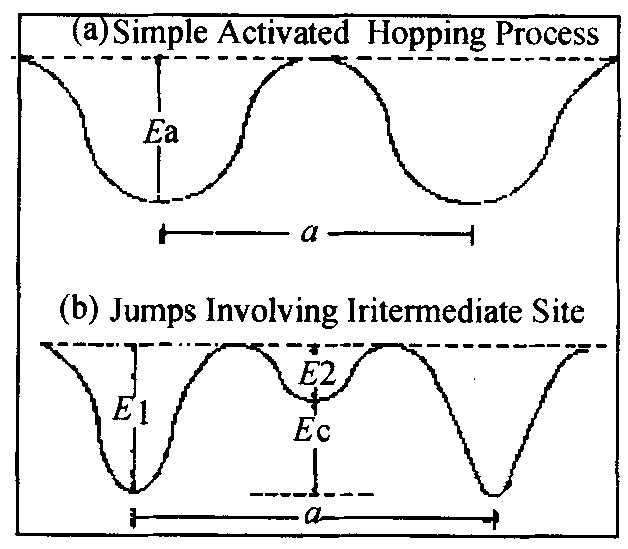
从微观来看, 扩散系数可由平衡位置间的跃迁表示, 即:
D=fTa2/6τd (2)
式中a为平均跃迁距离, τd为两次跃迁之间的平均时间, fT是校正因子。 图3 (a) 给出了涉及从势阱底直接跃迁的理想扩散。 Ea是扩散活化能且满足Arrhenius公式:
D=D0exp (-Ea/kBT) (3)
但实际证明氢的运动要复杂得多。 图3 (b) 给出了一种可能的跃迁方式, 此时观察到的Ea与势阱深度是不一致的。 与其它填隙原子 (如N, O, C) 相比, H原子在金属氢化物中的运动是相当快的, 观察到的室温扩散系数D值范围在~10-16和~10-6 cm2·s-1之间。
图3 扩散过程中氢同位素的势阱示意图
Fig.3 Sketch diagram of potential well of hydrogen isotopes during diffusion
3.1 扩散实验结果
钯-氢体系中的扩散系数已被不同的方法确定。 包括渗透、 氢吸收、 Gorsky技术、 准弹性中子散射 (QNS) 以及对稀释钯铁磁合金的退磁方法。
298 K时, 氢在Pd中的扩散系数相对较大, 当氢的含量很小时, 氕和氘在Pd 中的Einstein扩散系数分别为:
D*H=2.5×10-7exp (-21.8 kJ/RT·xH) m2·s-1 (4)
D*D=1.7×10-7exp (-19.9 kJ/RT·xH) m2·s-1 (5)
298 K时, H和D的扩散系数分别为3.8×10-11和5.5×10-11 m2·s-1。 尽管对H而言指前因子更大, 但D的扩散系数却比H大; H和D的扩散活化能之间的差异解释了D扩散更快。 Bohmholdt等
非理想状态下氢的Fick扩散系数D (r) 值是有实际价值的, 在298 K时, β相中的数值比在稀释相大约4.5倍
式中r是H/Pd原子比, D*为Einstein扩散系数 (与浓度无关) , a为氢的活度, μH可由pH2得到:
3.2 氢在钯中扩散的模拟模型
Gillan
Salomons
4 钯-氢体系的热力学性质
4.1 Pd-Q体系相图
Pd-Q最典型的性质是在临界点以下出现两种固相 (见图1) , 钯-氢体系的临界点见表1。 Pd-T是否存在临界点尚存争论, 其原因可能在于氚的危险性限制了实验测定的实现。
多年来一直认为相图的混溶带组成了完整的相图, 尽管这与热力学第三定律所要求的规律 (当T→0时, 无序将消失) 矛盾。 1978年Ross等
4.2 Pd-Q反应热力学的实验结果
Pd-H体系对热力学研究而言是方便的, 因为氢的化学位可容易地由氢气压力确定, 氢气压力与含氢金属相平衡。 从实验确定的等温线可得到μH, 从μH=0.5RTlnpH2随温度的变化, 可得到相关的偏摩尔焓和偏摩尔熵, 即ΔHH和ΔSH。 对于氢气在单相区吸收, 方程 (8) , (9) 可用:
(?lnp1/2/? (1/T) ) r=ΔHH/R (8)
T (?lnp1/2/?T) r+lnp1/2=-ΔSH/R (9)
在两固相处于平衡态, 坪台压力随温度的变化可推导出反应 (10) 的坪台热力学量:
式中a和b分别为稀释相和氢化物相的组成。 对两固相的p-c-T测量结果以及L
表1 钯-氢体系的临界常数
Table 1Critical parameter of Palladium-Hydrogen system
| 体系 | 临界常数 | ||
| 临界温度 Tc/K |
临界压力 pc/MPa |
临界Q/Pa原子比 rc (Q/Pd) |
|
| Pd-H | 563 | 1.9 | 0.257 |
| Pd-D | 556 | 3.9 | 0.25 |
| Pd-T | 无临界常数, 但存在分歧 | ||
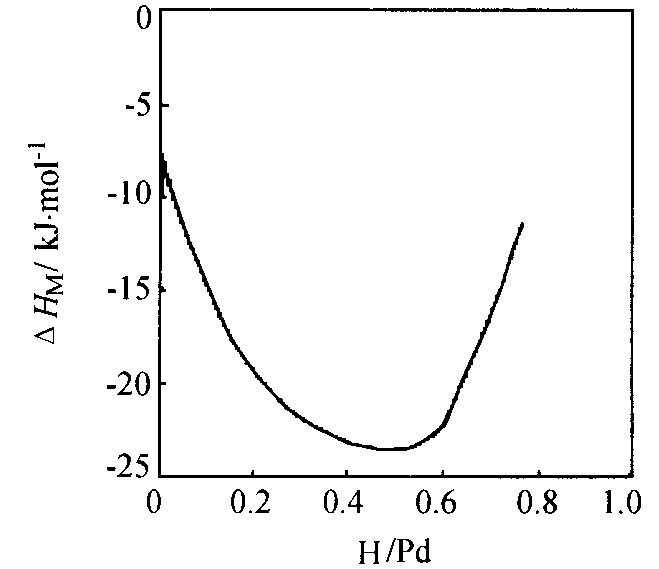
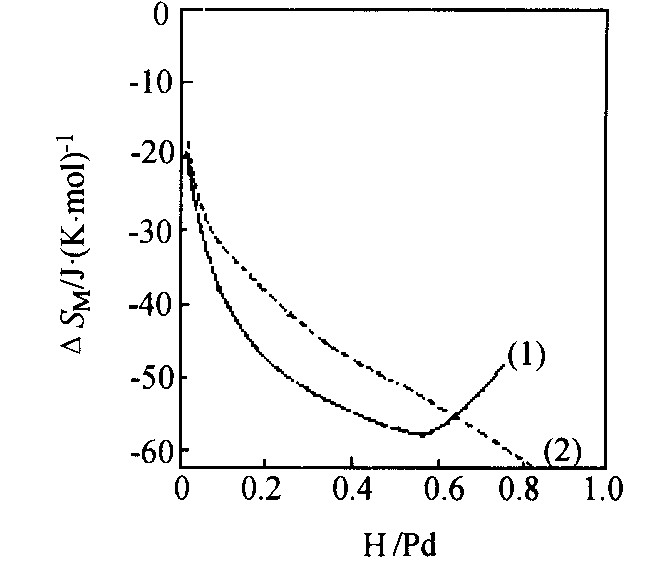
图4和5表明了ΔHH和ΔSH随r的变化, 可以看出ΔHH和ΔSH均存在最小值。 此时希望的温度应高于Tc (热力学量才可能是r的连续函数) , 对于图4和5, 温度被人为地选择在500 K, 但仍假设氢化物相还未形成。
无限稀释时氢溶解的相对偏摩尔焓ΔH
表2 Pd-H和Pd-D两相坪台区的焓和熵
Table 2Enthalpy and entropy of plateau phase for Pd-H and Pd-D
| Hf/ (kJ·mol-1) | Hd/ (kJ·mol-1) | Sf/ (kJ·mol-1) | Sd/ (kJ·mol-1) |
| 范特霍夫焓 | |||
| -18.70.15 (H) | 19.50.25 (H) | -46.30.4 (H) | 46.20.6 (H) |
| -16.80.30 (D) | 17.70.25 (D) | -46.70.8 (D) | 46.70.65 (D) |
| 量热焓 | |||
| -19.090.15 (H) | 19.280.20 (H) | -46.6 (H) | 46.6 (H) |
| -17.270.25 (D) | 17.230.25 (D) | -46.6 (D) | 46.4 (D) |
图4 HH随r的变化
Fig.4 Variation of HH with H/Pd=r
图5 ΔSH随r的变化
Fig.5 Variation of ΔSH with H/Pd=r (1) 实验数据; (2) 理想状态
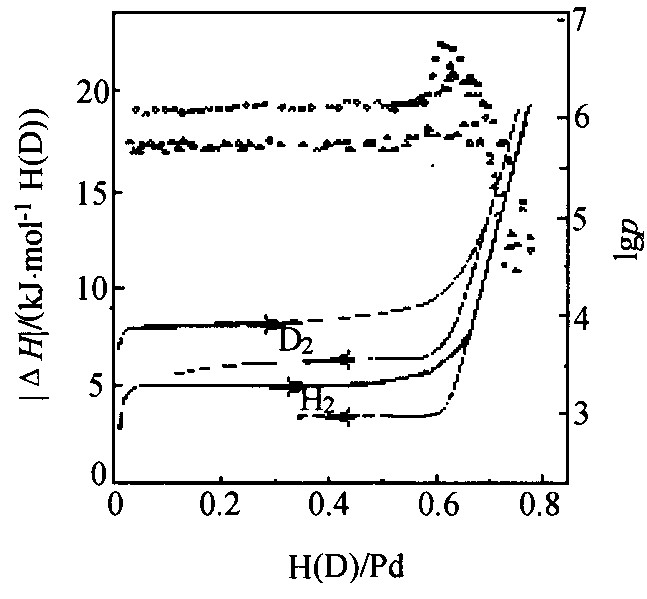
直接从反应量热确定焓变可替代p-c-T方法。 图7显示了298 K时在两相平台区及单一β相区由反应热量决定的吸放氢 (氕、 氘) 的相关焓变
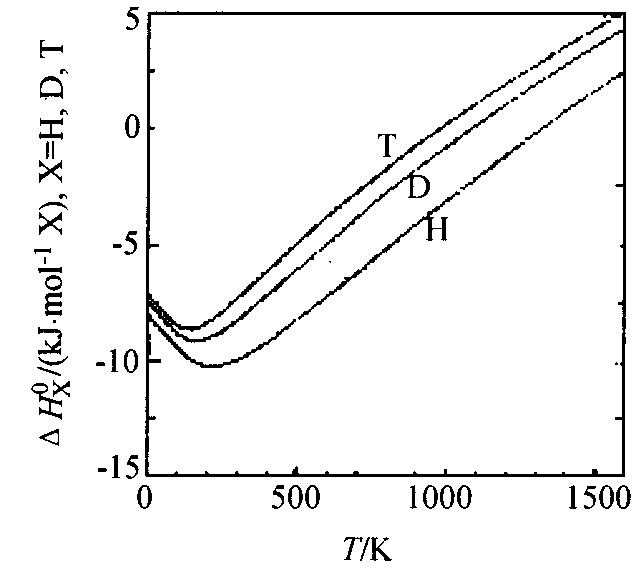
由量热计算的坪台区热焓几乎与温度无关。 例如, Picard等
图6 ΔH0Η与温度的函数关系图
Fig.6 Plot of ΔH
图7 量热法确定的298 K时Pd-H和Pd-D体系的焓变
Fig.7 Relative enthalpies for both Pd-H and Pd-D systems determined from reaction calorimetry (298 K) using Pd foil
式中的|ΔHplat|是量热值,
5 Pd氢化物的同位素效应
5.1 Pd氢化物中氢同位素效应的一般概念
L
同位素分离因子 (例如H和D) 被定义为:
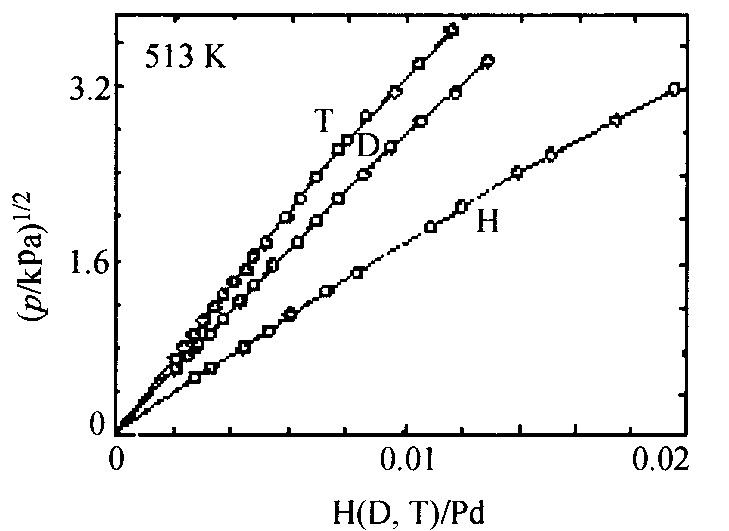
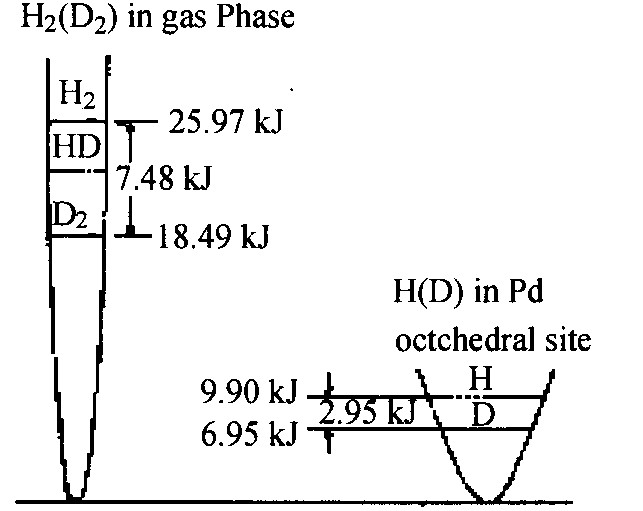
图8 α相氢溶解度的同位素效应
Fig.8 Isotopic effect of solubility in α-phase for palladium-hydrogen systems
图9 气相与α相中H, D零点能级的相对位置
Fig.9 Relative location of the zero point energy levels of H and D in gas phase and dissolved in α-phase of palladium
式中x代表气相 (g) 或固相 (s) 中的给定氢同位素的摩尔分数。 给出的同位素分离因子表达式未涉及氢-氢相互作用与同位素自身性质的关系。 后来Brodousky等
5.2 Pd氢化物的氢同位素分离因子
Pd具有相当大的同位素效应 (分离因子) , 对此较少有文献报道。 对Pd-H体系的分离因子结果相对完整的测量已由Fukada等
考虑平衡常数和分离因子的关系:
α=K/R (13)
对H-D交换反应K=0.5。 平衡常数与反应的标准自由能G0的关系由下式给出,
ΔG0=-RTlnK (14)
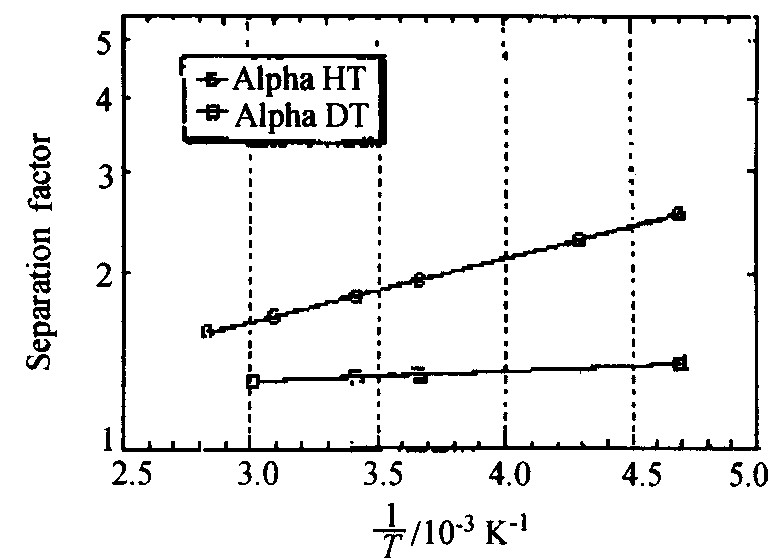
于是可得到lnα= (ΔH/T-ΔS) /R。 这种模型对α相是有效的, 因为可从经典热力学推导出来。 但是, 在Pd-H相图的β和两相区, 氢不是以纯组元形式存在, 而是分别以化合物及纯组元和化合物共存的形式存在, 所以理想溶液分析方法是不严格的, β相的分离因子与温度的关系将不同于前面的形式。 不同作者给出了分离因子 (α) 与温度的关系列于表3。 相比较而言, 在相同温度下, H-T混合物的分离因子更大, D-T的分离因子小于H-D。 H-T和D-T的分离因子示于图10
表3 分离因子 (α) 与温度 (T) 的关系
Table 3Variation relation of separation factor α with temperature
| α-T的关系表达式 | 参考文献 |
| αH2-HD=exp (228/T-0.121) | 32 |
| lgα=225/T-0.51 | 33 |
| lgα=215/T-0.47 | 34 |
| lnα=245/T+0.055 | 32 |
| lgα=119/T-0.07 (固相D组成接近0%) lgα=82/T+0.025 (固相D组成为70%) |
35 |
| α=exp[-0.3+B (xH) (·1000T) 0.75] B (xH) =0.50916-0.0037952xH-0.15589x2Η |
36 |
图10 H-T和D-T的分离因子与温度关系
Fig.10 Relationship between separation factor of H-T and D-T and temperature
6 Pd-H反应动力学与表面
研究氢与单晶Pd的不同晶面的相互作用的方法有: 热脱附谱 (TDS) 、 低能电子衍射 (LEED) 、 离子散射及理论计算。 观察到的反应行为与暴露给氢气的特定晶面有关。 例如120 K时, (110) 晶面上首先形成有序氢 (2×1) 结构, 少于一个单层, 当覆盖度增加时, (1×2) 的重构表面开始出现
7 钯-氚体系的氚老化效应
用于氚工艺的金属氢化物会在晶格中积累氚衰变产物3He。 由3He引起的金属氢化物晶体结构变化导致金属氢化物的吸放氢性能变化。 Nobile等
Pd放氢等温线所观察到的压力变化是温度的函数, 这是由于3He聚积导致晶格结构变化引起的。 以前对3He释放的测量
8 结束语
综上所述, 各国学者对钯-氢体系的研究是较为深入的, 但是一些基础问题的分歧依然存在, 数据的差异也比较明显, 钯的粒度及纯度对钯-氢体系的热动力学、 氢的扩散特性、 氢同位素分离性能以及溶解度等物化性能都存在影响, 氢同位素在不同形态钯表面的交换机理仍有待进一步研究, 钯的氚老化效应的微观机制仍不完全清楚, 因此, 对钯-氢体系的系统研究还需继续深入。
参考文献
[1] BaabaI , HardyP , SanMartinA , etal. J .Phys., 1987, 17:2041.
[2] ShirberJE , MorosinB . Phys.Rev., 1975, B12:117.
[3] AbbensethR , WipfH . J .Phys., 1980, F10:353.
[4] AlefeldG . Ber.BunsengesPhys.Chem., 1972, 76:746.
[5] AdersonIS , RossDK , CarlileC . Phys.Lett., 1978, 68A :249.
[6] BlaschkoO , FratzlP , KlemencicR . Phys.Rev., 1981, B81:277.
[7] BondR , RossDK . J .Phys.1982, F12:597.
[8] RushJ , RoweJ , RichterD . Z .Phys., 1984, B55:283.
[9] RoweJ , RushJ , SmithH , eta. Phys.Rev.Lett., 1974, 33:1297.
[10] DavisWD . KnollsAtomicPowerLab.Rep., 1954.1227.
[11] WorshamJE , WilkisonMK , ShullCG . J .Phys.Chem.SolidsPergamonPress, 1957, 3:303.
[12] L¨asserR , PowellGL . Phys.Rev., 1986, B34 (2) :578.
[13] LiJ , OrianiR , DarkenL . Z .Phys.Chem., 1966, 49:271.
[14] WriedtH , OrianiR . ActaMetall., 1970, 18:271.
[15] KirchheimR .ActaMetall., 1986, 34:37.
[16] ManzkeR , CreceliusG , FinkJ , etal. J .Phys., 1982, F12:L279.
[17] GuthrieS , WolferW . J .LessCommanMet., 1990.
[18] BesenbacherF , MyersS , NorskovJ. Nucl.Instr.Meth.Phys.Res., 1985, B78:55.
[19] KirchheimR . ActaMetall.1982, 30:1069.
[20] LynchJ, ClewleyJD , CurranT , etal. J .LessCommanMet., 1977, 55:153.
[22] KirchheimR . Prog.Mater.Sci., 1988, 32:261.
[23] BohmholdtG , WickeE . Z .Phys.Chem., 1967, NF56:133.
[24] GillanMJ . J .Phys., 1990, C 19:6169.
[25] CulvahouseJ , RichardsP . Phys.Rev., 1988, B 38:10020.
[26] SalomonsE . J .Phys.Condens.Matter., 1990, 2:845.
[27] L¨asserR , PowellGL . Phys.Rev., 1986, B 34:578.
[28] FlanaganT , LuoW , ClewleyJ . J .LessCommonMet., 1991.
[29] PicardC , KleppaOJ , BoureauG . J .Chem.Phys., 1978, 69:5549.
[30] L¨asserR . Phys.Rev., 1984, B 29:748.
[31] BrodowskyH , RepenningD . ZPhys.Chem., 1979, NF114:141.
[32] FukadaS , FuchinoueK , NishikawaM . JournalofNuclearMa terials, 1995, 226:311.
[33] ThomasCO , SmithHA . JournalofPhsicalChemistry, 1958, 63:427.
[35] BotterF , MenesJ , TistchenkoS , etal. BulletindelaSoci啨t啨ChimiquedeFrance, 1965, 11:3374.
[36] ThomasManuelOrtiz. LA -13454-T , DE98006025, LosAlamosNationalLaboratory.1998.
[37] AndreevBM , PerevezentsevAN , MandrykinIA , etal.Radio khimiya, 1986, 28 (2) :212.
[38] CattaniaM , PenkaV , BehmR , etal. Surf.Sci., 1983, 126:382.
[39] HeJ , HarringtonD , DriffithsK , etal. Surf.Sci., 1988, 198:413.
[40] FelterT , SowaE , VanHoveM . Phys.Rev., 1989, B40:891.
[41] KayB , PedenC , GoodmanDW . Phys.Rev., 1986, B 34:817.
[42] AuerW , GrabkeH . Ber, BunsengesPhys.Chem., 1974, 78:58.
[45] ThomasGJ , SwansigerWA , BaskesMI. J .Appl.Phys., 1979, 50:6942.
[46] CoronadoPR , FearonEM , GarzaRG , etal. FusionTechn ol, 1988, 14:741.
[47] ThomasGJ , MintzJM . J .Nucl.Mater., 1983, 116:336.
[48] LasserR , Bickman, K , Trinkaus. Phys.Rev., 1989, B 40:3306.
[49] WilsonWD , BissonCL , BaskesML . Phys.Rev., 1981, B24:5616.
[1] BaabaI , HardyP , SanMartinA , etal. J .Phys., 1987, 17:2041.
[2] ShirberJE , MorosinB . Phys.Rev., 1975, B12:117.
[3] AbbensethR , WipfH . J .Phys., 1980, F10:353.
[4] AlefeldG . Ber.BunsengesPhys.Chem., 1972, 76:746.
[5] AdersonIS , RossDK , CarlileC . Phys.Lett., 1978, 68A :249.
[6] BlaschkoO , FratzlP , KlemencicR . Phys.Rev., 1981, B81:277.
[7] BondR , RossDK . J .Phys.1982, F12:597.
[8] RushJ , RoweJ , RichterD . Z .Phys., 1984, B55:283.
[9] RoweJ , RushJ , SmithH , eta. Phys.Rev.Lett., 1974, 33:1297.
[10] DavisWD . KnollsAtomicPowerLab.Rep., 1954.1227.
[11] WorshamJE , WilkisonMK , ShullCG . J .Phys.Chem.SolidsPergamonPress, 1957, 3:303.
[12] L¨asserR , PowellGL . Phys.Rev., 1986, B34 (2) :578.
[13] LiJ , OrianiR , DarkenL . Z .Phys.Chem., 1966, 49:271.
[14] WriedtH , OrianiR . ActaMetall., 1970, 18:271.
[15] KirchheimR .ActaMetall., 1986, 34:37.
[16] ManzkeR , CreceliusG , FinkJ , etal. J .Phys., 1982, F12:L279.
[17] GuthrieS , WolferW . J .LessCommanMet., 1990.
[18] BesenbacherF , MyersS , NorskovJ. Nucl.Instr.Meth.Phys.Res., 1985, B78:55.
[19] KirchheimR . ActaMetall.1982, 30:1069.
[20] LynchJ, ClewleyJD , CurranT , etal. J .LessCommanMet., 1977, 55:153.
[22] KirchheimR . Prog.Mater.Sci., 1988, 32:261.
[23] BohmholdtG , WickeE . Z .Phys.Chem., 1967, NF56:133.
[24] GillanMJ . J .Phys., 1990, C 19:6169.
[25] CulvahouseJ , RichardsP . Phys.Rev., 1988, B 38:10020.
[26] SalomonsE . J .Phys.Condens.Matter., 1990, 2:845.
[27] L¨asserR , PowellGL . Phys.Rev., 1986, B 34:578.
[28] FlanaganT , LuoW , ClewleyJ . J .LessCommonMet., 1991.
[29] PicardC , KleppaOJ , BoureauG . J .Chem.Phys., 1978, 69:5549.
[30] L¨asserR . Phys.Rev., 1984, B 29:748.
[31] BrodowskyH , RepenningD . ZPhys.Chem., 1979, NF114:141.
[32] FukadaS , FuchinoueK , NishikawaM . JournalofNuclearMa terials, 1995, 226:311.
[33] ThomasCO , SmithHA . JournalofPhsicalChemistry, 1958, 63:427.
[35] BotterF , MenesJ , TistchenkoS , etal. BulletindelaSoci啨t啨ChimiquedeFrance, 1965, 11:3374.
[36] ThomasManuelOrtiz. LA -13454-T , DE98006025, LosAlamosNationalLaboratory.1998.
[37] AndreevBM , PerevezentsevAN , MandrykinIA , etal.Radio khimiya, 1986, 28 (2) :212.
[38] CattaniaM , PenkaV , BehmR , etal. Surf.Sci., 1983, 126:382.
[39] HeJ , HarringtonD , DriffithsK , etal. Surf.Sci., 1988, 198:413.
[40] FelterT , SowaE , VanHoveM . Phys.Rev., 1989, B40:891.
[41] KayB , PedenC , GoodmanDW . Phys.Rev., 1986, B 34:817.
[42] AuerW , GrabkeH . Ber, BunsengesPhys.Chem., 1974, 78:58.
[45] ThomasGJ , SwansigerWA , BaskesMI. J .Appl.Phys., 1979, 50:6942.
[46] CoronadoPR , FearonEM , GarzaRG , etal. FusionTechn ol, 1988, 14:741.
[47] ThomasGJ , MintzJM . J .Nucl.Mater., 1983, 116:336.
[48] LasserR , Bickman, K , Trinkaus. Phys.Rev., 1989, B 40:3306.
[49] WilsonWD , BissonCL , BaskesML . Phys.Rev., 1981, B24:5616.