载TGF-β1明胶微球涂层多孔钛对MG63细胞功能的影响
陈良建1, 2,汪瑞芳1,郭小平1,李益民2,何浩2,李挺2
(1. 中南大学 湘雅三医院,湖南 长沙,410013;
2. 中南大学 粉末冶金国家重点实验室,湖南 长沙,410083)
摘要:用改良乳化冷凝聚合交联法制备明胶缓释微球,体外评价载TGF-β1明胶微球对MG63细胞增殖和分化的影响,并优化TGF-β1作用浓度;用粉末注射成形技术制备60%孔隙度具有连通孔结构多孔钛,用涂覆法在多孔钛表层孔隙内制备载TGF-β1明胶微球涂层,MTT法检测该涂层对L929细胞毒性,ELISA法检测该涂层的药物动力特性,体外评价该涂层对MG63细胞的黏附、增殖和分化的影响。研究结果表明:TGF-β1浓度影响MG63细胞功能,在0.025~2.500 mg/g范围内,TGF-β1对MG63细胞的增殖和分化作用呈剂量正效应关系, 浓度为2.5 mg/g时,对MG63细胞分化作用最优,而TGF-β1浓度为25 mg/g时,对MG63细胞增殖有抑制作用;载TGF-β1明胶微球涂层多孔钛无细胞毒性,涂层具有缓释功能,能维持12d,该涂层有利于MG63细胞的黏附、增殖和 分化。
关键词:
中图分类号:R783.1 文献标志码:A 文章编号:1672-7207(2011)08-2266-08
Effects of TGF-β1 gelatin microspheres coated on
porous titanium on function of MG63 cells
CHEN Liang-jian1, 2, WANG Rui-fang1, GUO Xiao-ping1, LI Yi-min2, HE Hao2, LI Ting2
(1. Third Xiangya Hospital, Central South University, Changsha 410013, China;
2. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: Gelatin microspheres were made by improved emulsified cold condensation method. Effects of TGF-β1 gelatin microspheres on the proliferation and differentiation of MG63 cells were investigated in vitro, as well as the optimal TGF-β1 concentration. Porous titanium with a porosity of 60% and an inter-connected structure was prepared using a powder injection molding method. A coating of TGF-β1 loaded gelatin microspheres was applied in the pores of the porous titanium surface. MTT assay method was used to evaluate the cytotoxicity of the coating to L929 cells. The pharmacokinetics of the coating was tested with TGF-β1 ELISA kit. In vitro, the effect of the coating on adhesion, proliferation and differentiation of MG63 cells was investigated. The results show that the TGF-β1 concentration affects the function of MG63 cells. In vitro, the proliferation and differentiation of MG63 cells show a positive dose-effect relationship at TGF-β1 concentrations of 0.025-2.500 mg/g. TGF-β1 concentration of 2.500 mg/g is in favor of the differentiation, while the concentration of 25 mg/g inhibites cells’ proliferation. Porous titanium samples coated with TGF-β1 gelatin microspheres are nontoxic to L929 cells and are able to maintain a slow-release state during 12 d. The porous titanium implants coated with TGF-β1 loaded gelatin microspheres benefits MG63 cells adhesion, proliferation and differentiation on the 3th, 7th, 14th slot.
Key words: porous titanium; TGF-β1 loaded gelatin microspheres coating; MG63 cell; proliferation; differentiation
种植义齿已逐渐成为修复牙缺失的主流技术。现有的牙种植体多为全致密型,尚存如下不足:未提供骨组织长入的结构条件,骨整合形成时间长(需3~6月),初期稳定性低,种植体表面涂层易受植入剪切力破坏失效等。多孔种植体能提供骨质长入种植体的结构,实现生物固定,其力学性能与骨质相匹配,是新型种植体的研究热点。当前钛种植体改性研究多着力于改善种植体与细胞的亲和力,促进钙磷沉积和新骨生成,缺乏种植体与周围细胞和组织的深层互动。若新型钛种植体能主动动员周围细胞,启动并强化成骨信号,加快种植体周围骨组织的改建与整合,则有利于提高种植体初期的稳定性和成功率。已有研究证实局部应用生长因子可以促进骨髓基质细胞向成骨细胞分化,提高碱性磷酸酶活性和增加骨桥素mRNA的表达[1-2]。但生长因子直接局部应用存在扩散较快、易被蛋白酶分解、半衰期短等缺陷[3]。生长因子有效浓度和作用时间的维持是局部应用的前提。本文作者用明胶微球作为生长因子的缓释系统,通过体外细胞实验研究载TGF-β1缓释明胶微球涂层的多孔钛试样对成骨细胞功的影响,并优化明胶微球载TGF-β1作用浓度。
1 材料和方法
1.1 载TGF-β1明胶微球涂层多孔钛的制备
1.1.1 多孔钛的制备
用粉末注射成形技术制备孔隙率为60%,孔径为50~300 μm,呈连通孔结构多孔钛[4]。用丙酮、无水乙醇、去离子水超声波清洗各10 min。于温度为60 ℃的烘干箱中干燥,高温高压消毒后备用。
1.1.2 载TGF-β1明胶微球的制备
用改良乳化冷凝聚合交联法制备粒径为10~40 μm的明胶缓释微球[1]。每1 mg干燥微球中分别加入0.5,5,50,500 mg/L的TGF-β1溶液各5 μL,在4 ℃,pH=7.4条件下,保持24 h,充分溶胀后离心(1 200~ 1 500 r/min)15 min, 双蒸水洗涤2次,冻干,钴-60照射灭菌封存。
1.1.3 载TGF-β1明胶微球涂层多孔钛的制备
用质量分数为5%的明胶溶液浸泡多孔钛,负压条件下处理10 min,50 ℃干燥6 h。用无水乙醇配制质量分数为20 mg/mL TGF-β1明胶微球悬液涂敷多孔钛表面,用质量分数为2.5%的戊二醛溶液浸泡试样30 min后,用无水乙醇清洗3次,每次10 min,冷冻干燥,钴-60照射灭菌封存。
1.2 细胞毒性实验(MTT法)
将试样按0.2 g/mL的比例浸泡于含10%小牛血清的RPMI 1640培养基中,在细胞培养箱中浸提72 h 后,收集浸提液于4 ℃保存。将L929细胞悬液按2.5 ×104个/mL接种于96孔细胞培养板(200 μL/孔),培养24 h。材料组取浓度分别为100%,50%和10%(体积分数,下同)的浸提液交换原培养液,每组设6个平行孔。阴性对照组为含10%小牛血清的新鲜RPMI1640培养基,阳性对照组加入10 μL浓度为8 mol/L的苯酚溶液,继续培养3 d。加入噻唑蓝(MTT)溶液,继续培养4 h,弃上清,加入二甲基亚砜,振荡,用酶联免疫仪于波长490 nm下测其吸光度。
1.3 体外释药实验
随机选用载TGF-β1浓度分别为0.025,0.25,2.5,25 mg/g明胶微球涂层多孔钛试样各3个,置于无菌24孔细胞培养板,加入2 mL的1640培基,置于培养箱中24 h后,取浸提液后4 ℃保存,即为释放24 h的待测浸提液。以同样方法留取2,4,6,8,10和12 d的浸提液于4 ℃保存。按TGF-β1 ELISA试剂盒的操作说明,用酶联免疫仪于450 nm波长下测定浸出液吸光度,与TGF-β1标准曲线对照,计算各时间点样本TGF-β1浓度,绘制TGF-β1释放曲线。
1.4 优化明胶微球载TGF-β1浓度
用载不同浓度TGF-β1明胶微球与MG63细胞复合培养,通过检测载TGF-β1明胶微球对MG63细胞的增殖和分化影响,优化其浓度。
1.4.1 细胞增殖检测
用0.25%胰酶消化MG63细胞, 用含12%胎牛血清的1640培养基配制细胞浓度为5×104个/mL的细胞悬液。接种于24孔板内,培养24 h待细胞贴壁,加配制的载TGF-β1浓度分别为0.025,0.250,2.500,25.000 mg/g明胶微球2 mg,对照组不加生长因子的微球2 mg,设3个复孔,分别培养3,7和14 d。按SunBioTMAm-Blue细胞增殖与活性检测试剂说明书操作,在波长490 nm下分光光度酶标仪测定各孔有吸光度并记录,参照标准曲线,计算细胞增殖数。
1.4.2 细胞分化检测
取置于离心管中第3,7,14 天的培养液, 按碱性磷酸酶(ALP)测定试剂盒说明书(南京建成生物工程工程所第一分所)进行操作,用酶联免疫仪测定各孔吸光度并记录,参照标准曲线,计算ALP的活性。
1.5 载TGF-β1明胶微球涂层的多孔钛试样对MG63细胞的影响
1.5.1 细胞增殖的评价
设置3组实验,实验组为载2.5 mg/g TGF-β1明胶微球涂层多孔钛,对照组为直接用100 μL 10 mg/L TGF-β1溶液滴至多孔钛表面,未处理组为不加TGF-β1多孔钛试样,设3个复孔,以0.25%胰酶消化MG63细胞,以10%小牛血清的1640培养基调整至浓度为4.0×104个/mL的悬液,取2 mL细胞悬液接种于放有3组试样的24孔培养板内培养,分别在第3,7和14天,按SunBioTMAm-Blue细胞增殖与活性检测试剂说明书操作,在波长490 nm下分光光度酶标仪测定各孔吸光度并记录,参照标准曲线,计算细胞增殖数。
1.5.2 黏附形貌检测
试样与MG63细胞复合培养,分别在第7和第14天吸去培养液,再加入4 ℃预冷的2.5%戊二醛固定,于4 ℃保存。用酒精梯度脱水,临界点干燥,喷金,扫描电镜检测MG63细胞在多孔钛表面的黏附形貌。
1.5.3 细胞分化评价
碱性磷酸酶(ALP):试样与MG63细胞复合培养3,7,14 d后,收集各孔上清液,按ALP测定试剂盒说明书(南京建成生物工程工程所第一分所)进行操作,用酶联免疫仪测定各孔吸光度并记录,参照标准曲线,计算ALP的活性。
骨钙素(BGP):试样与MG63细胞复合培养3,7和14 d后,收集各孔上清液,按碘[125I]骨钙素反射免疫分析药盒(北京普尔伟业生物科技有限公司)说明书进行操作,用放射性检测仪测定各孔放射性计数值并记录,参照标准曲线,计算BGP活性。
1.6 统计分析
选用SpSS13.0统计软件包,数据用平均值(![]() )±标准差(s)表示(
)±标准差(s)表示(![]() ±s),采用单因素方差分析,P<0.05时,差异有显著性。
±s),采用单因素方差分析,P<0.05时,差异有显著性。
2 结果
2.1 载TGF-β1明胶微球涂层多孔钛表面形态
载TGF-β1明胶微球及其涂层多孔钛SEM图如图1和2所示。可见:载TGF-β1明胶缓释微球呈圆球型, 粒径较均匀,表面光滑,未见微孔和裂纹。多孔钛的表面和孔隙壁上沉积了明胶微球涂层。
2.2 细胞毒性试验
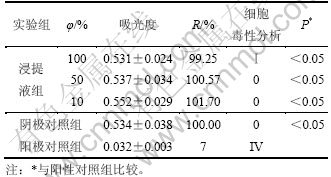
实验细胞为L929 细胞,3个实验组分别为浓度100%,50%,10%的浸提液、阴性对照组和阳性对照组。复合培养3 d 后,采用MTT 法检测试样细胞毒性,用490 nm 酶联免疫检测仪测定吸光度,用吸光度计算相对增殖率(R),R=De/Dn×100%。式中:De为试验组的吸光度;Dn为阴性对照组的吸光度。按R进行细胞毒性分级(CTS),见表1。由表1 看出,3 种浓度的浸提液的R 值与阳性对照组比较差异均较显著(p<0.05),CTS分级均为0~Ⅰ级,明胶缓释微球涂层多孔钛试样无细胞毒性,符合《医疗器械生物学评价国家标准GB/T 16886.1—2001》中对材料细胞毒性的要求。

图1 载TGF-β1明胶微球SEM图
Fig.1 SEM image of TGF-β1 loaded gelatin microspheres

图2 载TGF-β1明胶微球涂层多孔钛SEM图
Fig.2 SEM image of porous titanium coated with TGF-β1 loaded gelatin microspheres
表1 明胶微球涂层多孔钛对L929细胞毒性结果
Table 1 Results of cytotoxicity tests of porous titanium coated with TGF-β1 loaded gelatin microspheres with L929 cells
2.3 体外释放实验
生长因子的扩散速度和载体材料的降解速度,明胶微球在碱性条件下完全降解约需2月,体液pH=7.35~7.45,符合明胶微球降解的条件。用不加血清的细胞培养液为释放介质,按TGF-β1 ELISA试剂盒的操作说明。不同TGF-β1浓度的明胶缓释微球涂层多孔钛体外释放曲线如图3所示。从图3可看出:初期释放速度较快,24 h内达到20%~30%,其释放量与载TGF-β1的浓度相关,第3天时累计释放量达40%;随时间增加,释放速度减缓,第8天时,4种浓度试样释放速率接近一致,第12天时累计释放量为93%。
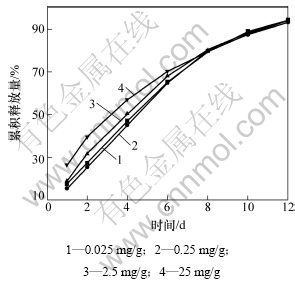
图3 不同TGF-β1含量的明胶缓释微球涂层多孔钛体外释放曲线
Fig.3 Release profile of porous titanium coated with different concentration TGF-β1 loaded gelatin microspheres
2.4 载TGF-β1明胶微球作用浓度的优化
2.4.1 TGF-β1浓度对细胞增殖影响
MG63细胞与载TGF-β1明胶微球复合培养3,7和14 d后,按SunBioTMAm-Blue细胞增殖与活性检测试剂说明书操作。MG63细胞在不同浓度TGF-β1下培养3,7和14 d时增殖的比较如图4所示。从图4可看出:同一时间点不同浓度TGF-β1明胶微球对MG63细胞的增殖影响不同,TGF-β1浓度在0.025~0.25 mg/g范围内,TGF-β1的浓度与MG63细胞增殖呈剂量正效应关系,当TGF-β1浓度为25 mg/g时,TGF-β1对MG63细胞增殖有抑制作用。
2.4.2 TGF-β1浓度对细胞分化影响
MG63细胞与载TGF-β1明胶微球复合培养3,7,14 d后,按ALP试剂盒操作。MG63细胞在不同浓度TGF-β1下培养3,7和14 d时ALP的活性如图5所示。从图5可看出:在0.025~2.5 mg/g范围内,TGF-β1浓度对MG63细胞分化呈剂量正效应关系,载TGF-β1浓度为2.5 mg/g时,明胶微球对MG63细胞分化促进作用优于其他4组。
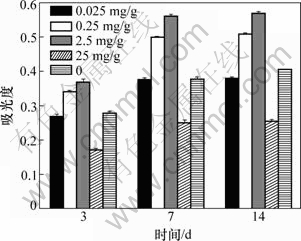
图4 MG63细胞在不同含量TGF-β1下培养3,7,14 d时增殖的比较
Fig.4 Comparison of cell proliferation of MG63 and different concentration of TGF-β1 after cultured 4, 7 and 14 d
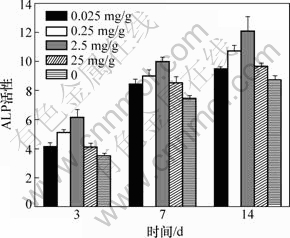
图5 MG63细胞在不同浓度TGF-β1下培养3,7和14 d时ALP的活性
Fig.5 ALP activity of MG63 cells and different concentration of TGF-β1 after cultured 3, 7 and 14 d
2.5 载TGF-β1明胶微球涂层对成骨细胞功能的影响
2.5.1 细胞增殖
3组试样与MG63细胞复合培养3,7和14 d,按SunBioTMAm-Blue试剂盒操作。3组多孔钛试样与MG63细胞培养复合3,7和14 d后细胞增殖的比较如图6所示。可见:在培养3和7 d时,实验组成骨细胞数量最多,对照组其次,未处理组最少,第14天时,实验组高于其他2组,而对照组与未处理组细胞增殖数量差别无显著性。
2.5.2 黏附形貌
3组试样与MG63细胞复合培养7和14 d后,扫描电镜检查MG63细胞试样表面黏附细胞数量与形貌。3组试样与MG63细胞复合培养7和14 d 的表面形貌如图7所示。可见:7 d时,实验组试样表面细胞数相对较多,细胞形态不规则,伪足多,细胞附着在孔隙边缘,有向孔隙内迁移趋势(图7(a));对照组试样表面黏附的MG63细胞数量比实验组少,细胞伸展良好,细胞跨过小孔隙形成细胞桥(图7(c));未处理组试样表面黏附细胞比实验组和对照组均少,细胞呈梭形,伪足少(图7(e))。14 d时,3组试样表面的细胞均生长良好,细胞多呈不规则多边形,实验组细胞伪足伸至微球表面,伸展良好,细胞紧贴孔隙侧壁和底壁生长,细胞跨越孔隙连接成片,呈叠瓦状结构(图7(b);对照组试样表面黏附细胞的形貌与实验组相似,细胞跨越孔隙连接成片生长(图7(d));未处理组细胞紧贴孔壁和孔底壁生长,但未形成叠瓦状结构(图7(f))。从上述结果可看出,试样与MG63细胞复合培养7 d时,实验组试样表面黏附细胞数量明显多于对照组和未处理组,细胞形态不规则,伪足多;14 d时,实验组和对照组试样表面黏附细胞数量均明显多于未处理组,细胞跨越孔隙生长连接成片,呈叠瓦状结构黏附在孔隙侧壁和底壁,未处理组试样表面黏附的细胞无此特点。
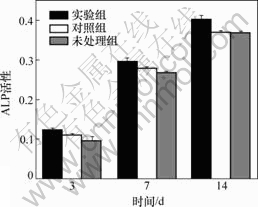
图6 3组多孔钛试样与MG63细胞培养复合3,7和14 d后细胞增殖的比较
Fig.6 Comparison of cell proliferation of MG63 and three groups porous titanium samples after cultured 3, 7 and 14 d

图7 3组试样与MG63细胞复合培养7和14 d 的表面形貌
Fig.7 Surface morphologies of MG63 cells cultured for 7 d and 14 d on three groups porous titanium samples
2.5.3 细胞分化
(1) ALP的检测。3组试样与MG63细胞复合培养3,7和14 d后,用ALP试剂盒检测培养液中ALP活性。3组试样与MG63细胞复合培养3,7和14 d后ALP的活性如图8所示。从图8可见:培养3和7 d时,实验组与对照组中ALP活性均高于未处理组的ALP活性,与未处理组比较差异有显著性(P<0.05),而实验组与对照组间比较差异无显著性(P>0.05);14 d时,实验组ALP活性高于对照组ALP活性,而对照组ALP活性高于未处理组ALP活性,组间比较差异有显著性(P<0.05)。
(2) 骨钙素检测。3组试样与MG63细胞复合培养3,7,14 d后,用骨钙素试剂盒检测培养液中骨钙素(BGP) 活性,结果如图9所示。从图9可见:培养3和7 d时,实验组和对照组的BGP活性均高于未处理组的BGP活性,与未处理组的BGP活性比较差异有显著性(P<0.05),而实验组与对照组间差异无显著性(P>0.05);14 d时,实验组的BGP活性高于对照组BGP活性,对照组BGP活性高于未处理组BGP活性,组间比较差异有显著性(P<0.05)。由上述ALP和BGP的检测结果可知,多孔钛试样用TGF-β1处理后有利于MG63细胞的分化,载TGF-β1明胶微球涂层对MG63细胞的作用优于直接用TGF-β1溶液组。
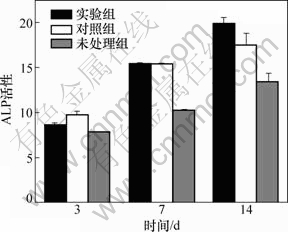
图8 3组试样与MG63细胞复合培养3,7和14 d后ALP的活性
Fig.8 ALP activity of MG63 cells and three groups porous titanium samples after cultured 3, 7 and 14 d
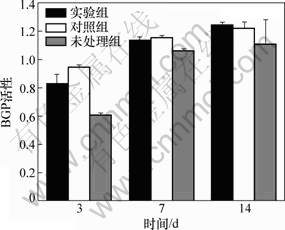
图9 3组试样与MG63细胞复合培养3,7和14 d后BGP活性
Fig.9 BGP activity of MG63 cells and three groups porous titanium samples after cultured 3, 7 and 14 d
3 讨论
钛和钛合金因具有良好力学性能和生物相容性,已被广泛应用于骨科的人工关节假体及牙种植体。钛生物活性差,钛植入体植入后形成骨整合时间一般需3~6 月。改善钛种植体表面的生物活性,加快骨整合形成是新型种植体的研究热点。局部应用促骨组织形成的生长因子是种植体表面改性的策略之一。已有研究证实在骨替代材料表面吸附多种生长因子可以促进成骨细胞的分化、基质分泌及钙化,包括促进有丝分裂因子(如IGF-1),增强骨细胞活性的因子(如TGF-β1)和诱导成骨的因子(如BMPS 等)[1]。TGF-β1有促成骨和成软骨作用,改变骨膜的细胞构成,诱导矿化的骨形成[5-6]。外源性生长因子存在稳定性低、生物膜透过性差、半衰期短、局部直接应用在体内很快被稀释和分解等不足。药物缓释系统具有缓释药物、靶向输送、在保证药物治疗作用的前提下减少给药剂量、降低药物毒性等优点[7]。局部采用缓释系统缓释生长因子能解决上述不足,但选用的载体材料和合适生长因子作用浓度目前尚存争议。适用于制备缓释系统的材料有聚乳酸、明胶、壳聚糖等,聚乳酸在体内降解产物为乳酸,可致局部发生炎症反应[8-9]。本研究选用明胶为缓释材料,明胶的组织相容性好,能自然降解,降解产物不引起组织炎症反应[10],是由氨基酸与肽类交联形成的直链聚合物,能进行多种表面修饰及反应,且含有精氨酸-甘氨酸-天冬氨酸(RGD)生物活性短肽,可与细胞表面受体结合,有利于细胞表面黏附分子识 别[11];生长因子为多肽结构,当溶胀于明胶微球中,明胶能与多肽形成氢键,能稳定多肽的天然构象,从而保持生长因子活性,明胶微球被包裹药物释放速度相对缓慢,能达到缓释的要求[12-13]。本课题组已采用改良乳化冷凝聚合交联法优化了明胶微球制备工 艺[14],本研究在此基础上优化明胶载TGF-β1浓度,研究载TGF-β1明胶微球涂层多孔钛试样对成骨细胞的影响。
种植体植入骨内10~12 d后,成骨细胞在种植体骨界面开始分化成骨,12~18 d成骨细胞活性增强,骨界面开始骨改建[15]。对种植体表面进行生物化改性,促进界面早期成骨细胞募集和分化,有利于骨整合形成。TGF-β1促进已被募集来的成骨细胞合成Ⅰ型胶原、纤维结合蛋白,具有抑制破骨细胞的活化,刺激成骨母细胞的增殖和活化等作用[10, 16],呈剂量依赖性促进骨源性间充质细胞向软骨分化,TGF-β1浓度对软骨细胞有促进或降低分化的双重调节作用[17]。在种植体表面用TGF-β1进行表面改性,将有利于促进早期启动骨愈合程序,有利于骨整合形成,但目前局部应用生长因子的最佳暴露时间和最佳浓度尚无定论。一般认为低浓度TGF-β1促进细胞增殖,而高浓度抑制细胞增殖[18]。有研究发现TGF-β1浓度在0.01~1.00 mg/L范围内,随剂量增加对成骨细胞的增殖作用也增强,质量浓度为1~10 mg/L时,促细胞增殖作用不明显,质量浓度大于10 mg/L时表现为对细胞增殖的抑制作用[19],而也有研究认为TGF-β1在低浓度(小于0.01 mg/L)时可促进成骨细胞的增殖,大于0.01 mg/L时随着浓度的增加,促增殖作用明显减弱[4]。本研究体外实验发现:载TGF-β1明胶微球与MG63细胞复合培养,TGF-β1浓度为0.025 mg/g的明胶微球对MG63细胞增殖无明显作用,25 mg/g时对MG63细胞增殖有抑制作用,浓度在0.25~2.5 mg/g范围时,对MG63细胞增殖和分化均有促进作用,对细胞增殖呈剂量正效应关系,TGF-β1浓度为2.5 mg/g的明胶微球对细胞增殖作用最优。
材料表面形貌和粗糙度、表面化学组成、亲水性、表面能和表面电荷影响细胞黏附。粗糙的表面结构、良好的表面化学组成与亲水性、高表面能和适合的表面电荷有利于成骨细胞的黏附[20-21]。本研究发现载TGF-β1明胶微球涂层和直接涂敷TGF-β1的多孔钛试样与MG63细胞复合培养7和14 d后,试样表面黏附的数量、细胞形态、伸展状况均优于未处理的多孔钛试样,培养7 d时,实验组试样表面黏附的细胞数量明显多于对照组。实验组对MG63细胞黏附和增殖作用优于B和未处理组,可能与以下因素有关:明胶是由氨基酸与肽类交联形成的直链聚合物,含有能与细胞表面整合素受体结合的生物活性短肽(RGD),有利于细胞表面黏附分子识别[11],对细胞黏附有利;表层孔隙内沉积载TGF-β1明胶微球,可持续释放TGF-β1,能维持TGF-β1浓度相对稳定,有利于细胞在试样表面募集,促进细胞合成分泌细胞外基质,为细胞黏附提供条件。在3和7 d时,对照组试样对MG63细胞的增殖和黏附作用优于未处理的未处理组试样,而14 d时,对照组试样表面黏附细胞的数量和形貌均优于未处理组,但对细胞的增殖作用两组间差异无显著性。可能是由于对照组试样的直接涂覆的TGF-β1短时间内大量稀释到培养基,而TGF-β1半衰期短,易水解,维持有效作用浓度时间不长;TGF-β1促进早期黏附的MG63合成分泌细胞外基质,为后期MG63细胞进一步黏附提供基础。
碱性磷酸酶(ALP)和骨钙素(BGP)是评价成骨细胞分化的指标,ALP是成骨细胞早期分化的指标,BGP是成骨细胞晚期分化指标,主要在矿化形成期分泌。本研究发现TGF-β1局部应用对MG63细胞的分化有利,在3和7 d时,涂覆载TGF-β1明胶微球涂层的实验组试样和直接添加TGF-β1液的对照组试样培养液中ALP和BGP的活性均高于未处理组的ALP和BGP活性,在14 d时,实验组培养液中ALP和BGP的活性高于对照组的ALP和BGP活性,对照组的ALP和BGP活性高于未处理组的ALP和BGP活性。可能原因是:多孔结构建立了细胞黏附的良好微环境,微球持续释放有效浓度生长因子,高密度的细胞黏附可诱导快速的聚集和分化;细胞形态的改变也可促进细胞分化[21]。从上述结果得知:载TGF-β1明胶微球涂层对MG63细胞分化作用优于直接涂覆TGF-β1的试样。
4 结论
(1) 多孔钛表层孔隙内载TGF-β1明胶微球涂层具有缓释作用,体外释放持续时间约12 d,涂层无细胞毒性。
(2) TGF-β1浓度影响MG63细胞的功能,TGF-β1浓度为0.25~2.5 mg/g范围的明胶微球有利于MG63细胞的增殖和分化,且呈剂量正效应关系, 浓度为2.5 mg/g的TGP-β1作用效果最佳,浓度低于0.25 mg/g的效果不明显,浓度高于2.5 mg/g时抑制增殖,但不影响分化。
(3) 载TGF-β1明胶微球涂层多孔钛试样对MG63细胞黏附、增殖和分化的作用优于直接应用TGF-β1和未处理的试样。载TGF-β1微球涂层试样在3,7和14 d 3个时间段均能有效促进MG63细胞的增殖和分化;直接涂覆TGF-β1溶液的试样在3和7 d时有促进细胞增殖作用,14 d时效果不明显。
参考文献:
[1] Bosetti M, Boccafoschi F, Leigheb M, et al. Effect of different growth factors on human osteoblasts activities: A possible application in bone regeneration for tissue engineering[J]. Biomolecular Engineering, 2007, 24(6): 613-618.
[2] Liua Y L, Enggista L, Kuffera A, et al. The influence of BMP-2 and its mode of delivery on the osteoconductivity of implant surfaces during the early phase of osseointegration[J]. Biomaterials, 2007, 28(16): 2677-2686.
[3] Clarke S A, Brooks R A, Lee P T, et al. The effect of osteogenic growth factors on bone growth into a ceramic-filled defect around an implant[J]. Bone Joint Surg Br, 2004, 22(5): 1016-1024.
[4] CHEN Liang-jian, LI Ting, LI Yi-min, et al. Porous titanium implants fabricated by metal injection molding[J]. Transactions of Nonferrous Metals Society of China, 2009, 19(5): 1174-1179.
[5] Liu Q, Rauth A M, Wu X Y, et al. Immobilization and bioactivity of glucose oxidase in hydrogel microspheres formulated by an emulsification-internal gelation-adsorption polyelectrolyte coating method[J]. International Journal of Pharmaceutics, 2007, 339(2): 148-156.
[6] GUO Chang-an, LIU Xue-guang. Novel gene-modified- tissueengineering of cartilage using stable transforming growth factor-β1-transfected mesenchymal stem cells grown on chitosan scaffolds[J]. Journal of Bioscience and Bioengineering, 2007, 103(6): 547-556.
[7] Kawai K, Suzuki S, Tabata Y, et al. Accelerated tissueregeneration through incorporation of basic fibroblast growth factor-impregnated gelatin microspheres into artificial dermis[J]. Biomaterials, 2000, 21(5): 489-499.
[8] Shim W S, Kim J H, Park H, et al. Biodegradability and biocompatibility of a pH and thermo-sensitive hydrogel formed from a sulfonamide-modified poly(ε-caprolactone-co-lactide)- poly(ethyleneglycol)-poly(ε-caprolactone-co-lactide) block co- polymer[J]. Biomaterials, 2006, 27(30): 5178-5185.
[9] Zhou Z H, Ruan J M, Zhou Z C, et al. Bioactivity of bioresorbable composite based on bioactive glass and poly-L-lactide[J]. Transactions of Nonferrous Metals Society of China, 2007, 17(2): 394-399.
[10] Yamamoto M, Ikada Y, Tabata Y. Controlled release of growth factors based on bio-degradation of gelatin hydrogel[J]. J Biomer Sci Polym Ed, 2001, 12: 77-88.
[11] Hersel U, Dahmen C, Kessler H. RGD modified polymers: biomaterials for stimulated cell adhesion and beyond[J]. Biomaterials, 2003, 24(10): 4385-4415.
[12] Cortesi R, Esposito E, Osti M, et al. Dextran cross-linked gelatin microspheres as a drug delivery system[J]. European Journal of Pharmaceutical Sciences, 1999, 47(12): 153-160.
[13] Chen F M, Zhao Y M, Wu H, et al. Enhancement of periodontal tissue regeneration by local decontrolled delivery of insulin-like growth factor-I from dextran-co-gelatin microspheres[J]. Journal of Controlled Release, 2006, 114: 209-222.
[14] 陈良建, 袁剑明, 李益民, 等. 多孔钛植入体表层孔隙内TGF-β1缓释明胶微球涂层的工艺优化[J]. 中南大学学报: 自然科学版, 2009, 40(5): 1228-1234.
CHEN Liang-jian, YUAN Jian-ming, LI Yi-min, et al. Optimization of porous titanium coated with TGF-β1 loaded gelatin microspheres process parameters[J]. Journal of Central South University: Science and Technology, 2009, 40(5): 1228-1234.
[15] Reddi A H, Wientroub S, Muthukumaran N. Biologic principles of bone induction[J]. Orthop Clin North Am, 1987, 18(2): 207-212.
[16] Janssens K, ten Diijke P, Jannssens S, et al. Transforming growth factor-β1 to the bone[J]. Endocr Rev, 2005, 26(6): 743-744.
[17] Worster A A, Nixon A J, Brower-Toland BD ,et al. Effect of transforming growth factor beta1 on chondrogenic differentiation of cultured equine mesenchymal stem cells[J]. Am J Vet Res, 2000, 61(9): 1003-1007.
[18] Lind M, Overgaard S, Nguyen T, et al.Transforming growth factor-beta stimulates bone on growth. Hydroxyapatite-coated implants studied in dogs[J]. Acta Orthop Scand, 1996, 67(6): 611-616.
[19] Shiels M J ,Mastro A M, Gay C V, et al. The effect of donor age on the sensitivity of osteoblasts to the proliferative effects of TGF-β1[J]. Life Sci, 2002, 170(25): 2967-2970.
[20] 陈良建, 张思慧, 李益民, 等. 改性后不同孔隙度多孔钛对成骨细胞功能影响的研究[J]. 中国有色金属学报, 2010, 20(4): 749-755.
CHEN Liang-jian, ZHANG Si-hui, LI Yi-min, et al. Effect of porosity of modified porous titanium on osteoblastic cells[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(4): 749-755.
[21] Zhu X L, Chen J, Scheideler L, et al. Cellular reactions of osteoblasts to micron and submicronscale porous structures of titanium surfaces[J]. Cells Tissues Organs, 2004, 178(1): 13-22.
(编辑 赵俊)
收稿日期:2011-02-20;修回日期:2011-05-16
基金项目:国家自然科学基金资助项目(357705760);国家“863”计划新材料领域专项(2007AA03Z114);中南大学粉末冶金国家重点实验创新基金资助项目(2010)
通信作者:陈良建(1967-),男,湖南攸县人,博士,副教授,从事牙种植体修复、颌骨缺损的赝复体修复及新型钛种植体的研究;电话:0731-88618554;E-mail:chen0313@xy3yy.com


