嗜酸氧化亚铁硫杆菌的耐砷驯化与浸矿能力
方芳1, 2, 3,钟宏1, 3,江放明1, 3,罗忠银2,孙晓伟2,许凯扬2
(1. 中南大学 化学化工学院,湖南 长沙,410083;
2. 长沙理工大学 化学与生物工程学院,湖南 长沙,410114;
3. 中南大学 有色金属资源化学教育部重点实验室,湖南 长沙,410083)
摘 要:
亚铁硫杆菌(Acidithiobacillus ferrooxidans, A.f)浸出砷金精矿过程中的氧化活性和耐砷能力,采用连续转接驯化法对分离纯化得到的A.f 菌株NSJ209进行耐砷驯化,并考察原始菌和驯化菌对As(Ⅲ)和As(Ⅴ)的耐受能力。研究结果表明:连续转接驯化可以提高NSJ209的氧化活性和对砷的耐受性,驯化菌在含3 g/L As(Ⅲ)的9K培养基中,84 h内Fe2+的平均氧化速率比驯化前提高了3.53倍,对As(Ⅲ)的耐受性从驯化前的4 g/L提高到6 g/L,对As(Ⅴ)的耐受性从驯化前的8 g/L提高到12 g/L。在温度30 ℃、pH 2.0、矿浆质量分数6%的条件下对砷金精矿进行浸出试验,浸出10 d,驯化菌对砷的浸出率达到91.6%,比原始菌提高了38.01%。
关键词:
中图分类号:TD925.5 文献标志码:A 文章编号:1672-7207(2013)10-3977-07
Domestication for arsenic-tolerant ability and bioleaching of Acidithiobacillus ferrooxidans
FANG Fang1, 2, 3, ZHONG Hong1, 3, JIANG Fangming1, 3, LUO Zhongyin2, SUN Xiaowei2, XU Kaiyang2
(1. School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China;
2. College of Chemistry and Biological Engineering,Changsha University of Science and Technology, Changsha 410114, China;
3. Key Laboratory of Resources Chemical of Nonferrous Metals, Ministry of Education,Central South University, Changsha 410083, China)
Abstract: To raise the oxidative activity and arsenic-tolerant ability of Acidithiobacillus ferrooxidans in the leaching of arsenic-containing gold concentrate, continuous transfer domestication was put forward to obtain strains of Acidithiobacillus ferroxidans which can tolerante high concentrations Arsenic, and the tolerant ability to As(Ⅲ) and As(Ⅴ) of the adapted bacteria and unadapted bacteria were studied. The results show that the continuous transfer domestication can raise the oxidation activity and arsenic-tolerant ability of NSJ209 strains. And in 84 h, the oxidation of Fe2+ is improved by nearly 3.53 times than unadapted bacteria in 9K culture medium containing 3 g/L As(Ⅲ). Compared with the unadapted bacteria, the tolerant ability to As(Ⅲ) is increased from 4 g/L to 6 g/L, and the tolerant ability to As(Ⅴ)) is increased from 8 g/L to 12 g/L. Under the conditions of 30 ℃, pH 2.0, pulp density 6%, after 10 d leaching, the arsenic leaching rate of the adapted bacteria is 91.6%, which is 38. 01% higher than that of unadapted bacteria.
Key words: Acidithiobacillus ferrooxidans; domestication; As(Ⅲ); As(Ⅴ); arsenic-containing gold concentrate
嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans, A.f)是一种能够分别以亚铁、单质硫以及硫化物作为能量来源的化能自养菌[1-4],现已被广泛应用于微生物冶金、煤炭脱硫、含硫废水的处理以及有用金属的回收[5-13]。其中,在低品位铜矿、金矿和铀矿的浸出已获得了一定规模的工业应用[9-14]。但是在含砷难处理金矿的浸出过程中,由于硫化物的分解,砷离子会不断地溶解,并以As(Ⅲ)和As(Ⅴ)或以两者氧化物的混合形态存在于浸出液中[10-13]。砷,尤其是As(Ⅲ),对微生物有很大的毒害作用,如果浸矿菌种对砷的耐受性不强,在浸矿过程中,为了保证细菌的活性,只能采用比较低的固液比,这样导致反应器体积庞大,单位体积的处理量小、浸出液多、浸出液浓度低,后续处理成本高。如果能选育出在较高砷浓度环境中能正常生长的浸矿菌种,则可以解决这些问题。但从自然界中分离、纯化得到的A.f 菌株普遍存在环境适应能力差的问题,尤其是As(Ⅲ)对其生长有明显的抑制作用[1]。因此,细菌如不进行耐高砷特性的定向选育,对高砷难处理金精矿将难以取得较好的生物浸出效果。提高菌种耐受性和活性常采用驯化育种和诱变育种等方法[14-16],随着现代生物技术的发展, 出现了转化、转导、接合、原生质体融合、代谢调控和基因工程等较为定向的育种方法[2, 17],但这些方法成功用在生产上的例子目前还不是很多,在微生物冶金领域驯化育种仍是当前用得最为普遍也是最经济实用的育种手段[2, 14-15]。驯化育种是利用微生物在逐渐适应环境的变化过程中基因会发生突变,在适合生长发育的新环境下成为优势菌种。浸矿细菌的驯化方法主要有矿浆驯化法和纯化学试剂驯化法,目前耐砷菌种的选育大多是采用从高砷金矿酸性矿坑水分离菌种然后再采用高砷金精矿矿浆进行驯化,矿浆驯化法[12-13]能综合提高菌株的适应性,但缺点是驯化环境中成分复杂,造成驯化目的不明确、驯化周期较长,细菌耐砷能力的提高非常有限。纯化学试剂驯化法[14]是在培养基中加入纯化学试剂,这种方法目的性较好,但当毒性因子浓度较高时,需较长时间才能适应,且需转接数次才能达到较好的驯化效果,以致驯化所需时间较长。针对这个问题,王永东等[14]采用连续转接驯化方法96 h 获得了氧化速率提高7.5 倍、能耐受1.0 g/L U6+的菌株,且获得了用传统驯化方法不能得到的耐受1.5 g/L U6+的菌株及能耐受120 mg/L F-的菌株。连续转接驯化法是用上一轮驯化的菌液为母液,接种到含更高浓度毒性因子的培养基中进行驯化,该方法可以加快驯化速度,提高驯化效果,在抗性浸矿细菌的选育有着其他方法不可比拟的优势,但在耐砷浸矿细菌的选育方面暂时还没有相关报道。为此,本文作者从国内某高砷金矿酸性矿坑水分离纯化得到的A.f 菌株NSJ209为原始菌,采用连续转接驯化法对NSJ209菌株进行耐砷驯化,考察原始菌和驯化菌对As(Ⅲ)和As(Ⅴ)的耐受能力并进行实际高砷金精矿的浸出试验,以期为生物冶金优势抗性菌种的选育提供简便、有效的育种手段,为微生物冶金方法在高砷难处理金矿的工业化应用做一些基础研究工作。
1 实验
1.1 菌种
使用的嗜酸氧化亚铁硫杆菌由本实验室从国内某高砷金矿酸性矿坑水分离纯化得到,命名为NSJ209,其最佳培养条件为:pH 2.0,温度30 ℃,转速180 r/min,采用9K培养基,配方如下(g/L):FeSO4·7H2O (44.7),(NH4)2SO4 (3.0),KCl (0.1),K2HPO4(0.50),MgSO4·7H2O (0.50),Ca(NO3)2 (0.01),用1:1 H2SO4调节pH为2.0。
1.2 实验仪器与设备
ZQ2Y-HC 高精度振荡培养箱(上海知楚仪器有限公司),AL104 分析天平(瑞士梅特勒-托利多集团),PHSJ-4A pH 计(上海雷磁仪器厂),CX31 生物显微镜(奥林巴斯集团),BPC-150F 型生化培养箱(上海一恒科学仪器有限公司),SW-CJ-10超净工作台(苏州净化),YXQ-LS-30S1立式压力蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂),SQJ1-XB-K-25血细胞计数板(Midwest-G),U-2910型紫外可见分光光度计(Hitachi)。
1.3 NSJ209的耐砷驯化
NSJ209 的耐受性实验和驯化实验都是在细菌的最佳培养条件下进行:培养温度30 ℃,pH 2.0,摇床转速180 r/min。As(Ⅲ)溶液用亚砷酸钠配制,As(Ⅴ)溶液用砷酸钠配制,按所需浓度加入到培养基中。
1.3.1 NSJ209 对As(Ⅲ)和As(Ⅴ)的耐受性实验
将NSJ209 按体积分数为10%的接种量接种到含不同As(Ⅲ)质量浓度(0~7 g/L,变化梯度为1 g/L)和不同As(Ⅴ)质量浓度(0~14 g/L,变化梯度为2 g/L)的9K培养基中,定期检测细菌密度和Fe2+浓度,确定其能耐受的最高离子浓度。
1.3.2 NSJ209 的耐As(Ⅲ)驯化
将NSJ209 按体积分数为10%的接种量接种到含As(Ⅲ)的9K培养基中进行驯化,当细菌生长繁殖至稳定期时,按1 g/L 梯度递增培养基中As(Ⅲ)质量浓度进行下一轮驯化。
1.4 砷金精矿的浸出实验
1.4.1 实验矿样
砷金精矿矿粉购自湖南省黄金洞金矿,粒度小于38 μm的占90% 以上,矿物中的主要组分为黄铁矿、砷黄铁矿、石英,矿样中的砷以毒砂形式存在,砷的质量分数为22.3%。
1.4.2 实验方法
准确称取金精矿矿粉6 g 置于容量为250 mL的摇瓶,加入50 mL pH 2.0 的9K无铁培养基预浸24 h,然后接种10 mL对数生长期的原始菌或驯化菌并补加培养基定容至100 mL,用1:1的硫酸调节pH后放入摇床,在温度30 ℃,转速180 r/min的空气浴恒温摇床内振荡浸出,浸出过程蒸发掉的水分用蒸馏水补充,取样消耗的液体用9K无铁培养基补充,浸出过程滴加1:1的硫酸或20%的NaOH溶液调节矿浆pH,每隔24 h检测细菌的密度和浸渣总砷(为As(Ⅲ)和As(Ⅴ)之和)的含量并计算砷的浸出率。
1.5 分析方法
Fe2+浓度采用重铬酸钾滴定法(参见GB/T 6730.8) 进行测定;细菌计数采用血球计数板在显微镜下直接计数;总砷含量采用新银盐法测定。
2 结果与讨论
2.1 初始As(Ⅲ)浓度对NSJ209亚铁氧化活性的影响
As(Ⅲ)对细菌NSJ209的生长有很大的抑制作用。图1所示为As(Ⅲ)对NSJ209氧化亚铁的影响。从图1可以看出:在反应前期Fe2+的氧化速率比较缓慢,这是由于细菌接种到新鲜的培养基后,为适应新环境需要一定的时间(停滞期)来调节代谢,重新合成必须的酶、辅酶或一些中间产物[2]。在无砷9K培养基中,细菌的停滞期是24 h,通过60 h可以氧化98 .5%的Fe2+。当As(Ⅲ)的质量浓度为1 g/L时,Fe2+则要84 h才能达到相同的氧化率;当As(Ⅲ)的质量浓度增加到3 g/L时,细菌的停滞期延长到48 h,培养120 h,Fe2+的氧化率才达到68.53%;当As(Ⅲ)的质量浓度为4 g/L时,细菌的生长则完全受到抑制,此时培养液澄清,经镜检发现活菌不多且运动缓慢,细菌几乎不能生长,这说明As(Ⅲ)达到质量浓度为4 g/L时,细菌的生长和氧化Fe2+的能力受到了强烈的抑制。因此,可以确定细菌NSJ209最大耐受As(Ⅲ)的质量浓度为4 g/L,细菌对砷的耐受性还不高,若用这样的菌种直接去浸出高砷金矿,必然使矿浆的固液比受到限制,故进行耐砷驯化是很必要的。
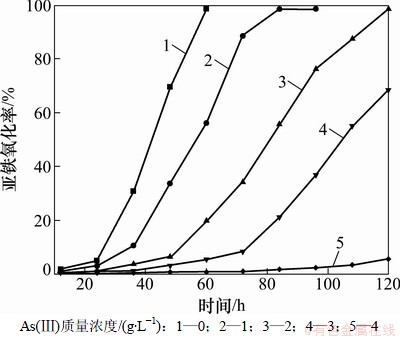
图1 As(Ⅲ)对NSJ209氧化Fe2+的影响
Fig. 1 Effect of As(Ⅲ) on biooxidation of ferrous iron by NSJ209
2.2 初始As(Ⅴ)浓度对NSJ209亚铁氧化活性的影响
As(Ⅴ)的毒性虽然比As(Ⅲ)要小,但对细菌NSJ209的生长也有较大的影响。图2所示为As(Ⅴ)对NSJ209氧化亚铁的影响。从图2可以看出:随着As(Ⅴ)质量浓度的增加,细菌的停滞期延长,细菌生长速率减慢,对Fe2+的氧化活性减弱。当初始As(Ⅴ)质量浓度达到8 g/L时,Fe2+的氧化速率非常缓慢,此时细菌生长受到严重抑制。据此可知,原始菌NSJ209耐受As(Ⅴ)最大的质量浓度是8 g/L。
2.3 NSJ209耐砷驯化
采用连续转接驯化对细菌NSJ209进行耐砷驯比,细菌驯化的起始As(Ⅲ)质量浓度采用2 g/L。图3所示为NSJ209驯化前后对Fe2+氧化率的比较。由图3可见:将在含2 g/L As(Ⅲ)的9K培养基中培养的NSJ209转接到含3 g/L As(Ⅲ)的9K培养基中培养84 h后,Fe2+的氧化率从21.12%提高到38.62%,Fe2+平均氧化率比原始菌提高了1.83倍,将在含As(Ⅲ) 3 g/L的9 K培养基中培养的细菌转接到含As(Ⅲ) 4 g/L的9 K培养基中进行培养,Fe2+平均氧化率则提高了8.8倍,此后都按1 g/L的梯度逐步提高As(Ⅲ)的浓度进行转接,当三价砷浓度提高到7 g/L后,发现细菌的生长完全受到抑制,此时培养液澄清,经镜检发现活菌不多且运动缓慢,细菌几乎不能生长,即使在此浓度下反复多次转接,细菌的耐受性也没有提高,因此,转接到含6 g/L As(Ⅲ)的9K培养基中培养的细菌是经驯化得到的耐砷能力最强的菌株,命名为NSJ209驯化菌。
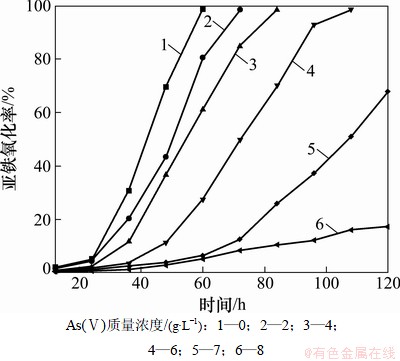
图2 As(Ⅴ)对NSJ209氧化Fe2+的影响
Fig. 2 Effect of As(Ⅴ) on biooxidation of ferrous iron by NSJ209
从图3还可以看出:在进行NSJ209的耐砷驯化时,将在相对较低的As(Ⅲ)浓度下驯化得到的菌株转接到较高As(Ⅲ)浓度的培养基中进行驯化,可较快获得氧化活性较高的菌株,且不需要在同一浓度下进行反复多次转接。由此可见,连续转接驯化方法在进行耐砷驯化时有明显的优势。但是,值得注意的是,经过驯化使细菌的耐砷能力得到提高,这一变化仅仅是由于环境因素的改变引起的,而由环境因素引起的细菌的变异性往往只是暂时性的,因此,细菌对高砷环境的适应性也往往只是暂时性的,这种适应具有反复性,如果让菌种继续生长在高砷环境中,其耐砷能力还会增强,相反,如果让其在低砷或无砷环境中生长时间过长,它的耐砷能力就会慢慢地减弱,因此,在以后的实验中,还需要设法保持并不断地提高其耐砷能力。
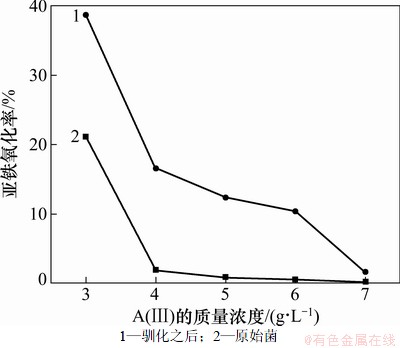
图3 NSJ209驯化前后对Fe2+氧化率的比较(培养84 h)
Fig. 3 Fe2+ oxidation rates of NSJ209 before and after arsenic-tolerant domestication(84 h)
2.4 初始As(Ⅲ)浓度对NSJ209驯化菌亚铁氧化活性的影响
图4所示为As(Ⅲ)对NSJ209驯化菌氧化亚铁的影响。从图4可以看出:NSJ209经过4次连续转接驯化以后,与驯化前相比,细菌耐As(Ⅲ)的能力有了明显的提高,一个明显的变化是细菌的停滞期缩短了,因此,在含砷环境中,细菌能够较快地进入对数生长期。从图4还可以看出:As(Ⅲ)质量浓度为1 g/L时,培养72 h,Fe2+的氧化率能够达到98.5%,而驯化前相同的培养时间只能达到88.4%的氧化率。与驯化前相比,在As(Ⅲ)质量浓度为2 g/L时培养72 h,Fe2+的氧化率从34.24%提高到93.71%,在As(Ⅲ)质量浓度为3 g/L时,生长停滞期从60 h降到了24 h ,84 h内Fe2+的平均氧化速率比驯化前提高了3.53倍,即使在As(Ⅲ)质量浓度为4 g/L(驯化前耐As(Ⅲ)的极限值)时,72 h内Fe2+的氧化率也有29.62%,另外驯化菌对As(Ⅲ)的耐受性从驯化前的4 g/L提高到6 g/L。因此,驯化后,细菌的耐砷能力和对Fe2+的氧化活性大大提高了。
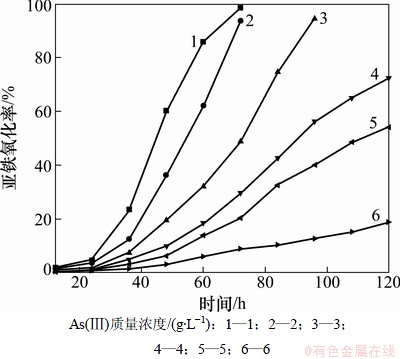
图4 As(Ⅲ)对NSJ209驯化菌氧化Fe2+的影响
Fig. 4 Effect of As(Ⅲ) on biooxidation of ferrous iron by adapted NSJ209 strain
2.5 初始As(Ⅴ)浓度对NSJ209驯化菌亚铁氧化活性的影响
图5所示为As(Ⅴ)对NSJ209驯化菌氧化亚铁的影响。由图5可以看出:通过对NSJ209的耐As(Ⅲ)连续转接驯化,细菌对As(Ⅴ)的耐受性也大大提高了,因此不需要另外对细菌进行耐As(Ⅴ)的驯化。比较图2和图5可以得出:驯化菌对Fe2+的氧化活性大大提高,耐砷能力也有了很大的提高。原始菌在As(Ⅴ)质量浓度为8 g/L时几乎不能生存,但驯化菌在含10 g/L As(Ⅴ)的9K培养基中培养120 h,Fe2+的氧化能达到60.57%。另外,驯化菌生长停滞期明显变短,在As(Ⅴ)质量浓度小于10 g/L时,细菌生长的停滞期为24 h,基本与在无砷9K培养基中相当,但原始菌在含6 g/L的As(Ⅴ)9K培养基中,停滞期要48 h。从图5还可以看出:驯化后,NSJ209对As(Ⅴ)的最大耐受浓度是12 g/L,比驯化前提高了4 g/L。因此,驯化菌是一株优良的耐砷菌种,有较大的使用价值和应用前景。
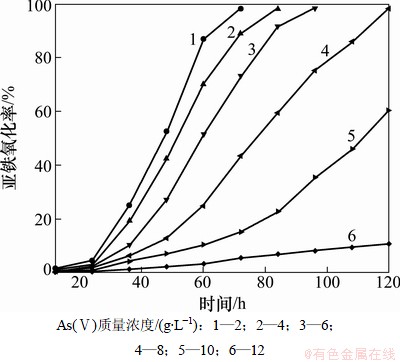
图5 As(Ⅴ)对NSJ209驯化菌氧化Fe2+的影响
Fig. 5 Effect of As(Ⅴ) on biooxidation of ferrous iron by adapted NSJ209 strain
2.6 驯化菌与原始菌对砷金精矿浸出效果比较
以原始菌作为对照,在温度30 ℃、pH 2.0、矿浆质量分数为6%的条件下,采用驯化菌进行砷金精矿的浸出实验,并与酸浸(pH 2.0的无菌无铁9K培养基)的浸矿效果进行对比。
原始菌、驯化菌在浸出过程中细菌的生长情况如图6所示(其中,N为细菌密度),驯化菌、原始菌和酸浸的浸出效果见图7。
从图7可以看出:在浸出的前3 d,驯化菌、原始菌和酸浸中砷的浸出速度都非常缓慢,浸出效果也几乎相当,有菌浸出的效果略高于无菌浸出,这是因为浸出初期,由于接种的细菌量较少,矿浆中细菌的初始浓度比较低,另外细菌刚接种,为适应矿浆新环境需要一定的时间(停滞期)来调节代谢,重新合成必须的酶、辅酶或一些中间产物,因此这段时间细菌繁殖速度慢,氧化活性低,对砷的浸出率低,这时酸浸起到了主导作用,菌种起辅助作用。从图6和图7可以看出:3 d之后,随着细菌的迅速繁殖,矿浆中细菌的密度增加,这时有菌浸出的效果明显高于无菌浸出,细菌浸出起到了主导作用,砷的浸出率也随之提高。同时还可以看出:驯化菌和原始菌细菌密度相当,但驯化菌的浸出效果要好于原始菌的浸出效果,说明驯化菌的活性要高于原始菌的活性。但随着矿浆中砷离子含量的增加,原始菌浸出中的细菌浓度慢慢下降,当到第7天,经镜检发现活菌不多且运动缓慢,细菌几乎不能生长,但驯化菌浸出液的细菌密度基本稳定,这时驯化菌对砷的浸出速度大大高于原始菌,这是因为原始菌经过耐砷驯化以后,细菌的耐砷能力和氧化活性大大提高了。浸出10 d,驯化菌对砷的浸出率达到91.6%,比原始菌提高了38.01%,这时矿浆中的总砷理论量达到12.26 g/L,不但远远高于NSJ209驯化菌耐受As(Ⅲ) 6 g/L的水平,还高于驯化菌耐受As(Ⅴ)12 g/L的水平,其原因可能是该菌株在实际矿石浸出过程中有一个驯化适应调整过程,使其耐砷能力有所提高。另外因为浸出过程中,随着砷和铁离子浓度的增加,有部分砷会生成砷酸铁沉淀,使得矿浆中实际砷含量比理论要低,同时也说明了浸出结束时,矿浆中的砷离子应该是以毒性较小的As(Ⅴ)为主。
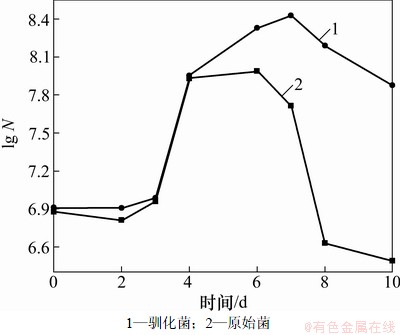
图6 驯化菌和原始菌在浸矿体系中的生长曲线
Fig. 6 Growth curves of adapted strain and unadapted strain in leaching system
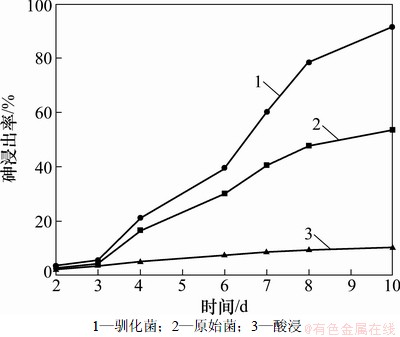
图7 驯化菌、原始菌和酸浸对砷浸出率的影响
Fig. 7 Effect of adapted strain, unadapted strain and acid leaching on arsenic leaching rate
3 结论
(1) As(Ⅲ)和As(Ⅴ)对试验用A.f 菌NSJ209的生长活性有很大的影响,主要表现是停滞期延长,对Fe2+的氧化活性降低,原始菌对As(Ⅲ)和As(Ⅴ)的耐受极限质量浓度分别为4 g/L和8 g/L。
(2) 连续转接驯化能大大提高NSJ209菌株对砷的耐受性,驯化菌对As(Ⅲ)的耐受性从驯化前的4 g/L提高到6 g/L,对As(Ⅴ)的耐受性从驯化前的8 g/L提高到12 g/L,驯化菌是一株优良的耐砷菌种,有较大的使用价值和应用前景。
(3) 驯化菌生长停滞期明显变短,氧化活性显著提高,在含3 g/L As(Ⅲ)的9 K培养基中,生长停滞期从60 h降到了24 h,84 h内Fe2+的平均氧化速度比驯化前提高了3.53倍。
(4) 在温度30 ℃、pH 2.0、矿浆质量分数为6%的条件下对砷金精矿进行浸出试验,浸出10 d,驯化菌对砷的浸出率达到91.6%,比原始菌提高了38.01%,说明该驯化菌能很好地用于高砷金精矿的生物浸出。
参考文献:
[1] Merwea J A, Deanea S M, Rawlings D E. The chromosomal arsenic resistance genes of Sulfobacillus thermosulfidooxidans[J]. Hydrometallurgy, 2010, 104(3/4): 477-482.
[2] 沈壁蓉, 吴学玲, 杜修桥, 等. 抗Cu2+嗜酸氧化亚铁硫杆菌的驯化及诱变育种[J]. 现代生物医学进, 2007, 7(4): 507-510.
SHEN Birong, WU Xueling, DU Xiuqiao, et al. Adaptation and mutagenie breeding of copper-resistant Acidthiobacillus ferrooxidans[J]. Progress in Modern Biomedicine, 2007, 7(4): 507-510.
[3] 覃文庆, 王军, 蓝卓越, 等. 浮选药剂对浸矿细菌活性的影响[J]. 中南大学学报: 自然科学版, 2004, 35(5): 759-762.
QIN Wenjun, WANG Jun, LAN Zhuoyue, et al. Effect of flotation reagent s on activity of bacteria in bioleaching[J]. Journal of Central South University: Science and Technology, 2004, 35(5): 759-762.
[4] ZHANG Chenggui, XIA Jinlan, ZHANG Ruiyong, et al. Comparative study on effects of Tween-80 and sodium isobutyl-xanthate on growth andsulfur-oxidizing activities of Acidithiobacillus albertensis BY-05[J]. Transaction of Nonferrous Metals Society of China, 2008, 18(4): 1003-1007.
[5] Matlakowska R, Sklodowska A. Adaptive responses of chemolithoautotrophic acidophilic Acidithiobacillus ferrooxidans to sewage sludge[J]. J Appl Microbiol, 2007, 102(6): 1485-1498.
[6] Novo M T M, Silva A C D, Moreto R, et al. Thiobacillusferrooxidans response to copper and other heavy metals: Growth, protein synthesis and protein phosphorylation[J]. Antonie Van Leeuwenhoek, 2000, 77(2): 187-195.
[7] Shi S Y, Fang Z H. Bioleaching of marmatite flotation concentrate with a moderately hermoacidophilic iron-oxidizing bacterial strain[J]. Minerals Engineering, 2005, 18(11): 1127-1129.
[8] XIA Jinlan, PENG Anan, HE Huan, et al. A new strain Acidithiobacillus albertensis BY-05 for bioleaching of metal sulfides ores[J]. Trans Nonferrous Met Soc China, 2007, 17(1): 168-175.
[9] 董颖博, 林海, 莫晓兰, 等. 不同能源物质对At.f 菌浸出低品位铜尾矿的影响[J]. 中南大学学报: 自然科学版, 2011, 42(5): 1181-1187.
DONG Yingbo, LIN Hai, MO Xiaolan, et al. Effect of different energy sources on At.f bacterial leaching of low-grade copper tailings[J]. Journal of Central South University: Science and Technology, 2011, 42(5): 1181-1187.
[10] Marquez M, Gaspar J, Bessler K E, et al.Process mineralogy of bacterial oxidized gold ore in Sao Bento Mine(Brasil)[J]. Hydrometallurgy, 2006, 83(1/2/3/4): 114-123.
[11] Arrascue M L, Niekerk J V. Biooxidation of arsenopyrite concentrate using BIOX process: Industrial experience in Tamboraque, Peru[J]. Hydrometallurgy, 2006, 83(1/2/3/4): 90-96.
[12] 罗志雄, 张广积, 方兆珩. 采用中温菌和常温菌浸出含砷金精矿[J]. 中国有色金属学报, 2007, 17(8): 1342-1347.
LUO Zhixiong, ZHANG Guangji, FANG Zhaoheng. Bioleaching arsenic-containing gold concentrates with MLY and At.f[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(8): 1342-1347.
[13] Wiertz J V, Mateo M, Escobar B. Mechanism of pyritecatalysis of As(III) oxidation in bioleaching solutions at 30 ℃ and 70 ℃[J]. Hydrometallurgy, 2006, 83(1/2/3/4): 35-39.
[14] 王永东, 丁德馨, 李广悦, 等. 氧化亚铁硫杆菌耐铀氟离子的连续转接驯化和联合驯化[J]. 过程工程学报, 2011, 11(5): 834-839.
WANG Yongdong, DING Dexin, LI Guangyue, et al. Continuous transfer domestication and associated domestication of Acidithiobacillus ferrooxidans for resistance of uranium and fluride ions[J].The Chinese Journal of Process Engineering, 2011, 11(5): 834-839.
[15] 熊英, 胡建平, 林滨兰, 等. 氧化亚铁硫杆菌的驯化与诱变选育[J]. 矿产综合利用, 2001, 6(6): 27-31.
XIONG Ying, HU Jianping, LIN Binlan, et al. Study on the domestication and mutagenic selection of Thiobacillus Ferrooxidans[J]. Multipurpose Utilization of Mineral Resources, 2001, 6(6): 27-31.
[16] 郭爱莲, 孙先锋, 朱宏莉, 等. He-Ne激光、紫外线诱变氧化亚铁硫杆菌及耐砷菌株的选育[J]. 光子学报, 1999, 28(8): 718-721.
GUO Ailian, SUN Xianfeng, ZHU Hongli, et al. The mutagenesis of Thiobacillus Ferrooxidans by He-Ne laser, ultra violet and the breeding of arsenate tolerant mutant[J]. Acta Photonica Sinica, 1999, 28(8): 718-721.
[17] 赵清, 刘相梅, 詹杨, 等. 一株高效抗砷喜温硫杆菌工程菌的构建[J]. 微生物学报, 2005, 45(5): 675-679.
ZHAO Qing, LIU Xiangmei, ZHAN Yang, et al. Construction of an engineered Acidithiobacillus caldus with high-efficiency arsenic resistance[J]. Acta Microbiologica Sinica, 2005, 45(5): 675-679.
(编辑 杨幼平)
收稿日期:2012-12-28;修回日期:2013-03-30
基金项目:国家自然科学基金资助项目(51104024);湖南省自然科学基金资助项目(10JJ6019);湖南省教育厅项目(10C0399);湖南省科技厅项目(2013SK3141)
通信作者:钟宏(1961-),男,浙江龙泉人,教授,从事化工冶金和浮选药剂绿色合成等研究;电话:0731-88830654;E-mail:zhongh@csu.edu.cn
摘要:为提高嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans, A.f)浸出砷金精矿过程中的氧化活性和耐砷能力,采用连续转接驯化法对分离纯化得到的A.f 菌株NSJ209进行耐砷驯化,并考察原始菌和驯化菌对As(Ⅲ)和As(Ⅴ)的耐受能力。研究结果表明:连续转接驯化可以提高NSJ209的氧化活性和对砷的耐受性,驯化菌在含3 g/L As(Ⅲ)的9K培养基中,84 h内Fe2+的平均氧化速率比驯化前提高了3.53倍,对As(Ⅲ)的耐受性从驯化前的4 g/L提高到6 g/L,对As(Ⅴ)的耐受性从驯化前的8 g/L提高到12 g/L。在温度30 ℃、pH 2.0、矿浆质量分数6%的条件下对砷金精矿进行浸出试验,浸出10 d,驯化菌对砷的浸出率达到91.6%,比原始菌提高了38.01%。
[2] 沈壁蓉, 吴学玲, 杜修桥, 等. 抗Cu2+嗜酸氧化亚铁硫杆菌的驯化及诱变育种[J]. 现代生物医学进, 2007, 7(4): 507-510.
[3] 覃文庆, 王军, 蓝卓越, 等. 浮选药剂对浸矿细菌活性的影响[J]. 中南大学学报: 自然科学版, 2004, 35(5): 759-762.
[9] 董颖博, 林海, 莫晓兰, 等. 不同能源物质对At.f 菌浸出低品位铜尾矿的影响[J]. 中南大学学报: 自然科学版, 2011, 42(5): 1181-1187.
[12] 罗志雄, 张广积, 方兆珩. 采用中温菌和常温菌浸出含砷金精矿[J]. 中国有色金属学报, 2007, 17(8): 1342-1347.
[14] 王永东, 丁德馨, 李广悦, 等. 氧化亚铁硫杆菌耐铀氟离子的连续转接驯化和联合驯化[J]. 过程工程学报, 2011, 11(5): 834-839.
[15] 熊英, 胡建平, 林滨兰, 等. 氧化亚铁硫杆菌的驯化与诱变选育[J]. 矿产综合利用, 2001, 6(6): 27-31.
[16] 郭爱莲, 孙先锋, 朱宏莉, 等. He-Ne激光、紫外线诱变氧化亚铁硫杆菌及耐砷菌株的选育[J]. 光子学报, 1999, 28(8): 718-721.
[17] 赵清, 刘相梅, 詹杨, 等. 一株高效抗砷喜温硫杆菌工程菌的构建[J]. 微生物学报, 2005, 45(5): 675-679.


