文章编号:1004-0609(2007)05-0783-06
尿素均匀沉淀法制备超细α-Al2O3粉体
肖 劲,万 烨,周 峰,秦 琪,陈燕彬
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:以Al2(SO4)3和CO(NH2)2为原料,通过均匀沉淀法制备出前驱物Al(OH)3,并煅烧得到超细α-Al2O3粉体。研究CO(NH2)2和Al2(SO4)3的摩尔比、Al2(SO4)3起始摩尔浓度、反应温度、反应时间等对前驱物制备的影响。利用X射线衍射仪、扫描电镜、热重/差示扫描法(DTA/TGA)等多种现代分析检测技术对粉体的性能进行了表征。结果表明:在CO(NH2)2和Al2(SO4)3的摩尔比为10?1、Al2(SO4)3起始浓度为0.05 mol/L、反应温度为90 ℃、反应时间为60 min的条件下,能得到分散性能良好、粒径为2 μm左右且粒度分布均匀的球形超细α-Al2O3粉体。
关键词:
中图分类号:TF 123 文献标识码:A
Preparation of ultrafine α-Al2O3 powder by homogenous precipitation
XIAO Jin, WAN Ye, ZHOU Feng, QIN Qi, CHEN Yan-bin
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: Al(OH)3 was synthesized as the precursor by the precipitation reaction of aluminum sulfate and urea, which was calcined to get ultrafine α-Al2O3. The effects of mole ratio of CO(NH2)2 to Al2(SO4)3, initial concentrations of Al2(SO4)3, reaction temperature and reaction time on the preparation of α-Al2O3 were investigated. The structural properties of powder were characterized by X-ray diffractrometry, scanning electron microscope and DTA/TGA measurements. The results show that spherical ultrafine α-Al2O3 powder with non-aggregation and the average particle size of about 2 μm was produced under the conditions: mole ratio of CO(NH2)2 to Al2(SO4)3 is 10?1, initial concentration of Al2(SO4)3 is 0.05 mol/L, reaction temperature is 90 ℃ and the reaction time is 60 min.
Key words: ultrafine α-Al2O3 powder; homogenous precipitation; dispersion; spherical
超细α-Al2O3具有高的表面活性、高的光吸收性能、耐磨、耐高温、耐腐蚀等优越性能,是一种极为重要的结构及功能陶瓷材料,在光、电、医疗和信息等领域有着广泛的应用。为了获得良好的成型和烧结性能,要求α-Al2O3粉末具有纯度高、超细、粒度分布窄、形貌规则等特点[1-4]。
到目前为止,超细α-Al2O3粉体的制备方法众 多[5-8],大致可以分为固相法、气相法、液相法三大类。固相法虽然操作简单,但是能耗较大,生成颗粒的粒径难以控制,且粉末的收集很困难;气相法虽然可以制备无团聚、粒径分布窄的粉体,但是设备投资大,操作复杂,且同样存在收集困难的缺点。液相法操作简单、能得到性能优越的粉末,因此液相法的应用非常广泛,其中均匀沉淀法可制备出粒度分布均匀的产物,操作简单可控,是一种获得超细α-Al2O3粉体的理想方法。很多文献已经通过该方法制备出了性能优异的超细Al2O3粉体[9-16]。
本实验以Al2(SO4)3和CO(NH2)2为原料,通过均匀沉淀法得到前驱物Al(OH)3,经煅烧后得到超细α-Al2O3粉末;系统研究CO(NH2)2和Al2(SO4)3的摩尔比、Al2(SO4)3起始摩尔浓度、反应温度、反应时间等对产物制备的影响,使用多种测试方法对产物的性能进行表征,并确定最佳的工艺条件。
1 实验
1.1 样品的制备
图1所示为超细α-Al2O3粉体的制备工艺流程图。具体实验过程如下:量取一定浓度的硫酸铝溶液,溶入一定量的尿素作为沉淀剂,同时添加适量的PEG1000于反应器内作为分散剂,然后将反应器置于加热套内加热到一定温度,在搅拌作用下进行反应。当沉淀出现后,保温搅拌一定时间后,将沉淀移出过滤、洗涤,重复数次后烘干、煅烧得到超细α-Al2O3粉体。
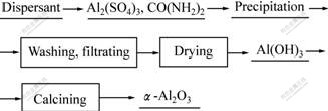
图1 超细α-Al2O3粉体的制备工艺流程图
Fig.1 Manufacture process flow diagram of ultrafine α-Al2O3
1.2 样品的表征
采用日本理学D/max-rA型转靶全自动X射线衍射仪(Cu靶,入射波长0.154 1 nm)对前驱物以及煅烧产物做XRD晶相结构分析;采用日本JEOL厂JSM-5600LV扫描电镜观测前驱物和煅烧产物形貌以及分散情况;采用SDT Q600型热分析仪在空气气氛下对前驱物进行热重/差示扫描法(DTA/TGA)分析;采用上海精宏实验设备有限公司JA21002电子天平称量前驱物质量,并计算前驱物的产率。
2 结果与分析
2.1 反应原理
常规的中和沉淀反应通常是在体系中局部发生,沉淀条件很不均匀。用尿素作沉淀剂,中和沉淀反应在体系中各处同时均匀发生,从而可以保持沉淀初级粒子的均匀性。其具体的反应原理如下:
尿素的水解反应:
![]()
氨水电离得到沉淀剂OH-:
![]()
沉淀反应:
![]()
在目标温度下,随着反应时间的延长,溶液的pH值不断升高,当pH值升高到3.5时,CO2开始产生;当溶液pH值升高到4.2时,溶液中开始产生了沉淀。据文献[17-18]报道,在沉淀反应过程中可能会产生一种中间产物Al(OH)3SO4,但是该化合物随后会很快 消失。
2.2 各工艺条件对前驱物制备的影响
2.2.1 CO(NH2)2和Al2(SO4)3摩尔比的影响
根据2.1节中的方程式,可以判断反应体系中CO(NH2)2与Al2(SO4)3理论摩尔比为3?1,因为尿素不可能完全水解,所以在实验中必须使用过量的CO(NH2)2。通过实验发现,CO(NH2)2和Al2(SO4)3摩尔比对前驱物的物理、化学性能影响不大,但是对反应过程中沉淀产生所需的时间影响很大。图2所示为在反应温度为90 ℃、Al2(SO4)3浓度为0.1 mol/L的条件下,CO(NH2)2和Al2(SO4)3摩尔比与沉淀产生所需时间的关系。可以看出,随着CO(NH2)2和Al2(SO4)3摩尔比的增大,沉淀出现越趋容易,当比值达到10?1以后,反应1 h之内便能得到沉淀产物。鉴于CO(NH2)2和Al2(SO4)3摩尔比为12?1时,沉淀出现的时间缩短较少,为了避免物料的浪费,因此在实验过程中,选择CO(NH2)2和Al2(SO4)3摩尔比为10?1进行反应。
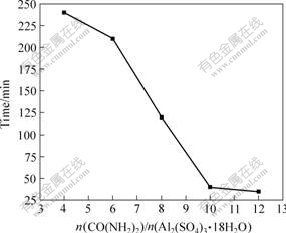
图2 CO(NH2)2和Al2(SO4)3摩尔比与沉淀产生所需时间的关系
Fig.2 Effect of mole ratio of CO(NH2)2 to Al2(SO4)3 on production of deposit (T=363 K, c(Al2(SO4)3)=0.1 mol/L)
2.2.2 Al2(SO4)3起始摩尔浓度的影响
控制CO(NH2)2和Al2(SO4)3摩尔比为10?1,采用Al2(SO4)3起始摩尔浓度为:0.05,0.10,0.15,0.20 mol/L进行实验,图3所示为各浓度条件下得到前驱物的SEM像。可以看出,随着Al2(SO4)3·18H2O起始摩尔浓度的增加,前驱物的团聚现象越来越严重。特别是当Al2(SO4)3·18H2O起始摩尔浓度达到0.20 mol/L时,前驱物颗粒都粘接到一起,团聚现象非常严重。这是因为随着Al2(SO4)3摩尔浓度的提高,成核诱导期会缩短,因而晶核的生长期相对延长,晶粒间相互碰撞聚结甚至发生“溶合”反应现象较严重,致使颗粒的分散性能恶化,粘连加剧。为了得到分散性能优异的前驱物,采用Al2(SO4)3·18H2O起始摩尔浓度为0.05 mol/L。

图3 不同Al2(SO4)3起始浓度制备的前驱物的SEM像
Fig.3 SEM images of precursor prepared with different initial Al2(SO4)3 concentrations (a) 0.05mol/L; (b) 0.10 mol/L; (c) 0.15 mol/L; (d) 0.20 mol/L
2.2.3 反应温度的影响
反应温度对尿素的水解存在很重要的影响。60 ℃以下尿素几乎不发生水解;随着温度的升高,尿素的水解速率开始加快;但是当温度高于126 ℃时,尿素会产生副反应生成缩二脲、缩三脲和聚氰酸等,溶液中NH3的有效浓度反而下降。图4所示为在CO(NH2)2和Al2(SO4)3摩尔比为10?1、Al2(SO4)3起始摩尔浓度为0.05 mol/L的条件下,不同反应温度下制备的前驱物的SEM像。可以看出,在100 ℃时,所得前驱物颗粒出现了多个粒子相互连接的形态、且部分颗粒的球形已经变形;而在90 ℃时,所得前驱物颗粒呈规则的球形,且颗粒分散性能好。因此选择90 ℃为该实验的反应温度。

图4 不同反应温度下制备出前驱物的SEM像
Fig.4 SEM images of precursor prepared at different reaction temperatures: (a) 90 ℃; (b) 100 ℃, nCO(NH2)2)/nAl2(SO4)3)= 10?1, c(Al2(SO4)3)=0.10 mol/L)
2.2.4 反应时间的影响
尿素的水解速度随停留时间的增加而增大,因而要得到高的产物收率,就必须维持一定反应时间。图5所示为前驱物在90 ℃的反应温度下,反应时间与产率的关系。可以看出,前驱物的产率随着反应时间的延长而不断提高,当反应时间为60 min以后,产率能达到70%以上。
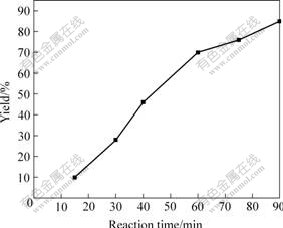
图5 反应时间与前驱物产率的关系
Fig.5 Relationship of reaction time and yield of precursor (T=363 K)
同时从另一方面考虑,反应时间也不宜过长,时间过长会引起小颗粒重新溶解,大颗粒继续长大,从而引起前驱物粉末的团聚严重、粒径分布宽化。图6所示为在不同反应时间下制备出前驱物的SEM像。可以看出,随着反应时间的延长,前驱物的分散性能恶化,且前驱物颗粒粗化严重。因此选择反应时间为60 min。

图6 不同反应时间下制备出前驱物的SEM像
Fig.6 SEM images of precursor prepared under different reaction times: (a) 60 min; (b) 90 min
2.3 产物物质认证
图7所示为前驱物的X射线衍射谱,图8所示为煅烧产物的X射线衍射谱。可以看出:前驱物为无定型产物,这与文献[19]相吻合。而从图8可以看出:该煅烧产物与PDF标准卡11-0661一致,表明该产物为纯相的α-Al2O3,且其峰线尖锐说明其结晶性能完善,纯度高。

图7 前驱物的X射线衍射谱
Fig.7 XRD pattern of precursor
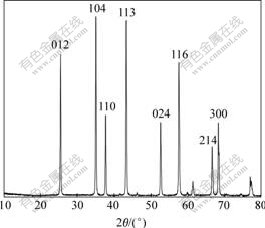
图8 煅烧产物的X射线衍射谱
Fig.8 XRD pattern of calcined product
图9所示为前驱物的DSC/TGA曲线。可以看出:当温度低于600 ℃时,随着煅烧温度的提高,前驱物的质量损失是一个连续的过程,TGA曲线表现为连续下降。当温度高于600 ℃后,TGA曲线几乎为水平曲线,表明前驱物的分解质量损失过程已经结束。此时前驱物的总质量损失为34%左右,这与Al(OH)3分解生成Al2O3的理论质量损失率(34.6%)相吻合。因此可以判断该前驱物为纯度较高的Al(OH)3。

图9 前驱物的DSC/TGA曲线
Fig.9 DSC/TGA curves of precursor
2.4 优化产物SEM分析
通过2.2节中的论述,按照最佳条件(Al2(SO4)3的摩尔浓度为0.05 mol/L、CO(NH2)2和Al2(SO4)3摩尔比为10?1、反应温度为90 ℃、反应时间为60 min)制备出前驱物Al(OH)3粉末,并于1 200 ℃煅烧2 h得到了α-Al2O3粉末。图10所示为前驱物Al(OH)3的SEM像,

图10 Al(OH)3的SEM像
Fig.10 SEM image of Al(OH)3
图11所示为煅烧产物α-Al2O3的SEM像。可以看出:前驱物Al(OH)3与煅烧产物α-Al2O3颗粒均呈规则的球形、粒径大小为2 μm左右、粒度分布均匀且分散性能良好。

图11 α-Al2O3的SEM像
Fig.11 SEM image of α-Al2O3
3 结论
1) 以Al2(SO4)3和CO(NH2)2为原料,采用均匀沉淀法能制备出球形前驱物Al(OH)3,该前驱物在1 200 ℃煅烧2 h得到结晶性能完善、纯度高、分散性能良好、粒径为2 μm左右且粒度分布均匀的球形超细α-Al2O3粉体。
2) CO(NH2)2与Al2(SO4)3的摩尔比、Al2(SO4)3起始摩尔浓度、反应温度、反应时间等工艺条件均对前驱物的制备具有一定的影响。其中随着CO(NH2)2与Al2(SO4)3摩尔比变大,沉淀出现所需的时间会不断缩短;随着Al2(SO4)3起始摩尔浓度的提高,前驱物的团聚现象越来越严重;随着反应温度的升高,前驱物的分散性能变差;反应时间的延长会提高前驱物的产率,但是同样会造成前驱物颗粒粒度粗化,且分散性能不断恶化。
3) 该实验的最佳条件如下:CO(NH2)2和Al2(SO4)3摩尔比为10?1,Al2(SO4)3起始摩尔浓度为0.05 mol/L,反应温度为90 ℃,反应时间为60 min。
REFERENCES
[1] Ibrahim D M, Khalil T, Mostafa A A. Densification of alumina produced by urea formaldehyde sol-gel polymeric route[J]. Ceramics International, 1999, 25: 273-280.
[2] 顾 峰, 沈 悦, 徐 超, 夏义本, 张建成. 分散剂聚合度对超细氧化铝粉体特性的影响[J]. 功能材料, 2005, 36(2): 318-320.
GU Feng, SHENG Yue, XU Chao, XIA Yi-ben, ZHANG Jian-cheng. The influence of polymerization degree of dispersing agent on the powder properties of nano alumina[J]. Journal of Functional Materials, 2005, 36(2): 318-320.
[3] 王雅娟, 李春喜, 王子镐. 超声波-化学沉淀法制备超细氧化铝粒子[J]. 北京化工大学学报, 2002, 29(4): 8-11.
WANG Ya-juan, LI Chun-xi, WANG Zi-hao. Preparation of alumina nanometer particles by an ultrasonic precipitation method[J]. Journal of Beijing University of Chemical Technology, 2002, 29(4): 8-11.
[4] Pratima M. Low-temperature synthesis of α-alumina from aluminium salt and urea[J]. Materials Letters, 2002, 55(6): 425-429.
[5] 唐海红, 焦淑红, 杨红菊, 张爱贤. 纳米氧化铝的制备及应用[J]. 中国粉体技术, 2002, 8(6): 37-39.
TANG Hai-hong, JIAO Shu-hong, YANG Hong-jü, ZHANG Ai-xian. Preparation and utilization of nanometer alumina[J]. China Powder Science and Technology, 2002, 8(6): 37-39.
[6] 张永刚, 闫 裴. 纳米氧化铝的制备及应用[J]. 无机盐工业, 2001, 33(3): 19-22.
ZHANG Yong-gang, YAN Fei. Preparation and application of nano-alumina[J]. Inorganic Chemicals Industry, 2001, 33(3): 19-22.
[7] 吴志鸿. 纳米氧化铝的制备及其在催化领域的应用[J]. 工业催化, 2004, 12(2): 35-39.
WU Zhi-hong. Preparation of nanoparticle alumina and its application in catalysis[J]. Industrial Catalysis, 2004, 12(2): 35-39.
[8] 李慧韫, 张天胜, 杨 南. 纳米氧化铝的制备方法及应用[J]. 天津轻工业学院学报, 2003, 18(4): 34-37.
LI Hui-yun, ZHANG Tian-sheng, YANG Nan. The Preparation and application of nanometer-Al2O3[J]. Journal of Tianjin University of Light Industry, 2003, 18(4): 34-37.
[9] Nagai H, Hokazono S, Kato A. Synthesis of aluminium hydroxide by a homogeneous precipitation method Ⅰ—Effect of additives on the morphology of aluminium hydroxide[J]. British Ceramic Transactions and Journal, 1991, 90(2): 44-48.
[10] 霍彩霞, 何丽君. 以尿素为沉淀剂制备超细γ-Al2O3粉体[J]. 甘肃联合大学学报(自然科学版), 2004, 18(4): 45-47.
HUO Cai-xia, HE Li-jun. The preparation of nano-sized γ-Al2O3 powders by using urea as precipitating agent[J]. Journal of Gansu Lianhe University (Natural Sciences), 2004, 18(4): 45-47.
[11] Nagai H, Oshima Y, Hirano K, Sintering behaviour of aluminium oxides derived from aluminium hydroxides with various morphologies[J]. British Ceramic Transactions and Journal, 1993, 92(3): 114-119.
[12] DONG Hai-feng, XIA Hai-ping. Effect of heating time and desalting process on the diameters of nano-alumina and their polydispersity[J]. Journal of Functional Materials, 2005, 36(4): 583-585, 588.
[13] Macedo M I F, Osawa. C C, Bertran C A. Sol-gel synthesis of transparent alumina gel and pure gamma alumina by urea hydrolysis of aluminium nitrate[J]. Journal of Sol-Gel Science and Technology, 2004, 30(3): 135-140
[14] Ada K, Sarikaya Y, Alemdaroglu T, Onal M. Thermal behaviour of alumina precursor obtained by the aluminium sulphate-urea reaction in boiling aqueous solution[J]. Ceramic International, 2003, 29(5): 513-518.
[15] Ramanathan S, Roy S K, Bhat R, Upadhyaya D D, Biswas A R. Preparation and characterization of boehmite precursor and sinterable alumina powder from aqueous aluminium chloride-urea reaction[J]. Journal of Alloys and Compounds, 1996, 243: 39-44.
[16] Ramanathan S, Roy S K, Bhat R, Upadhyaya D D, Biswas A R. Alumina powders from aluminium nitrate-urea and aluminium sulphate-urea reactions-the role of the precursor anion and process conditions on characteristics[J]. Ceramics International, 1997, 23: 45-43.
[17] Sarikaya Y, Ada K, Alemdaroglu T, Bozdogan I. The effect of Al3+ concentration on the properties of alumina powders obtained by reaction between aluminum sulphate and urea in boiling aqueous solution[J]. Journal of European Ceramic Society, 2002, 22: 1905-1910.
[18] 蔡卫权, 李会泉, 张 懿. Al3+浓度对水热法合成低密度薄水铝石性质的影响[J]. 功能材料, 2004, 35(6): 779-784.
CAI Wei-quan, LI Hui-quan, ZHANG Yi. The effect of Al3+ concentration on the properties of boehmites synthesized by hydrothermal homogeneous precipitation method[J]. Function Material, 2004, 35(6): 779-784.
收稿日期:2006-09-20;修订日期:2006-12-28
通讯作者:肖 劲,副教授;电话:0731-8876454; E-mail: 13607445108@hnmcc.com
[2] 顾 峰, 沈 悦, 徐 超, 夏义本, 张建成. 分散剂聚合度对超细氧化铝粉体特性的影响[J]. 功能材料, 2005, 36(2): 318-320.
[3] 王雅娟, 李春喜, 王子镐. 超声波-化学沉淀法制备超细氧化铝粒子[J]. 北京化工大学学报, 2002, 29(4): 8-11.
[5] 唐海红, 焦淑红, 杨红菊, 张爱贤. 纳米氧化铝的制备及应用[J]. 中国粉体技术, 2002, 8(6): 37-39.
[6] 张永刚, 闫 裴. 纳米氧化铝的制备及应用[J]. 无机盐工业, 2001, 33(3): 19-22.
[7] 吴志鸿. 纳米氧化铝的制备及其在催化领域的应用[J]. 工业催化, 2004, 12(2): 35-39.
[8] 李慧韫, 张天胜, 杨 南. 纳米氧化铝的制备方法及应用[J]. 天津轻工业学院学报, 2003, 18(4): 34-37.
[10] 霍彩霞, 何丽君. 以尿素为沉淀剂制备超细γ-Al2O3粉体[J]. 甘肃联合大学学报(自然科学版), 2004, 18(4): 45-47.
[18] 蔡卫权, 李会泉, 张 懿. Al3+浓度对水热法合成低密度薄水铝石性质的影响[J]. 功能材料, 2004, 35(6): 779-784.


