中国有色金属学报 2004,(11),1969-1976 DOI:10.19476/j.ysxb.1004.0609.2004.11.030
乙酰丙酮铑(Ⅲ)的化学性质
昆明贵金属研究所国家贵金属材料工程技术研究中心,昆明贵金属研究所国家贵金属材料工程技术研究中心,昆明贵金属研究所国家贵金属材料工程技术研究中心,昆明贵金属研究所国家贵金属材料工程技术研究中心,昆明贵金属研究所国家贵金属材料工程技术研究中心,云南瑞升科技有限公司 昆明650221 ,昆明650221 ,昆明650221 ,昆明650221 ,昆明650221 ,昆明650106
摘 要:
合成了乙酰丙酮铑,并采用紫外、红外、核磁和质谱等手段研究了乙酰丙酮铑(Ⅲ)的化学结构特征。结果表明:乙酰丙酮铑属于低自旋的惰性配合物;由于配合物中离域π键的形成,配体羰基已不具备典型的羰基特征;在快原子的轰击下,乙酰丙酮铑的配位键逐一断裂,释放出游离的乙酰丙酮,最后形成103Rh+,同时伴随共价键的断裂与重排;在磁场中,由于Rh3+的强吸电子效应以及螯合环的环电子流效应,H核化学位移向低场移动。通过TG-DTA和GC-MS分析并探讨了乙酰丙酮铑的热分解行为,为其应用提供了热学依据和理论参考,并建议以300℃作为以乙酰丙酮铑为前驱体的CVD铑沉积工艺的沉积温度。
关键词:
中图分类号: O627.8
作者简介:梁广(1981),男,硕士研究生;刘伟平,研究员;电话:0871 5133648;E mail:cuiliang1234@163.com;
收稿日期:2003-12-12
基金:国家院所技术开发资助项目(2004EG115047);云南省院所技术开发资助项目(2003KFZX 15);
Chemical properties of rhodium(Ⅲ) acetylacetonate
Abstract:
Rhodium(Ⅲ) acetylacetonate [Rh(acac)3], a precursor for preparing Rh layers by CVD technique, was prepared. Its spectroscopic properties were investigated via UV-vis, IR, ()1HNMR and MS and its thermal decomposition behavior via TG-DTA and GC-MS. The results show that, Rh(acac)3 is a low spinning and inert coordination compound, the characteristics of carbonyls in the ligand disappear due to the formation of conjugate π bonds in Rh3+—acac- chelating ring, after bombarded by fast atoms, the coordination bonds break and the organic covalent bonds are splited with the formation of ()103Rh+, chemical shifts of H nuclei go downward to low field because of electron-attraction of Rh3+ and electron-cyclic effect in the chelating rings, and it sublimates and decomposes at (247 ℃) and 245 ℃ in air and argon, respectively. Series of new complexes, different with the temperatures, appear in the course of the decomposition, according to which it is suggested that a better deposit temperature should be (300 ℃) when plating Rh layers via CVD technique with Rh(acac)3 as the precursor.
Keyword:
rhodium(Ⅲ) acetylacetonate; chemical structure; thermal properties; CVD;
Received: 2003-12-12
以Cl-、 SO
乙酰丙酮铑(Ⅲ)[Rh(acac)3]是一种新型的贵金属有机配位化合物。 随着化学气相沉积技术(CVD)的日趋成熟, 乙酰丙酮铑因其易挥发、 易分解、 易溶于多种有机溶剂等特点
Rh(acac)3的合成方法国外文献中已有报道
1 实验
1.1 合成
取水合三氯化铑(铑含量不低于38%, 云南贵研铂业股份有限公司提供)1.00 g, 用50 mL水溶解, 加4 mol/L的NaOH(分析纯)溶液10 mL沉淀出Rh(OH)3, 过滤、 洗涤后用稀硝酸溶解, 得到硝酸铑溶液, 然后加入过量Hacac(上海化学试剂厂, 分析纯)搅拌回流, 析出黄色的Rh(acac)3晶体, 过滤收集后用水、 乙醇洗涤, 在70 ℃下烘干, 得到1.16 g的产品, 收率为76%。 所得Rh(acac)3样品的元素分析结果为C 45.00%、 H 5.29%、 Rh 25.44%, 与Rh(acac)3元素理论含量(C 45.01%、 H 5.25%、 Rh 25.72%)一致(C、 H元素分析由中国科学院上海药物所检测中心测定, Rh含量由昆明贵研铂业公司分析中心测定)。
1.2 结构特性测试及热性质测试
将乙酰丙酮铑(Ⅲ)样品溶于氯仿中, 并以氯仿为参比, 在岛津UV-2201型紫外可见分光光度计上测定其在200~600 nm范围内的电子光谱图, 并计算确定其λmax及相应ε; 以氯仿为溶剂, 用DRX500型核磁共振仪(瑞士)记录其1HNMR谱; 以甘油为基质, 采用FAB+在Autospec 3000型高分辩质谱仪(英国)上测定其MS; 其红外光谱采用KBr压片法在FTS-135型红外光谱仪(美国)上测定。
热重-差热分析所用仪器为日本理学电机株式会社生产的Thermoflex系列热分析装置的TG-DTA部分。 乙酰丙酮铑在空气和氩气两种气氛条件下进行, 升温速率都为10 K/min, 都用开放氧化铝坩埚盛装样品, 参比样品都为α-Al2O3粉末, 气流流速都为50 mL/min。
为进一步研究Rh(acac)3的热分解行为, 分别在惰性和空气两种气氛下进行气-质联用分析, 检测出在不同温度下两种样品的主要分解产物。 此分析所用仪器为CDS PYROPROBE 2000型热裂解仪及HP6890/MS5972型气-质联用分析仪(美国)。 Rh(acac)3样品设定的5个温度为250、 300、 400、 500、 600 ℃, 连续升温到指定温度后保持10 s, 然后裂解产物马上随载气(空气或氩气)进入气相色谱进行分离, 再进入质谱进行检测。
2 结果与讨论
2.1 电子光谱
图1所示为Rh(acac)3在氯仿溶液(5.80×10-5 mol/L)中的紫外-可见吸收光谱。 由图可知, Rh(acac)3在紫外-可见光区出现了两个强吸收峰与一个肩峰, 根据郎伯-比耳定律吸光度计算公式A=εbc (其中A为吸光度; ε为摩尔吸光系数; c为溶液摩尔浓度; b为光程长度, 本实验中b 值为1 cm), 可计算出各吸收峰的摩尔吸光系数εmax。
图1 乙酰丙酮铑在氯仿溶液中的紫外-可见吸收光谱
Fig.1 UV-vis absorpbance spectra for chloroform solution of Rh(acac)3
对于λmax为320.3 nm(εmax为10 602.9 L·mol-1·cm-1)和240.6 nm(εmax为8 758.6 L·mol-1·cm-1)的吸收峰, 从位置和吸收强度来看, 应归属于中心离子的d→d跃迁。 由于游离配体[Na(acac)]的π→π*跃迁特征吸收峰在λmax=261 nm处
由于Rh3+属于d6电子构型
2.2 红外光谱
乙酰丙酮钠与乙酰丙酮铑的红外光谱见表1。
乙酰丙酮钠又称2,5-戊二酮钠, 在室温下存在如下共振互变结构, 并由于π电子云的离域, 其共振式中烯醇式的比例大大增加
因此, 在IR光谱上, 出现两种类型的CO不对称伸缩振动吸收峰, 酮式CO和烯醇式CO, 前者为1 668.98 cm-1(m), 后者因共轭体系而降低, 为1 623.79 cm-1(s)。
乙酰丙酮根与Rh3+配位后,形成了大π键, 环上电子云往中心离子的方向移动, 使得CO键减弱, 已不具备典型的羰基特征, 其伸缩振动吸收峰波数下降了约100 cm-1。 同时, 由于离域大π键的形成, 使得配体原共振式中两种不同的CO均一化, 在红外光谱上表现为1 569.39 cm-1的强吸收峰。 Acac-配位化合物的νM-O是相当重要的, 因为它们直接提供了有关M—O键强度的信息。 Nakamoto等
简正坐标计算和同位素位移研究都表明了450 cm-1附近的谱带是M—O与C—CH3弯曲振动模式偶合的, 而在低频区则是比较纯粹的M—O伸缩振动谱带。 限于实验条件(如红外光谱的频区限制、同位素研究等), 本研究只能从理论上将表1中的465.96 cm-1谱峰归属为Rh—O键伸缩振动与C—CH3弯曲振动的偶合, 将434.84 cm-1谱峰归属为Rh-acac环的变形振动
表1 乙酰丙酮钠与乙酰丙酮铑的红外光谱
Table 1 Infrared spectrum of Na(acac) and Rh(acac)3 (cm-1)
| Na(acac) | Rh(acac)3 | Corresponding | Na(acac) | Rh(acac)3 | Corresponding |
3 073.89 |
3 077.15 | ν(CH) | 1 012.09 |
1 022.71 | ρ(CH3) |
| ν(CH3) | 912.28 |
936.70 | ν(CC)+ν(CO) | ||
767.63 |
π(CH) | ||||
1 668.98 |
ν(CO) | ν(C—CH3)+Ring deformation +ν(Rh—O) |
|||
1 623.79 |
1 569.38 | ν(CO) | |||
1 510.09 |
1 518.64 | ν(CC) | 656.10 |
662.87 | |
1 451.81 |
δ(C—H)+ν(CC) | ||||
1 409.85 |
1 383.36 | δ(CH3) | 647.50 | Ring deformation+ν(Rh—O) | |
1 235.37 |
1 270.94 | ν(C—CH3)+ν(CC) | 465.96 | ν(Rh—O)+ν(C—CH3) | |
1 205.09 |
1 201.82 | δ(C—H)+ν(C—CH3) | 434.84 | Ring deformation |
2.3 质谱
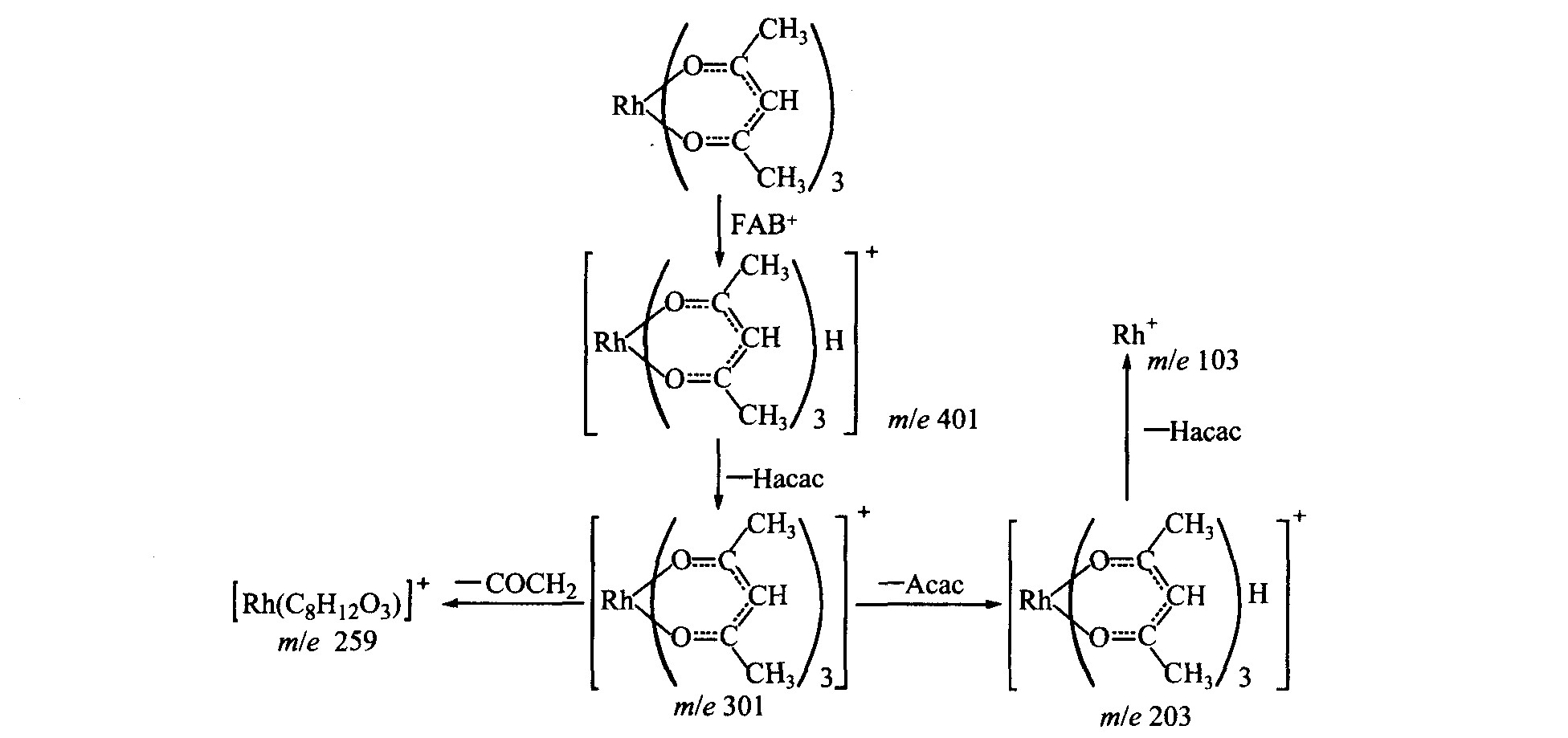
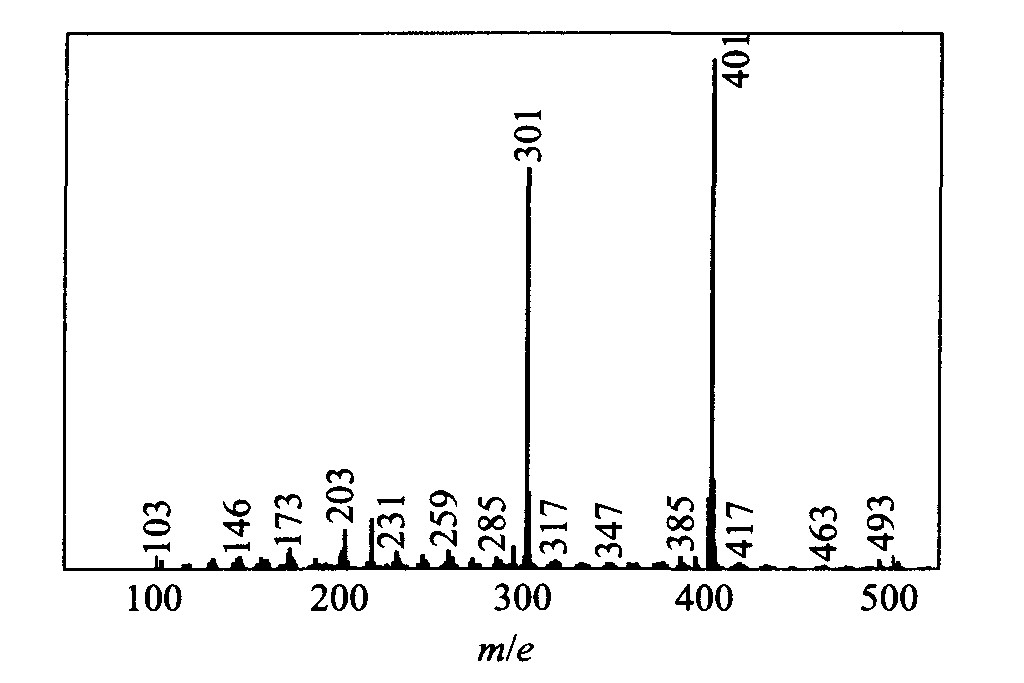
在快原子轰击(FAB+)下, 乙酰丙酮铑出现了分子离子峰M+, 相对强度100%, 并接着分裂成质荷比(m/e)为301(相对丰度84%)、 203(相对丰度10%)和259(相对丰度5%)等碎片峰, 其裂解反应如图2所示。
可见, 在快原子轰击下, 键强相对较弱的配位键先断裂, 逐步释放出配体, 最后形成103Rh+, 同时也伴随着有机共价键的断裂。
同时在MS上还出现了m/e为493(相对丰度3%)的离子峰, 可以解释为乙酰丙酮铑的分子与基质甘油分子(C3H8O3)加合而成。 在快原子的轰击下, Rh3+与3个乙酰丙酮中的其中1个以Rh—C3键配位
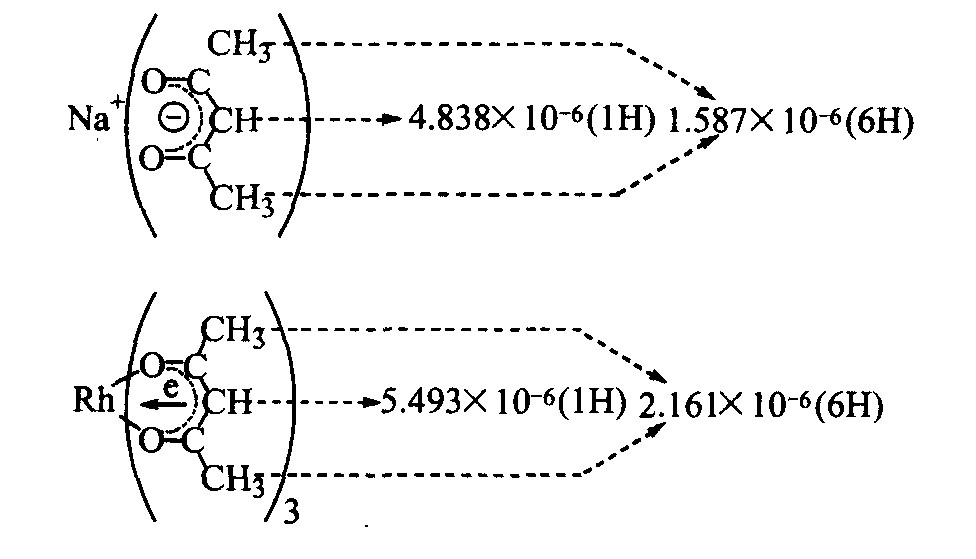
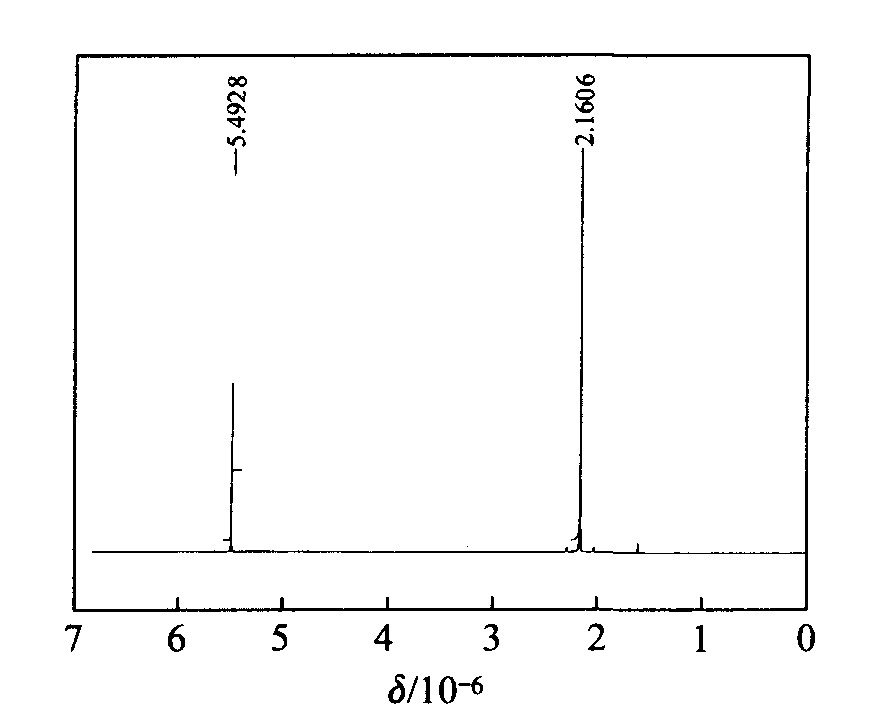
2.4 核磁共振氢谱
Rh(acac)3和Na(acac)的谱图
图2 乙酰丙酮铑质谱中主要碎片离子峰的形成
Fig.2 Formation of main protonized peaks in MS of Rh(acac)3
图3 乙酰丙酮与铑的Rh—C键配位示意图
Fig.3 Formation of Rh—C bonded chelate
图4 Rh(acac)3的FAB+质谱
Fig.4 FAB+ mass spectrum of Rh(acac)3
图5 Rh(acac)3的核磁共振氢谱
Fig.51HNMR of Rh(acac)3
2.5 乙酰丙酮铑的TG-DTA分析
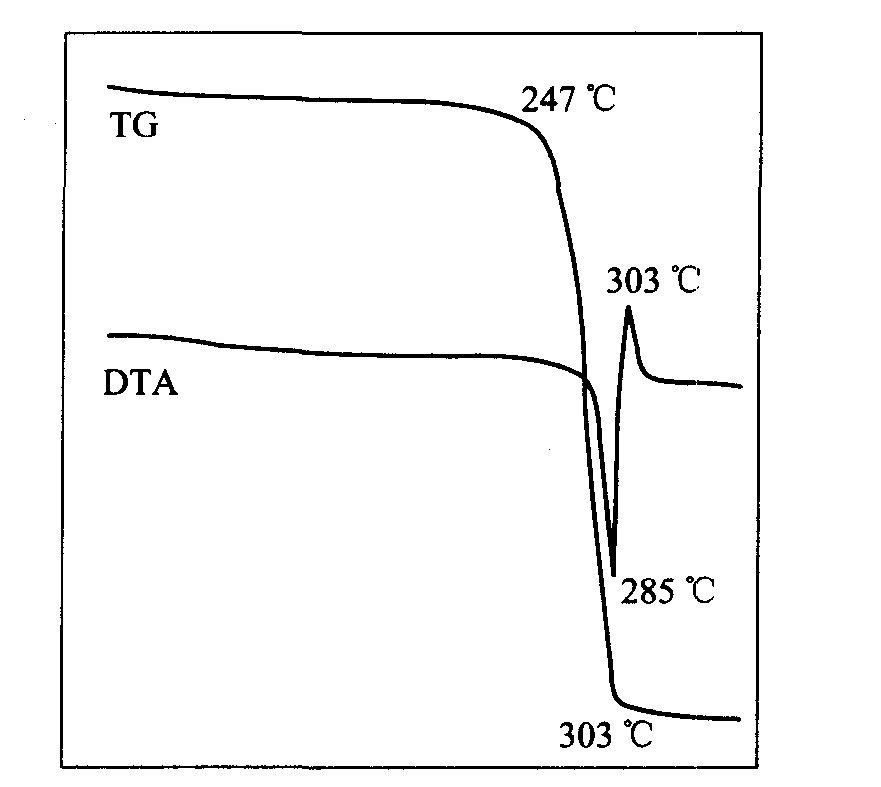
图6, 7所示分别为乙酰丙酮铑在空气气氛和氩气气氛中的TG—DTA曲线。
图6 Rh(acac)3在空气中的TG—DTA曲线
Fig.6 TG—DTA curves of Rh(acac)3 in air
图7 Rh(acac)3在氩气中的TG—DTA曲线
Fig.7 TG—DTA curves of Rh(acac)3 in argon
从图6中的TG曲线可知, 在空气气氛下, Rh(acac)3的外推起始温度为247 ℃, 此时它开始吸热升华, 质量逐渐损失, TG曲线下降, 直到303 ℃时质量损失终止, 曲线又趋于平稳, 说明已生成了稳定的新相; 同时观察差热曲线发现, DTA曲线在温度升高的同时由于越来越剧烈的升华和配体分解吸热, 在285 ℃出现吸热峰顶。 同时, Rh(acac)3分解出的有机配体在空气中氧化燃烧, 燃烧放出的热量将DTA曲线的升华、 分解吸热峰抵消、 掩盖并拉扯成放热峰, 在303 ℃达到放热峰顶温度, 此后Rh(acac)3的热重和差热曲线都趋于平稳, 在坩埚中剩下分解产生的稳定相金属铑, 质量损失率为88.8%。 其热学方程式为
式中 ΔH表示热量。
在图7中的氩气气氛下, Rh(acac)3从245 ℃开始缓慢吸热升华, 质量逐渐损失, 同时伴随着配合物的分解以及分解后产生的有机配体的再分解, 导致DTA曲线出现明显的强吸热峰, 并在259 ℃达到吸热峰顶。 与在氧气气氛下不同的是, 乙酰丙酮铑在惰性气氛下不能氧化燃烧, 只能随着温度的升高而加快升华与裂解, 不会出现放热的过程, 因而在DTA曲线上只出现吸热峰而没有放热峰。 在外推终了温度269 ℃之后, TG与DTA曲线都趋向平稳, 说明也生成了稳定的新相, 整个过程质量损失率91.6%, 可见其在惰性气氛中升华更充分, 质量损失更完全。 其热学方程式为:
2.6 GC-MS行为及其分析
Rh(acac)3在空气和氩气中不同温度下的热裂解产物分别列于表2和表3中。
由表2可以看出, 在所考察的温度范围内, 空气气氛下, Rh(acac)3的分解产物主要是其配体2,4-戊二酮。 实验结果说明: 受热后键强较弱的配位键首先断裂生成配体2,4-戊二酮基, 同时发生了分子内氧化还原反应, 配体失去电子
表2 空气气氛下Rh(acac)3的热分解主要产物
Table 2 Thermolytic products of Rh(acac)3 in air at different temperatures
Rh(acac)3 in air |
Percentage of peak area at different temperatures/% |
||||
250 ℃ |
300 ℃ | 400 ℃ | 500 ℃ | 600 ℃ | |
2,4-pentanedione |
82.70 | 96.91 | 93.7 | 92.3 | 79.50 |
Nonanal |
3.19 | 0.31 | 0.39 | 0.39 | 0.69 |
Benzyl benzoate |
2.19 | 0.38 | 0.21 | ||
3-acetyl-2,5-dimethyl furan |
0.66 | 0.39 | 1.53 | 0.28 | |
Rh(acac)3 |
10.67 | 0.35 | 4.62 | 2.53 | 2.43 |
表3 氩气气氛下Rh(acac)3的热分解主要产物
Table 3 Thermolytic products of Rh(acac)3 in argon at different temperatures
Product |
Percentage of peak area at different temperatures/% |
||||
250 ℃ |
300 ℃ | 400 ℃ | 500 ℃ | 600 ℃ | |
2,4-pentanedione |
50.28 | 62.96 | 53.15 | 52.55 | 46.66 |
1-propen-2-ol acetate |
34.56 | 35.38 | 42.57 | 40.76 | 40.33 |
3-buten-2-one |
2.10 | 3.80 | 5.68 | ||
3-penten-2-one |
0.28 | 0.18 | 1.58 | ||
2-butanone |
0.97 | 0.88 | 2.29 | ||
Furan |
0.55 | 0.42 | 0.63 | ||
Hexan-2,4-dione, enol |
0.37 | 1.78 | |||
另外, 在空气气氛下Rh(acac)3的裂解产物中没有发现二氧化碳, 而一般情况下有机物在空气中温度越高会越容易燃烧, 也就越容易生成二氧化碳, 但实验结果却不是如此, 这可能与实验条件有关。 在热裂解过程中, 热裂解仪在升温保温过程中都是密闭的, 空气量不大, 氧气含量更少, 且裂解过程中少部分氧气在高温下解离, 参与自由基组合反应, 以致裂解室处于高温和缺氧状态, 氧化燃烧生成的少量二氧化碳可能与分解产生的碳单质反应生成一氧化碳, 而一氧化碳由于其质荷比太小而不能被仪器检测到; 也可能其氧化本身就不完全, 只能到生成一氧化碳的阶段。
从表3中的数据可以看出: 惰性气氛下, 在所考查的温度范围内, 2,4-戊二酮虽仍是主要分解产物, 但其含量较空气气氛中已大为减少, 可能是氧或氮的存在会抑制2,4-戊二酮裂解成自由基碎片, 但其机理尚不可知; 随着温度的提高, 碎片重组为结构越来越复杂, 种类越来越繁多的其他化合物, 如400 ℃后Rh(acac)3裂解后的主要产物还包括乙酸-2-丙烯醇酯、 3-丁烯-2-酮、 3-戊烯-2-酮、 2-丁酮、 4-羟基-3-己烯-2-酮和呋喃等, 也可以明显地看出温度对Rh(acac)3配体裂解程度的影响。
可以看出: 两种气氛下, 只有在300 ℃时, 乙酰丙酮铑分解产物最简单, 2,4-戊二酮等稳定的挥发性产物含量大, 原样剩余量小; 在以乙酰丙酮铑作为前驱体制备铑镀层时, 这个温度可以较好地避免由于高温下有机组分分解而引起的碳共沉积
当然, CVD工艺过程的沉积纯度、 沉积质量和沉积速率还受到如物理化学反应、 表面动力反应、 基体材料及加热方式等条件的影响。 本文仅在其前驱体的热化学分析上得出以上结论, 为具体的CVD镀铑工艺参数优化提供参考。
3 结论
以三氯化铑为初始原料, 合成了CVD技术制备铑低维材料的前驱体乙酰丙酮铑(Ⅲ), 产率为76%。 通过电子光谱、 IR、 MS、 1HNMR, 研究了乙酰丙酮铑的化学结构特征, 并采用TG—DTA与GC—MS研究了其热分解行为。 结构特征研究表明: 乙酰丙酮铑属于低自旋的惰性配合物, 在配位取代反应动力学上是稳定的; 在IR中, 由于配合物中离域π键的形成, 配体羰基已不具备典型的羰基特征, Rh—O伸缩振动位于465.98 cm-1; 在快原子的轰击下, 乙酰丙酮铑的配位键逐一断裂, 释放出游离的乙酰丙酮,最后形成103Rh+, 同时伴随着共价键的断裂; 在磁场中, 由于Rh3+的强吸电子效应以及螯合环的环电子流效应, H核的屏蔽减小, 化学位移向低场移动, 示意乙酰丙酮与金属离子形成配位螯合环是其具有强大配位能力的主要原因。 热分析结果表明: 在空气和氩气气氛下, 乙酰丙酮铑分别在247 ℃与245 ℃时开始升华分解并伴随着氧化燃烧、 分解及自由基重组, 氧化燃烧释放的热量大于升华和分解所需的热量; 乙酰丙酮铑在空气和氩气中的主要分解产物都是2,4-戊二酮, 但空气中由于氧的存在, 出现不饱和度更大的产物; 300 ℃时, 乙酰丙酮铑分解产物最简单, 2,4-戊二酮等稳定的挥发性产物含量大, 原样剩余量小, 可以较好地避免由于高温下有机组分分解而引起的碳共沉积, 可以作为CVD镀铑的沉积温度。
参考文献
[1] HartleyFR.TheChemistryofPlatinumandPalladium[M].London:AppliedSciencePulishersLtd,1973.1012.
[10] 张祥麟,康 衡.配位化学[M].长沙:中南工业大学出版社,1986.601604.ZHANGXianglin,KANGHeng.CoordinationChem
istry[M].Changsha:CentralSouthUniversityofTech nologyPress,1986.601604.