均匀沉淀法制备Ca2Co2O5粉体材料
王海东,陈水波,万巍
(中南大学 资源加工与生物工程学院,湖南 长沙,410083)
摘 要:
sub>3)2·4H2O,Co(NO3)2·6H2O和CO(NH2)2为原料,采用均匀沉淀法制备Ca2Co2O5粉体材料。采用FT-IR,TG-DSC,XRD和SEM等手段对样品进行表征,并探讨均匀沉淀法的制备机理。研究结果表明:采用均匀沉淀法,在摩尔比n[CO(NH2)2]:n[Ca2+/Co2+]=4,阳离子浓度比[Ca2+]:[Co2+]=0.200:0.125,加热时间t为3 h时,可获得一定化学组成的前躯体;前驱体于800 ℃保温8 h后,可获得颗粒粒度为1 μm、分布均匀的片状Ca2Co2O5粉体。
关键词:
中图分类号:TB34 文献标志码:A 文章编号:1672-7207(2013)06-2181-05
Preparation of Ca2Co2O5 powders by homogeneous precipitation
WANG Haidong, CHEN Shuibo, WAN Wei
(School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China)
Abstract: Homogeneous precipitation method was applied to synthesize Ca2Co2O5 powders by using Ca(NO3)2·4H2O,Co(NO3)2·6H2O and CO(NH2)2 as raw materials. The samples were investigated by FT-IR,TG-DSC, XRD and SEM. The possibility of synthesis mechanism of homogeneous precipitation was discussed. The results show that precursor with certain chemical composition can be obtained by using homogeneous precipitation when molar ratio n[CO(NH2)2]:n[Ca2+/Co2+]=4, concentration ratio of cationic molarity [Ca2+]:[Co2+]=0.200:0.125 and heating time is 3 h, uniform plate-like Ca2Co2O5 powders with grain size of 1 μm can be obtained by calcining the precursor at 800 ℃ for 8 h.
Key words: Ca2Co2O5 powders; homogeneous precipitation; preparation mechanism
近年来,由于能源与环境问题的日益突出,迫切希望能够发展一种可降低化石燃料、符合环保要求的绿色可再生能源技术。热电技术正是一种以热电材料为基础,实现热能与电能相互转化的环保能源技术。热电材料是一种具有热电效应的功能材料,热电效应包括Seebeck效应(用于发电)和Peltier效应(用于制冷)。热电材料一般采用热电优值来表征其热电性能。热电优值越高,表示热电性能越好。热电材料要具有高的热电优值,则应具有高Seebeck系数、高电导率和低热导率[1-3]。传统热电材料包括Bi-Te系列、Pb-Te系列和Si-Ge系列等,在高温下容易分解或氧化,影响其使用性能和寿命[4]。自Terasaki等[5]研究发现层状结构的过渡金属氧化物NaCo2O4具有优异的热电性能以来,氧化物热电材料以其耐高温、耐氧化、无毒、制备工艺简单等优点引起了广泛关注[6-9]。但由于NaCo2O4存在易潮解、在高温下Na+易挥发等问题,限制了其应用。Ca2Co2O5作为另一种氧化物热电材料,克服了NaCo2O4的缺点,高温时化学性能稳定,热电性能优越,应用潜力巨大。Ca2Co2O5是一种复杂的层状结构氧化物。其结构由岩盐型Ca2CoO3+δ层和CdI2型CoO2沿c轴堆叠而成。在CoO2层,Co原子被6个O原子包围,形成八面体结构,八面体之间通过棱相互连接。而Ca2CoO3+δ层由Ca,Co和O离子组成[10-13]。Ca2Co2O5粉体的制备方法有固相反应法、溶胶-凝胶法等[14-15]。固相反应法工艺简单,容易大规模量化生产,但该法存在原料混合程度低、反应温度高、反应时间长等缺点。溶胶-凝胶法可提高原料混合程度,控制产品的形态和粒度,但是,由该方法所得粉体较疏松,易残留有机质,不利于后期烧结工作。均匀沉淀法具有使原料达到离子级别混合、降低反应温度、缩短反应时间等优点,是一种极具潜力的粉体合成方法,为此,本文作者以硝酸钙、硝酸钴和尿素为原料,采用均匀沉淀法制备Ca2Co2O5粉体材料。
1 实验
1.1 样品制备
实验所用药品均为分析纯。按一定摩尔比称取Ca(NO3)2·4H2O,Co(NO3)2·6H2O和CO(NH2)2,以去离子水为溶剂,溶解并混合均匀,配成均匀透明的红色溶液。再将混合溶液放入高压反应釜中,于90 ℃水浴条件下,磁力搅拌加热3 h,得紫红色前驱体。接着,将前驱体过滤,洗涤,在80 ℃下干燥12 h,研磨。最后,将前驱体放入马弗炉内,在温度为750~800 ℃、空气气氛条件下煅烧8 h,得Ca2Co2O5粉体材料。
1.2 样品测试及表征
采用日本SHIMADZU公司制造的AA-6800型原子吸收分光光度计测定沉淀前、后阳离子浓度,并由公式Ψ=(c0-c)/c0×100%计算得到阳离子(Ca2+/Co2+)沉淀率(其中:Ψ为阳离子沉淀率;c0为初始溶液中阳离子浓度;c为均匀沉淀后溶液中阳离子浓度)。前驱体采用德国Netzsch公司制造的STA449C型同步热分析仪从室温到1 000 ℃,在升温速度为10 ℃/min和空气气氛下进行差热-热重分析(TG-DSC);红外分析采用美国Nicolet公司制造的NEXUS670型傅里叶红外光谱仪(FTIR),从400 cm-1到4 000 cm-1,采用KBr压片法对前驱体和样品进行分析;物相分析采用日本理学株式会社制造的D/Max 2500 VB+型X线衍射仪(XRD)进行分析,采用Cu Kα辐射;形貌和粒度采用日本电子株式会社制造的JSM-6360LV型扫描电子显微镜(SEM)观察。
2 结果与分析
2.1 尿素与阳离子摩尔比
尿素与阳离子摩尔比对前驱体的合成具有重要影响。若尿素与阳离子摩尔比小,则阳离子沉淀率低,所得前驱体少;若尿素与阳离子摩尔比大,则易产生剩余,造成浪费。实验分别对5组不同摩尔比(即摩尔比n[CO(NH2)2]:n[Ca2+/Co2+]=2,3,4,5,6)的初始溶液合成前驱体过程进行分析。尿素与阳离子的摩尔比与阳离子沉淀率的关系如图1所示。
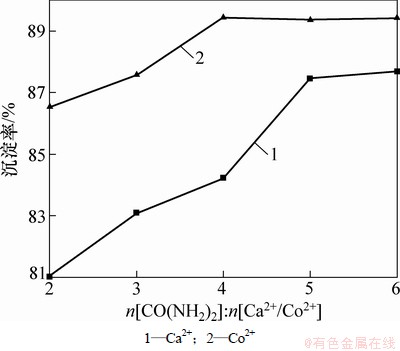
图1 摩尔比与阳离子沉淀率的关系
Fig. 1 Relationship between precipitation rate of Ca2+ and Co2+ at different mole ratios
从图1可见:Co2+沉淀率随尿素与阳离子摩尔比的增大而增大,但是,当尿素与钴离子的摩尔比达到4时,Co2+沉淀率达89%,且不再随该摩尔比增大而增大;同时,Ca2+沉淀率也随尿素与阳离子摩尔比的增大而增大,在尿素与钙离子摩尔比达到5时,Ca2+沉淀率的增大不再明显。这种现象可以通过溶度积理论来解释[16],即由于钴的碳酸盐的溶度积小于钙的碳酸盐的溶度积,所以,Co2+沉淀率大于Ca2+沉淀率,前驱体合成过程需增加钙盐的用量。并且由于受碳酸盐固有溶度积的限制,阳离子沉淀率提高到一定程度后,不再增大。考虑到成本与实验因素,确定尿素与阳离子摩尔比4作为最佳实验条件。
2.2 钙离子与钴离子配比分析
由图1可知:Co2+沉淀率大于Ca2+沉淀率。因此,Ca(NO3)2·4H2O和Co(NO3)2·6H2O的用量对前驱体的组成会产生影响,最终影响Ca2Co2O5粉体的化学组成。实验在n[CO(NH2)2]:n[Ca2+/Co2+]=4条件下,配制多组不同阳离子浓度比的初始溶液,合成前驱体。然后,对前驱体在800 ℃保温8 h所得样品进行XRD分析,结果如图2所示。分析结果表明:原溶液中Ca2+浓度过高,易造成Ca2Co2O5粉体中CaO剩余;Co2+浓度过高,易造成Ca2Co2O5粉体中Co3O4剩余。在浓度比[Ca2+]:[Co2+]=0.200 0:0.125 0时,所得样品几乎为纯相Ca2Co2O5粉体,因此,确定此为最佳阳离子配比。
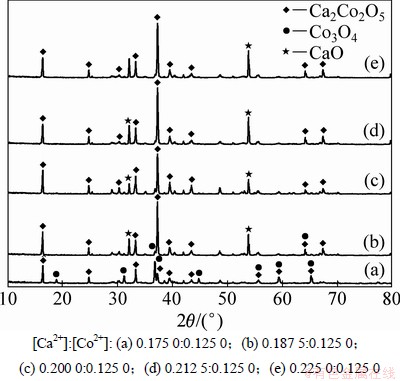
图2 不同阳离子配比溶液合成的样品XRD谱
Fig. 2 XRD patterns of samples synthesized by different cationic concentration solutions
2.3 加热时间
均匀沉淀过程尿素的分解是逐步进行的,因此,加热反应时间对尿素的分解具有一定影响,从而影响阳离子的沉淀率,对前驱体化学组成产生影响。实验在n[CO(NH2)2]:n[Ca2+/Co2+]=4和[Ca2+]:[Co2+]= 0.200: 0.125条件下,对水浴加热时间t与阳离子沉淀率的关系进行分析,结果如图3所示。从图3可见:起初随着加热时间的延长,Co2+沉淀率不断提高,在t=3 h时,沉淀率达89%,随后不再随加热时间的延长而提高,说明反应已接近化学平衡;而Ca2+沉淀率随加热时间延长不断提高,但提高幅度减小。该过程可用化学平衡理论进行解释[17]:沉淀反应开始时,Ca2+和Co2+浓度大,反应速率大;随着加热时间的延长,Ca2+和Co2+浓度降低,因此,反应速率逐渐降低;当t=3 h时,Co2+沉淀过程正反应速率与逆反应速率接近相等,达到化学学平衡,其组成不再变化。因此,确定t=3 h为实验加热时间。
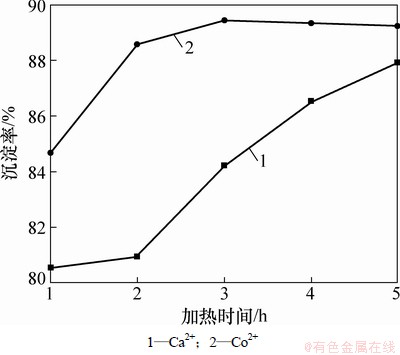
图3 阳离子沉淀率与加热时间的关系
Fig. 3 Relationship between cationic precipitation rate and heating time
2.4 前驱体TG-DSC分析
图4所示为前驱体的TG-DSC(即差热-热重曲线)。从图4可见:在200 ℃左右出现较平缓的吸热峰,并伴随有2.23%的质量损失,这是前驱体脱去表面吸附水所致;在255.20 ℃有1个明显的吸热峰,并伴随有12.34 %的质量损失,这是碱式碳酸钴发生脱羟基作用和碳酸根分解作用,同时生成Co3O4的过程;分解温度超过250 ℃,是因为前驱体结晶性良好,具有一定热稳定性;在752.64 ℃出现1个大的吸热峰,并伴随有18.88%的质量损失,这是CaCO3分解成CaO,然后与Co3O4晶化为Ca2Co2O5的过程;在892.53 ℃出现1个尖锐的吸收峰,表明Ca2Co2O5发生晶型转变,生成Ca9Co12O28和Ca3Co2O6;在928.31 ℃还有1个明显的吸热峰,表明晶型由Ca9Co12O28转变为Ca3Co2O6[15];当温度升至900 ℃时,TG曲线上还出现很小的质量损失现象,这可能是发生晶型转变时,晶体内部分元素析出,并在高温条件下出现气化现象。
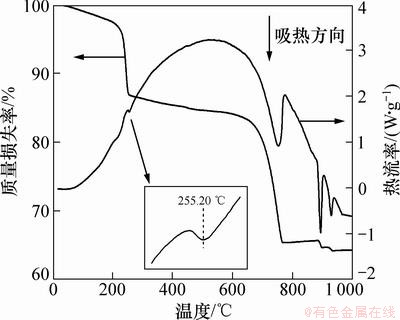
图4 前驱体的TG-DSC曲线
Fig. 4 TG-DSC curves of precursor
2.5 煅烧温度分析
前驱体的煅烧温度对Ca-Co-O体系的晶型变化具有重要影响,在不同的煅烧温度下可以获得不同的同质异构体。在不同煅烧温度下所得粉体的XRD图谱如图5所示。从图5可见:当煅烧温度为750 ℃和800 ℃时,所得粉体为Ca2Co2O5;当煅烧温度为850 ℃和900 ℃时,所得粉体为Ca9Co12O28和Ca3Co2O6的混合物;当煅烧温度为950 ℃时,所得粉体为Ca3Co2O6。这与TG-DSC分析结果一致。Ca9Co12O28和Ca3Co2O6为不同使用温度下的Ca-Co-O体系热电材料,说明均匀沉淀法也可以作为其他热电材料的合成方法。
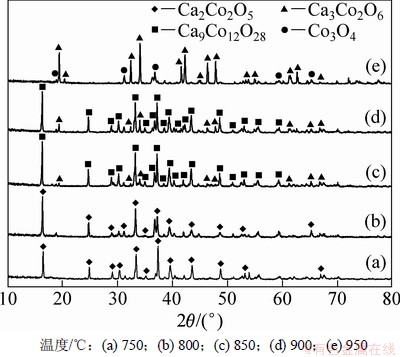
图5 不同煅烧温度下所得粉体的XRD谱
Fig. 5 XRD patterns of precursor calcined at different temperatures for 8 h
2.6 前驱体及Ca2Co2O5粉体FT-IR分析
实验采用FTIR对前驱体及Ca2Co2O5粉体的基团结构进行分析,结果如图6所示。图6(a)中,振动频率3 499.1 cm-1对应OH-1的伸缩,1 483.6 cm-1对应CO32-面内弯曲振动,1 077.6 cm-1对应CO32-对称伸缩振动,851.8 cm-1对应CO32-非对称伸缩振动,704.1 cm-1对应CO32-面外弯曲振动[18]。分析表明:该前驱体为含羟基的金属碳酸盐。结合前驱体的TG-DSC分析,可以推测均匀沉淀法合成前驱体的反应过程如下(Me代表金属阳离子)[19-20]:
CO(NH2)2+H2O→CO2+2NH3·H2
NH3·H2O NH4++OH-
NH4++OH-
Men++nOH-→Me(OH)n
xMe(OH)n+yCO2+zH2O→Mex(OH)nx-2y(CO3)y
此外,图6(b)中,振动频率726.5 cm-1对应Ca-O在Ca2Co2O5中的伸缩模式,669.2 cm-1 和573.4 cm-1为Co-O的振动频率。曲线(b)相对平滑,表明样品中无杂质基团,所得样品为较纯Ca2Co2O5粉体。
2.7 形貌和粒径分析
Ca2Co2O5粉体和前驱体的形貌和粒度采用SEM进行分析,结果如图7所示(其中,图7(a)所示为前驱体的SEM照片,图7(b)所示为Ca2Co2O5粉体的SEM照片)。从图7(a)可以看出:前驱体为微米级颗粒,并发生了团聚现象。从图7(b)可以看出:Ca2Co2O5粉体为均匀的片状颗粒,粒径为1 μm左右。
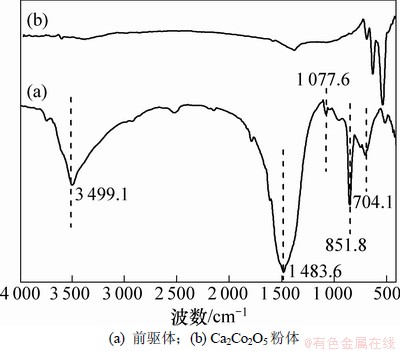
图6 前驱体和Ca2Co2O5粉体的FTIR谱
Fig. 6 FTIR spectra of precursor and Ca2Co2O5

图7 前驱体和Ca2Co2O5粉体的SEM照片
Fig. 7 SEM images of precursor and Ca2Co2O5
3 结论
(1) 前驱体为含羟基的碳酸钴和碳酸钙混合物。
(2) 通过控制尿素用量、阳离子配比、加热时间与煅烧温度等制备条件,可以获得不同晶型的Ca-Co-O体系热电材料。
(3) 采用均匀沉淀法,在摩尔比n[CO(NH2)2]: n[Ca2+/Co2+]=4,浓度比[Ca2+]:[Co2+]= 0.200:0.125,加热时间t为3 h,煅烧温度为800 ℃条件下,可以制备得到粒度均匀、粒径约1 μm的片状Ca2Co2O5粉体材料。
参考文献:
[1] Bux S K, Fleurial J P, Kaner R B. Nanostructured materials for thermoelectric applications[J]. Chemical Communications, 2010, 46(44): 8311-8324.
[2] Chen G, Dresselhaus M S, Dresslhaus G, et al. Recent developments in thermoelectric materials[J]. International Materials Reviews, 2003, 48(1): 45-66.
[3] Snyder G J, Toberer E S. Complex thermoelectric materials[J]. Nature Materials, 2008, 7(2): 105-114.
[4] Sootsman J R, Chung D Y, Kanatzidis M G. New and old concepts in thermoelectric materials[J]. Angewandte Chemie International Edition, 2009, 48(46): 8616-8639.
[5] Terasaki I, Sasago Y, Uchinokura K. Large thermoelectric power in NaCo2O4 single crystals[J]. Physical Review B: Condensed Matter, 1997, 56(3): 12685-12687.
[6] Koshibae W, Tsutsui K, Maekawa S. Thermopower in cobalt oxides[J]. Physical Review B, 2000, 62(11): 6869-6872.
[7] Li S, Funahashi R, Matsubara I, et al. High temperature thermoelectric properties of oxide Ca9Co12O28[J]. Journal of Materials Chemistry, 1999, 9(8): 1659-1660.
[8] Masuda Y, Nagahama D, Itahara H, et al. Thermoelectric performance of Bi- and Na-substituted Ca3Co4O9 improved through ceramic texturing[J]. Journal of Materials Chemistry, 2003, 13(5): 1094-1099.
[9] Nagira T, Ito M, Katsuyama S, et al. Thermoelectric properties of (Na1-yMy)xCo2O4(M=K, Sr, Y, Nd, Sm and Yb; y=0.01-0.35)[J]. Journal of Alloys and Compounds, 2003, 348(1): 263-269.
[10] Lambert S, Leligny H, Grebille D. Three forms of the misfit layered cobaltite [Ca2CoO3][CoO2]1.62·A 4D structural investigation[J]. Journal of Solid State Chemistry, 2001, 160(2): 322-331.
[11] Ling C D, Karina A, Siegbert S, et al. Structural investigation of oxygen non-stoichiometry and cation doping in misfit-layered thermoelectric (Ca2CoO3-x)(CoO2)δ, δ≈1.61[J]. Journal of Solid State Chemistry, 2007, 180(4): 1446-1455.
[12] Liu P S, Chen G, Pei J, et al. Preparation and characterization of the new oxides Ca2-xNaxCo2O5[J]. Physical B, 2008, 403(10): 1808-1812.
[13] Miyazaki Y, Tatsuro M, Mitsuko O, et al. Modulated structure of misfit-layered cobalt oxide [Ca2(Co0.65Cu0.35)2O4]0.63CoO2[J]. The Japan Society of Applied Physics, 2003, 42(12): 7467-7473.
[14] Pei J, Chen G, Li X, et al. Molten salt synthesis and thermoelectric properties of Ca2Co2O5[J]. Materials Letters, 2009, 63(17): 1459-1461.
[15] ZHANG Yanfeng, ZHANG Jiuxing, LU Qingmei, et al. Synthesis and characterization of Ca3Co4O9 nanoparticles by citrate sol-gel method[J]. Materials Letters, 2006, 60(20): 2443-2446.
[16] 李洪桂. 湿法冶金学[M]. 长沙: 中南大学出版社, 2005: 171-248.
LI Honggui. Science of hydrometallurgy[M]. Changsha: Central South University Press, 2005: 171-248.
[17] 王正烈, 周亚平. 物理化学[M]. 北京: 高等教育出版社, 2006: 213-243.
WANG Zhenglie, ZHOU Yaping. Physical chemistry[M]. Beijing: Higher Education Press, 2006: 213-243.
[18] Al-hosney H A, Grassian V H. Water, sulfur dioxide and nitric acid adsorption on calcium carbonate: A transmission and ATR-FTIR study[J]. Physical Chemistry Chemical Physics, 2005, 7(6): 1266-1276.
[19] Wang L, Sondi I, Matijevic E. Preparation of uniform needle-like aragonite particles by homogeneous precipitation[J]. Journal of Colloid and Interface Science, 1999, 218(2): 545-553.
[20] XU Rong, ZENG Huachun. Dimensional control of cobalt hydroxide carbonate nanorods and their thermal conversion to one dimensional arrays of Co3O4 nanoparticles[J]. Journal of Physical Chemistry B, 2003, 107(46): 12643-12649.
(编辑 陈灿华)
收稿日期:2012-09-20;修回日期:2012-11-18
基金项目:教育部博士点基金资助项目(20100162110062);中南大学研究生学位论文创新基金资助项目(2011ssxt260)
通信作者:王海东(1963-),男,广西梧州人,教授,博士生导师,从事材料数模与控制及矿物材料研究;电话:0731-88836963;E-mail:joewhd@126.com
摘要:以Ca(NO3)2·4H2O,Co(NO3)2·6H2O和CO(NH2)2为原料,采用均匀沉淀法制备Ca2Co2O5粉体材料。采用FT-IR,TG-DSC,XRD和SEM等手段对样品进行表征,并探讨均匀沉淀法的制备机理。研究结果表明:采用均匀沉淀法,在摩尔比n[CO(NH2)2]:n[Ca2+/Co2+]=4,阳离子浓度比[Ca2+]:[Co2+]=0.200:0.125,加热时间t为3 h时,可获得一定化学组成的前躯体;前驱体于800 ℃保温8 h后,可获得颗粒粒度为1 μm、分布均匀的片状Ca2Co2O5粉体。


