文章编号:1004-0609(2009)12-2222-08
过热度和电流密度对半石墨质阴极
低温电解膨胀性能的影响
李 劼,方 钊,吕晓军,田忠良,赖延清,胥 建
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:
采用改进型阴极电解膨胀率测试仪,研究低温电解质[K3AlF6/Na3AlF6]-AlF3-Al2O3中电流密度和过热度对半石墨质阴极电解膨胀性能的影响,并对阴极的电解膨胀性能进行数值化表征。结果表明:金属K和Na由表及里渗透进入阴极内部;随着过热度和电流密度的增大,阴极电解膨胀率均呈增大趋势;当电解质过热度由10 ℃升高至50 ℃时,阴极电解膨胀率由1.41%增大至2.10%;随电流密度的增大阴极电解膨胀率呈现出不同的增幅;当电流密度小于0.4 A/cm2或大于0.7 A/cm2时,阴极电解膨胀率均明显增大;而当电流密度在0.4 A/cm2到0.7 A/cm2之间变化时,阴极电解膨胀率相对恒定、增幅最小;数学模型中引入的参数可用于表征阴极的电解膨胀及低温电解质中阴极抗K和Na渗透性能;低温电解时,降低熔体过热度、选择合适的阴极电流密度均可减小金属K和Na对阴极的破坏作用。
关键词:
铝电解;半石墨质阴极;电解膨胀;电流密度;过热度;低温电解;
中图分类号:TF 821 文献标识码: A
Effects of superheat and current density on electrolysis expansion performance of semi-graphitic cathode at low temperature
LI Jie, FANG Zhao, L? Xiao-jun, TIAN Zhong-liang, LAI Yan-qing, XU Jian
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The effects of current density and superheat of potassium and sodium penetration in [K3AlF6/Na3AlF6]-AlF3- Al2O3 on the electrolysis expansion of semi-graphitic cathode melts were studied with a modified laboratory Rapoport apparatus. A mathematical model was introduced to numerically character the electrolysis expansion performance of the semi-graphitic cathode. The results show that potassium and sodium penetrate into the semi-graphitic cathode from exterior to interior. The electrolysis expansion of semi-graphitic cathode increases with increasing current density and superheat. When the superheat increases from 10 ℃ to 50 ℃, the electrolysis expansion increases gradually from 1.41% to 2.10%. However, as the current density rises, the electrolysis expansion increases obviously before 0.4 A/cm2, and after 0.7 A/cm2 the electrolysis expansion increases obviously again. When the current density ranges in 0.4-0.7 A/cm2, the electrolysis expansion keeps constant relatively, and its increase is the least. In addition, the parameters introduced in the mathematical model can reflect the same information with the curve of electrolysis expansion, and sequentially character the resistance performance to K and Na penetration accurately at low temperature. At low temperature the destructive effect resulted from potassium and sodium penetration can be reduced by reducing superheat and choosing proper current density.
Key words: aluminum electrolysis; semi-graphitic cathode; electrolysis expansion; current density; superheat; low temperature electrolysis
当前铝电解工业因采用传统Hall-Héroult电解工艺,存在能耗高和温室气体排放多等不足,节能减排任务艰巨。而低温铝电解工艺采用低温电解质降低电解温度,实现铝电解的节能降耗,已经受到人们的广泛关注,成为铝电解技术的研究热点和发展方向。JAMES和HALVOR[1]以及CILIANU和PANAT[2]研究发现,在一定温度范围内,电解温度每降低10 ℃,电流效率将提高1%~2%,节能效果显著。但是,电解温度的降低不利于电解质中氧化铝的溶解,从而在电解槽中形成大量的沉淀,使电解无法正常进行。因此,选择合适的低温电解质是实现低温铝电解节能的关键。钾冰晶石-氧化铝作为典型的低温电解质体系[3-7],具有优异的氧化铝溶解能力及电解过程中良好的运行稳定性。然而,GALASIN等[8]和LI等[9]研究发现,钾对阴极的渗透力极强,会对阴极造成严重的(膨胀)破坏作用,单一钾冰晶石作为电解质,阴极使用寿命将大幅缩短,最终导致电解槽寿命降低。而电解槽作为铝电解的关键装备,其使用寿命的长短不仅影响着电解铝的生产成本及原铝产量,而且关系到废弃内衬引起的环境污染等问题[10]。从阴极寿命和氧化铝溶解能力两方面综合考虑,钾冰晶石和钠冰晶石的复合电解质体系,将成为一种更具潜力的新型低温电解质体系。因此,研究钾冰晶石和钠冰晶石复合电解质体系下阴极的电解膨胀性能十分必要。
阴极电解膨胀的影响因素较多,除了电解质和阴极材料自身组成与特性外,电解工艺条件也是影响阴极电解膨胀的重要因素。RATVIK等[11]研究发现,钠冰晶石电解质体系中,当电流密度低于0.2 A/cm2和高于0.7 A/cm2时,随着电流密度的增加,阴极电解膨胀率逐渐增大,而在0.2 A/cm2至0.7 A/cm2的范围内,阴极电解膨胀率趋于恒定,并没有明显增大。XUE和YE[12]研究表明,随着电流密度的增大,金属Na渗透进入阴极的深度逐渐增大,但电流密度在0.3 A/cm2到0.5 A/cm2之间以及电流密度大于0.7 A/cm2时,渗透深度增幅很小,出现了一个平台,这与S?RLIE和YE[13]的研究结果类似。此外,过热度也会对阴极的电解膨胀性能产生影响,在相同电解质组成不同电解温度条件下的钠冰晶石熔体中所进行的实验研究表明,较高的电解温度会导致阴极电解膨胀率的增大,造成阴极的破损[14]。因此,有必要在新型含钾低温电解质体系中深入研究电流密度和熔体过热度对阴极电解膨胀性能的影响。
本文作者选用普通半石墨质阴极为研究对象,针对新型含钾低温电解质体系[K3AlF6/Na3AlF6]-AlF3- Al2O3,考察电流密度和过热度对半石墨质阴极电解膨胀性能的影响,并对电解后阴极试样剖面进行元素微区分析。
1 实验
1.1 阴极试样和试剂
将半石墨质阴极机械加工成d20 mm×60 mm的圆柱体,在其中一个端面上钻出d5 mm×20 mm的圆孔,用于连接不锈钢导杆和试样。实验所用的化学试剂分别为K3AlF6(分析纯),Na3AlF6(分析纯),Al2O3(分析纯)和AlF3(工业纯)。
1.2 电解膨胀率测试
采用自制的改进型阴极电解膨胀率测试仪测试阴极试样的线性膨胀位移,通过式(1)计算出阴极电解膨胀率。

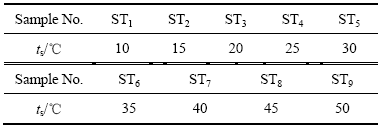
将待测试样置于一垂直管式炉内的高纯石墨制电解槽中,试样浸入电解质的深度为25 mm。实验分两组进行,电解质组成相同,分子比(αCR)为1.6,钾冰晶石含量与钾冰晶石和钠冰晶石总量之比(βKR)为0.3,电解质初晶温度(tL)为873 ℃。在考察电流密度对阴极电解膨胀性能的影响时,过热度(ts)为50 ℃,所使用的电流密度见表1。而在考察过热度对阴极电解膨胀性能的影响时,电流密度(JCD)为0.8 A/cm2,所使用的过热度见表2。两组实验所用氧化铝的浓度均为相应电解质的饱和浓度,电解时间为1.5 h,实际电解温度均等于电解质的初晶温度与过热度之和。整个实验过程是在高纯氩气保护性气氛下进行的。

图1 阴极电解膨胀性能测试装置
Fig.1 Schematic diagram of apparatus for electrolysis expansion: 1—Spiral rod; 2—Transducers; 3—Stainless steel strip; 4—Gas outlet; 5—Ring flange; 6—Graphite piston; 7— Insulation casing; 8—Corundum furnace tube; 9—Corundum lid; 10— Test specimen (cathode); 11—Graphite crucible; 12—Cryolite melt; 13—Corundum disk; 14—Graphite base; 15—Steel rod; 16—Cooling pipe; 17—Gas inlet
表1 实验用电流密度
Table 1 Current density in experiments

表2 实验用过热度
Table 2 Superheat in experiments
1.3 电解后阴极试样剖面分析
采用日本电子公司生产的NORAN VANTAGE4105型X射线能谱仪对试样剖面由边部至中部进行EDS元素微区分析。
2 结果与讨论
2.1 电解后半石墨质阴极剖面元素微区分析
将电解后的阴极试样CD9和ST9沿径向方向 剖开,其剖面距底部约10 mm。采用NORAN VANTAGE4105型X射线能谱仪对试样剖面进行元 素微区分析。图2所示为试样CD9剖面中心处的X 光量子能谱图。从图2可以看出,F、Al、K和Na 等元素均不同程度地渗透到阴极内部,表明电解过 程中,一部分电解质或金属K和Na渗透进入阴极 内部。

图2 试样CD9剖面中部的EDS谱
Fig.2 EDS patterns of center of cross-section of CD9
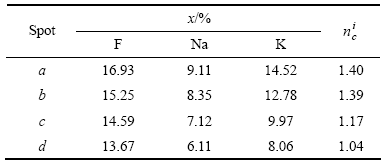
表3所列为沿试样CD9剖面径向方向,由试样边部至其中心部位(见图3中a、b、c和d)各点处F、K和Na各元素的摩尔分数以及元素K、Na物质的量之和与元素F物质的量之比。其中元素K和Na物质的量之和与元素F物质的量之比以![]() 表示。
表示。
在钠冰晶石体系中进行电解时,一般认为[15],渗透进入阴极的物质主要包括NaF、Na3AlF6和Na5Al3F14等,由此可以推断,在低温电解质[K3AlF6/Na3AlF6]- AlF3-Al2O3中进行电解时,从电解质的组成来看,元素Na或元素K与元素F的物质的量之比最大为1。这个值均小于表3中所示出的元素K和元素Na的物质的量之和与元素F的物质的量之比(![]() ),说明渗透进入阴极的元素K和Na不完全是以电解质组分形式存在,而有一部分是电解过程中阴极表面所析出的并渗透进入阴极形成嵌合物的金属K和Na。同时,由表及里
),说明渗透进入阴极的元素K和Na不完全是以电解质组分形式存在,而有一部分是电解过程中阴极表面所析出的并渗透进入阴极形成嵌合物的金属K和Na。同时,由表及里![]() 值的减小说明,金属K和Na由外而内渗透进入到阴极内部,渗入量逐渐减少。各点处K的含量均大于Na的含量,说明K比Na有着更强的渗透力。
值的减小说明,金属K和Na由外而内渗透进入到阴极内部,渗入量逐渐减少。各点处K的含量均大于Na的含量,说明K比Na有着更强的渗透力。

图3 CD9阴极剖面分析部位示意图
Fig.3 Schematic diagram of analytical positions on cross-section of sample CD9
表3 试样CD9剖面各点元素的摩尔分数及各点处K、Na物质的量之和与F物质的量之比(![]() )
)
Table 3 Mole fraction of elements in spots on cross-section and ratio of summation of amount of substance K and Na to amount of substance F

电解过程中,由于阴极极化作用,金属K和Na会在阴极表面析出,这部分K和Na在碱金属s电子与碳元素中π电子的键合驱动力作用下,渗透进入阴极材料内部,形成碱金属-石墨插层化合物(GICs)。这种化合物的一个重要的典型的结构现象就是阶现象,即插层物以一定的周期性,排列在宿体石墨的层间。GICs可以根据阶数n来分类,n为相邻两层插层物之间的石墨片数,如图4所示。
对于电解过程中阴极表面所析出的金属Na来说,其渗透进入阴极,所形成的GICs多为高阶,如C64Na, 其为8阶GICs,即每一层钠原子之间相隔8层碳原子。而对于金属K来说,其渗透进入阴极所形成的GICs多为低阶,如C8K,其为1阶GICs,即每一层钾原子之间,相隔1层碳原子。正是由于这样一个原因,使得渗透进入阴极,形成插层化合物的金属K的量大于形成插层化合物的金属Na的量,宏观上则表现为渗透进入阴极的金属K的量大于金属Na的量,金属K具有比金属Na更强的渗透能力[16-17]。同时,由于阴极材料存在一定的开气孔率,电解过程中会出现电毛细现象,这会使较多的电解质渗透进入阴极,并填充在阴极内部孔隙之中,进一步增加电解质与阴极的接触面积,加剧金属K和Na向阴极渗透并形成插层化合物。
此外,从表3中还可以看出,阴极剖面各点处均有F元素的存在,说明电解过程中,除了碱金属的渗透外,以氟化物形式存在的电解质同样由外至内渗透进入了阴极。这部分氟化物的渗入,会导致极化条件下便阴极表面碱金属的析出量的增大,使其阴极造成更强的破坏作用,最终缩短电解槽的使用寿命。
图5所示为试样ST9剖面中心处的X光量子能谱。与试样CD9检测结果类似,F、Al、K和Na等元素均不同程度的渗透进入了阴极内部,表明存在部分电解质或金属K和Na渗透进入了阴极内部。
表4所列为沿试样ST9剖面径向方向,由试样边部至其中心部位(点a、b、c和d)各点处F、K和Na各元素的摩尔分数以及元素K、Na物质的量之和与元素F物质的量之比。与试样ST9剖面的分析结果类似,金属K和Na由外而内,渗透进入阴极内部,渗入量逐渐减小。同一点处,K的含量大于Na的含量,K比Na有着更强的渗透能力,同时,氟化物的存在,强化碱金属对阴极的破坏作用。

图4 石墨插层化合物的结构模型
Fig.4 Structure model of graphite intercalation compounds

图5 试样ST9剖面中部的EDS能谱
Fig.5 EDS pattern of central part of on cross-section sample ST9
表4 试样剖面各点元素摩尔分数及各点处K、Na物质的量之和与F物质的量之比
Table 4 Mole fractions of elements in spots of cross-section and ratio of summation of amount of substance K and Na to amount of substance F
2.2 过热度对阴极电解膨胀率的影响
图6所示为不同过热度时阴极电解膨胀率随电解时间的变化曲线。从图6可以看出,不同过热度的条件下所测得的电解膨胀率曲线均呈抛物线状,在刚开始通电电解时,阴极电解膨胀率的增加速率较快;随着电解的不断进行,阴极电解膨胀率的增加速率逐渐减缓,最后趋于恒定。当过热度为50 ℃时,阴极电解膨胀率最大,为2.10%;当过热度为10 ℃时,阴极电解膨胀率最小,为1.26%。图7所示为电解1.5 h后阴极电解膨胀率随过热度的变化曲线。从图7可看出,随着过热度的增大,阴极的电解膨胀率逐渐增大。

图6 不同过热度条件下阴极电解膨胀率曲线
Fig.6 Electrolysis expansion curves of cathode at different superheats

图7 电解后阴极电解膨胀率随过热度的变化曲线
Fig.7 Changing curves of electrolysis expansion with superheat after electrolysis
铝电解过程中阴极主反应为铝离子放电析出金属铝,随着电解过程的进行,Al与金属K和Na的析出电位之差会发生变化。在一定条件下,金属K和Na便会和Al共同析出,沉积在阴极的表面。析出的这部分金属K和Na会通过碳素晶格或孔隙扩散渗透至碳素晶格层内,与碳阴极反应形成GICs,从而加大石墨层间距离,宏观上则表现为阴极试样的膨胀和破损。因此,阴极表面金属K和Na的析出直接影响着阴极的电解膨胀性能。随着温度的升高,金属K、Na和Al之间的析出电位差值减小[18],这使得K和Na易于与金属Al在阴极表面共同析出。析出离子反应方程式如式(2)所示。
Na+/K++e=Na/K(dissolved) (2)
宏观上则表现为阴极电解膨胀率随温度的升高而增大。
另一方面,温度的升高不仅可以增加离子的扩散速率,使阴极附近的熔体不易产生贫化层,阴极表面附近区域的Na+和K+浓度增高,而且也会增加电化学反应的速率[19],有利于金属K和Na的生成,最终造成电解后阴极电解膨胀率的增大。
2.3 电流密度对阴极电解膨胀率的影响
图8所示为不同电流密度的条件下阴极电解膨胀率随电解时间的变化曲线。从图8可以看出,当电流密度为1.0 A/cm2时,阴极电解膨胀率最大,为2.52%;当电流密度为0.2 A/cm2时,阴极电解膨胀率最小,为1.14%。图9所示为电解1.5 h后阴极电解膨胀率随电流密度的变化曲线。由图9可看出,随着电流密度的提高,阴极电解膨胀率逐渐增大,但在不同电流密度段,阴极电解膨胀率的增幅有所不同。在电流密度由0.2 A/cm2增大到0.4 A/cm2的过程中,阴极电解膨胀率逐渐增加且增幅明显;而当电流密度从0.4 A/cm2增大到0.7 A/cm2时,阴极电解膨胀率的增幅明显减小,出现一个平台;当电流密度继续增大至1.0 A/cm2时,阴极电解膨胀率又以较大幅度增加。

图8 不同电流密度条件下阴极电解膨胀率曲线
Fig.8 Electrolysis expansion curves of cathode at different current densities

图9 电解1.5 h后阴极电解膨胀率随电流密度的变化曲线
Fig.9 Changing curves of electrolysis expansion with current density after electrolysis
随着电流密度的增大,阴极极化作用明显增强,电解质与阴极润湿性得到改善,这使得电解质更加容易渗透进入阴极材料,引发更多金属K和Na的渗入,形成GICs[20],导致材料更大的膨胀率。同时,电流密度会对阴极表面附近扩散层中NaF的浓度产生影响,即影响熔盐和阴极界面上的分子比[11]。电解质中存在着大量的K+和Na+,且电流基本上是由K+和Na+迁移的。随着电流密度的提高,大量的K+和Na+迁移至阴极表面附近,造成这一局部区域电解质的分子比提高,从而导致反应方程式(3)向右移动,阴极表面金属K和Na生成量增大,金属K和Na渗透进入阴极的量随之增加。
Al(l)+3NaF/KF(in electrolyte)=
3Na/K(dissolved)+AlF3(in electrolyte) (3)
此外,电流密度也会影响到金属K、Na与Al之间的析出电位差[21]。在电解过程中,当电流密度增大时,阴极表面附近区域Al3+离子浓度迅速减小,同时Na+和K+离子浓度相对增大,这会引起金属K、Na和Al之间析出电位差的减小,甚至K、Na优先析出。因此,随着电流密度的增大,阴极表面会有更多量的金属K、Na析出,增加阴极表面碱金属的浓度,强化金属K、Na对阴极的渗透。
至于电流密度从0.4 A/cm2增大至0.7 A/cm2,阴极电解膨胀率增幅减小这一现象,国内外的研究者在钠电解质体系下也得到类似的研究结果[11-13],其原因是与电解生成的铝液和阴极之间的润湿性改变有关。当电流密度在0.4至0.7 A/cm2之间变化时,铝液与阴极之间的润湿性得到一定的改善,在电解过程中,阴极周围包覆一层铝膜,这可在一定程度上阻碍K和Na的渗透,使得阴极电解膨胀率增幅相对较小。当电流密度较小时,铝液与阴极之间的润湿性较差,铝液的保护能力较弱;但当电流密度继续增大时,相比于铝液保护膜,K和Na的渗透力更为显著,从而表现出电解膨胀率进一步增大。
2.4 半石墨质阴极低温电解膨胀性能的数值化表征
从图6和8中可以直接读出试样的低温电解膨胀率,它是金属K和Na渗透进入阴极材料中量的反映,仅为电解过程中某一时刻的K和Na渗透量,未能涉及渗透速率,而渗透速率的大小对阴极材料也有很大影响。此外,电解膨胀率曲线是一种图形,只用于表征材料性能、或比较阴极材料的优劣。为此,引入数学模型,探索利用数值来表征半石墨质阴极的低温电解膨胀性能。
图6和8中所示的电解膨胀率曲线与现行工业用电解质中阴极电解膨胀率曲线相似,均表现为随着时间的增加,在初期,阴极膨胀率增加很快,然后逐渐降低,到一定时间后,基本稳定在某一值。因此, 可以通过数学模型引入参数a和因子Q对含钾低温 电解质中所测得的阴极电解膨胀率曲线进行数值化表征[22]:
![]() (4)
(4)
式中:参数a表征阴极材料电解膨胀率;因子Q表征金属K和Na对阴极的渗透速率,Q是一个既与a有关,也与b有关的量,Q=a/b。
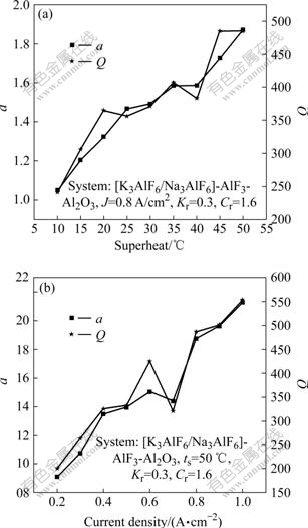
图10 不同过热度及不同电流密度条件下参数a和因子Q变化曲线
Fig.10 Changing curves of constant a and factor Q at different superheat (a) and current density (b)
图10所示为不同过热度及不同电流密度条件下参数a和因子Q的变化曲线。从图10中可看出,随着过热度的提高,参数a和因子Q逐渐增大,即阴极电解膨胀率和K、Na渗透速率随过热度的提高而增大。而随着电流密度的增大,无论参数a还是因子Q均呈增大的趋势,即阴极电解膨胀率和K、Na渗透速率随着电流密度的增大而增大。但与过热度对阴极电解膨胀性能影响不同的是,这种增大的趋势并不是线性的。当电流密度从0.2 A/cm2增大到0.4 A/cm2时,参数a和因子Q逐渐增大;而当电流密度由0.4 A/cm2增大到0.7 A/cm2时,他们的增幅明显减小。最后,当电流密度从0.7 A/cm2增加到1.0 A/cm2时,他们的增幅又增大。这与图6和8中所描述的实验结果一致,因此,联合分析参数a和因子Q可以实现对低温电解质[K3AlF6/Na3AlF6]-AlF3-Al2O3中半石墨质阴极电解膨胀性能的数值化表征。
从图10可以看出,参数a和因子Q出现个别异于上述规律的异常点。例如,当过热度为20 ℃时的因子Q大于过热度为25 ℃时的因子Q,再如当电流密度为0.6 A/cm2时的参数a大于当电流密度为0.7A/cm2时的参数a,这种现象也与图6和8中所表述的结果一致,进一步说明利用数学模型(4)对低温电解质[K3AlF6/Na3AlF6]-AlF3-Al2O3中半石墨质阴极电解膨胀性能进行数值化表征的可行性。
通过以上讨论可看出,采用数学模型(4)可准确、便捷、全面地对阴极电解膨胀性能进行分析对比,进而利用参数a和因子Q数值化表征出低温电解质[K3AlF6/Na3AlF6]-AlF3-Al2O3中半石墨质阴极电解膨胀性能,避免使用图形来比较判定材料性能所带来的不便。
3 结论
1) 在低温电解质[K3AlF6/Na3AlF6]-AlF3-Al2O3中电解时,金属K和Na在阴极表面析出,并由外至内渗透进入半石墨质阴极内部,K比Na具有更强的渗透能力。
2) 过热度对K和Na共同作用所引起的阴极电解膨胀影响明显,当过热度由10 ℃升高至50 ℃时,阴极电解膨胀率增大为原来的1.6倍。降低过热度可以减少阴极电解膨胀率和渗透速率。
3) 电流密度由0.2 A/cm2增大为1.0 A/cm2时,阴极电解膨胀率增大为原来的2.21倍,且在0.4 A/cm2至0.7 A/cm2之间变化时,阴极电解膨胀率增加缓慢,可以在这一范围内选择合适的电流密度进行电解,以减少阴极材料的膨胀和破损。
4) 通过实验数据对数学模型(4)进行验证,表明参数a和因子Q可真实准确地反映低温电解质[K3AlF6/Na3AlF6]-AlF3-Al2O3中阴极的电解膨胀率和渗透速率,从而可以直观、全面地比较或数值化表征半石墨质阴极的低温电解膨胀性能。
REFERENCES
[1] JAMES W E, HALVOR K. Sustainability, climate change, and greenhouse gas emissions reduction: responsibility, key challenges, and opportunities for the aluminum industry[J]. JOM, 2008, 60(8): 25-31.
[2] CILIANU M, PANAIT N. Evolution of the physico-chemical properties of the electrolyte in industrial aluminium electrolysis cells[J]. UPB Scientific Bulletin: Chemistry and Materials Science, 2003, 65(3): 63-73.
[3] GRJOTHEIM K, KVANDE H. Physico-chemical properties of low-melting baths in aluminium electrolysis[J]. Metall, 1985, 39(6): 510-513.
[4] SLEPPY W C, COCHRAN C N. Bench scale electrolysis of aluminium in sodium fluoride-aluminium fluride melts below 900 ℃[C]// WARREN S P. Light Metals 1979. USA: TMS, 1979: 385-395.
[5] JACOBS T B, BROOKS R. Electrolytic reduction of aluminum: United States, 5279715[P]. 1994.
[6] 高炳亮. 低温铝电解新研究[D]. 沈阳: 东北大学, 2003: 3-10.
GAO Bing-liang. New studies on low-temperature aluminium electrolysis[D]. Shenyang: Northeastern University, 2003: 3-10.
[7] 王家伟. Na3AlF6-K3AlF6-AlF3体系的初晶温度、Al2O3溶解能力及NiFe2O4基惰性阳极低温电解腐蚀研究[D]. 长沙: 中南大学, 2008: 7-14.
WANG Jia-wei. Research on liquidus temperature and Al2O3 dissolving ability of Na3AlF6-K3AlF6-AlF3 system and corrosion resistance of NiFe2O4 based inert anodes in low temperature aluminum electrolysis[D]. Changsha: Central South University, 2008: 7-14.
[8] GALASIU I, GALASIU R, THONSTAD J. Inert anodes for aluminium electrolysis[M]. Düsseldorf: Aluminium- Verlag, 2007: 23-24.
[9] LI Jie, FANG Zhao, LAI Yan-qing, L? Xiao-jun, TIAN Zhong-liang. Electrolysis expansion performance of semigraphitic cathode in [K3AlF6/Na3AlF6]-AlF3-Al2O3 bath system[J]. Journal of Central South University of Technology, 2009, 16(3): 422-428.
[10] JAMES W E. The evolution of technology for light metals over the last 50 years: Al, Mg and Li[J]. JOM, 2007, 59(2): 30-38.
[11] RATVIK P A, ST?RE A, SOLHEIM A, TRYGVE F. The effect of current density on cathode expansion during start-up [C]// DAVID H D Y. Light Metals 2008. USA: TMS, 2008: 973-978.
[12] XUE Ji-lai, ?YE H A. Sodium and bath penetration into TiB2-carbon cathodes during laboratory aluminium electrolysis [C]// CUTSHALL E R. Light Metals 1992. USA: TMS, 1992: 773-778.
[13] ST?RE M, ?YE H A. Chemical resistance of cathode carbon materials during electrolysis[C]// MCGEER J P. Light Metals 1984. USA: TMS, 1984: 1059-1070.
[14] ST?RE M, ?YE H A. Evaluation of cathode material properties relevant to the life of Hall-Heroult cells[J]. Journal of Applied Electrochemistry, 1989, 19(4): 580-588.
[15] BRILLOIT P, LOSSIUS L P, ?YE H A. Melt penetration and chemical reactions in carbon cathodes during aluminum electrolysis.Ⅰ. Laboratory experiments[J]. Publ Transp Int, 1994, 42(2): 1237-1246.
[16] CLAIRE H, ALBERT H, PHILIPPE L. Ternary graphite intercalation compounds associating an alkali metal and an electronegative element or radical[J]. Solid state sciences, 2004, 6(1): 125-138.
[17] 葛军饴, 曹世勋, 蔡传兵, 张金仓. 石墨插层化合物超导体研究进展[J]. 低温物理学报, 2008, 30(1): 1-7.
GE Jun-yi, CAO Shi-xun, CAI Chuan-bing, ZHANG Jin-cang. Recent progress of graphite-intercalation-compounds superconductors[J]. Chinese Journal of Low Temperature Physics, 2008, 30(1): 1-7.
[18] 邱竹贤. 预焙槽炼铝[M]. 北京: 冶金工业出版社, 2005: 311-314.
QIU Zhu-xian. Smelting aluminum in pre-baked cell[M]. Beijing: Metallurgical Industry Press, 2005: 311-314.
[19] STERTEN A, SOLLI P A. Cathodic process and cyclic redox reactions in aluminium electrolysis cells[J]. Journal of Applied Electrochemistry, 1995, 25: 809-816.
[20] WANG Zhao-wen, BAN Yun-gang, SHI Zhong-ning, GAO Bing-liang, LV Ding-xiong, MA Cheng-gui, KAN Hong-ming, HU Xian-wei. Penetration of sodium and electrolyte to vibratory compaction TiB2 cathode[C]// DAVID H D Y. Light Metals 2008. USA: TMS, 2008: 1029-1032.
[21] FROLOV A V, ALEXANDER O G, NIKOLAI I S, NINA P K, LEONID V S, LARISSA M B, VICTOR P S, YURII P Z. Wetting and cryolite bath penetration in graphitized cathode materials[C]// TRAVIS J G. Light Metals 2006. USA: TMS, 2006: 645-649.
[22] L? Xiao-jun, LI Qing-yu, LAI Yan-qing, LI Jie. Digital characterization and mathematic model of sodium penetration into cathode material for aluminum electrolysis[J]. Journal of Central South University of Technology, 2009, 16(1): 96-100.
基金项目:国家重点基础研究发展计划资助项目(2005CB623703);国家高技术研究发展计划资助项目(2008AA030502)
收稿日期:2009-03-25;修订日期:2009-09-18
通信作者:李 劼,教授,博士;电话:0731-88830649;E-mail: 13808488404@163.com
摘 要:采用改进型阴极电解膨胀率测试仪,研究低温电解质[K3AlF6/Na3AlF6]-AlF3-Al2O3中电流密度和过热度对半石墨质阴极电解膨胀性能的影响,并对阴极的电解膨胀性能进行数值化表征。结果表明:金属K和Na由表及里渗透进入阴极内部;随着过热度和电流密度的增大,阴极电解膨胀率均呈增大趋势;当电解质过热度由10 ℃升高至50 ℃时,阴极电解膨胀率由1.41%增大至2.10%;随电流密度的增大阴极电解膨胀率呈现出不同的增幅;当电流密度小于0.4 A/cm2或大于0.7 A/cm2时,阴极电解膨胀率均明显增大;而当电流密度在0.4 A/cm2到0.7 A/cm2之间变化时,阴极电解膨胀率相对恒定、增幅最小;数学模型中引入的参数可用于表征阴极的电解膨胀及低温电解质中阴极抗K和Na渗透性能;低温电解时,降低熔体过热度、选择合适的阴极电流密度均可减小金属K和Na对阴极的破坏作用。


