DOI: 10.11817/j.issn.1672-7207.2021.05.002
金焙砂酸浸液两段pH调控氧化法制备四氧化三铁新工艺
张霜华,郑雅杰,曹攀,赵云龙
(中南大学 冶金与环境学院,湖南 长沙,410083)
摘 要:
为原料,通过单因素实验对CaO与NaOH两段pH调控氧化法制备Fe3O4新工艺进行研究,并在此基础上进行放大实验,对两段pH调控氧化法与石灰一段pH调控氧化法制备Fe3O4工艺进行对比分析。研究结果表明:在反应温度为80 ℃,一段pH为6.45,反应时间为1.5 h,二段pH为9,初始Fe2+浓度为0.5 mol/L、搅拌速度为200 r/min、空气流量为1.2 L/min、反应时间为1.5 h和磁场强度为140 kA/m的最佳条件下,两段pH调控氧化法制备的Fe3O4产物中铁质量分数为65.00%,铁回收率为94.78%,Fe3O4产物与石膏副产物质量比为1.0:1.2;两段pH调控氧化法制备所得Fe3O4产物中铁质量分数为64.25%,铁回收率为93.78%;与石灰一段pH调控氧化法制备Fe3O4相比,铁质量分数提高11.76%,铁回收率提高8.24%,含砷石膏副产物产量降低41.67%。
关键词:
中图分类号:TF831 文献标志码:A
文章编号:1672-7207(2021)05-1407-11
Novel oxidation process with two-stage pH regulation for preparation of Fe3O4 from acid leaching solution of gold calcine
ZHANG Shuanghua, ZHENG Yajie, CAO Pan, ZHAO Yunlong
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: A novel oxidation process with two-stage pH regulation by CaO and NaOH for preparation Fe3O4 was studied by single factor experiments using acid leaching solution of gold calcine as raw materials. The scale-up experiment was carried out, and the processes of preparing Fe3O4 by oxidation method with two-stage pH regulation and lime one-stage pH regulation were compared. The results show that the mass fraction of iron in Fe3O4 product prepared by oxidation method with two-stage pH regulation is 65.00%, the iron recovery rate is 94.78%, and the mass ratio of Fe3O4 product to gypsum by-product is 1.0:1.2 when pH is 6.45 and reaction time in the first stage is 1.5 h, in the second stage, pH value is 9, the reaction temperature is 80 ℃, the initial Fe2+ concentration is 0.5 mol/L, the stirring speed is 200 r/min, air flow rate is 1.2 L/min, the reaction time in the second stage is 1.5 h, and the magnetic field is 140 kA/m. Under the best condition, the iron mass fraction of Fe3O4 product prepared by oxidation method with two-stage pH regulation is 64.25% and the iron recovery rate is 93.78%. Compared with the Fe3O4 product by oxidation method with lime one-stage pH regulation, the iron mass fraction increases by 11.76%, the iron recovery rate increases by 8.24%,and the output of arsenic-containing gypsum by-product is reduced by 41.67%.
Key words: acid leaching solution; pyrite reduction; two-stage pH regulation; oxidation method; ferroferric oxide
随着易浸金矿日益枯竭,难处理金矿的开发利用备受关注[1-3]。氧化焙烧具有投资适中、效率高和技术成熟等特点,因而被广泛用于难冶金精矿的预处理[4-6]。矿石焙烧后,通常采用酸浸的方式进一步消除铁对金浸出的阻碍作用[7-8]。然而,酸浸产生大量含铁酸浸液,对含铁酸浸液进行合理处置,可减少对环境的危害,降低处理成本,提高企业经济效益。目前,对于含铁酸浸液的处理主要有2条途径:1) 调节pH,待重金属及有害成分达到排放标准后,用作生产用水或直接排放[9-12]。此类方法处理过程简单,但会产生大量废渣,甚至可能会造成二次污染;2) 对酸浸液进行中和利用,以回收其中有价组分,其中铁多以绿矾和铁系氧化物的形式回收[13-16]。铁系氧化物中Fe3O4具有许多优异的性能,在磁性材料、催化剂和生物化学等领域应用广泛,为此,许多学者对四氧化三铁的制备进行了研究[17-19]。中和法和氧化法是制备Fe3O4材料常用方法[17]。采用中和法制备Fe3O4生产成本高,且制备的Fe3O4产品磁性能差。采用氧化法所制得的Fe3O4产品质量高,磁性能好。采用氧化法制备Fe3O4常用的pH调整剂为石灰和氢氧化钠[17-20]。采用石灰一段pH调控氧化法制备四氧化三铁将产生大量杂质质量分数高的石膏副产物[18-19]。采用氢氧化钠一段pH调控氧化法制备四氧化三铁,生产成本高,难以适应大规模生产需求[20]。
为此,本文作者提出以金焙砂酸浸液为原料,通过硫铁矿还原、蒸发结晶、石灰和氢氧化钠两段pH调控氧化法制备四氧化三铁的思路,研究两段pH调控氧化法制备四氧化三铁过程,二段pH、初始Fe2+浓度、反应温度、二段反应时间、空气流量以及磁分离对四氧化三铁制备的影响。在此基础上进行放大实验,对两段pH调控与石灰一段pH调控氧化法制备Fe3O4工艺进行对比分析。
1 实验
1.1 实验原料
实验原料为金焙砂酸浸液,其主要元素组成如表1所示。实验用硫铁矿主要元素组成如表2所示。
表1 酸浸液主要元素组成(质量浓度)
Table 1 Major element compositions of acid leaching solution(mass concentration) g/L

表2 硫铁矿主要元素组成(质量分数)
Table 2 Major element compositions of pyrite (mass fraction) %

由表1可知:金焙砂酸浸液中主要总铁质量浓度为50.99 g/L,其中,Fe(Ⅱ)的质量浓度为8.43 g/L,H+质量浓度为1.30 g/L;As,Al,Ca 和Cu质量浓度分别为1.42,0.87,0.62和0.20 g/L。由表2可知:硫铁矿中主要元素为Fe和S,其质量分数分别为45.00%和49.50%,其他杂质元素质量分数较低。
1.2 实验步骤
1) 硫铁矿还原。取2.5 L酸浸液置于5 L三颈瓶中,升温至80 ℃恒温,在搅拌状态下缓慢加入300 g球磨后的硫铁矿(粒度低于74 μm的硫铁矿质量分数大于95%),还原2 h后过滤。
2) 蒸发结晶。取硫铁矿还原后液置于5 L烧杯中,加热浓缩至溶液体积的1/2后,冷却结晶,结晶过程结束后过滤。
3) 溶解。取一定质量的上述结晶绿矾置于1 L烧杯中,在25 ℃时加去离子水溶解,配制一定浓度的硫酸亚铁溶液。
4) 两段pH调控与氧化。取200 mL一定浓度的FeSO4溶液置于500 mL三颈瓶中,在常温搅拌状态下缓慢加入石灰乳(AR)调节pH至6.45,再用2.5 mol/L NaOH(AR)溶液调pH至固定值(8~11)。当pH调至实验所需值后,加热至固定温度(60~100 ℃)后恒温,通入空气(0.2~0.8 L/min),反应一定时间(30~120 min)后过滤。
5) 磁分离。取经两段pH调控与氧化后过滤得到的产物置于500 mL三颈瓶中,按5%固体质量加入去离子水配制成矿浆。将配制好的矿浆通过进样漏斗缓慢加入磁选管中,在磁选强度为140 kA/m时磁选10 min,收集磁性产物和非磁性产物,并分别过滤烘干。两段pH调控氧化法从酸浸液中回收四氧化三铁的流程如图1所示。
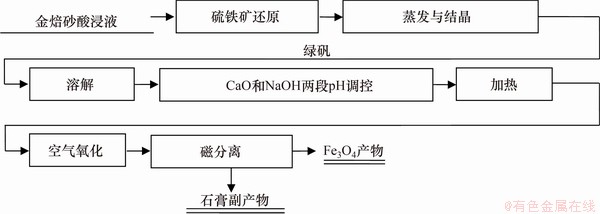
图1 两段pH调控氧化法从酸浸液中回收四氧化三铁流程
Fig. 1 Flow chart of magnetite recovery from acid leaching solution by two-stage pH regulation and oxidation
1.3 分析与检测
采用重铬酸钾法分析Fe2+和总铁质量浓度[17-18];采用X射线衍射仪(XRD,Rigaku D/max-TTR III,Rigaku)分析产物物相(发光源为Cu靶Kα辐射,管电压为25 kV,管电流为400 mA,步长为0.02°,2θ为10.0°~70.0°,波长λ=1.540 56×10-10 m);采用扫描电镜(SEM, JSM-ⅠT300, JEOL)观察产物表面形貌;采用激光粒度分析仪(Mastersizer 3000, Malvern)分析产物颗粒粒度组成;采用pH计(pHS-25, 雷磁)测定溶液pH;采用X线荧光光谱仪(XRF-1800,日本岛津)测定结晶绿矾的化学成分;采用化学分析法测定四氧化三铁产物及石膏副产物主要化学成分。
酸浸液中Fe3+还原率x的计算式为


式中:[Fe3+]酸浸液和[Fe3+]还原后液分别为酸浸液和还原后液中Fe3+的浓度。
2 结果与讨论
2.1 酸浸液的还原与蒸发结晶
当反应温度为80 ℃时,按液固比5:1在酸浸液中加入机械球磨后的硫铁矿进行还原。还原时间对酸浸液中Fe3+还原率的影响如图2所示。
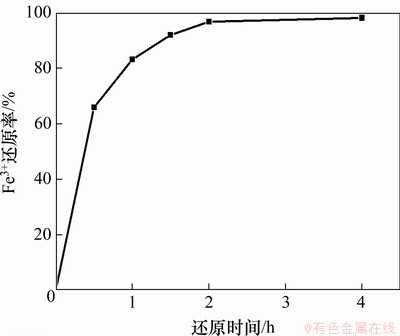
图2 还原时间对酸浸液中Fe3+还原率的影响
Fig. 2 Effect of reduction time on Fe3+ reduction rate in acid leaching solution
由图2可知:当还原时间由0 h增加至2 h时,Fe3+还原率由0增加至96.80%;继续延长还原时间至4 h时,Fe3+还原率增加至98.20%。还原时间增加2 h,铁还原率仅增加1.40%,因此,选择2 h为最佳还原时间。还原2 h后,还原后液中H+浓度为2.00 mol/L。硫铁矿还原Fe3+过程主要电极反应如表3所示。
表3 硫铁矿还原Fe3+过程主要电极反应
Table 3 Main electrode reactions in reduction of Fe3+ by pyrite
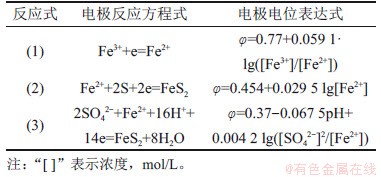
由表3可知:当H+浓度为1.30 mol/L,离子活度为1时,电极反应(1),(2)和(3)的电极电位分别为0.770,0.454和0.378 V;当H+浓度为2.00 mol/L时,电极反应(1),(2)和(3)的电位分别为0.770 ,0.454和0.390 V。彭春丽[15]发现在硫铁矿还原Fe3+时仅有少量S生成。在本实验H+浓度(1.3~2.0 mol/L)范围内,硫铁矿还原Fe3+主要反应为[21]:
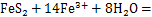

可见:硫铁矿能将Fe3+还原为亚铁离子,增加还原时间,上述反应更加充分,Fe3+还原率增加。
硫铁矿还原后液蒸发结晶,当浓缩比为2/1时,结晶产物XRD图谱及SEM图像如图3所示,结晶产物荧光分析结果(XRF)如表4所示。

图3 结晶产物XRD和SEM图像
Fig. 3 XRD pattern and SEM images of crystal products
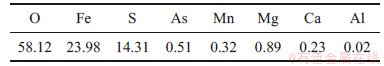
由图3(a)可知,FeSO4·4H2O为干燥后结晶产物中主要成分,其他成分质量分数较低。由图3(b)可知结晶产物结晶度较高,晶型完整。FeSO4·4H2O为FeSO4·7H2O干燥过程中脱水的产物。由表4可知:结晶产物中铁、氧和硫质量分数分别为23.98%,58.12%和14.31%,其他杂质质量分数均较低。
表4 结晶产物XRF元素分析结果(质量分数)
Table 4 XRF element analysis results of crystal products (mass fraction) %
2.2 结晶绿矾制备Fe3O4
2.2.1 二段pH对Fe3O4制备的影响
单一采用氢氧化钠调节pH,生产成本高。单一采用石灰调节pH会生成大量石膏,且生成的四氧化三铁中杂质质量分数高,为此,研究石灰与氢氧化钠两段pH调控氧化法对四氧化三铁制备的影响。
Fe(OH)2解离平衡方程为
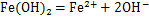
其中:Ksp为8×10-16。由上式计算可知,当Fe2+浓度为1 mol/L时,Fe2+开始水解的pH为6.45。为了降低渣量,减少铁离子损失,确定一段石灰调节硫酸亚铁溶液pH至6.45。
在反应温度为80 ℃,亚铁离子浓度为0.5 mol/L,搅拌速度为200 r/min,一段pH和反应时间分别为6.45和1.5 h,空气流量为1.2 L/min,二段反应时间为2 h条件下,采用氢氧化钠进行二段pH调节。二段pH对产物中Fe3+与Fe2+物质的量比(n(Fe3+)/n(Fe2+))的影响结果如图4所示。
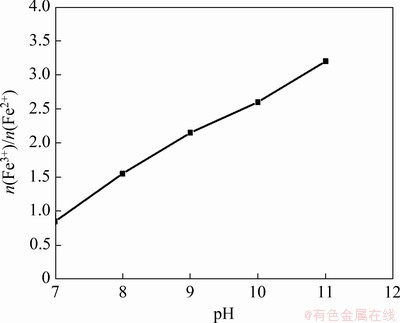
图4 二段pH对产物中Fe3+与Fe2+物质的量比的影响
Fig. 4 Effect of the second stage pH on n(Fe3+)/n(Fe2+) in products
由图4可知:当二段pH由7升至11时,产物中n(Fe3+)/n(Fe2+)由0.85增加至3.20。n(Fe3+)/n(Fe2+)增加是碱性增强、Fe2+氧化速率加快所致[22]。在实验过程中发现当二段pH为7~8时,溶液呈墨绿色且有灰绿色絮状物生成;在二段pH为9~10时,溶液呈黑色且有黑色颗粉末状物质生成;在二段pH为11时,溶液呈黑褐色且有黑褐色粉末状物质生成;当二段pH=9时,产物中n(Fe3+)/n(Fe2+)为2.15,与Fe3O4中的n(Fe3+)/n(Fe2+)最接近。
当二段pH为9时,产物XRD图谱如图5所示。
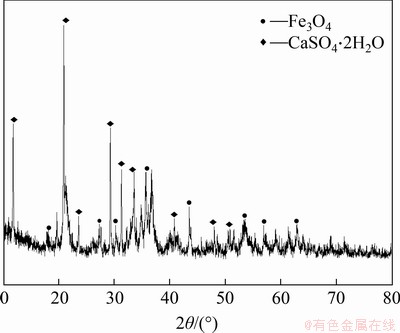
图5 二段pH为9时的产物XRD图谱
Fig. 5 XRD pattern of product when the second stage pH is 9
由图5可知:在二段pH为9时,产物主要由磁铁矿(Fe3O4)和石膏(CaSO4·2H2O)组成。综合产物XRD分析结果及产物中n(Fe3+)/n(Fe2+),选择pH=9为最佳二段pH。
2.2.2 初始Fe2+浓度对Fe3O4制备的影响
在反应温度为80 ℃,一段pH和反应时间分别为6.45和1.5 h,二段pH为9,搅拌速度为200 r/min,空气流量为1.2 L/min,二段反应时间为2 h条件下,初始Fe2+浓度对产物中n(Fe3+)/n(Fe2+)的影响如图6所示。
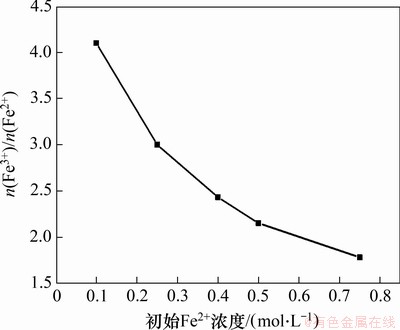
图6 初始Fe2+浓度对产物中n(Fe3+)/n(Fe2+)的影响
Fig. 6 Effect of initial Fe2+ concentration on n(Fe3+)/n(Fe2+) in products
由图6可知:当初始Fe2+浓度由0.10 mol/L增加至0.75 mol/L时,产物中n(Fe3+)/n(Fe2+)由4.10降低至1.78。由于Fe2+水解生成Fe(OH)2胶体,且随着初始Fe2+浓度增加,Fe(OH)2胶体浓度增加,体系黏度增加,氧的传质速率降低,导致Fe(OH)2氧化速率降低,从而产物中n(Fe3+)/n(Fe2+)下降[18];当初始Fe2+浓度为0.5 mol/L时,产物中n(Fe3+)/n(Fe2+)为2.15,最接近四氧化三铁中的n(Fe3+)/n(Fe2+)(2:1),因此,选择0.5 mol/L为最佳初始Fe2+浓度。
2.2.3 二段反应时间对Fe3O4制备的影响
在反应温度为80 ℃,一段pH和反应时间分别为6.45和1.5 h,二段pH为9,初始Fe2+浓度为0.5 mol/L,搅拌速度为200 r/min,空气流量为1.2 L/min时,二段反应时间对产物中n(Fe3+)/n(Fe2+)的影响如图7所示。
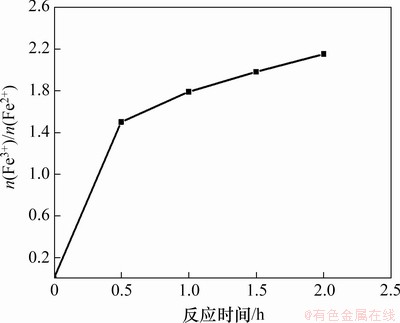
图7 二段反应时间对产物中n(Fe3+)/n(Fe2+)的影响
Fig.7 Effect of reaction time of the second stage on n(Fe3+)/n(Fe2+) in products
由图7可知:当二段反应时间由0.5 h增加至2.0 h时,产物中n(Fe3+)/n(Fe2+)由1.50增加至2.15;延长反应时间,Fe(OH)2氧化为Fe(OH)3的反应以及Fe(OH)2与Fe(OH)3脱水化合生成Fe3O4的反应进行得越充分,因此,产物中n(Fe3+)/n(Fe2+)随反应时间的增加而增加[19];当反应时间为1.5 h时,产物中n(Fe3+)/n(Fe2+)为1.98,最接近Fe3O4中的n(Fe3+)/n(Fe2+)。同时,通过实验发现:当反应时间为0.5 h和1.0 h时,反应溶液呈灰色,其原因是生成的较少Fe3O4与石膏混合导致产物颜色呈灰色;当反应时间为1.5 h时,溶液颜色明显加深呈纯黑色,这是由于大量Fe3O4生成。实验现象与实验结果均表明,1.5 h为最佳反应时间。
当反应时间为1.5 h时,产物的XRD及SEM图如图8所示。
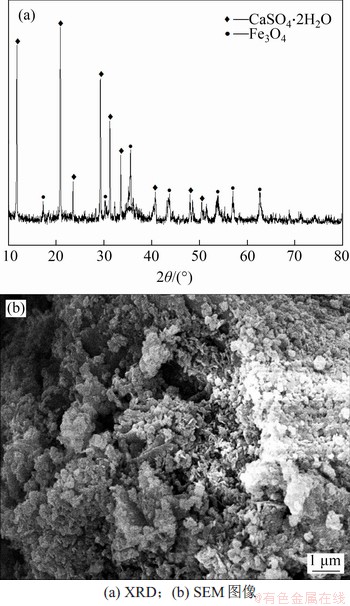
图8 反应时间为1.5 h时产物的XRD及SEM图像
Fig. 8 XRD pattern and SEM image of product at t=1.5 h
由图8(a)可知:产物主要为磁铁矿(Fe3O4)和石膏(CaSO4·2H2O)的混合物。研究表明,采用氧化法制备的四氧化三铁呈粒状或球形,而此过程中生成的石膏主要呈柱状、针状或不规则的板状[17-18],因此,由图8(b)可知生成的Fe3O4以小颗粒团聚体形式存在。
2.2.4 反应温度对Fe3O4制备的影响
在一段pH和反应时间分别为6.45和1.5 h,二段pH为9,初始Fe2+浓度为0.5 mol/L,搅拌速度为200 r/min,空气流量为1.2 L/min,二段反应时间为1.5 h条件下,反应温度对产物中n(Fe3+)/n(Fe2+)的影响如图9所示。
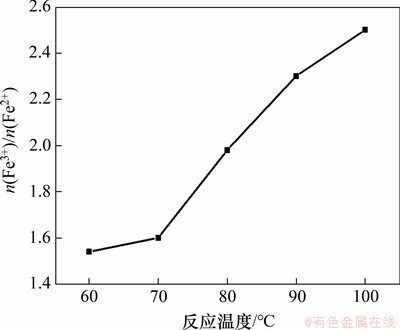
图9 反应温度对产物中n(Fe3+)/n(Fe2+)的影响
Fig. 9 Effect of reaction temperatures on n(Fe3+)/n(Fe2+) in products
由图9可知:当温度由60 ℃增加至100 ℃时,产物中n(Fe3+)/n(Fe2+)由1.54增加至2.50;低温时,Fe2+氧化速率低,随着温度增加,Fe2+氧化速率及加成脱水反应速率增加,故产物中n(Fe3+)/n(Fe2+)增加[13];当反应温度为60 ℃和70 ℃时,产物中n(Fe3+)/n(Fe2+)分别为1.54和1.60,不满足Fe3O4中的量比特征(n(Fe3+):n(Fe2+)=2:1);当反应温度达到80 ℃时,产物中n(Fe3+)/n(Fe2+)为1.98,符合Fe3O4中n(Fe3+)/n(Fe2+)的量比特征;当反应温度为90 ℃和100 ℃时,产物中n(Fe3+)/n(Fe2+)分别为2.3和2.5,偏离Fe3O4中n(Fe3+)/n(Fe2+)的量比特征。故选择80 ℃为较适宜温度。当反应温度为80 ℃时,产物XRD和SEM图像如图10所示。
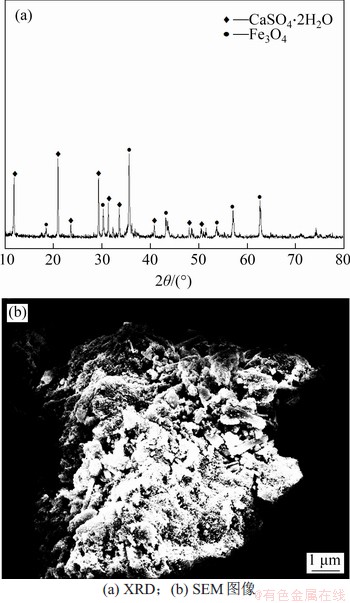
图10 80 ℃时产物的XRD图谱及SEM图像
Fig.10 XRD pattern and SEM image of products at 80 ℃
由图10(a)可知产物主要为磁铁矿(Fe3O4)和石膏(CaSO4·2H2O)的混合物。由图10(b)可知:在80 ℃时,产物中四氧化三铁(Fe3O4)和石膏(CaSO4·2H2O)团聚明显;石膏(CaSO4·2H2O)呈柱形、板状附着在Fe3O4的表面,且结晶度完整,易与Fe3O4分离。
2.2.5 空气流量对Fe3O4制备的影响
在反应温度为80 ℃,一段pH和反应时间分别为6.45和1.5 h,二段pH为9,初始Fe2+浓度为0.5 mol/L,搅拌速度为200 r/min,二段反应时间为1.5 h条件下,空气流量对产物中n(Fe3+)/n(Fe2+)的影响如图11所示。
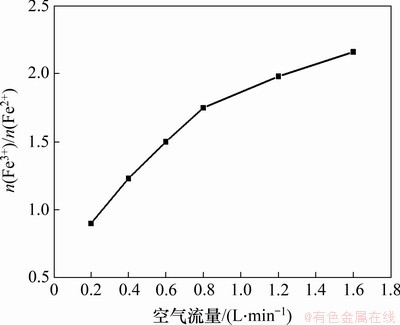
图11 空气流量对产物中n(Fe3+)/n(Fe2+)的影响
Fig. 11 Effect of air flow rate on n(Fe3+)/n(Fe2+) in products
由图11可知:当空气流量由0.2 L/min增加至1.6 L/min时,产物中n(Fe3+)/n(Fe2+)由0.90增加至2.16;随着空气流速增大,氧气传质加快,Fe(OH)2的氧化速度加快,故n(Fe3+)/n(Fe2+)增加[23];当空气流量为1.2 L/min时,产物中n(Fe3+)/n(Fe2+)为1.98,符合Fe3O4中n(Fe3+)/n(Fe2+)的量比特征。故选择 1.2 L/min为最佳空气流量。
2.3 两段中和氧化产物的磁选分离及放大实验
2.3.1 磁选分离四氧化三铁和石膏
在磁场强度为140 kA/m时,采用磁选管对氧化后所得产物进行磁选分离,实验结果如表5所示。
表5 产物磁选分离结果(质量分数)
Table 5 Magnetic separation results of products (mass fraction) %
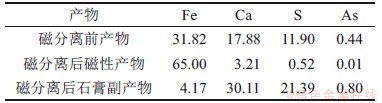
由表5可知:磁分离前产物主要元素Fe,Ca和S的质量分数分别为31.82%,17.88%和11.90%,产物中铁品位低,杂质质量分数高,难以实现直接利用;磁分离后产物中主要元素Fe质量分数为65.00%,杂质Ca质量分数降低至3.21%;磁分离后石膏副产物中主要元素Ca和S的质量分数分别为30.11%和21.39%,Fe质量分数为4.17%;磁选后铁的回收率达94.78%,磁性产物与石膏副产物质量比为1.0:1.2,有效实现了四氧化三铁与石膏的分离。
两段pH调控氧化法制备四氧化三铁过程发生的反应式为[17-19]:




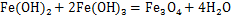
采用两段pH调控氧化法制备四氧化三铁。在一段石灰调节pH过程中,石膏副产物最先生成;在二段氢氧化钠调节pH过程中,Fe2+水解,生成Fe(OH)2胶体,部分Fe(OH)2胶体附着在石膏副产物颗粒表面;在加热通入空气过程中,Fe(OH)2胶体部分氧化为Fe(OH)3,同时,Fe(OH)2与Fe(OH)3脱水化合生成Fe3O4。由于采用两段pH调控,氧化后混合产物中仅有少部分Fe2+以Fe(OH)2或Fe3O4的形式附着在石膏副产物颗粒表面或包裹在石膏副产物颗粒中,大部分Fe2+通过水解、氧化及脱水最终转化为单体Fe3O4颗粒。混合产物中Fe3O4产物颗粒与石膏副产物颗粒之间相互夹杂情况少,因此,对采用两段pH调控氧化法制备四氧化三铁得到的混合产物进行磁选,磁性产物中铁质量分数显著提高。
2.3.2 酸浸液两段pH调控氧化法制备四氧化三铁放大实验结果
为了进一步验证以酸浸液为原料采用两段pH调控氧化法制备四氧化三铁工艺的可行性及优势,在上述最佳条件下进行了放大实验。实验步骤如下:取8 L 0.5 mol/L FeSO4溶液,加入石灰乳,调节pH为6.45,再用2.5 mol/L NaOH溶液调节pH到9,在搅拌速度为200 r/min,反应时间为90 min,反应温度为80 ℃,空气流量为1.2 L/min条件下,反应1.5 h后过滤,用去离子水将产物配制质量分数为5%矿浆,经磁选管分离磁性产物和非磁性产物,并分别过滤烘干。
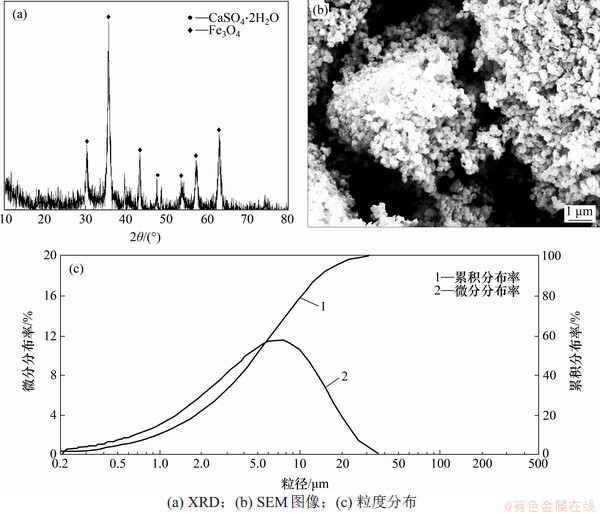
图12 放大实验四氧化三铁产物的XRD的图谱、SEM图像及粒度分布
Fig. 12 XRD pattern, SEM image and particle size distribution of Fe3O4 obtained in amplification experiment
放大实验所得磁性产物及石膏副产物干燥后质量分别为327.5 g和390.0 g。放大实验所得磁性产物及石膏副产物主要元素组成如表6所示。
表6 两段pH调控氧化法制备四氧化三铁放大实验结果(质量分数)
Table 6 Amplification experiment results of preparation of Fe3O4 by two-stage pH regulation and oxidation method (mass fraction) %

由表6可知:磁分离后磁性产物中主要元素Fe质量分数分别为64.25%,杂质Ca质量分数为3.50%;磁分离后石膏副产物中主要元素Ca和S质量分数分别为30.03%和21.40%,Fe质量分数仅为3.56%。磁性产物中铁的回收率为93.79%,每生产1 t磁性产物,产生石膏副产物1.19 t。放大实验所得磁性产物的XRD的图谱、SEM图像及粒径分布如图12所示。
由图12(a)可知:放大实验磁性产物中主要物相为Fe3O4,含有少量CaSO4·2H2O。由图12(b)可知四氧化三铁产物颗粒分布均匀,未见到明显石膏。由图12(c)可知四氧化三铁产物的粒径为0.2~40.0 μm,中位粒径D50为4.92 μm。
2.3.3 两段pH调控氧化法与一段pH调控氧化法制备四氧化三铁产物组成比较
石灰与氢氧化钠两段pH调控以及石灰一段pH调控氧化法所制备的四氧化三铁产物及石膏副产物主要元素组成如表7所示。
表7 两段pH调控与一段pH调控氧化法所制备的四氧化三铁产物及石膏副产物主要元素组成(质量分数)
Table 7 Major element compositions of Fe3O4 products and gypsum by-products prepared by oxidation methods with two-stage pH regulation and one-stage pH regulation (mass fraction) %

由表7可知:石灰与氢氧化钠两段pH调控以及石灰一段pH调控氧化法制备四氧化三铁过程产生的石膏副产物均含有砷,属于含砷石膏副产物;与石灰一段pH调控氧化法制备四氧化三铁产物相比,两段pH调控氧化法所制备的四氧化三铁产物中铁质量分数高11.76%。
石灰与氢氧化钠两段pH调控以及石灰一段pH调控氧化法制备所得四氧化三铁产物中铁回收率与石膏副产物产量如表8所示。
表8 两段pH调控与一段pH调控氧化法制备四氧化三铁时Fe3O4产物中铁的回收率及石膏副产物产量
Table 8 Iron recovery in Fe3O4 product and gypsum by-product yield when oxidation methods with two-stage pH regulation and one-stage pH regulation were used to prepare Fe3O4

由表8可知:两段pH调控氧化法所制备的四氧化三铁产物中铁的回收率为93.79%,每生产1 t四氧化三铁,产生的含砷石膏副产物产量为1.19 t;石灰一段pH调控氧化法制备四氧化三铁所得磁选产物中铁质量分数分别为85.55%,每生产1 t四氧化三铁,产生的含砷石膏副产物产量为2.04 t;与石灰一段pH调控氧化法制备四氧化三铁相比,采用两段pH调控氧化法制备四氧化三铁过程中,铁的回收率提高8.24%,含砷石膏副产物产量减少41.67%,显著减少了含砷石膏副产物的产量。
3 结论
1) 在反应温度为80 ℃,一段pH和反应时间分别为6.45和1.5 h,二段pH为9,初始Fe2+浓度为0.5 mol/L,搅拌速度为200 r/min,空气流量为1.2 L/min,二段反应时间为1.5 h以及磁分离过程中磁场强度为140 kA/m的最佳条件下,石灰与氢氧化钠两段pH调控氧化法制备四氧化三铁所得四氧化三铁中铁的品位为65.00%,铁的回收率为94.78%,四氧化三铁与石膏副产物质量比为1.0:1.2。
2) 在最佳条件下,氧化钙和氢氧化钠两段pH调控氧化法制备四氧化三铁放大实验制备的磁性产物中主要元素Fe质量分数为64.25%,杂质Ca质量分数为3.50%。磁分离后石膏副产物中主要元素Ca和S质量分数分别为30.03%和21.40%,Fe质量分数仅为3.56%。磁性产物主要物相为Fe3O4,含有少量CaSO4·2H2O。Fe3O4产物中铁的回收率为93.79%,每生产1 t磁性产物,产生石膏副产物1.19 t。
3) 与石灰一段pH调控氧化法制备四氧化三铁相比,氧化钙与氢氧化钠两段pH调控氧化法制备四氧化三铁过程中,Fe3O4产物中铁的质量分数提高11.76%,铁的回收率提高8.24%,含砷石膏副产物产量减少41.67%。
参考文献:
[1] 马芳源, 代淑娟, 刘淑杰. 中国难处理金矿石研究现状[J]. 黄金, 2017, 38(1): 64-67.
MA Fangyuan, DAI Shujuan, LIU Shujie. Current research status of refractory gold ores in China[J]. Gold, 2017, 38(1): 64-67.
[2] 贺秀珍, 钟清慎, 马玉天, 等. 复杂金精矿矿物特性及焙烧预处理工艺研究[J]. 有色金属(冶炼部分), 2014(8): 38-41.
HE Xiuzhen, ZHONG Qingshen, MA Yutian, et al. Study of mineral characteristics and roasting pretreatment technology of complex gold concentrate[J]. Nonferrous Metals (Extractive Metallurgy), 2014(8): 38-41.
[3] YANG Hongying, WANG Sihui, SONG Xiangling, et al. Gold occurrence of Jiaojia gold mine in Shandong Province[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(9): 2072-2077.
[4] WANG Guohua, XIE Jianping, LI Shoupeng, et al. Two-step oxidation of refractory gold concentrates with different microbial communities[J]. Journal of Microbiology and Biotechnology, 2016, 26(11): 1871-1880.
[5] DE MICHELIS I, OLIVIERI A, UBALDINI S, et al. Roasting and chlorine leaching of gold-bearing refractory concentrate: Experimental and process analysis[J]. International Journal of Mining Science and Technology, 2013, 23(5): 709-715.
[6] HAMMERSCHMIDT J, GUNTNER J, KERSTIENS B. Roasting of gold ore in the circulating fluidized-bed technology[J]. Developments in Mineral Processing, 2005, 15: 433-453.
[7] ZHANG Shuanghua, ZHENG Yajie, CAO Pan, et al. Process mineralogy characteristics of acid leaching residue produced in low-temperature roasting-acid leaching pretreatment process of refractory gold concentrates[J]. International Journal of Minerals, Metallurgy, and Materials, 2018, 25(10): 1132-1139.
[8] 杨永斌, 曾冠武, 李骞, 等. 高硫砷金矿焙砂的硫酸熟化法预处理[J]. 中国有色金属学报, 2014, 24(9): 2380-2386.
YANG Yongbin, ZENG Guanwu, LI Qian, et al. Pretreatment by sulfuric acid-curing of calcine roasting for gold ores with high sulfur and arsenic contents[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(9): 2380-2386.
[9] WANG Yongliang, HAN Peiwei, LU Yonggang, et al. Removal of arsenic and heavy metals from arseniccontaining acid wastewater with iron salt and lime[J]. Environmental Engineering and Management Journal, 2019, 18(12): 2655-2662.
[10] WANG Yongliang, XIAO Li, LIU Hongxiao, et al. Acid leaching pretreatment on two-stage roasting pyrite cinder for gold extraction and co-precipitation of arsenic with iron[J]. Hydrometallurgy, 2018, 179: 192-197.
[11] MBEDZI N, IBANA D, DYER L, et al. The effect of oxidant addition on ferrous iron removal from multi-element acidic sulphate solutions[C]// Proceedings of the 1st International Process Metallurgy Conference. Bandung, Indonesia: American Institute of Physics 1805, 2017: 030002-1-030002-8.
[12] KALIN M, FYSON A, WHEELER W N. The chemistry of conventional and alternative treatment systems for the neutralization of acid mine drainage[J]. Science of the Total Environment, 2006, 366(2/3): 395-408.
[13] 冯海军, 王冠宁, 王立宝, 等. 酸洗废液及污泥制备磁性氧化铁颜料的工艺[J]. 化工进展, 2019, 38(2): 1129-1133.
FENG Haijun, WANG Guanning, WANG Libao, et al. Process for preparing magnetic iron oxide pigment by pickling waste liquid and sludge[J]. Chemical Industry and Engineering Progress, 2019, 38(2): 1129-1133.
[14] LI Xiang, WANG Chuankai, ZENG Yu, et al. Bacteria-assisted preparation of nano α-Fe2O3 red pigment powders from waste ferrous sulfate[J]. Journal of Hazardous Materials, 2016, 317: 563-569.
[15] 彭春丽. 磁铁矿还原法制备绿矾及其母液回收新技术[D]. 长沙: 中南大学, 2004: 1-14.
PENG Chunli. Preparation of alum by magnetite reduction and new technology of mother liquor recovery[D]. Changsha: Changsha: Central South University, 2004: 1-14.
[16] AUER G, LAILACH G, MEISEN U, et al. Method for reprocessing waste acid to form gypsum and iron oxide: US6416723[P]. 2002-07-09.
[17] 杨喜云, 龚竹青, 彭长宏, 等. 空气氧化法制备Fe3O4的反应机理[J]. 中南大学学报(自然科学版), 2008, 39(3): 454-458.
YANG Xiyun, GONG Zhuqing, PENG Changhong, et al. Formation mechanism of magnetite prepared by air oxidation[J]. Journal of Central South University(Science and Technology), 2008, 39(3): 454-458.
[18] YU Wang, PENG Yinglin, ZHENG Yajie. Recovery of magnetite from FeSO4·7H2O waste slag by co-precipitation method with calcium hydroxide as precipitant[J]. Journal of Central South University, 2017, 24(1): 62-70.
[19] YU Wang, PENG Yinglin, ZHENG Yajie. Recovery of iron from waste ferrous sulphate by co-precipitation and magnetic separation[J]. Transactions of Nonferrous Metals Society of China, 2017, 27(1): 211-219.
[20] 姜小萍, 雷有栋. 共沉淀法制备四氧化三铁的工艺[J]. 广西民族大学学报(自然科学版), 2017, 23(2): 93-96.
JIANG Xiaoping, LEI Youdong. Ferroferric oxide coprecipitation preparation process are discussed[J]. Journal of Guangxi University for Nationalities(Natural Science Edition), 2017, 23(2): 93-96.
[21] 郑雅杰, 彭春丽, 肖忠良, 等. 机械活化硫铁矿还原Fe3+反应动力学[J]. 中南大学学报(自然科学版), 2004, 35(3): 376-380.
ZHENG Yajie, PENG Chunli, XIAO Zhongliang, et al. Kinetics of Fe3+ reduction by mechanical activated pyrite[J]. Journal of Central South University(Science and Technology), 2004, 35(3): 376-380.
[22] 许佩华, 刘波潮, 刘雨文, 等. 空气氧化Fe2+动力学及含铁污水处理技术研究[J]. 化学研究, 2019, 30(1): 76-84.
XU Peihua, LIU Bochao, LIU Yuwen, et al. Study on Fe2+ kinetics of air oxidation and treatment of sewage containing iron[J]. Chemical Research, 2019, 30(1): 76-84.
[23] 周宏民, 刘跃进, 熊双喜. 钛白副产硫酸亚铁制备氧化铁黑的研究[J]. 湘潭大学自然科学学报, 2001, 23(2): 65-69.
ZHOU Hongmin, LIU Yuejin, XIONG Shuangxi. The preparation of pigment of iron black oxide from the byproduct of titanium Dioxide FeSO4·H2O[J]. Natural Science Journal of Xiangtan University, 2001, 23(2): 65-69.
(编辑 陈灿华)
收稿日期: 2020 -09 -12; 修回日期: 2020 -12 -25
基金项目(Foundation item):新疆维吾尔族自治区高新技术研究发展计划项目(201515108);新疆维吾尔族自治区战略性新兴产业专项资金资助项目(201552) (Project(201515108) supported by Program of High Technology Research and Development Xinjiang Uygur Autonomous Region; Project(201552) supported by the Fund of Strategic Emerging Industries of Xinjiang Uygur Autonomous Region)
通信作者:郑雅杰,博士,教授,从事有色金属冶金和污染控制等研究;E-mail: zyj@csu.edu.cn
引用格式: 张霜华, 郑雅杰, 曹攀, 等. 金焙砂酸浸液两段pH调控氧化法制备四氧化三铁新工艺[J]. 中南大学学报(自然科学版), 2021, 52(5): 1407-1417.
Citation: ZHANG Shuanghua, ZHENG Yajie, CAO Pan, et al. Novel oxidation process with two-stage pH regulation for preparation of Fe3O4 from acid leaching solution of gold calcine[J]. Journal of Central South University(Science and Technology), 2021, 52(5): 1407-1417.
摘要:以金焙砂酸浸液为原料,通过单因素实验对CaO与NaOH两段pH调控氧化法制备Fe3O4新工艺进行研究,并在此基础上进行放大实验,对两段pH调控氧化法与石灰一段pH调控氧化法制备Fe3O4工艺进行对比分析。研究结果表明:在反应温度为80 ℃,一段pH为6.45,反应时间为1.5 h,二段pH为9,初始Fe2+浓度为0.5 mol/L、搅拌速度为200 r/min、空气流量为1.2 L/min、反应时间为1.5 h和磁场强度为140 kA/m的最佳条件下,两段pH调控氧化法制备的Fe3O4产物中铁质量分数为65.00%,铁回收率为94.78%,Fe3O4产物与石膏副产物质量比为1.0:1.2;两段pH调控氧化法制备所得Fe3O4产物中铁质量分数为64.25%,铁回收率为93.78%;与石灰一段pH调控氧化法制备Fe3O4相比,铁质量分数提高11.76%,铁回收率提高8.24%,含砷石膏副产物产量降低41.67%。
[1] 马芳源, 代淑娟, 刘淑杰. 中国难处理金矿石研究现状[J]. 黄金, 2017, 38(1): 64-67.
[2] 贺秀珍, 钟清慎, 马玉天, 等. 复杂金精矿矿物特性及焙烧预处理工艺研究[J]. 有色金属(冶炼部分), 2014(8): 38-41.
[8] 杨永斌, 曾冠武, 李骞, 等. 高硫砷金矿焙砂的硫酸熟化法预处理[J]. 中国有色金属学报, 2014, 24(9): 2380-2386.
[13] 冯海军, 王冠宁, 王立宝, 等. 酸洗废液及污泥制备磁性氧化铁颜料的工艺[J]. 化工进展, 2019, 38(2): 1129-1133.
[15] 彭春丽. 磁铁矿还原法制备绿矾及其母液回收新技术[D]. 长沙: 中南大学, 2004: 1-14.
[17] 杨喜云, 龚竹青, 彭长宏, 等. 空气氧化法制备Fe3O4的反应机理[J]. 中南大学学报(自然科学版), 2008, 39(3): 454-458.
[20] 姜小萍, 雷有栋. 共沉淀法制备四氧化三铁的工艺[J]. 广西民族大学学报(自然科学版), 2017, 23(2): 93-96.
[21] 郑雅杰, 彭春丽, 肖忠良, 等. 机械活化硫铁矿还原Fe3+反应动力学[J]. 中南大学学报(自然科学版), 2004, 35(3): 376-380.
[22] 许佩华, 刘波潮, 刘雨文, 等. 空气氧化Fe2+动力学及含铁污水处理技术研究[J]. 化学研究, 2019, 30(1): 76-84.
[23] 周宏民, 刘跃进, 熊双喜. 钛白副产硫酸亚铁制备氧化铁黑的研究[J]. 湘潭大学自然科学学报, 2001, 23(2): 65-69.


