网络首发时间: 2019-09-23 15:53
硫代硫酸盐-EDTA-铜离子浸金体系电化学研究
云南开放大学化学工程学院
云南国防工业职业技术学院
昆明理工大学国土资源工程学院
摘 要:
硫代硫酸盐-乙二胺四乙酸(EDTA)-铜离子浸金体系采用乙二胺四乙酸(EDTA)代替氨水作为铜的络合剂,所得到的络合物具有稳定性好,电极电势较低等优点,从理论上可以作为金的浸出液用于金的提取。本文采用Tafel曲线,开路电势,循环伏安这3种方法探究了硫代硫酸盐对金的腐蚀的影响,考查了铜离子浓度对硫代硫酸盐电化学行为影响以及硫代硫酸盐循环伏安行为,结果表明:硫代硫酸盐浓度的增加使金的腐蚀更加容易,超过0.10 mol·L-1后,由于硫代硫酸盐浓度的增加,其在金电极表面的产物导致电极的钝化,从而导致金的腐蚀变得困难;随着铜离子浓度的增加,硫代硫酸盐还原电位负移,峰电流增加,说明在该条件下,硫代硫酸盐更加容易被消耗;循环伏安表明峰电流与扫描速度平方根成直线关系,属于扩散控制,这个过程中,硫代硫酸盐还原电子转移数约为1,硫代硫酸盐循环伏安行为表明lnIp与1/T呈良好的线性关系,其活化能Ea=5.498 kJ·moL-1,说明为浓差极化所致。
关键词:
硫代硫酸盐;乙二胺四乙酸(EDTA);Tafel曲线;开路电势;循环伏安;
中图分类号: TF831
作者简介:项朋志(1978-),男,湖北黄冈人,副教授,研究方向:工业分析教学和研究,E-mail:xpzynkd@163.com;*叶国华,副教授;电话:15925163112;E-mail:ghye581@163.com;
收稿日期:2018-09-18
基金:国家自然科学基金项目(51304090,51764024,51604130);云南教育厅科学研究基金项目(2018js377)资助;
Electrochemical Study of Thiosulfate-EDTA-Copper Ion Leaching Gold System
Xiang Pengzhi Ye Guohua
School of Chemical Engineering,Yunnan Open University
Yunnan Vocational College of National-Defense Technology
College of Land and Resources Engineering,Kunming University of Science and Technology
Abstract:
Disodium ethylenediamine tetraacetate(EDTA) was used as copper complex agent instead of ammonia in the thiosulfate-EDTA-copper ion system. The obtained complex had the advantages of good stability and low electrode potential. It could be used as gold leaching solution for gold extraction. The Tafel curves, the open circuit potential, cyclic voltammograms were used to explore the thiosulfate influence on the corrosion of gold, examine the cyclic voltammetric behavior. The results showed that the increase in concentration of thiosulfate could lead to easy corrosion for gold when its concentration was more than 0.1 mol·L-1, the increase of the concentration of thiosulfate could lead to the corrosion of gold difficult due to the passivation on the gold electrode surface; with the increase of copper concentration, thiosulfate reduction potential was negatively shifted and peak current increased, indicating that thiosulfate was more easily consumed under the condition. The cyclic voltammetry showed a linear relationship between peak current and square root of scanning speed, which was diffusion control. During this process, the reduction electron transfer number of thiosulfate was about 1. The cyclic voltammetry of thiosulfate also showed a good linear relationship between lnIp and 1/T, and its activation energy was Ea=5.498 kJ·mol-1, indicating that it was caused by concentration difference polarization.
Keyword:
thiosulfate; disodium ethylenediamine tetraacetate(EDTA); Tafel curve; open circuit potential; cyclic voltammetry;
Received: 2018-09-18
非氰化提金方法有很多
4Au+8S2O
在实际工艺中, 硫代硫酸盐铜氨浸金体系研究相对较多, 研究者多采用铜氨硫代硫酸盐体系
EDTA化学名称为乙二胺四乙酸, 微溶于水, 并不适合作络合剂, 通常用作络合剂的是乙二胺四乙酸二钠(也简称为EDTA)。 EDTA是一种良好的配合剂, 它有六个配位原子, 其与稀土元素和过渡金属等形成稳定的水溶性络合物。 EDTA与铜离子可以形成配位比为1∶1的络合物Cu(EDTA)2+, 其络合稳定常数大于四氨合铜离子的稳定常数, 其标准电极电势为0.13 V。 童雄等
1 实 验
1.1 试 剂
实验采用硫代硫酸盐、 五水硫酸铜、 氢氧化钠、 EDTA等试剂均为分析纯(国药集团化学试剂有限公司), 实验用水为二次蒸馏水。
1.2 浸出体系
浸出体系由不同浓度的硫代硫酸钠、 EDTA、 铜离子组成。
1.3 电化学分析
电化学分析采用CHI630E电化学工作站(上海辰华仪器有限公司); 三电极体系: 金电极为工作电极(纯金片99.99%, 贵研铂业, 测量面积为1.0 cm2); 铂丝为对电极; Ag/AgCl为参比电极。 分析前工作电极先用金相砂纸打磨成光亮, 之后用王水浸泡, 二次蒸馏水洗涤后待用。 分析方法采用Tafel曲线, 开路电势, 循环伏安方法。 其中循环伏安起始时从正向负扫描。
2 结果与讨论
2.1 不同硫代硫酸盐浓度下Tafel曲线
在浓度为0.08~0.16 mol·L-1这个范围内考查硫代硫酸盐对金的腐蚀影响, 从图1可以看出, 随着硫代硫酸盐浓度的增加, 金的腐蚀电位先负移, 随后正移, 腐蚀电位在其浓度为0.10 mol·L-1时最负, 腐蚀电流在浓度为0.08 mol·L-1最大, 其余浓度对应的腐蚀电流变化并不大。 这表明硫代硫酸盐浓度对金的腐蚀影响较大, 在一定的浓度范围内, 随着硫代硫酸盐浓度的增加, 金的腐蚀更加容易。 但超过0.10 mol·L-1后, 其在金电极表面的产物导致电极产生钝化, 从而导致金的腐蚀变得困难, 因此在实际金的浸出时硫代硫酸盐浓度的选择和控制是有必要的, 硫代硫酸盐浓度过大不但消耗过多的试剂, 增加了浸出成本, 而且可能会导致了金的浸出困难。
2.2 不同浓度硫代硫酸盐浓度下开路电势
为了进一步探究在稍低浓度的硫代硫酸盐对金的溶出的影响, 考查了金电极在不同浓度硫代硫酸盐浓度下开路电势, 结果如图2所示, 在浓度为0.02~0.10 mol·L-1这个范围内, 随着硫代硫酸盐浓度的增加, 金电极在硫代硫酸盐-EDTA-铜离子浸金体系起始开路电势和稳定开路电势均负移, 稳定的时间也大大缩短
图1 不同硫代硫酸盐浓度下金腐蚀Tafel曲线
Fig.1 Tafel curves of gold corroded at different thiosulfate-concentrations
(电极:金电极,铜的浓度:0.002 mol·L-1,EDTA的浓度:0.004 mol·L-1)
(electrode:gold electrode,copper concentration:0.002 mol·L-1,EDTA concentration:0.004mol·L-1)
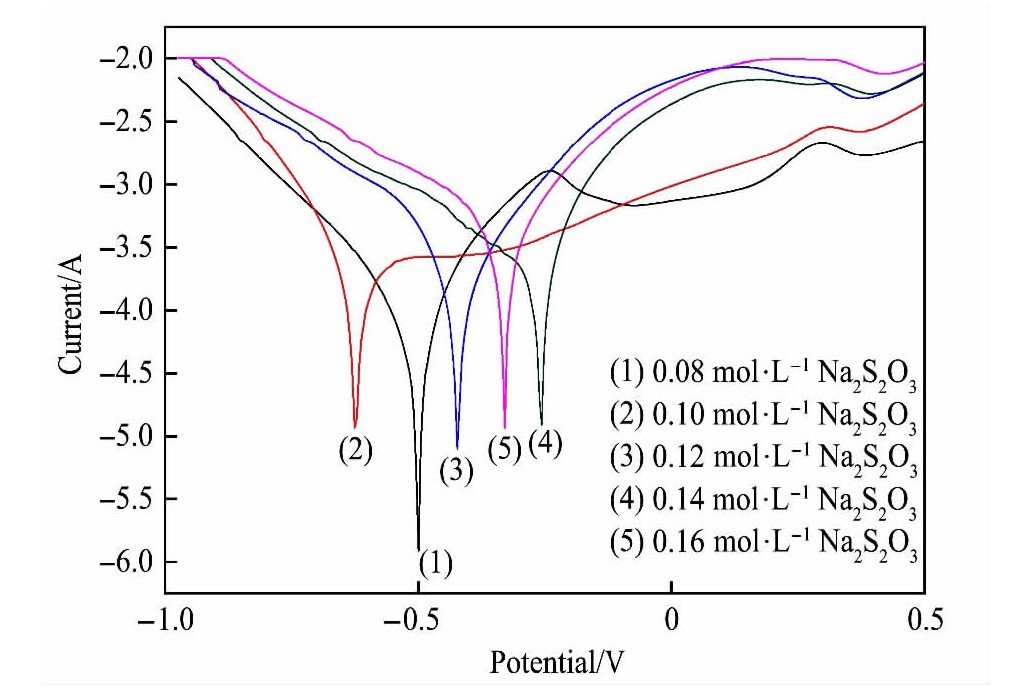
2.3 铜离子对硫代硫酸盐电化学行为影响
改变浸金体系中铜离子浓度来考查其对硫代硫酸盐影响, 其结果见图3和4, 随着铜离子浓度的增加, 硫代硫酸盐还原电位负移, 峰电流增加, 硫代硫酸盐还原电位负移表明在该体系中硫代硫酸盐在金电极上还原愈来愈难, 原因可能是铜离子浓度的增加促进了硫代硫酸盐的氧化, 所以硫代硫酸盐还原峰增加了, 由于硫代硫酸盐浓度的减少, 导致了其还原电位负移, 综合以上情况说明在实际浸出时, 铜离子的浓度选择是至关重要的, 本文铜离子浓度均选取0.002 mol·L-1, 在满足对铜离子摩尔比1∶1的基础上, 还需要控制EDTA用量。 其浓度也并非越大越好, 原因是其浓度改变, 必然会进一步影响Cu(EDTA)2+的电极电势, 从而影响了金的浸出效率。 在实际工艺中, EDTA的最佳浓度应以实验为准。
2.4 硫代硫酸盐循环伏安曲线
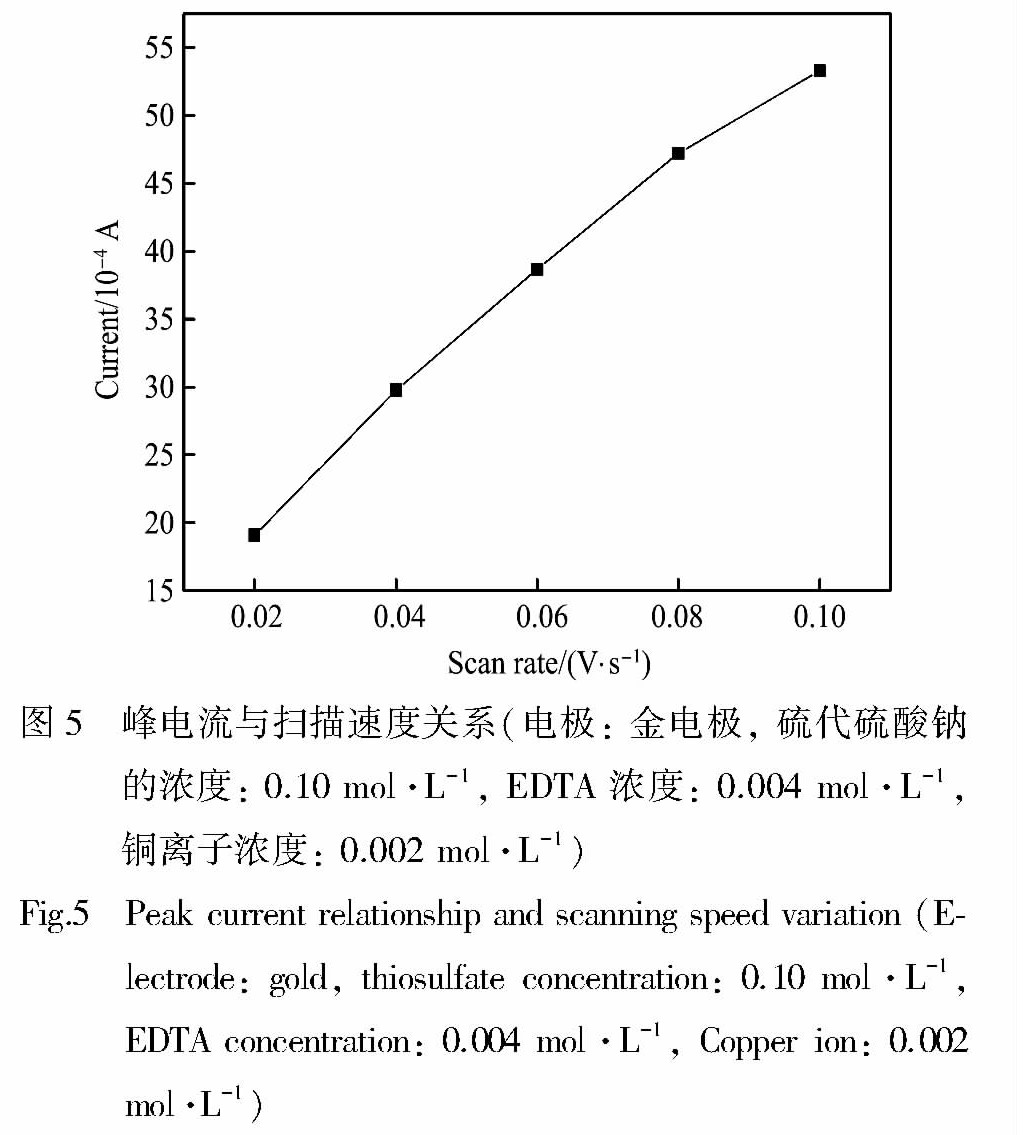
采用金电极, 考查了硫代硫酸盐-EDTA-铜离子浸金体系硫代硫酸盐循环伏安曲线, 该体系具体条件如下: 硫代硫酸钠的浓度: 0.10 mol·L-1, EDTA浓度: 0.004 mol·L-1, 铜离子: 0.002 mol·L-1, 从图3可以看出硫代硫酸盐还原峰非常典型, 硫代硫酸盐中硫元素的化合价为+2价, 处在中间价态, 既可以升高也可以降低, 即可以表现氧化性也可以表现还原性。 在该体系中无论是采用金电极还是铂电极作为工作电极, 硫代硫酸盐阴极过程所产生的特征峰都较为典型, 本文以还原峰作为目标峰, 考察了扫速对峰电流和峰电位的影响。 一般说来, 峰电流与扫描速度平方根成直线关系的是受扩散控制, 峰电流与扫描速度成直线关系的是受吸附控制, 从图5可以发现峰电流与扫描速度成直线关系, 这说明硫代硫酸盐在金表面为吸附控制
图2 不同浓度硫代硫酸盐浓度下开路电势与时间的关系
Fig.2 Open circuit potential time curves of gold electrode with thiosulfate concentrations
(电极:金电极,铜离子浓度:0.002 mol·L-1,ED-TA浓度:0.004 mol·L-1)
(Electrode:gold electrode,Copper concentration:0.002 mol·L-1,EDTA concentration:0.004 mol·L-1)
Ep=-0.04031+0.05187lnv0.5 (R=0.9616) (2)
根据方程E=K-(RTlnv0.5)/anF
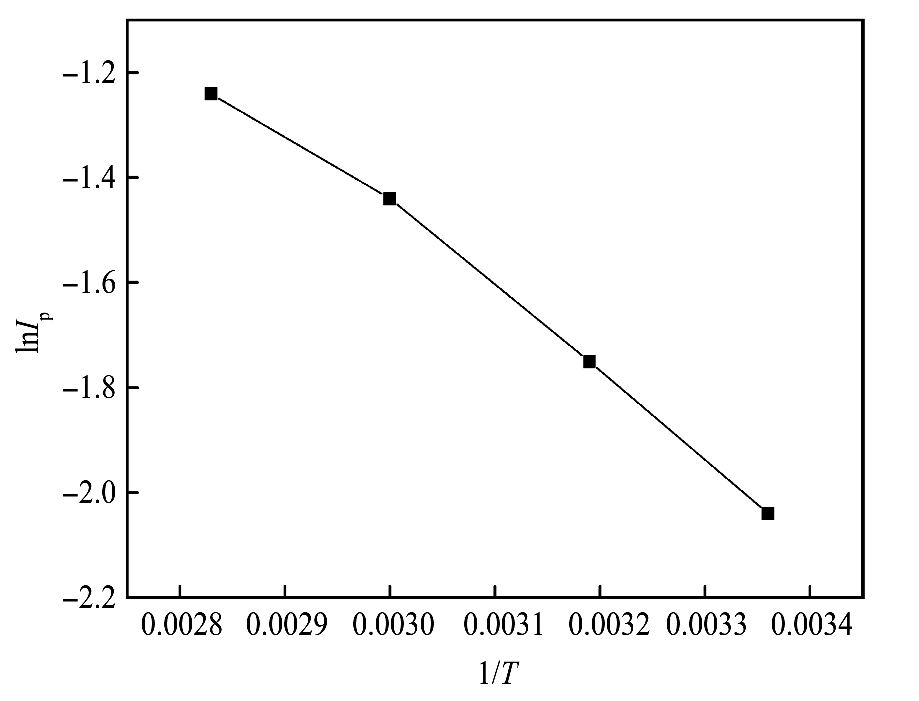
2.5 硫代硫酸盐峰电流与温度的关系
为更深入了解硫代硫酸盐在金电极的反应机制备, 采用金电极并利用循环伏安法考查了不同温度下硫代硫酸盐峰电流的变化, 并对lnIp与1/T进行拟合, 结果见图7。 从图7可以看出lnIp与1/T呈良好的线性关系。 根据Randles-sevcik方程
Ip=0.4463(nF)3/2AC0D1/2(RT)-1/2v1/2 (3)
可以求得扩散系数D, 式中A为工作电极表面积(cm2), C0为电活性物质本体的浓度(mol·ml-1), D为扩散系数(cm2), 又根据方程(4):
D=D0exp(-Ea/RT) (4)
式中, Ea为扩散活化能, D0为指前因子, R为气体常数, 把(4)式代入到(3)式得方程(5):
Ip=0.4463(nF)3/2AC0[D0exp(-Ea/RT)]1/2(RT)-1/2v1/2 (5)
从(5)式可以看出在条件一定时lnIp与1/T呈线性关系。 根据图7所拟合的线性回归方程求得活化能, 图中斜率为-403.8(R=0.9908), 通过计算得Ea=5.498 kJ·mol-1, 硫代硫酸盐在金电极为浓差极化
图7 lnIp与1/T关系
Fig.7 Relationship between lnIp and 1/T
(电极:金电极,硫代硫酸钠的浓度:0.1 mol·L-1,EDTA浓度:0.004 mol·L-1,铜离子浓度:0.002 mol·L-1,扫描速度:50 m V·s-1)
(Electrode:gold electrode,thiosulfate concentration:0.10 mol·L-1,EDTA concentration:0.004 mol·L-1,Copper ion:0.002 mol·L-1,Scan rate:50 m V·s-1)
3 结 论
1. 通过Tafel曲线和开路电势表明随着硫代硫酸盐浓度的增加, 金的腐蚀更加容易, 超过0.10 mol·L-1后, 由于硫代硫酸盐浓度的增加, 其在金电极表面的产物导致电极钝化, 从而导致金的腐蚀变得困难; 随着铜离子浓度的增加, 硫代硫酸盐还原电位负移, 峰电流增加, 硫代硫酸盐还原电位负移表明在该体系中硫代硫酸盐在金电极上还原愈来愈难。
2. 循环伏安表明峰电流与扫描速度平方根成直线关系, 属于扩散控制, 在这个过程中, 硫代硫酸盐还原电子转移数约为1。
3. 硫代硫酸盐循环伏安行为表明lnIp与1/T呈良好的线性关系, 其活化能Ea=5.498 kJ·mol-1, 说明为浓差极化所致。
4. 从电化学角度探讨了硫代硫酸盐浓度对金的腐蚀影响、 铜离子浓度对硫代硫酸盐电化学行为影响。 而对于实际金矿石浸出, 各物料的最适宜的浓度应以试验为准。
参考文献