萃取法处理低镍钴浸出液的工艺研究
北京有色金属研究总院生物冶金国家工程实验室
摘 要:
针对目前生物浸出液中铁含量高而有价金属浓度低的情况,并且在低温低pH值条件下对铁与镍、钴进行分离。选取N235+TBP为萃取剂,采用煤油作为稀释剂,考察了单级萃取硫酸盐溶液体系中铁与镍、钴离子的分离情况及影响因素,并在此基础上进行了3级错流萃取的实验研究,同时研究了负载有机相反萃的条件。结果表明:N235-TBP体系萃铁的速率很快,料液初始pH和相比(O/A)对铁的萃取率影响很大而对镍钴萃取影响较小,对于含铁10 g.L-1、镍2.23 g.L-1、钴1.3 g.L-1的合成料液,当有机相为35%N235-10%TBP-磺化煤油,相比(O/A)为1∶1.5,料液初始pH为1.1,接触时间为4 min时,铁的萃取率为90%,镍的损失率为2.8%,钴的损失率为3.3%,铁、镍的分离系数(βFe/Ni)达到312,铁、钴的分离系数(βFe/Co)达到265;经过3级错流萃取后的硫酸盐溶液体系中萃余液含铁低于0.02 g.L-1,铁的总萃取率接近99.8%,镍的损失率为4.4%,钴的损失率为5.7%,铁与镍钴基本完全分离;以0.5 mol.L-1的H2SO4为反萃剂,铁的单级反萃率大于95%;含铁9.58 g.L-1的有机相在相比为1∶1时,经过2级错流反萃,铁基本上被反萃完全。
关键词:
中图分类号: TF804.2
作者简介:王福兴(1983-),男,黑龙江黑河人,硕士;研究方向:生物冶金;黄松涛(E-mail:hst@mail.grinm.com.cn);
收稿日期:2010-11-15
基金:国家“863”计划项目(2007AA060903);国家“973”计划项目(2010CB630906)资助;
Extraction of Leaching Solution with Low Ni and Co Content
Abstract:
For treating the bio-leachate solution with high concentration of Fe and low concentration of valuable metals,Fe was separated from Ni and Co at low temperature and low pH.N235+TBP and kerosene were selected as extraction agent and diluent respectively.The factors that affect separation of Fe from Ni and Co in extraction solvent system consisting of sulphate were investigated.Based on the experimental results,a three-stage cross-flow extraction was carried out.Meanwhile,the conditional factors of the reextraction of loaded organic phase were studied.The results demonstrated that the rate of Fe extraction by N235-TBP system was fast.Initial pH and Vorg∶ Vaq had great effect on Fe extraction but had limited effect on Ni and Co extraction.For composite liquid containing Fe 10 g · L-1,Ni 2.23 g · L-1,Co 1.3 g · L-1,at Vorg∶ Vaq of 1∶ 1.5 and initial pH of 1.1,the extraction ratio of 90% for iron was achieved after one-stage extraction at a reaction temperature of 30 ℃ for 4 min reaction time with 35% extraction agent concentration.The loss ratio of Ni and Co was 2.8% and 3.3%,respectively.The separation coefficient between Fe and Ni(βFe/Ni) reached 312 and that between Fe and Co(βFe/Co) reached 265.After three-stage cross-flow extraction,Fe concentration in the raffinate of sulphate liquid system was lower than 0.02 g · L-1,and general Fe extraction ratio approached 99.8%.The loss ratio of Ni and Co was 4.4% and 5.7%,respectively.Fe was essentially separated from nickel and cobalt.Above 95% of stripping ratio could be obtained with 0.5 mol · L-1 of H2SO4 as the stripping agent.At Vorg∶ Vaq of 1∶ 1,iron in loaded organic phase containing 9.58 g · L-1 iron could be easily and completely stripped after a two-stage cross-flow stripping.
Keyword:
extractive separation;iron(Ⅲ) removal;nickel and cobalt;tertiary amine;tributyl phosphate;
Received: 2010-11-15
铁是自然界中最常见的元素之一 , 在有色金属冶金及无机化工领域中, 铁作为常见杂质而存在。 如何控制铁、 分离铁及利用铁是一个很普遍的难题
酸性磷酸酯是萃取除铁的常用试剂, 具有代表性的有P204, P507, P538 和Cyanex272等。 这类萃取剂对Fe(III)的萃取极为有效, 但最大的缺点是载铁有机相的反萃十分困难, 特别是在高酸度下萃取铁时, 有机相即使用5~6 mol·L-1的硫酸反萃, 效果也不是很理想
羧酸类萃取剂在冶金分离过程中应用较早。 羧酸的酸性一般较烷基磷酸弱, 在适当pH范围内, 能够以二聚体形式按照阳离子交换历程萃取Fe(III)。
胺类对铁的萃取能力和选择性随胺的结构不同而有很大的差别, 一些学者对胺类的萃铁机制作了广泛的研究
1 实 验
1.1 仪器及试剂
实验所用的主要仪器包括PHSJ-3F数显型酸度计(上海楚柏实验室设备有限公司); 220 V~1000 W电子外用炉(北京中兴伟业仪器有限公司), 125 ml分液漏斗。
实验用萃取剂N235(叔胺7301)为工业试剂, 平均分子量353, 经过蒸馏提纯后纯度≥98%; 改性剂磷酸三丁酯(TBP)为分析纯试剂; 稀释剂磺化煤油为工业试剂, 硫酸铁, 硫酸镍, 硫酸钴为分析纯试剂。
1.2 实验方法
1.2.1 合成料液的配制 合成料液系用硫酸铁、 硫酸镍、 硫酸钴及去离子水配制而成, 其中铁、 镍、 钴的浓度分别为10, 2.23和1.30 g·L-1, 其成分按照某生物浸出液中铁、 镍、 钴含量配制。
1.2.2 萃取及反萃有机相的配制 萃取实验有机相的基本组成为35%N235, 10%TBP和55%磺化煤油(体积比)。 反萃剂为0.5 mol·L-1的硫酸。
1.2.3 实验步骤 所有实验均在恒定温度下进行。 按照一定相比将有机相和待萃水相置于分液漏斗中, 用浓硫酸或氢氧化钠调节水相的初始pH值, 充分振荡5 min; 静置分相直至相界面清晰且有机相澄清后, 取萃余液, 用PHSJ-3F型酸度计测定平衡pH值, 用重铬酸钾容量法分析铁的含量, 用分光光度计分析镍、 钴含量, 通过差减法分别计算有机相中的铁、 镍、 钴的含量。 反萃实验的操作步骤同上。
计算公式:
萃取率=(原液金属离子浓度-萃余液金属离子浓度)/原液金属离子浓度×100%
分配比D=(∑A)o/(∑A)a (下脚a, o分别代表水相及有机相)
分离系数βA/B=DA/DB=(∑A)o(∑B)a/(∑A)a (∑B)o(下脚a, o分别代表水相及有机相)。
2 结果与讨论
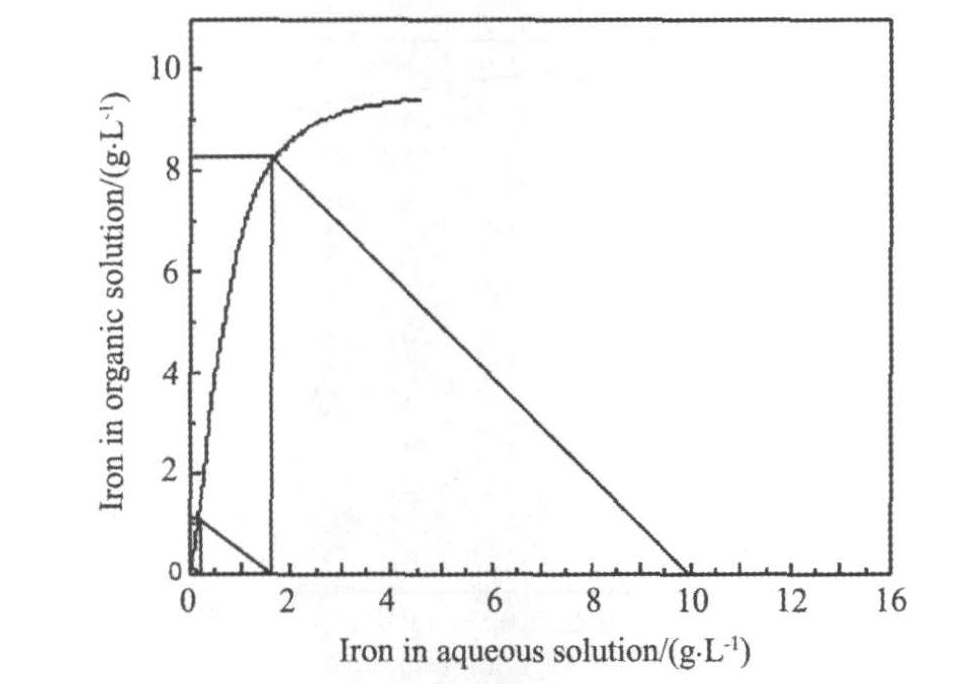
2.1 铁的萃取等温线
为了探讨硫酸盐体系中铁与镍钴的萃取分离, 首先研究一下单铁离子在硫酸介质中存在状态和萃取行为, 硫酸介质中Fe(III)的存在状态通常是比较复杂的, 存在水解、 络合、 聚合等多种反应, 溶液中的离子种类以及相互关系与溶液的酸度和Fe(III)本身的浓度有关。 N235-TBP混合体系从硫酸盐溶液中协同萃取Fe(III)的机制是, Fe(III)在水解、 络合、 聚合等过程的共同作用下生成了复杂的萃合物, 萃取平衡可表示为
Fe3++SO
在室温下, 配置一系列不同浓度的硫酸铁溶液均将pH调整为1.1, 以固定相比(o/a)1∶1.5分别进行萃取。
图1所示为系列浓度法测定的萃铁等温线, 用35%N235+10%TBP煤油做稀释剂萃取除铁, 可将原液中初始浓度含铁为10 g·L-1, 经过3级错流萃取可降低至0.02 g·L-1, 并且由图1可以看出原液含铁浓度较低条件下萃取, 铁在有机相和水相中分配比D(萃取平衡时有机相中铁离子浓度/水相中铁离子浓度)急剧增大, 这是由于有机相载铁负荷远没有达到饱和状态, 而当有机相中铁离子浓度达到9.5 g·L-1时, 萃铁等温线基本平衡, 即有机相载铁负荷基本达到饱和, 实验测得萃取剂载铁饱和容量为9.58 g·L-1。
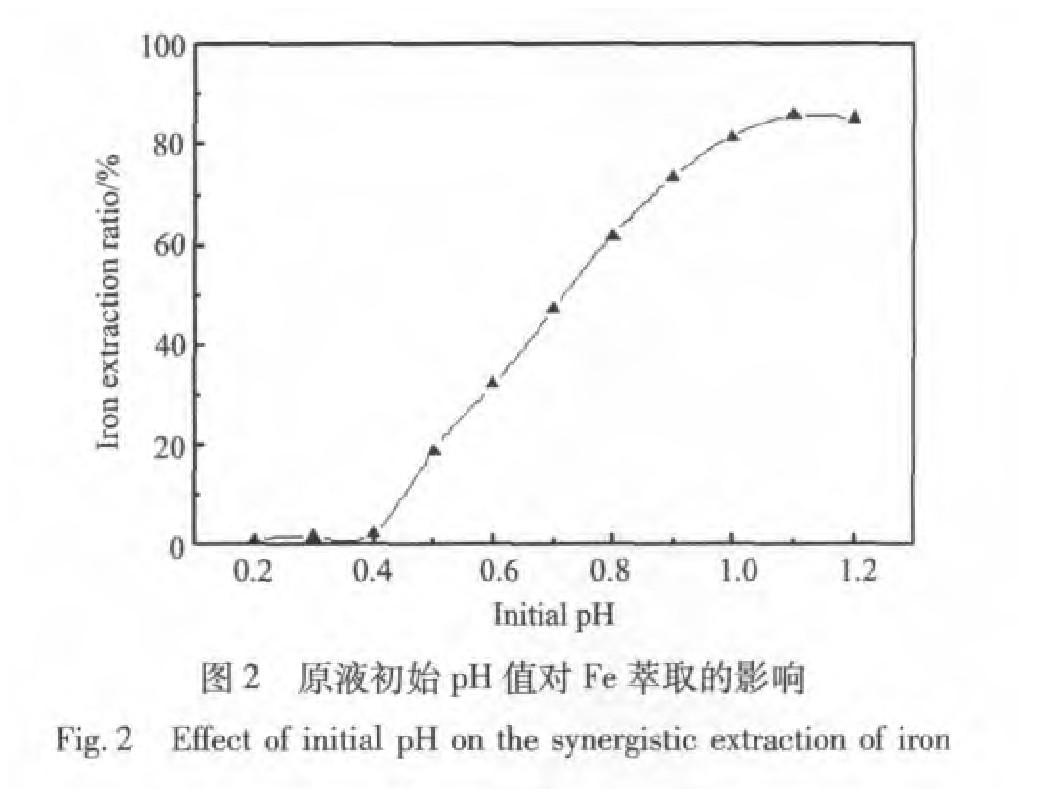
2.2 原液初始pH对萃取的影响
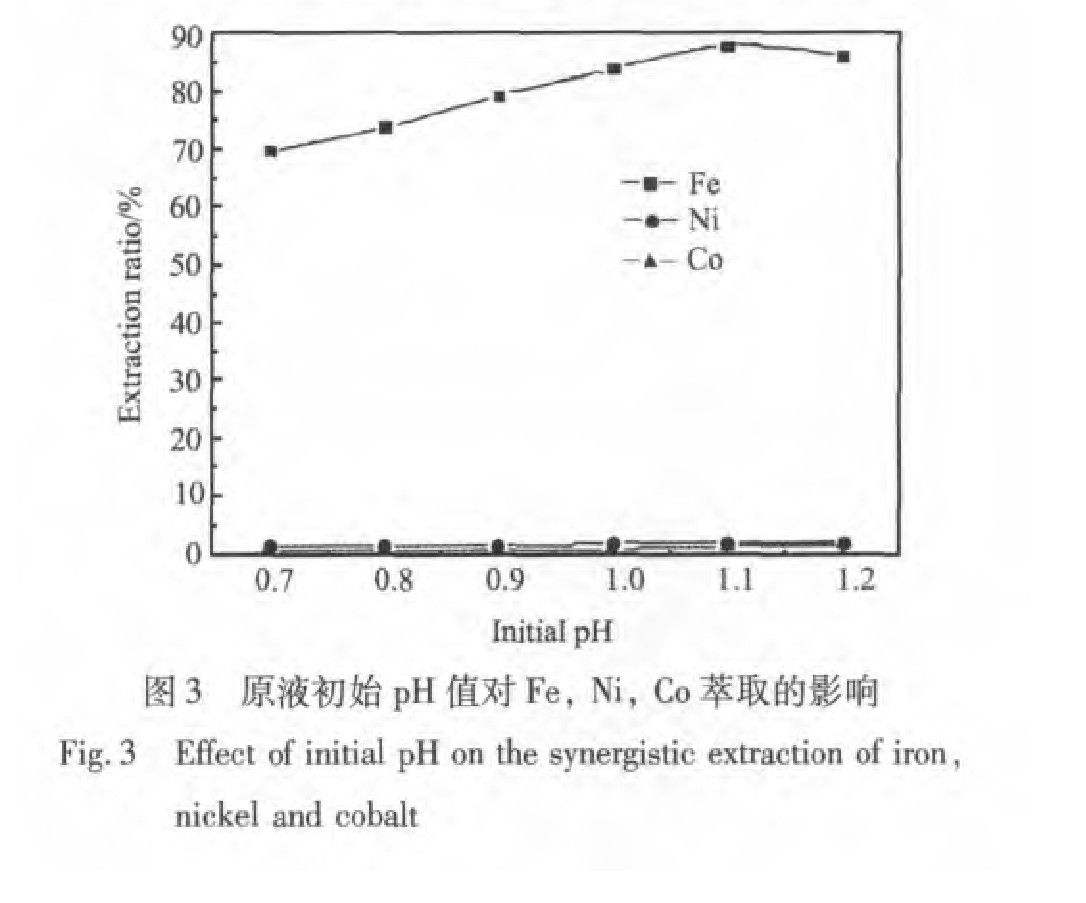
由图2可以看出铁在高酸度条件下萃取率很低, 而当原液pH大于0.4时铁的萃取率随pH升高而增大, 但是当pH大于1.1时铁的萃取率略有下降, 也就是说在其他条件不变的情况下, 当pH值为1.1时铁的萃取率达到最大值, 一般认为, 萃铁曲线的最高点是由于不同酸度下有机相中自由胺分子、 胺的硫酸盐及酸式硫酸盐的比例不同引起的
由图3可以看出镍、 钴萃取率随pH升高而变化不大基本保持不变。 所以pH在1~1.1之间为宜, 既提高了铁的萃取率又减少了镍、 钴的损失, 在以下的实验中以pH为1.1为最佳的分离条件。
图1 35%N235铁萃取平衡等温线
Fig.1 35%N235 extraction isotherm of iron
2.3 接触时间对铁、 镍、 钴萃取分离的影响
将有机相和待萃水相按照1∶1.5的相比置于分液漏斗中, 调节溶液初始pH值至1.1, 振荡一定时间后, 分别测定Fe(III), Ni(II), Co(II)的萃取率。
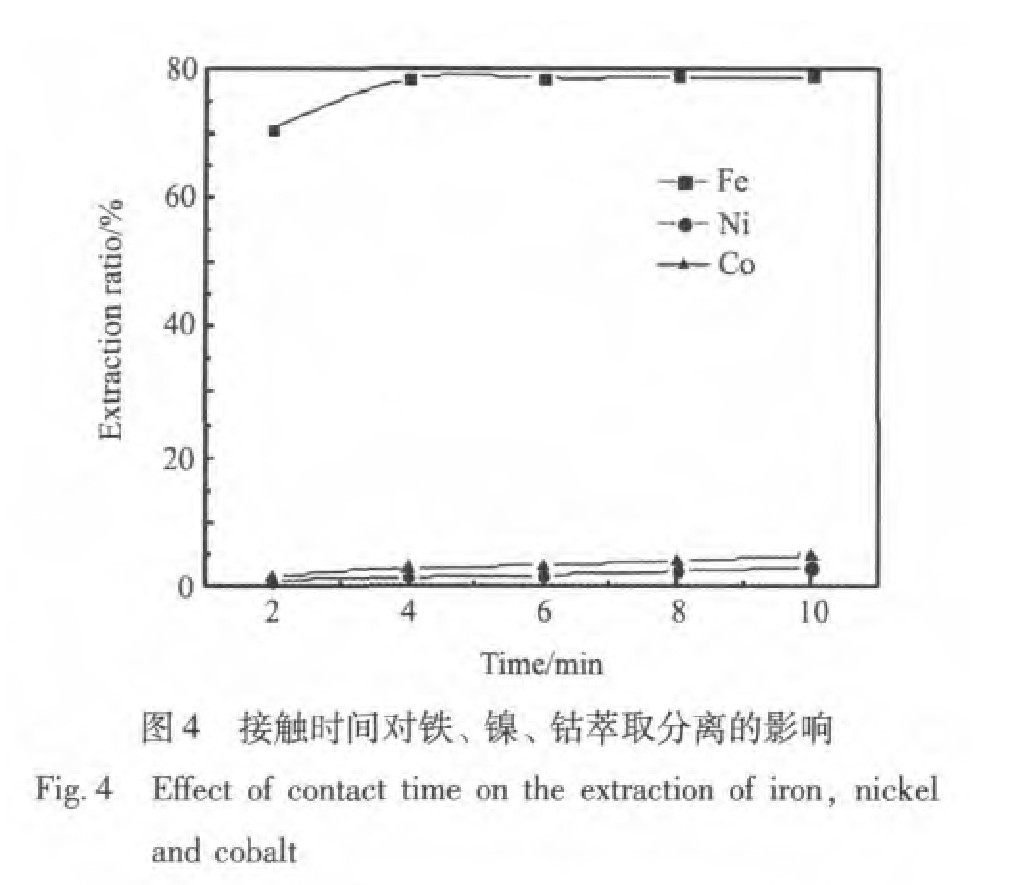
由图4可以看出N235-TBP体系萃铁的速率很快, 4 min内基本上萃铁达到平衡。 随着接触时间的延长, 铁的萃取率基本不变, 而镍、 钴的萃取率增加这是因为N235-TBP体系萃取镍、 钴的平衡时间较长, 所以为了减少镍、 钴的损失量接触时间不宜太长; 但如果接触时间过短萃铁反应尚未达到平衡会影响铁的萃取率, 所以接触时间以3~4 min为宜。
2.4 萃取剂浓度铁、 镍、 钴萃取分离的影响
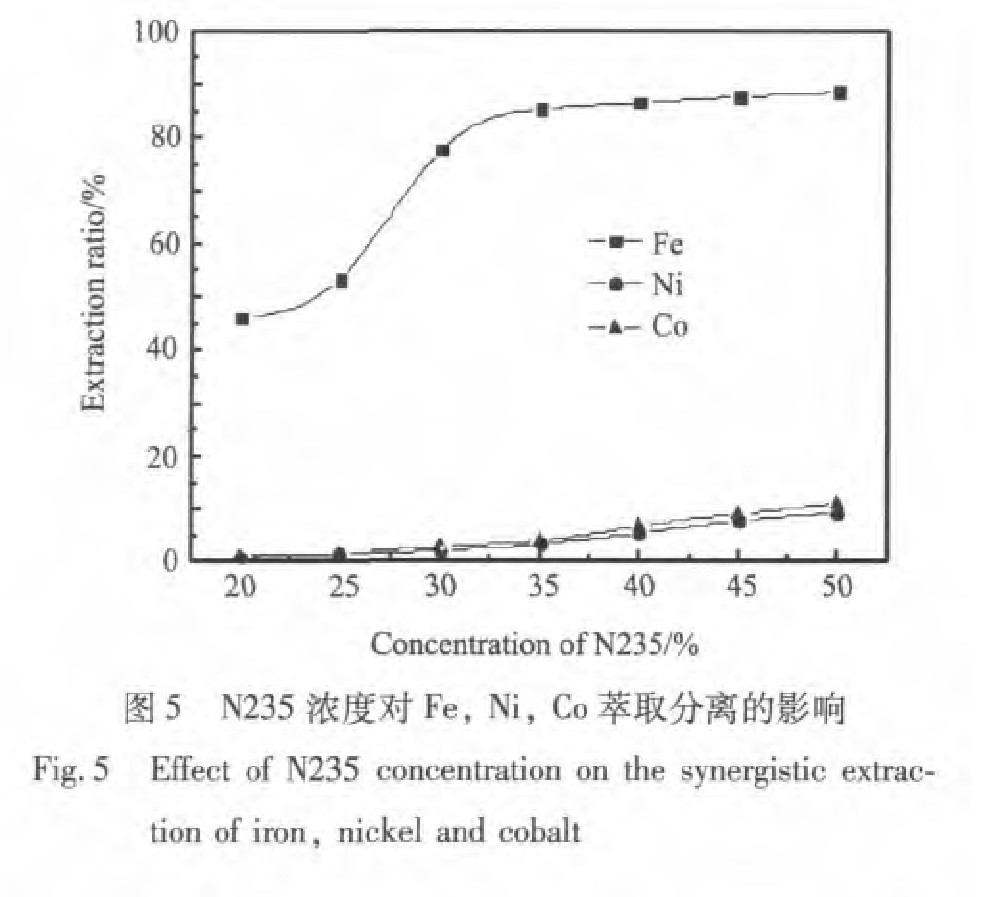
由图5可以看出在N235浓度较低的范围内铁的萃取率增加缓慢, 然后铁的萃取率迅速增加, 最后在N235浓度较高的范围内又趋于平缓。 而镍、 钴的萃取率在N235浓度较低的范围内增加缓慢, 在N235浓度较高的范围内镍、 钴的萃取曲线斜率明显增大, 即镍、 钴的损失量增大, 因此在相比(O/A)固定的条件下, 增大N235浓度相当于增加萃取剂物质的量, 因此有利于Fe(III)的萃取。 如果N235浓度过高, 由于其活度降低, 萃铁能力不再增加, 反而增加了镍、 钴的损失率, 故N235浓度为30%至35%为最佳。
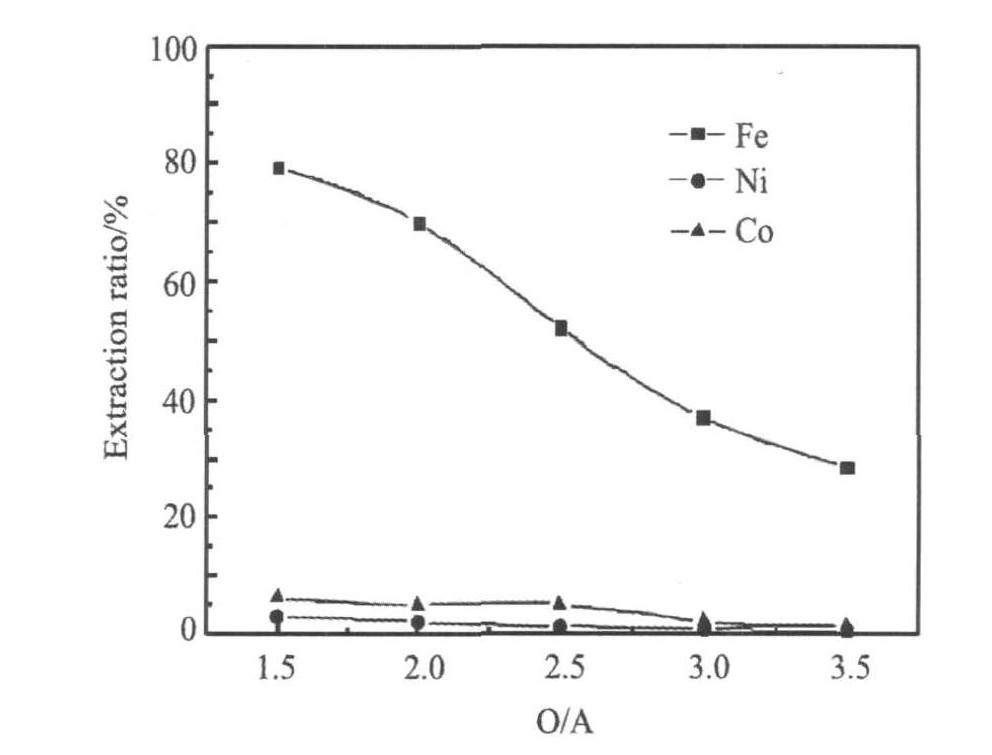
2.5 相比对铁萃取的影响
由图6可以看出铁、 镍、 钴萃取率随着相比减小而减小, 但相比太大会导致两相分离时间延长; 发生乳化现象, 给分离带来困难; 甚至造成萃取剂中毒, 为了保证铁的萃取率又要减小镍、 钴的损失率相比控制在1:1.5左右较为适宜。
图6 相比对Fe, Ni, Co萃取分离的影响
Fig.6 Effect of o/a ratio on the separation of iron, nickel and cobalt
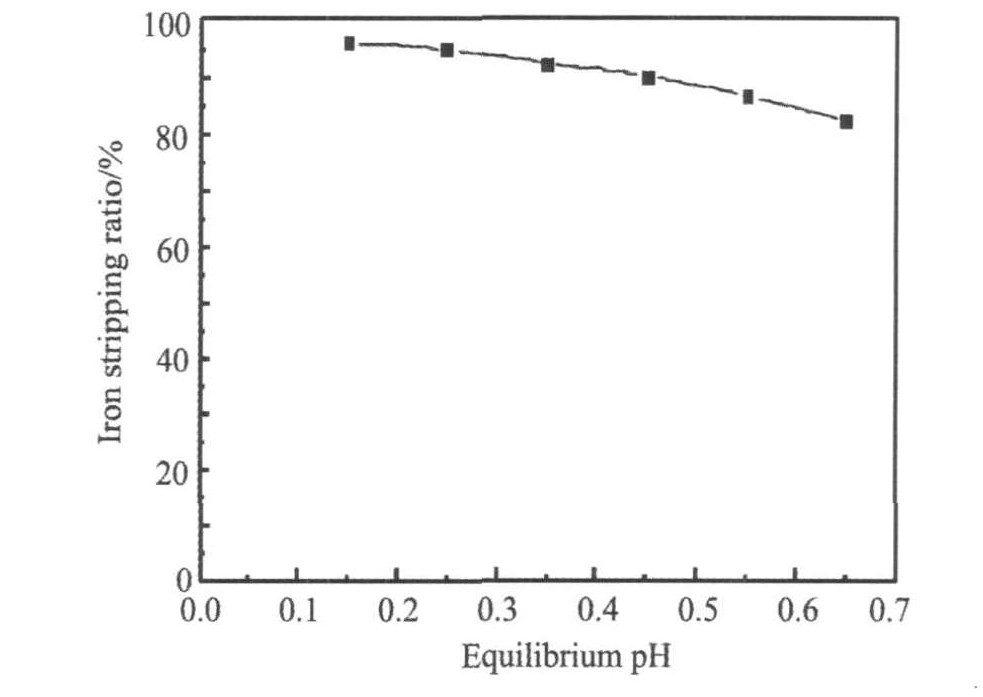
2.6 硫酸浓度对反萃的影响
图7表明了反萃液平衡pH值对Fe(III)反萃率的影响。 当平衡pH小于0.9时, Fe(III)的反萃率随平衡pH增加下降缓慢, 且均大于90%, 当平衡pH大于0.9时, Fe(III)的反萃率随平衡pH增加下降较快, 当pH为1.3时Fe(III) 的反萃率仅为82%, 根据陈家墉等
2.7 不同原液pH的3级错流萃取分离
实验结果表明, 当原液pH值为1.1时, 以含35%N235, 10%TBP的有机相作萃取剂,在相比为1∶1.5条件下, 含铁10 g·L-1的合成料液经过3级错流萃取, 萃余液含铁低于0.02 g·L-1, 铁的总萃取率接近99.8%, 镍的损失率为4.4%, 钴的损失率为5.7%, 基本上达到了铁与镍钴的分离。
图7 平衡pH值对铁反萃的影响
Fig.7 Effect of Equilibrium pH on the stripping of iron
图8 原液pH的三级错流萃取
Fig.8 Effect of initial pH on the three-stage cross-flow extraction
3 结 论
1. 铁的萃取率随pH升高而增大, 但是当pH大于1.1时铁的萃取率略有下降, 也就是说在其他条件不变的情况下, 当pH值为1.1时铁的萃取率达到最大值。
2. 在N235浓度较低的范围内铁的萃取率增加缓慢, 然后铁的萃取率迅速增加, 最后在N235浓度较高的范围内又趋于平缓。 而镍、 钴的萃取率在N235浓度较低的范围内增加缓慢, 在N235浓度较高的范围内镍、 钴的萃取曲线斜率明显增大, 即镍、 钴的损失量增大, 因此在相比(O/A)固定的条件下, 故N235浓度为30%至35%为最佳。
3. N235-TBP体系萃铁的速率很快, 4 min内基本上达到平衡。 随着接触时间的延长, 镍、 钴的萃取率增加, 而铁的萃取率基本不变, 所以为了减少镍、 钴的损失量接触时间不宜太长以3~4 min为宜。
4. 以含35%N235, 10%TBP的有机相作萃取剂, 在相比为1∶1.5条件下, 含铁10 g·L-1的合成料液经过3级错流萃取, 萃余液含铁低于0.02 g·L-1, 铁的总萃取率接近99.8%, 镍的损失率为4.4%, 钴的损失率为5.7%, 基本上达到了铁与镍钴的分离。
5. 以0.5 g·L-1的H2SO4作反萃剂, 在相比为1∶1的条件下, 铁的单级反萃率大于95%, 含铁9.58 g·L-1的有机相经过2级错流反萃, 铁基本上被反萃完全, 贫有机相可以不经处理循环使用。
参考文献