文章编号:1004-0609(2008)S1-0117-04
高钴硫酸锌溶液中锌粉净化除钴的机理
曾桂生1,谢 刚2
(1. 南昌航空大学 环境与化学工程学院, 南昌 330063;
2. 昆明理工大学 材料与冶金工程学院,昆明 650093)
摘 要:
采用高浓度钴离子的硫酸锌溶液, 研究锌粉置换除钴机理。对置换后的净化渣进行SEM和EPMA分析。研究结果表明,温度不同时,表面沉积物的结构也不同,表面沉积物的结构影响置换的速度。通过对产物结构的研究,可推测出锌粉置换除钴过程的机理。首先锌粉和钴离子结合形成一种钴-锌合金,这一反应可以比较快速达到平衡,然后合金继续和钴离子反应得到钴单质,这个过程是整个反应的控制步骤。
关键词:
中图分类号:TF 111.3; TF 813; TF 803.25 文献标识码:A
Mechanism of cobalt removal from high cobalt zinc sulphate solution with zinc powder
ZENG Gui-sheng1, XIE Gang2
(1. School of Environment and Chemical Engineering, Nanchang Hangkong University, Nanchang 330063, China;
2. Faculty of Materials and Metallurgical Engineering, Kunming University of Science and Technology, Kunming 650093, China)
Abstract: Zinc sulfate solution with high cobalt concentration was used to study the mechanism of cobalt removal. Residues after the cementation process from zinc sulfate solution were analyzed by SEM and electron probe micro-analysis (EPMA). With the increase of temperature, cobalt removal can be improved considerably. The mechanism of cobalt removal by zinc powder is thought as follows. Firstly, the cobalt ion forms Co-Zn alloy with zinc particles, and the reaction reaches equilibrium quickly; secondly, the Co-Zn alloy continues reacting to Co with Co2+, which is the control procedure of the whole reaction.
Key words: zinc sulphate solution; cobalt removal; mechanism
湿法炼锌在浸出过程中残留有铜、镉、钴、镍及少量砷、锑、锗等杂质。这些杂质的存在一方面影响阴极锌的质量,另一方面显著降低电流效率,增大电能消耗,对于锌电积极为有害,故必须进行净化除 去[1-4]。国内学者基本上是对净化工艺进行研究[5],对净化机理研究的不够透彻。在所有杂质中,钴相对于其它几种杂质(镍、锗、锑、砷)是最难除去的。对钴难以除去的原因及净化机理,目前没有形成统一的认识[6-8]。因此,研究用锌粉置换法除去硫酸锌溶液中钴的机理,可以对湿法炼锌工艺的净化提供理论指导,进一步优化除钴工艺,以期对硫酸锌溶液杂质进行深度净化。
相对于其它置换体系,如Ag-Cu、Cu-Fe、Cu-Zn和Cd-Zn,Co-Zn体系缺乏足够的理论研究,主要是因为该体系复杂、添加剂的加入及影响因素较多。
在悬浮颗粒上进行的置换,比在旋转圆盘或者旋转圆柱体上的置换具有更大的意义,因为工业规模的置换过程往往采用粒状金属粉末在各种搅拌式反应器内实现。虽然对锌粉置换后的净化渣可能存在的物相有种种理论推导和预测以及一些检测的报道[9-10],但仍然显得说服力不够。因为研究用的硫酸锌溶液均采用工业上的净化前液,工业净化前液成分复杂,硫酸锌溶液中各种杂质之间互相影响,钴离子浓度很低(几毫克至几十毫克)。净化渣中钴含量也比较低,采用X射线衍射分析净化渣的物相时,由于碱式硫酸锌的严重干扰,对钴及其化合物特别是金属间化合物的检测显得很困难。考虑到这些原因,研究硫酸锌溶液除钴机理时,本实验中作者采用模拟溶液,同时采用高浓度的钴离子溶液(3 g/L)作为研究对象,同时采用EPMA(电子探针)分析净化渣。
1 实验
每次取配制溶液500 mL,使[Zn]2+=140 g/L, [Co]2+=3 g/L,初始pH= 4.0。锌离子以ZnSO4·7H2O(分析纯),钴以CoSO4·7H2O(分析纯)形式加入。当温度达到指定温度时,向溶液中一次性加入电炉合金锌粉,其中有效锌量为理论量的2倍,净化时间为60 min。
实验研究装置如图1所示。溶液转速采用0~6 000 r/min连续可调的D40-2F型机械搅拌控制,搅拌速度控制在600 r/min。
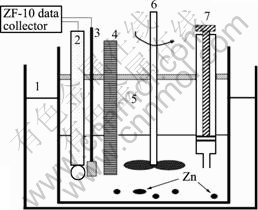
图1 锌粉置换除钴过程示意图:1-水浴锅;2-烧杯;3-甘汞电极;4-研究用阴极;5-温度计;6-搅拌器;7-取样装置
Fig.1 Schematic map of apparatus used during cementation experiments with zinc powder
在不同温度的高浓度钴离子硫酸锌溶液中进行锌粉置换,对真空过滤所得净化液进行化学分析,测定锌粉置换的除钴率。对所得净化渣用环氧树脂固定,经抛光、打磨,然后采用SEM、EPMA(日本岛津公司,型号EPMA-1600)分析硫酸锌溶液净化渣,确定锌粉置换过程中产物形态。
2 结果及讨论
为了考察温度对锌粉置换除钴的影响,在60、70、80和90 ℃进行实验。温度对除钴的影响结果如图2所示。从图2可以看出,温度越高,对除钴置换反应越有利。根据Arrelnius公式,随着温度的升高,越有利于除钴。从测得的铁族元素的析出超电位可以看出,随着温度的升高,铁族元素的超电位降低。有研究者认为这些元素的析出超电位由其电子结构决定,电析反应由金属的亚稳定状态到稳定状态的转移速度决定,而且它几乎只与温度有关。另一方面,升高温度可增大二价钴离子从母液到锌粉表面的浓差扩散速度,因此,提高温度可显著提高除钴效果。
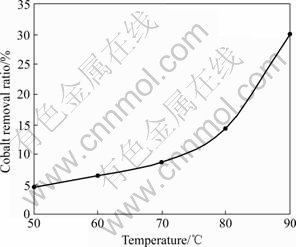
图2 温度对除钴的影响
Fig.2 Effect of temperature on cobalt removal
对净化前和净化后的锌粉进行了SEM分析,结果如图3所示。从图3中可以清楚观察到置换前的锌粉微粒很分散,而置换后的锌粉微粒结合紧密,且颗粒较小[11]。可见锌粉已发生溶解,但反应仅在锌粉表面上进行,而达不到锌粉内部,这是锌粉置换除钴过程会有大量锌粉浪费而发生不了反应,导致锌粉的消耗量需要理论量的几百倍才能达到净化要求的主要原因。被置换的钴和形成的碱式盐必须从锌粉表面及时清除,以暴露出锌粉的新表面,因此必须加强搅拌,尽量使反应扩散到锌粉内部。强化搅拌也有利于被置换离子的扩散,增加与锌粉接触的机会,加速置换反应的进行。因此,在锌粉置换除钴过程中,在搅拌条件较好的情况下,采用更细的锌粉会取得加速除钴过程的效果。锌粉置换除钴反应是在锌粉表面上进行的,锌粉的表面积越大,溶液中钴离子与锌粉接触的机会越多,因而越有利于加速除钴反应。

图3 净化前(a)和净化后(b)锌粉的SEM形貌
Fig.3 SEM morphologies of Zn powder before(a) and after(b) cementation
图4所示为不同温度下锌粉置换钴的EPMA图。从图4可以看出,60 ℃时锌粉置换除钴反应基本上不发生,看不到钴和钴-锌合金的生成,这是由于锌离子的存在在温度较低的时候抑制了置换反应的进行。70 ℃时,锌粉颗粒由外至内依次为:钴、钴-锌合金、碱式硫酸锌和锌粉。由于碱式硫酸锌将锌粉颗粒包裹住,这样会阻碍置换除钴的顺利进行。但和60 ℃时相比,从EPMA可以观察到少许钴和钴-锌合金,只是形成的量很少,尤其是单质钴。80 ℃时,锌粉颗粒由外至内依次为:钴、钴-锌合金、碱式硫酸锌和锌粉。90 ℃时,锌粉颗粒由外内层依次为:钴、碱式硫酸锌和锌粉,观察不到钴-锌合金的形成。
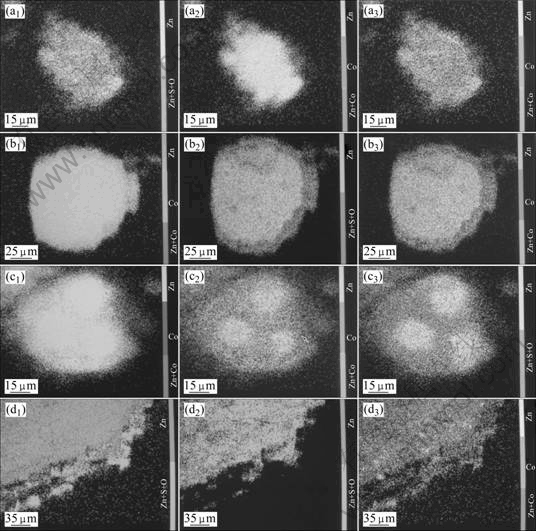
图4 高钴硫酸锌溶液不同温度下置换后产物的EPMA图
Fig.4 EPMA images of residues after cementation by zinc dust at different temperatures: (a) 60 ℃; (b) 70 ℃; (c) 80 ℃; (d) 90 ℃
从不同温度的置换情况来看,推断锌粉置换除钴过程的机理如下:首先,锌粉和钴离子结合形成钴-锌合金,该反应可以比较快速达到平衡;然后,这种合金继续和钴离子反应得到钴单质,这个过程是整个反应的控制步骤。这个过程的的反应机理可表示为
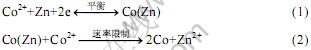
很多研究者都认为钴置换反应为一级反应[12-15]。本实验结果表明这个置换过程比一级反应复杂得多,锌粉置换反应不是单一的反应,也不是简单的一级反应,至少包括以下2个反应:形成钴合金和形成单质钴。锌粉置换除钴分2个过程进行,刚开始(约10 min)是一个很快速的过程,这是一个化学控制过程,然后反应受扩散过程控制。因为在锌浓度很高时,由于溶液中的pH较高,锌将部分水解生成碱式硫酸锌和氢氧化锌沉淀,这些沉淀吸附在锌粉表面阻碍了钴离子的进一步放电,从而阻碍了除钴反应的进行。并且溶液中含有较高的Zn2+将使溶液的粘度增大,使置换反应的扩散层厚度增大,反应速度降低。
3 结论
1) 温度导致碱式硫酸锌包裹锌粉的情况发生变化。温度升高,反应越容易进行。
2) 温度不同时表面沉积物的结构也不同,表面沉积物的结构影响置换的速度。锌粉置换除钴过程的机理为:首先,锌粉和钴离子结合形成一种钴-锌合金,这一步反应可以比较快速达到平衡,然后这种合金继续和钴离子反应得到钴单质,这个过程是整个反应的控制步骤。锌粉置换反应不是单一的反应,也不是简单的一级反应,至少包括2个反应:形成钴合金和在锌粉表面形成碱式钴盐。锌粉置换除钴分2个过程进行,刚开始(约10 min)是一个受化学控制的快速过程,然后反应受扩散过程控制。
REFERENCES
[1] AMY N, WANG W, DEMOPOULOS G P, HOULACHI G. The removal of cobalt from zinc electrolyte by cementation: A critical review[J]. Min Pro Ext Met Rev, 2000, 20(1): 325-356.
[2] HABASHI F. A short history of hydrometallurgy[J]. Hydrometallurgy, 2005, 79(1/2): 15-22.
[3] DAI Jun, WANG De-quan, JIANG Lan, JIN Man. Removal of cobalt from zinc sulphate solution using rude antimony trioxide as additive[J]. Trans Nonferrous Met Soc China, 2002, 12(6): 1172-1175.
[4] XU R, MA K, GUO Z. Activation mechanism of Sb2O3 during removal of cobalt from zinc sulphate solution[J]. Hydrometallurgy,2006, 82(3/4): 150-153.
[5] LU Ying. The effect of impurities on the deposition of zinc sulphate soulution[D]. Kunming: Kunming University, 2004: 38-52. (in Chinese)
[6] DREHER T M, NELSON A, DEMOPOULOS G P, FILIPPOU D. The kinetics of cobalt removal by cementation from an industrial zinc electrolyte in the presence of Cu, Cd, Pb, Sb and Sn additives[J]. Hydrometallurgy, 2001, 60(2): 105-116.
[7] ZENG G, XIE G, YANG D, WANG J, LI X, LI R. The effect of cadmium ion on cobalt removal from zinc sulfate solution[J]. Minerals Engineering, 2006, 19(2): 197-200.
[8] LAWSON F, NHAN I T. Kinetics of removal of cobalt from zinc sulfate electrolytes by cementation [C]// Proceedings of the society of the chemical industry symposium. Manchester, 1981: 1-10.
[9] MOGHADDAM J, SARRAF M R, ABDOLLAHY M, YAMZNI Y. Purification of zinc ammoniacal leaching solution by cementation: Determination of optimum process conditions with experimental design by Taguchi’s method[J]. Separation and Purification Technology, 2006, 51(2): 157-164.
[10] JARI N. Statistical analysis of cobalt removal from zinc electrolyte using the arsenic-activated process[J]. Hydrometallurgy, 2004, 73(1/2): 123-132.
[11] ANNA M P, SIMONA P, STELLA D. Kinetics of cobalt cementation on zinc powder [J]. Ind Eng Chem Res, 1995, 34: 3090-3095.
[12] RAGHAVAN R, UPADHYAY P N. Innovative hydro- metallurgical processing technique for industrial zinc and manganese process residues[J]. Hydrometallurgy, 1999, 51: 207-226.
[13] FOUNTOULAKIS S G. Studies in the cementation of cobalt with zinc in the presence of copper and antimony additives[D]. Columbia: Columbia University, 1983: 55-82.
[14] STEPHAN B, MARIUSZ W, ACHIM W H, MARTIN S. Electro- chemical characterizations of precipitates formed on zincin alkaline sulphate solution with increasing pH values[J]. Electrochemistry Communications, 2004, 6(8): 800-804.
[15] TONDER G J V, CILLERS P J, MEYER E H O, VEGTER N M, KLUE R, IZATT S R, BRUENING R L. Cobalt and nickel removal from zincor impure electrolyte by molecular recognition technology(MRT)-pilot plant demonstration[J]. The Journal South African Institute of Mining and Metallurgy, 2002, 102(1): 11-17.
基金项目:江西省自然科学基金资助项目(2007GZH1510);南昌航空大学科研基金资助项目(EA200702012)
通讯作者:曾桂生,博士,副教授;E-mail: zengguisheng@hotmail.com


