DOI:10.19476/j.ysxb.1004.0609.2017.05.023
含铟铁矾渣焙烧水浸法回收锌和铟
张魁芳,刘志强,戴子林,高丽霞
(广东省稀有金属研究所 广东省稀土开发及应用重点实验室,广州 510650)
摘 要:
针对铁矾渣的危害性及处理现状,结合其物相特点,提出“焙烧-水浸法”从含铟铁矾渣中回收锌、铟的清洁工艺,系统研究焙烧过程物相变化及反应机理,确定最佳焙烧条件。考察浸出时间、温度、固液比对浸出的影响规律。结果表明:在650 ℃焙烧2 h,可使含铟铁矾渣分解,同时Zn和In生成易于浸出的ZnSO4和In2(SO4)3,铁以难浸出Fe2O3形式存在。在常温下,控制液固比5:1,用水浸出焙砂 0.5 h,Zn和In浸出率分别为72.02%和78.73%,Fe浸出率仅为4.42%,而Ag和Pb进入渣中富集回收。
关键词:
文章编号:1004-0609(2017)-05-1045-06 中图分类号:TF09 文献标志码:A
近年来,国内锌产量迅速增长,2010年锌产能超过400万t,其中85%的锌采用湿法冶炼工艺,锌铁分离是其中重要的工序之一,浸出液中除铁的工艺,主要有针铁矿法、赤铁矿法和黄钾(钠)铁矾法等[1-4]。黄钾(钠)铁矾法由于易沉淀析出、溶解度低、过滤性好、试剂消耗少和生产成本低等优点而应用最广。但其主要缺点是渣量大、有价金属损失较多、稳定性差和堆存性不好[5-6]。据统计,每生产1 t Zn,就需产生0.3 t铁矾渣。若不有效处理,不仅占用宝贵的土地资源,造成其中有价金属In、Cu、Zn等资源的浪费,且渣中的Pb、Cd、As等重金属在自然堆存条件下会不断溶出污染地下水和土壤[7],我国重金属污染综合防治“十二五”规划提出:铅锌冶炼行业将实施重金属总量控制与常规污染物总量控制并举的总量控制措施,因此,锌冶炼渣的减量化处理已刻不容缓。
现有铁矾渣的处理方法主要集中于无害化固定处理和回收有价金属两方面。铁矾渣无害化固定技术可分为高温烧结法、还原焙烧-磁选法、高温水解法和溶剂浸出法等[8-11]。铁矾渣中的铁资源分别以硅酸盐、铁酸盐或Fe2O3等形态在炼铁、微晶玻璃、陶瓷材料、颜料或建材等领域得到增值利用,而重金属元素则得到有效回收或固化处理。但由于运营成本高,这些工艺都未推广应用。回收有价金属方面,主要应考虑铁矾渣中Zn和稀散金属In的回收。铁矾法沉铁时,浸出液中的铟以类质同相的形式生成铟铁矾而进一步富集于矾渣,一般采用“高温还原挥发硫酸浸出 D2EHPA萃铟锌板置换”[12-15]或“硫酸浸出萃取置换”[16]工艺回收铟,如国内来宾冶炼厂采用高温还原挥发铁矾渣来回收In,株洲冶炼厂采用高温还原挥发酸浸渣来回收Zn、In,该工艺存在的主要问题是铟总回收率低、能耗大、生产成本高,同时挥发工序产生的低浓度SO2 烟气严重污染环境,赵宏等[16]采用直接硫酸浸出In并萃取置换回收,该过程浸出温度为90 ℃,酸度达150 g/L,生产成本较高。陈永明等[17]提出了先碱浸分解铁矾渣,再选择性酸浸Zn和In,最后铁渣磁选得到铁精矿的全湿法工艺,可有效回收In,Zn等有价金属及部分Fe,但NaOH及酸消耗成本高。
综上所述可知,现有的含铟铁矾渣湿法处理工艺普遍存在处理成本高、酸碱消耗大等弊端,同时有可能在处理过程中形成二次污染,效果并不理想,为此,有必要开发一种环境友好、流程简单、成本低廉、有价金属回收率高的含铟铁矾渣湿法处理工艺,实现高效回收铁矾渣中的In和Zn等有价金属及锌精矿铁资源的增值利用,避免铁渣堆存所带来的环境污染。本文作者在结合铁矾渣的物相特点基础上,提出“焙烧-水浸法”从含铟铁矾渣中回收Zn、In的清洁工艺,系统研究焙烧过程物相变化、反应机理及浸出条件参数,为铁矾渣的无害化、资源化处理提供新的工艺思路,具有重要指导意义。
1 实验
1.1 实验试剂及原料
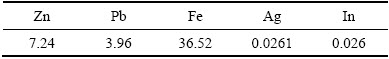
实验所用含铟铁矾渣来自国内某厂硫化锌精矿湿法炼锌除铁工序,其主要化学组成及物相分析见表1及图1,实验所用主要化学试剂浓硫酸(广州化学试剂厂)均为分析纯、水为去离子水。
表1 含铟铁矾渣主要化学成分
Table 1 Main chemical components of ammonium jarosite residue bearing indium (mass fraction, %)

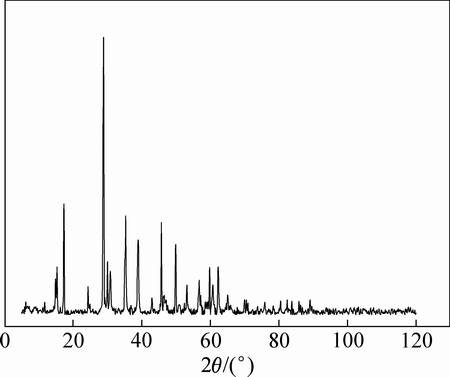
图1 含铟铁矾渣的XRD谱
Fig. 1 XRD pattern of ammonium jarosite residue bearing indium
由表1可知,铁矾渣的主要化学组成为Fe(26.4%)、Zn(6.10%)和Pb(2.88%),另外,还有192 g/t In及194 g/t的Ag有价金属。根据XRD谱可知,原料中的Fe绝大部分以铵矾[(NH4)Fe3(SO4)2(OH)6]形态存在,还有一部分呈ZnFe2O4 相,而铁矾渣中的Zn主要为ZnFe2O4。浸出液中的铟在铁矾法沉铁时主要以类质同相的形式生成铟铁矾而进一步富集于矾渣中。由于铁酸锌和铟铁矾晶体都是相对稳定结构,难以直接进行Zn和In浸出,因此,选择通过焙烧先破坏稳定结构再浸出。
1.2 实验装置及分析仪器
实验用主要焙烧设备为SX2系列箱式电阻炉(宜兴市锦源电炉制造有限公司生产)。焙烧渣的浸出反应容器为三口烧瓶,加热装置采用HH-1数显恒温水浴锅(常州澳华仪器有限公司生产),搅拌装置为JJ-1A精密增力电动搅拌器(常州澳华仪器有限公司生产),过滤采用SHZ-95B型循环水式多用真空泵(巩义市予华仪器有限责任公司生产)。
分析仪器:实验中固相采用标准方法进行化学溶样,溶样液和各阶段浸出液的化学成分采用电感耦合等离子发射光谱仪(Optimal5300DV, Perkin- ElmerInstruments)进行测定,固相物相分析采用X射线衍射仪(X'Pert Pro MPD,Cu Kα辐射,40 kV,30 mA)。
1.3 实验方法
实验流程图和浸出实验装置如图2和3所示。
焙烧:将块状物品磨细烘干供实验使用,取一定量样品于瓷坩埚中,将坩埚置于SX2系列箱式电阻炉中焙烧,实验温度范围为350~850 ℃,每隔50 ℃焙烧一个样品,焙烧时间2 h,确定最佳焙烧温度。
浸出:最佳温度焙烧后的焙砂如图3进行浸出实验,考察不同酸浓度、液固比、反应时间、反应温度对浸出结果的影响。

图2 实验流程图
Fig. 2 Flow sheet of experiment

图3 浸出实验装置图
Fig. 3 Leaching experiment device
2 结果与分析
2.1 焙烧
含铟铁矾渣在不同温度下焙烧2 h后称取质量,计算烧失率。分别取焙砂一定量用1 mol/L 硫酸溶液在25 ℃下浸出1 h并测定各元素的浸出率。不同焙烧温度下的质量烧失率曲线及各元素浸出率如图4~6所示。
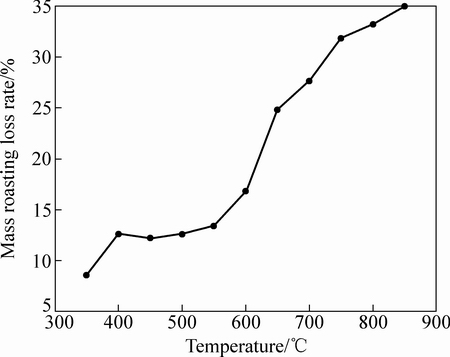
图4 含铟铁矾渣在不同温度下焙烧2 h的烧失率
Fig. 4 Mass roasting loss rate of ammonium jarosite residue bearing indium after roasting at various temperatures for 2 h
由图4可知,经350~400 ℃焙烧后,含锢铁矿渣的质量烧失率明显增加,经400~550 ℃焙烧后,含锢铁矾渣的质量烧失率变化不大;经550 ℃以上焙烧后,含锢铁矾渣的质量烧失率逐渐增加;经600 ℃焙烧后,含锢铁矾渣的质量损失率显著上升。选取其中350、400、650以及850 ℃焙砂做物相分相,研究不同温度下焙烧的物相变化,如图5所示。结合图5可以看出,含铟铁矾渣在350~400 ℃焙烧过程中,(NH4)2(Fe/In)3(SO4)2(OH)6 的XRD峰逐渐变弱,可见黄钾铁矾渣在350~400 ℃焙烧失去结晶水,结构逐渐破坏,在400 ℃开始出现(Fe/In)2(SO4)3的XRD峰,而650 ℃以上焙烧时(NH4)2(Fe/In)3(SO4)2(OH)6 的XRD峰已完全消失,同时,ZnFe2O4的XRD峰消失,出现ZnSO4 和Fe2O3 峰值。当温度继续升高,硫酸盐进一步分解并氧化生成稳定氧化物(Fe/In)2O3和ZnFe2O4 。
结合物相特点,焙烧过程在不同温度下的主要反应如下:


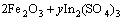 (1)
(1)
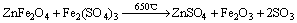 (2)
(2)
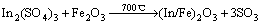 (3)
(3)
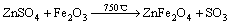 (4)
(4)

图5 含铟铁矾渣不同温度焙烧2 h后XRD谱
Fig. 5 XRD patterns of ammonium jarosite residue bearing indium after roasting at various temperatures for 2 h

图6 含铟铁矾渣在不同温度下焙烧2 h后在1 mol/L H2SO4中的浸出率
Fig. 6 Leaching rate of ammonium jarosite residue bearing indium in 1 mol/L H2SO4 after roasting at various temperatures for 2 h
从图6可看出,随着焙烧温度的升高,Zn、In、Fe的浸出率均呈先上升后下降的趋势变化。结合不同温度焙烧过程反应机理式,主要原因如下:在开始阶段,随着焙烧温度的升高,如式(1)含铟铁矾渣分解,有部分Fe2(SO4)3盐生成,同时In也生成In2(SO4)3,所以In、Fe浸出率明显上升,Zn浸出率一直较低。当温度达到500~650 ℃,由于反应(2),Fe的硫酸盐与铁酸锌反应逐渐生成难浸出的Fe2O3和ZnSO4,所以Fe的浸出率逐渐下降至接近0%,Zn的浸出率也上升至最大值,In仍主要以In2(SO4)3形式存在,浸出率变化不大。随后,温度继续升高,Zn、In的硫酸盐进一步发生(3)、(4)反应氧化生成难浸出的氧化物形式,浸出率反而不断下降。为此,选用650 ℃作为最佳焙烧温度。含铟铁矾渣焙烧后,由于水分和SO3放出,渣质量产生变化,各元素成分含量也相应提高。焙砂成分见表2。
表2 含铟铁矾渣650 ℃焙烧2 h后主要化学成分
Table 2 Main chemical components of ammonium jarosite residue bearing indium after roasting at 650 ℃ for 2 h (mass fraction, %)
2.2 浸出
2.2.1 硫酸浓度对浸出率的影响
含铟铁矾渣650 ℃焙烧2 h所得焙砂用硫酸浸出,液固比为5:1,浸出温度25 ℃,浸出时间2 h。控制硫酸浓度分别为0(纯水)、0.5、1、1.5、2 mol/L,研究不同硫酸浓度对浸出率的影响,结果如图7所示。
由图7可知,当酸度从0升高至2 mol/L时,Zn和In的浸出率变化并不明显,均分别在70%和80%左右,Fe浸出率均较低,接近6%。这主要原因是由于根据前文对不同温度下焙烧的相图变化和反应式,可知在650 ℃下,焙烧2h后,含铟铁矾渣分解成In2(SO4)3、ZnSO4和Fe2O3,In2(SO4)3和ZnSO4均可溶于水,为此不需要消耗酸,用纯水即可浸出进入溶液,
而生成的Fe2O3晶体结构稳定,在硫酸溶液中相对稳定,随着酸度变化均维持在较低水平,且在纯水中的浸出率明显低于硫酸溶液中,可获得较理想效果。综合考虑,选用纯水做浸出剂为宜。

图7 硫酸浓度对浸出率的影响
Fig. 7 Influence of H2SO4 concentration on leaching rate
2.2.2 浸出液固比对浸出率的影响
含铟铁矾渣650 ℃焙烧2 h所得焙砂用纯水浸出,浸出温度为25 ℃,浸出时间为2 h,控制液固比分别为4:1、5:1、6:1、7:1,研究液固比对浸出率的影响,其结果如图8所示。

图8 液固比对浸出率的影响
Fig. 8 Influence of solid-liquid ratio on leaching rate
由图8可以看出,随着液固比的增加,Zn和In浸出率呈先上升,在液固比5:1之后,浸出率达到平衡,而液固比变化对铁基本没有影响。主要原因是由于当液固比为4:1时,体系黏度增大,搅拌困难,同时焙烧颗粒与浸出液之间不能充分接触,浸出液中金属离子浓度过高促使浸出逆向反应加大,浸出率受限;但液固比持续增大时,使得浸出率中的离子浓度明显降低,不利于后续处理,也增加设备负担。因此,液固比以5:1为宜。
2.2.3 浸出时间对浸出率的影响
含铟铁矾渣650 ℃焙烧2 h所得焙砂用纯水浸出,浸出温度为25 ℃、液固比5:1、控制浸出时间分别为0.5、1、2、3 h时研究浸出时间对浸出率的影响如图9所示。从图9可以看出,浸出反应所需时间较短,在0.5 h,In、Zn浸出均已达到平衡,为此选用0.5 h作为浸出时间即可。
2.2.4 浸出温度对浸出率的影响
含铟铁矾渣650 ℃焙烧2 h所得焙砂用纯水浸出,浸出时间为0.5 h,液固比5:1。分别控制浸出温度为25、45、60、75、90 ℃,研究浸出温度对浸出率影响,其结果如图10所示。
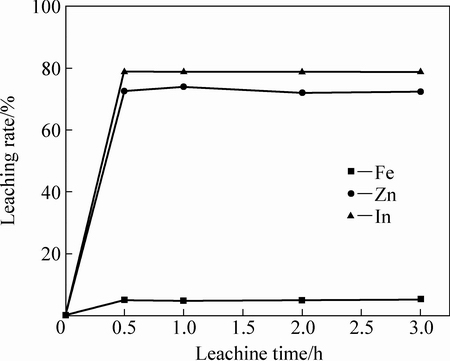
图9 浸出时间对浸出率的影响
Fig. 9 Influence of leaching time on leaching rate

图10 浸出温度对浸出率的影响
Fig. 10 Influence of leaching temperature on leaching rate
从图10可以看出,当温度从25 ℃上升至90 ℃,In、Zn、Fe的浸出率均略有上升,但变化十分缓慢,主要原因是由于本浸出环节主要发生的反应是In和Zn的硫酸盐溶于水的过程,硫酸盐含量并不是很高且较易溶于水,所以温度对于溶解过程影响并不大,而生成的Fe2O3晶体结构稳定,在硫酸溶液中相对稳定,升高浸出温度对晶体破坏作用并不强,浸出率仍然保持在低水平,无明显变化。
2.3 综合实验
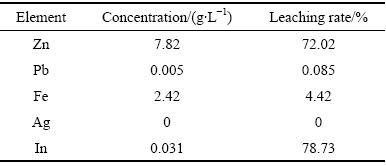
按单因素条件实验所确定的最佳条件:取焙烧后的铁矾渣150 g,浸出剂为纯水,浸出时间0.5 h,浸出温度为25 ℃,浸出的液固比为5:1。进行试验,反应后过滤,并将滤液收集于1000 mL 容量瓶中定容。测定各元素成分如表3所示。Zn、In的平均浸出率为72.02%、78.73%,而Fe浸出率仅为4.42%,Pb、Ag全部进入渣中富集。
表3 浸出液的化学成分及其浸出率
Table 3 Chemical components and leaching rate of lixivium
3 结论
1) 在650 ℃焙烧2 h,可使含铟铁矾渣分解,同时Zn和In生成易于浸出的ZnSO4、In2(SO4)3,Fe以难浸出的Fe2O3形式存在。
2) 在常温下,控制液固比5:1,用水浸出焙砂 0.5 h,Zn、In浸出率分别为72.02%、78.73%,Fe浸出率仅为4.42%,而Ag、Pb富集进入浸出渣中。
3) 本工艺流程短,同时浸出过程中采用水做浸出剂,而未使用酸、碱,成本低廉,清洁环保。
REFERENCES
[1] 孙成余, 张侯文. 湿法炼锌E.Z.针铁矿法除铁工艺研究[J]. 中国有色冶金, 2015(6): 68-70.
SUN Cheng-yu, ZHANG Hou-wen. Research of process of E.Z.goethite removing iron in zinc hydrometallurgy[J]. China Nonferrous Metallurgy, 2015(6): 68-70.
[2] 吴克明, 孙大林, 胡 杰. 湿法炼锌过程中除铁工艺的进展[J]. 矿产综合利用, 2014(6): 6-9.
WU Ke-ming, SUN Da-lin, HU Jie. Progress of technology optimization of precipitation of iron in zinc hydrometallurgy[J]. Multipurpose Utilization of Mineral Resources, 2014(6): 6-9.
[3] 张成松, 赵 婷. 赤铁矿除铁法在湿法炼锌工艺中的应用[J]. 湖南有色金属, 2014, 30(2): 39-41.
ZHANG Cheng-song, ZHAO Ting. Applacation of the hematite process for removing iron in the zinc hydrometallurgical production[J]. Hunan Nonferrous Metalls, 2014, 30(2): 39-41.
[4] 森 维, 孙红燕, 李正永, 林大志, 宋兴诚, 杨继生. 锌湿法冶炼过程中除铁方法的研究进展[J]. 矿冶, 2013, 22(3): 71-74.
SEN Wei, SUN Hong-yan, LI Zheng-yong, LIN Da-zhi, SONG Xing-cheng, YANG Ji-sheng. Progress of research on methods of removing iron from zinc hydrometallurgy process[J]. Mining & Metallurgy, 2013, 22(3): 71-74.
[5] 薛佩毅, 巨少华, 张亦飞, 王新文. 焙烧-浸出黄钾铁矾渣中多种有价金属[J].过程工程学报, 2011, 11(1): 56-60.
XUE Pei-yi, JU Shao-hua, ZHANG Yi-fei, WANG Xin-wen. Recovery of valuable metals by leaching of roasted jarosite residue[J]. The Chinese Journal of Process Engineering, 2011, 11(1): 56-60.
[6] 吴文伟, 李妹妹, 廖 森. 黄钾铵铁矾的热分解过程及其产物[J]. 有色金属, 2009, 61(3): 72-75.
WU Wen-wei, LI Mei-mei, LIAO Sen. Products and kinetics of potassium jarosite thermal decomposition[J]. Nonferrous Metals, 2009, 61(3): 72-75.
[7] KENDALL D S. Toxicity characteristic leaching procedure and iron treatment of brass foundry waste[J]. Environ Sci Technol, 2003, 37(2): 361-371.
[8] ASOKAN P, SAXENA M, ASOLEKER S R. Hazardous jarosite use in developing non-hazardous product for engineering application[J]. Journal of Hazardous Materials, 2006, 137(3): 1589-1599.
[9] PAPPU A, SAXENA M, ASOLEKER S R. Hazardous jarosite use in developing non-hazardous product for engineering application[J]. J Hazard Mater, 2006, 137(3): 1589-1599.
[10] PAPPU A, SAXENA M, ASOLEKER S R. Jarosite characteristics and its utilization potentials[J]. Sci Total Environ, 2006, 359(2): 232-243.
[11] HAGE J L T, SCHUILING R D, VRIEND S P. Production of magnetite from sodium jarosite under reducing hydrothermal conditions: the reduction of Fe (III) to Fe (II) with cellulose[J]. Can Metall Q, 1999, 38(4): 267-276.
[12] RAY L F, DARIA L W, RACHAEL-ANNE W, ANTHONY M,WAYDE M. A thermogravimetric study of the alunites of sodium,potassium and ammonium[J]. Thermochemical Acta, 2006, 443(1): 56-61.
[13] RISTIC M, MUSIC S, OREHOVEC Z. Thermal decomposition of synthetic ammonium jarosite[J]. Journal of Molecular Structure, 2005, 744(3): 295-300.
[14] RAY L F, RACHAEL-ANNE W, THEO K J, WAYDE M.Thermal decomposition of ammonium jarosite (NH4)Fe3(SO4)2(OH)6[J]. Journal of Thermal Analysis and Calorimetry, 2006, 84(2): 489-496.
[15] RAY L F, LOCKE A J, MARTENS W. Thermal analysis of beaverite in comparison with plumb ojarosite[J]. Journal of Thermal Analysis and Calorimetry, 2008, 92(3): 887-892.
[16] 赵 宏, 洪艳霞. 回收铁矾渣中铟的试验研究[J]. 甘肃冶金, 2014, 36(5): 31-34.
ZHAO Hong, HONG Yan-xia. Experimental research on recovery of indium from iron-vanadium slag[J]. Gansu Metallurgy, 2014, 36(5): 31-34.
[17] 陈永明, 唐谟堂, 杨声海. NaOH分解含铟铁矾渣新工艺[J]. 中国有色金属学报, 2009, 19(7): 1322-1331.
CHEN Yong-ming, TANG Mo-tang, YANG Sheng-hai. Novel technique of decomposition of ammonium jarosite bearing indium in NaOH medium[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(7): 1322-1331.
Recovery of Zn and In from ammonium jarosite residue bearing indium by roasting - water leaching method
ZHANG Kui-fang, LIU Zhi-qiang, DAI Zi-lin, GAO Li-xia
(Guangdong Province Research Institute of Rare Metal, Guangdong Province Key Laboratory of Rare Earth Development and Application, Guangzhou 510650, China)
Abstract: Based on the perniciousness and dispose status of ammonium jarosite residue and its phase characteristics, a new process recovering Zn and In from ammonium jarosite residue bearing indium by roasting - water leaching method was put forward. The phase transformation and reaction mechanism of roasting process were investigated, and the best roasting conditions were determined. The effect laws of leaching time, temperature and solid-liquid ratio on leaching were investigated. The results show that, after roasting of jarosite at 650 ℃ for 2 h, ammonium jarosite bearing indium is decomposed into Fe2O3, ZnSO4 and In2(SO4)3. The roasted jarosite residue is leached by water at room temperature for 0.5 h. The leaching rate of Zn and In are 72.02% and 78.73%. The leaching rate of Fe is only 4.42%, Ag and Pb are enriched into the residue.
Key words: ammonium jarosite residue bearing indium; roasting; water leaching; Zn; In
Foundation item: Project(51404078) supported by the National Youth Science Foundation China; Project(2015A020215018) supported by the Science and Technology Plan of Guangdong Province, China
Received date: 2016-04-12; Accepted date: 2016-09-14
Corresponding author: LIU Zhi-qiang; Tel: +86-20-61086372; E-mail: Lzqgd168@126.com
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51404078);广东省科技计划项目(2015A020215018)
收稿日期:2016-04-12;修订日期:2016-09-14
通信作者:刘志强,教授级高工;电话:020-61086372;E-mail:Lzqgd168@126.com
摘 要:针对铁矾渣的危害性及处理现状,结合其物相特点,提出“焙烧-水浸法”从含铟铁矾渣中回收锌、铟的清洁工艺,系统研究焙烧过程物相变化及反应机理,确定最佳焙烧条件。考察浸出时间、温度、固液比对浸出的影响规律。结果表明:在650 ℃焙烧2 h,可使含铟铁矾渣分解,同时Zn和In生成易于浸出的ZnSO4和In2(SO4)3,铁以难浸出Fe2O3形式存在。在常温下,控制液固比5:1,用水浸出焙砂 0.5 h,Zn和In浸出率分别为72.02%和78.73%,Fe浸出率仅为4.42%,而Ag和Pb进入渣中富集回收。
[1] 孙成余, 张侯文. 湿法炼锌E.Z.针铁矿法除铁工艺研究[J]. 中国有色冶金, 2015(6): 68-70.
[2] 吴克明, 孙大林, 胡 杰. 湿法炼锌过程中除铁工艺的进展[J]. 矿产综合利用, 2014(6): 6-9.
[3] 张成松, 赵 婷. 赤铁矿除铁法在湿法炼锌工艺中的应用[J]. 湖南有色金属, 2014, 30(2): 39-41.
[4] 森 维, 孙红燕, 李正永, 林大志, 宋兴诚, 杨继生. 锌湿法冶炼过程中除铁方法的研究进展[J]. 矿冶, 2013, 22(3): 71-74.
[5] 薛佩毅, 巨少华, 张亦飞, 王新文. 焙烧-浸出黄钾铁矾渣中多种有价金属[J].过程工程学报, 2011, 11(1): 56-60.
[6] 吴文伟, 李妹妹, 廖 森. 黄钾铵铁矾的热分解过程及其产物[J]. 有色金属, 2009, 61(3): 72-75.
[16] 赵 宏, 洪艳霞. 回收铁矾渣中铟的试验研究[J]. 甘肃冶金, 2014, 36(5): 31-34.
[17] 陈永明, 唐谟堂, 杨声海. NaOH分解含铟铁矾渣新工艺[J]. 中国有色金属学报, 2009, 19(7): 1322-1331.


