镧基储氢材料氢化物LaNi5Hx的第一性原理
张传瑜1, 高 涛1, 齐新华1, 陈 东1, 张云光1, 朱正和1, 陈 波2
( 1. 四川大学 原子分子物理研究所, 成都 610065;
2. 中国工程物理研究院 物理与化学研究所, 绵阳 621900)
摘 要:
从密度泛函理论为基础的第一性原理出发, 运用全势能线性缀加平面波方法, 对LaNi5Hx(x=3, 4, 5)进行了建模研究, 经过优化得到稳定的晶体结构, 从理论上验证其存在性, 并计算给出了它们的电子密度以及状态密度图。 结果表明: 在几种模型中, H原子最终稳定地排布在基平面(12n位)和中间面(6m位)上, 并且趋向晶胞的同一侧; 随着H原子的增多, 晶胞参数a值(0.5273~0.5310nm)增大相对较小, 而c值(0.4075~0.4165nm)有较大的增加, 与实验结果一致; 并且La与Ni的相互作用进一步减弱。
关键词: LaNi5Hx; 镧基储氢材料; 第一性原理; 全势能线性缀加平面波方法 中图分类号: TG139.7
文献标识码: A
First-principle on hydrides LaNi5Hx for hydrogen storage process
ZHANG Chuan-yu1, GAO Tao1, QI Xin-hua1, CHEN Dong1,
ZHANG Yun-guang1, ZHU Zheng-he1, CHEN Bo2
(1. Institute of Atomic and Molecular Physics, Sichuan University,Chengdu 610065, China;
2. Institute of Nuclear Physics and Chemistry,Chinese Academy of Engineering Physics, Mianyang 621900, China)
Abstract: The density functional GGA method and the full-potential linearized augmented plane wave were used to optimize the cell and internal parameters of hydrides LaNi5Hx(x=3, 4, 5). The equilibrium structure, density of state and charge density were worked out. The results indicate that hydrogen atoms are distributed in the basal plane(12n site) and the middle plane (6m site) at end and tend to lie in the same side. With the increase of the number of hydrogen atom in the alloy, a value of crystal cell parameter (0.5273-0.5310nm)increases comparatively less whereas c value (0.4075-0.4165nm) increases comparatively more, which agrees exactly with the experiment; moreover the interaction between La atom and Ni atom bring down further.
Key words: LaNi5Hx; La-based hydrogen storage material; first principle; full-potential linearized augmented plane wave (FLAPW)
储氢材料作为一种多用途材料, 已引起了人们的普遍关注, 研究储氢材料的微观结构以及储氢的状态对于了解和改进储氢材料的性能有着重要的意义。 LaNi5是AB5型化合物中较为理想的二元储氢材料, 在实验和理论上都得到了广泛的研究。 在储氢的过程中, 随着氢浓度的增大, 一般认为储氢材料从固溶相(α相)经过中间过程(α+β相), 最后到达氢化相(β相)。 近年来的研究[1-4]表明, LaNi5-H2体系在储氢中间过程中除了固溶体相(α相)与完全氢化物相(LaNi5H6)之外还有一个或更多的氢化物相LaNi5Hx(x≤5), 也被称为中间相。 这些氢化物是吸氢和放氢的必经过程, 但对于它们的研究相对比较少。 目前见于文献的有LaNi5H3, Nomura等[1]发现在平衡压中的等温线在313K时, LaNi5H2系统中存在两个平台区, 相应的分子式分别为LaNi5H≈3和LaNi5H≈6。 Akiba等[2]通过对体系压力—组分等温线的精确测量, 发现了一种新的化合物相LaNi5H3 , X射线衍射分析证明, 此相与固溶相及氢化相具有相同的六方晶体结构。 对于LaNi5H4, Matsumoto等[3]通过X射线衍射分析, 在储氢过程中, 发现了接近于LaNi5H4的相。 Lartigue等[4]用中子衍射的方法研究了LaNi5D5的一些性质。 但是, 对于中间过程体系中氢化物内部H原子的微观状态和结构参数, 目前尚无研究报道。 而对应这些结果, 无疑对优化材料的吸氢释氢过程以及储氢新材料的设计是有意义的。
本文作者在密度泛函框架下, 采用全势能线性缀加平面波(FLAPW)方法, 计算研究了LaNi5Hx(x=3, 4, 5)的晶体结构、 态密度和电子密度。
1 计算模型与方法
1.1 计算模型
LaNi5是一种具有CaCu5型晶体结构的稀土储氢合金。 其中La占1a位(0, 0, 0), Ni占2c位(13, 23), 0)和3g位(12), 0,(12)), 属于六方晶系, 空间群为P6/mmm, 吸氢后晶系和空间群不变。
1.1.1 LaNi5H3的模型
一个LaNi5晶胞中共有37个空隙, 根据Westlake[5]提出的经验假设: 在母体金属晶格中, 氢原子最先填充的位置是半径r≥0.04 nm的四面体空隙。 Tatsumi等[6]计算得出: 12n位的能量最低, 其次为6m位。 Ono等[7]的假设在LaNi5H3形成时H原子主要占据靠近基平面(12n位), 对 LaNi5H3构造了模型1和模型2。
1.1.2 LaNi5H4, 5的模型
根据LaNi5H3和LaNi5H7的计算结果[8]比较可知, H原子首先排布晶体中上层的间隙, 并且优先占据12n和6m位。 对LaNi5H4和LaNi5H5分别构造了以下3个模型。
计算过程将对上述几种模型的晶胞参数和氢原子内部参数进行优化计算, 给出中间相计算的优化结果。
1.2 计算方法
为了计算LaNi5Hx(x=3, 4, 5)的电子结构和能量, 本文将采用全电子水平下的全势能线性缀加平面波方法(FLPW)。 该方法对计算晶体的电子结构非常精确, 它是从密度泛函理论为基础的第一性原理出发, 首先将晶体多电子方程化为单电子方程(Kohn-Sham方程), 然后通过引入线性缀加平面波基函数对单电子方程进行计算, 同时也引入了广义梯度近似理论(GGA)将单电子的交换能表示成电子密度和梯度的函数, 对于该项有不同的简化方法, 本文采用的是Perdoew96。 在线性缀加平面波基函数的选取和对单电子方程自洽场求解时势能模型的建立都采用了“Muffin-Tin”模型[9]。
本文计算采用WIEN2K软件, 上述计算方法已经包含在该程序中。
2 结果和讨论
本文所有的计算都是在密度泛函框架下进行的, 在计算方程Kohn-Sham时, 采用了Muffin-Tin 模型对不同区域的电子使用不同的波函数, 其中La 和Ni原子的RMT都为0.095nm, H 原子为0.037nm ; 在交换能的计算中取-81.6eV 将内层电子和价电子分开, 外层电子的电子组态为: La5s25p65d16s2; Ni-3p63d84s2; H 1s。 在初始化时, 布里渊区中采样k点数取为500, 在能量的求解自洽场叠代过程中收敛精度控制为: 1.36×10-3 eV。 由于计算中对于内层电子的计算采用了相对论的密度泛函处理, 故在计算中考虑了相对论效应。
2.1 结构优化结果
结构优化时, 首先保持c/a不变, 改变体积; 及保持体积不变, 而改变c/a比值, 两种计算分别多次反复进行, 在结构优化的同时采用了牛顿力学方法对每个原子平衡位置进行了初步优化, 直到前后两次结果的计算之差小于1%。
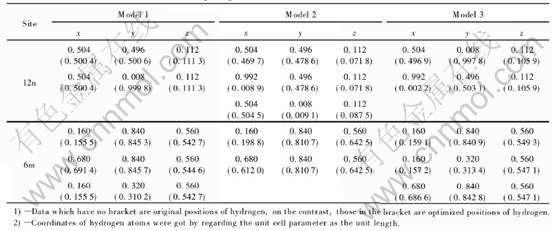
优化后的H的位置见表1~3, 由于合金体积的膨胀, 模型中氢原子的位置在间隙周围移动, 最终稳定地分布在基平面和中间面上, 并且都分布在晶胞的同一侧, 这可能是由于体积膨胀引起此侧的间隙变大造成的, 并且与Tatsumi等[6]根据LaNi5D6.7的实验数据提出了几种假设的有序氢化物模型, 得到较为理想的双晶胞稳定结构相吻合。
从表4优化结果可以看出, 对于LaNi5H3, 模型1和模型2能量之差仅有0.09eV, 与文献[6]的
表1 LaNi5H3晶胞中的H原子占位模型
Table 1 Hydrogen location in unit cell of LaNi5H3
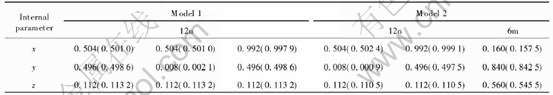
表2 LaNi5H4晶胞中的H原子占位模型
Table 2 Hydrogen location in unit cell of LaNi5H4

表3 LaNi5H5晶胞中的H原子占位模型
Table 3 Hydrogen location in unit cell of LaNi5H5
结果一致, 并且与 LaNi5[9]的体积和晶胞参数相比, 两个模型的体积和晶胞参数都有不同程度的增大, 而模型1与实验值符合的较好, 故以模型1为例进行以下分析。 对于LaNi5H4, 3个模型与实验值基本符合, 而模型2的能量最低, 仅以模型2为例作下面的分析。 对于LaNi5H5, 晶胞的能量继续降低和体积进一步膨胀, 其中以模型3的能量最低, 故以模型3为例作下面的分析。
通过对表1~4分析可得, 随着H原子的增多, 晶胞进一步膨胀, 晶胞参数a值从0.5273增大到0.5310nm, 有相对小的增大, 而c值从0.4075增大到0.4165nm, 增大趋势比较明显, 与实验结果一致[6]; 并且晶胞体积逐渐增大, 由于随着晶格体积的增加, 氢化物趋于稳定[10], 因此合金的稳定性随H原子的增加而增加。
2.2 态密度的分析
态密度对于分析材料中的原子成键和材料特性有重要的意义。 本文给出了LaNi5Hx(x=3, 4, 5)的费密能级以及投影态密度图。
表4 LaNi5Hx(x=3, 4, 5)的晶胞参数、能量以及体积变化的优化结果
Table 4 Optimized results for unit cell parameters,energy and volume expansion of LaNi5Hx(x=3, 4, 5)
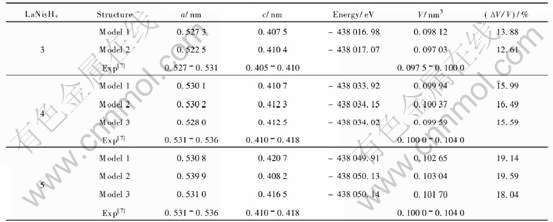
图1所示为LaNi5Hx(x=3, 4, 5)的总体态密度图。 以费米能级(EF)为0点, 其中LaNi5H3的EF=-9.4342eV, LaNi5H4的EF=-9.3718eV, LaNi5H5的EF=-9.1949eV, 与LaNi5相比[9] 费米能级逐渐升高, 总能量降低, 体积进一步膨胀, 这也可能是吸氢过程中平台压升高的原因之一。 随着H原子的增多, 合金的总体态密度向EF处靠近; 并且LaNi5H3在-5.77~-5.30eV之间有宽度为0.47eV的禁带, LaNi5H4的禁带出现在-5.34~-4.66eV之间, 且其宽度为0.68eV, LaNi5H5在-5.05~-4.33eV之间也出现一禁带, 其宽度为0.73 eV, 禁带的宽度逐渐变大, 这可能由于c轴膨胀较大造成的。 而禁带以下态密度的宽度增大的相对较小, 这可能是由于a轴膨胀较小造成的。

图1 LaNi5Hx(x=3, 4, 5)的总体态密度
Fig.1 Total DOS of LaNi5Hx(x=3, 4, 5)
图2所示为LaNi5Hx(x=3, 4, 5)的La的4f轨道的态密度图。 其态密度主要出现在价带3.0eV 附近, 与图1相比, 价带主要是由La的4f轨道提供的。 图3所示为LaNi5Hx(x=3, 4, 5)的Ni的3d轨道的态密度图。 与图1相比, Ni的3d轨道占据了导带的绝大部分权重, 且在EF处的态密度主要是由Ni原子提供。 图4所示为LaNi5Hx(x=3, 4, 5)的H的s 轨道的态密度图。 随着H原子的增多, 态密度向EF处靠近, 并且之间的禁带变窄。
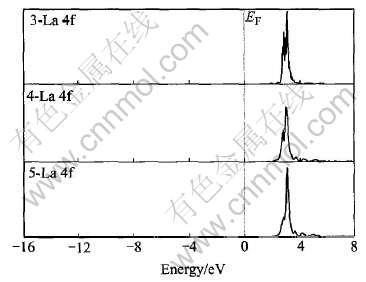
图2 LaNi5Hx(x=3, 4, 5)中La的部分态密度
Fig.2 Partial DOS of La in LaNi5Hx(x=3, 4, 5)
通过图1~4可以得出, La的态密度向高能量一端平移, 而Ni和H的态密度变化趋势相反, 向低能量一端移动, 这也能反映出H与Ni的结合强度要比与La的结合强度大, 并且La的4f轨道与Ni的3d轨道成键被减弱, 这种成键作用在吸氢后被减弱可能是造成合金经过多次吸放氢后出现粉化的原因之一[11]。 并且在禁带以下态密度的展宽主要是由Ni的d轨道和H的s、 p轨道提供, 而La原子的p轨道也提供了少量的电子。 可见, 随着H原子的增加H原子与Ni原子之间离域形成共价键[12], 而La原子与H 原子有较大的电负性差别[13], 因此它们之间相互作用显示离子性强于共价性。
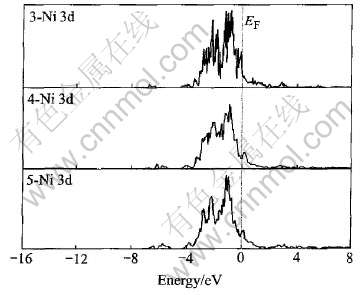
图3 LaNi5Hx(x=3, 4, 5)中Ni的部分态密度
Fig.3 Partial DOS of Ni in LaNi5Hx(x=3, 4, 5)
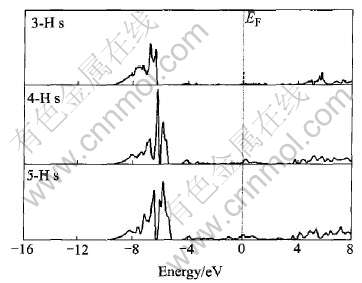
图4 LaNi5Hx(x=3, 4, 5)中H的部分态密度
Fig.4 Partial DOS of H in LaNi5Hx(x=3, 4, 5)
2.3 电荷密度的分析
电荷密度的空间分布, 对于分析材料的原子之间成键以及材料特性也有重要的作用。 LaNi5Hx(x=3, 4, 5)优化后的电子密度在空间的分布如图5~7所示。
由图5(a)所示为LaNi5H3顶面的电荷密度投影图。 可以看出, H原子位于靠近顶面的位置, 且它的周围有较高的电荷密度分布。 并且H原子的电荷密度分布与Ni原子的电荷密度有明显的重叠, 而与La原子的电荷分布没有重叠的趋向, 表明H原子与其周围的Ni原子离域形成共价键, 而与La没有直接的成键作用。 从图5(b)可以看到, 虽H原子距离La原子较近, 但其电子密度却向着Ni原子方向弥散, 这也说明了H与Ni的结合强度要比与La的结合强度大。
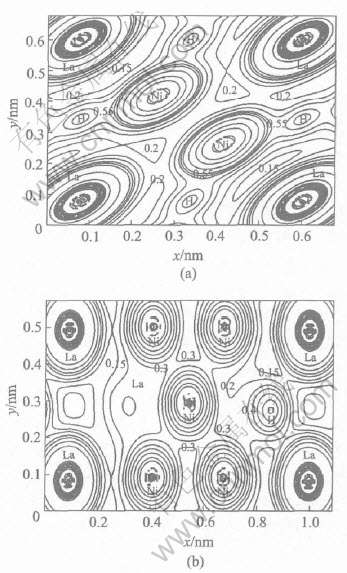
图5 LaNi5H3在(0001)面和(![]() )面的电荷密度
)面的电荷密度
Fig.5 Charge density in plane (0001) (a) and plane ![]() (b) of LaNi5H3(unit: 103 e/nm3)
(b) of LaNi5H3(unit: 103 e/nm3)
图6(a)所示为LaNi5H4的 (0001) 面的电荷密度投影图。 由于H只是非常靠近顶面, 所以显示的H原子周围的电荷密度曲线相对少些, 但是在该区域仍有较大的电荷密度分布。 从图6(b)可以看出, 氢所在的位置是La的电子密度较低的间隙位置, 这也可能是H优先占据半径r≥0.04 nm的四面体空隙[5]的原因。

图6 LaNi5H4在(0001)面和(![]() )面的电荷密度
)面的电荷密度
Fig.6 Charge density in plane (0001) (a) and plane (![]() ) (b) of LaNi5H4(unit: 103 e/nm3)
) (b) of LaNi5H4(unit: 103 e/nm3)
与LaNi5H7相比[8], H原子与Ni原子的电子仍然发生明显的交叠, 二者相互作用形成共价键由图7(a), 由于H原子位于该面上, 所以其周围的电子密度曲线较多, 并且周围电子密度很大。 同时由于体积膨胀较大, 使La原子与Ni原子之间的相互作用进一步减弱(图7(b))。
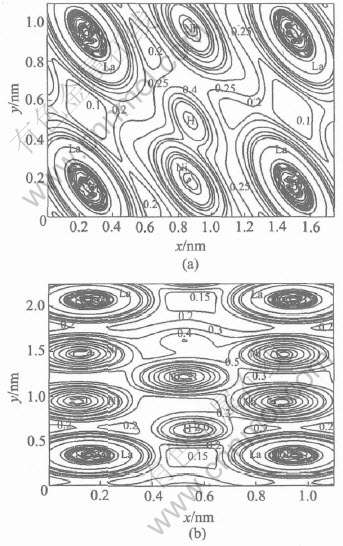
图7 LaNi5H5在 (010) 面和((110))面的电荷密度
Fig.7 Charge density in plane (![]() ) (a) and plane (
) (a) and plane (![]() ) (b) of LaNi5H5(unit: 103 e/nm3)
) (b) of LaNi5H5(unit: 103 e/nm3)
从图5~7的电子密度分析可得, 随着合金中H的含量的增大, 从图形上可看到H原子与Ni原子之间的成键情况, 而La原子作为氢化物的形成元素[14, 15], 虽然与H原子之间具有较大的亲合力, 但是它们之间成键较弱。
3 结论
1) 从第一性原理出发, 首次对储氢中间过程中存在的氢化物LaNi5Hx(x=3, 4, 5)的晶体结构以及稳定性进行了建模研究, 给出了相应的晶体结构、 态密度以及电荷密度。
2) 由LaNi5Hx(x=3, 4, 5)的结构优化结果得出, 氢原子稳定的分布在基平面和中间面上, 并且趋于晶胞的同一侧。 随着H原子的增多, 晶胞参数a的增大相对较小, 而c值的增大趋势比较明显, 并且金属氢化物稳定性增强。
3) 对LaNi5Hx(x=3, 4, 5)的态密度和电子密度分析表明, H易与Ni离域形成共价键, 而与La成键情况不明显; La原子与Ni原子之间的相互作用随着H原子的增加而有所减弱。
REFERENCES
[1]Nomura K, Uruno H, Shinozuka H, et al. Effects of lattice strain on the hysteresis of pressure-composition isotherms for the LaNi5-H2 system[J]. J Less-Common Met, 1985, 107: 221-230.
[2]Akiba E, Nomura K, Ono S. A new hydride phase of LaNi5H3[J]. J Less-Common Met, 1987, 129: 159-164.
[3]Matsumoto T, Matsushita A. A new intermediate hydride in the LaNi5-H2 system studied by in situ X-ray diffractometry[J]. J Less-Common Met, 1986, 123: 135-144.
[4]Lartigue C, Percheron A, Achard J C. Hydrogen ordering in the β-LaNi5Dx>5 phases: A neutron diffraction study[J]. J Less-Common Met, 1985, 113: 127-148.
[5]Westlake D G. A geometric model for the stoichiometry and interstitial site occuping in hydrides of LaNi5, LaNi4Al, LaNi4Mn[J]. J Less-Common Met, 1983, 91: 275-292.
[6]Tatsumi K, Tanaka I, Inui H, et al. Atomic structures and energetics of LaNi5-H solid solution and hydrides[J]. Phys ReV B, 2001, 64: 184105.
[7]Ono S, Nomura K, Akiba K. Phase transformations of the LaNi5-H2 system[J]. J Less-common Met, 1985, 113: 113-117.
[8]Hector L G Jr, Herbst J F, Capehart T W. Electronic structure calculations for LaNi5 and LaNi5H7: energetics and elastic properties[J]. J Alloys Comp, 2003, 353: 74-85.
[9]齐新华, 高涛, 等. LaNi5电子与能量结构的全电子计算[J]. 原子分子物理学报, 2004, 21: 366-372.
QI Xin-hua, GAO Tao, et al. Full-electronic calculations on the equilibrium structure and energy of LaNi5 crystal[J]. J At Mol Phys, 2004, 21: 366-372.
[10]Mendelsohn M H, Gruen D M, Dwight A E. The effect of alumimum additions on the structural and hydrogen absorption properties of AB5 alloys with particular reference to the LaNi5-xAlx ternary alloy system[J]. J Less-Common Met, 1979, 63: 193-207.
[11]韦文楼, 郭进, 邓文, 等. LaNi5基合金电极性能与其电子结构的相关性[J]. 中国有色金属学报, 2002, 12: 501-504.
WEI Wen-lou, GUO Jin, DENG Wen, et al. Correlation between electronic structure of LaNi5 base alloys and hydrogen absorption properties[J]. The Chinese Journal of Nonferrous Metals, 2002, 12: 501-504.
[12]郭进, 韦文楼, 马树元, 等. LaNi5电子结构与成键特征[J]. 金属学报, 2003, 39: 10-12.
GUO Jin, WEI Wen-lou, MA Shu-yuan, et al. Electronic structure and bond character of LaNi5[J]. Acta Metall Sin, 2003, 39: 10-12.
[13]Nakamura H, Nguyen-Manh D, et al. Electronic structure and energetics of LaNi5, α-La2Ni10H and β-La2Ni10H14[J]. J Alloys Comp, 1998, 281: 81-91.
[14]van Vucht J H N, Kuipers F A, et al. Reversible room-temperature absorption by intermetallic compounds[J]. Philips Res Repts, 1970, 25: 133-140.
[15]Yukawa K, Nakatsuka K, Morinaga M. Design of hydrogen storage alloys in view chemical bond between atoms[J]. Solar Energy Materials & Solar Cells, 2000, 62: 75-80.
基金项目: 国家自然科学-中国工程物理研究所联合基金资助项目(10276027)
收稿日期: 2005-09-07; 修订日期: 2005-11-20
通讯作者: 高涛, 副教授; 电话: 028-85405234; E-mail: gthhl@sina.com


