溶液浓度对前驱体FePO4·xH2O及LiFePO4性能的影响
彭春丽,沈超,张宝,张佳峰,李倩
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘 要:
摘 要:以NH4H2PO4和FeSO4·7H2O为原料,H2O2为氧化剂,通过液相法合成FePO4·xH2O前驱体,将FePO4·xH2O,Li2CO3和葡萄糖球磨混合以低温固相法合成正极材料LiFePO4,研究溶液浓度对前驱体FePO4·xH2O和LiFePO4的影响;采用X线衍射(XRD)和扫描电镜(SEM)对样品的晶体结构和形貌进行表征,采用比表面积分析和原子发射光谱分析等手段比较不同的溶液浓度对产物性能的影响。研究结果表明:当溶液浓度为0.1,0.3,0.5,1.0和1.5 mol/L时制备的FePO4·2H2O均为纯相,在溶液浓度为1.0 mol/L时合成的FePO4·xH2O含2个结晶水,即x=2;溶液浓度为1.0 mol/L时合成的FePO4·xH2O制备的LiFePO4具有良好的电化学性能;充放电容量为0.1C(其中,C为充、放电倍率)首次放电容量达154.4 mA?h/g,循环30次后容量保持率为99.7%。
关键词:
中图分类号:TM 912.9 文献标志码:A 文章编号:1672-7207(2010)05-1668-06
Effect of solution concentration on FePO4·2H2O precursor and performance of LiFePO4
PENG Chun-li, SHEN Chao, ZHANG Bao, ZHANG Jia-feng, LI Qian
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: FePO4·2H2O was prepared by liquid phase method in air using NH4H2PO4, FeSO4·7H2O and oxidant of H2O2 as starting materials. LiFePO4 was synthesized at low temperature with the homogeneous mixture of Li2CO3, glucose and FePO4·2H2O. The structures of FePO4·2H2O and LiFePO4 were characterized by XRD and SEM. The effect of solution concentration on FePO4·2H2O precursor and LiFePO4 was represented by specific surface area and element contents using ICP-AES. The results show that no impurities exist in FePO4·2H2O synthesized with solution concentration from 0.1 mol/L to 1.5 mol/L. LiFePO4/C made from FePO4·2H2O precursor with the solution concentration of 1 mol/L shows excellent electrochemical performance. It has an initial discharge capacity of 154.4 mA?h/g at 0.1C, and capacity retention remains 99.7 % after 30 cycles.
Key words:lithium ion batteries; LiFePO4; precursor; solution concentration; electrochemical performance
Padhi等[1]发现的橄榄石型LiFePO4不但能够可逆地嵌入?脱出Li+,还具有较高的理论容量(170 mA?h/g)和可逆容量的优点,人们对正极材料LiFePO4进行了大量的理论研究和实际应用。目前,LiFePO4的合成方法主要分为固相法和湿化学法两大类,其中:固相法有高温固相法、机械化学法和微波法等[2-6];湿化学法分水热法、共沉淀法、溶胶-凝胶法等[7-10]。丁燕怀等[11]采用固相法制备锂离子电池正极材料并研究了煅烧温度对LiFePO4电化学性能的影响;郑俊超等[12]采用低温固相法研究了pH对前驱体FePO4·xH2O和LiFePO4性能的影响;Yu等[13]在采用液相法制备LiFePO4/C过程中分别考察了流速、温度、pH以及压力对产物的影响;Chen等[14]考察了不同的碳源对高温固相合成的LiFePO4/C性能的影响;张宝等[15]采用共沉淀法制备FePO4·xH2O前驱体,然后与乙炔黑混合,在高纯氩气气氛保护下,利用碳热还原法制备LiFePO4/C。目前,有关反应体系溶液浓度对合成前驱体FePO4·xH2O以及LiFePO4性能影响的研究很少,为此,本文作者对其进行研究,同时对浓度与FePO4·xH2O中结晶水数量的关系进行探讨。
1 实验
1.1 材料的制备
将NH4H2PO4(AR)和FeSO4·7H2O(AR)按照物质的量比依次配制成浓度为0.1,0.3,0.5,1.0和1.5 mol/L的溶液,以一定的流速同时加入烧杯并放置于恒温水浴槽中强烈搅拌。随后加入过量H2O2,溶液立即出现大量白色沉淀。充分反应后陈化一段时间,洗涤过滤数次后干燥,得到浅黄色FePO4·xH2O粉末。将干燥的FePO4·xH2O和Li2CO3按物质的量比混合,并加入过量的葡萄糖(AR),置于行星式球磨机中高速混合球磨一段时间,然后将混合物取出,在真空干燥箱中充分干燥后装入管式炉中煅烧,得到LiFePO4。
1.2 材料的表征
采用日本RIGAKU D/MAX型X线衍射仪对样品的晶体结构进行XRD物相分析。物相分析的条件是:Cu Kα辐射,波长为1.540 6×10-10 m,管压为40 kV,管流为300 mA,扫描速度为8 (°)/min,步长为0.02°,扫描范围2θ为10°~90°;采用JEOL公司的JSM- 5612LV扫描电子显微镜,在电压为20 kV时,分别以不同的放大倍数对样品的表面形貌进行观察;采用美国生产的SDT-Q600型DSC-TGA分析仪进行热重差热分析,温度从20 ℃升到1 000 ℃,升温速度为 10 ℃/min,保护气氛为99.999%的氩气;采用由美国热电元素公司生产的电感耦合等离子发射光谱仪(型号:Intrepid 11 XSP)分析材料含量。
1.3 电池组装和测试
将活性物质LiFePO4、黏结剂PVDF(聚偏二氟乙烯)和导电剂乙炔黑按质量比80:10:10混合均匀,加入定量溶剂NMP(N-甲基吡咯烷炯),研磨成浆状;再将电极浆料均匀地涂覆于厚度为0.02 mm的铝箔上,经120 ℃鼓风干燥后裁成直径为1.4 cm的正极片;最后于60 ℃真空干燥6 h。以金属锂片作负极,Celgard2400为隔膜,1 mol/L LiPF6(EC,DMC和EMC质量比为1:l:1)为电解液,在氩气保护的手套箱内装配完成CR2025型扣式电池。采用深圳市新威尔电子有限公司生产的BTS-51型二次电池性能检测仪对电池的充、放电性能进行测试。
2 结果和讨论
2.1 反应物浓度对FePO4·xH2O的影响
图1所示为不同浓度条件下合成的FePO4·xH2O于480 ℃热处理12 h后转化为晶态的FePO4的XRD谱。由图1可见:在所有反应物浓度条件下合成产物的衍射峰与纯相FePO4(JCPDS29-715)谱图吻合,说明合成的FePO4均为纯相,表明浓度为0.1, 0.3, 0.5, 1.0和1.5 mol/L时对合成产物FePO4·xH2O的物相没有影响。
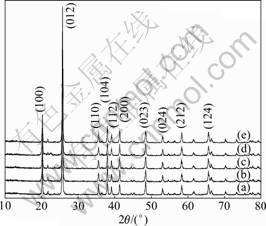
溶液浓度/(mol?L-1): (a) 0.1;(b) 0.3;(c) 0.5;(d) 1.0;(e) 1.5
图1 溶液浓度不同时合成的FePO4的XRD谱
Fig.1 XRD patterns of FePO4 at various concentrations of solution
图2所示为不同浓度下合成的FePO4·xH2O的扫描电镜图。由图2可见:随着溶液浓度的增大,合成的FePO4·xH2O颗粒粒径呈增大趋势。其原因可能是随着浓度的增大,溶液中反应粒子之间接触的概率增大,核化速率加快,导致颗粒粒度增大。
表1所示是不同浓度下合成的FePO4·xH2O中Fe含量和结晶水的数量;图3所示是溶液浓度为1 mol/L时合成的前驱体FePO4·xH2O的热重-差热图。由表1可见:随着溶液浓度的逐渐增大,Fe的含量逐渐增大而结晶水的数目逐渐减小。这可能是因为随着溶液浓度的不断增大,颗粒粒度也不断增大,而比表面积和表面吸附力逐渐减小,致使结晶水的含量不断减小。所以,不同浓度下合成FePO4·xH2O中的x不同,且随着溶液浓度增大,x逐渐减小。在溶液浓度为1 mol/L

溶液浓度/(mol?L-1): 0.1;(b) 0.3;(c) 0.5;(d) 1.0;(e) 1.5
图2 溶液浓度不同时合成的FePO4·xH2O的SEM像
Fig.2 SEM images of FePO4·xH2O at various concentrations of solution
表1 溶液浓度不同时合成的FePO4·xH2O中Fe含量和结晶水的数量
Table 1 Content of Fe and number of crystal water of FePO4·xH2O at various concentrations of solution
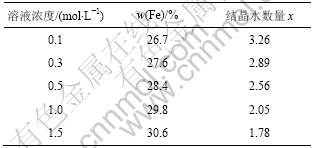
时,FePO4·xH2O中结晶水的数目接近2。由图3可见:当温度为20~500 ℃时,第1次质量损失基本完成,约为19%,而此范围内曲线上只有1个反应峰,即
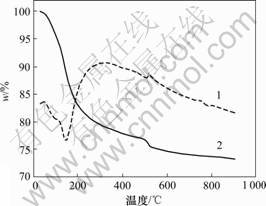
1—差热扫描量热法(DSC);2—热重分析(TGA)
图3 溶液浓度为1 mol/L时合成的FePO4·xH2O的热重-差热(DSC-TGA)图
Fig.3 DSC-TGA curves of FePO4·xH2O at concentration of 1 mol/L
失去结晶水反应峰,此质量损失过程应为磷酸铁失去结晶水的过程。因此,在溶液浓度为1 mol/L时,磷酸铁有2个结晶水,即FePO4·xH2O为FePO4·2H2O。所以,可以通过调节溶液浓度来控制结晶水的含量,为LiFePO4的制备确定Fe源、Li源和C源的物质的量比。
2.2 溶液浓度对LiFePO4性能的影响
图4所示为以不同溶液浓度下合成的FePO4·xH2O为前驱体合成的LiFePO4的XRD谱。由图4可见:在以溶液浓度分别为0.1,0.3,0.5,1.0和1.5 mol/L时合成的FePO4·xH2O为前驱体合成的LiFePO4与标准图谱一致,说明合成的LiFePO4为纯相。而过量的碳以无定形态存在,不会破坏LiFePO4的晶体结构,LiFePO4 仍将保持正交晶系橄榄石型结构。
图5所示为以不同溶液浓度下合成的FePO4·xH2O为前驱体合成的LiFePO4的SEM图。碳源的加入能有
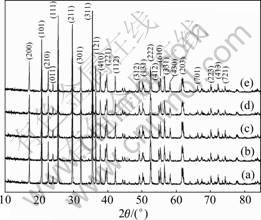
溶液浓度/(mol?L-1): (a) 0.1;(b) 0.3;(c) 0.5;(d) 1.0;(e) 1.5
图4 不同溶液浓度下合成的LiFePO4的XRD谱
Fig.4 XRD patterns of LiFePO4 at various concentrations of solution

溶液浓度/(mol?L-1): (a) 0.1;(b) 0.3;(c) 0.5;(d) 1.0;(e) 1.5
图5 溶液浓度不同时合成的LiFePO4的SEM图像
Fig.5 SEM images of LiFePO4 at various concentrations of solution
效地减小材料的颗粒尺寸,并且材料的电导率比纯LiFePO4的电导率提高5个数量级以上。由图5可见,碳均匀分布于LiFePO4之间,能显著提高LiFePO4的电导率;在溶液浓度为1.0 mol/L时合成的LiFePO4粒子呈类球形(见图5(d)),其颗粒粒径分布均匀,一次粒径约为0.5 μm,较其他样品粒径小,颗粒粒径减少能提高LiFePO4的利用率;同时,絮状葡萄糖颗粒包覆良好,增强了LiFePO4的电导性,从而有利于提高LiFePO4的电化学性能。
图6所示为以不同溶液浓度下合成的FePO4·xH2O为前驱体,在氩气气氛下于650 ℃碳热还原12 h得到的LiFePO4在0.1C的倍率下的首次放电曲线(其中,C为充、放电倍率)。由图6可见:当浓度为0.1,0.3,0.5,1.0和1.5 mol/L时,首次放电容量分别为123.8,137.6,144.0,154.4和110.6 mA?h/g。其中在浓度为1.0 mol/L时合成的LiFePO4首次放电比容量最高。所以,当溶液浓度为1.0 mol/L时,由该条件下合成的FePO4·xH2O前驱体制备的LiFePO4的首次放电性能 最佳。
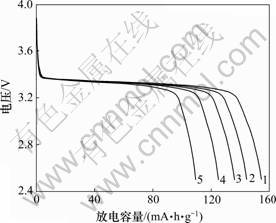
溶液浓度/(mol?L-1): 1—1.0;2—0.5;3—0.3;4—0.1;5—1.5
图6 溶液浓度不同时合成LiFePO4的放电曲线
Fig.6 Discharge curves of LiFePO4 at various concentrations of solution
图7所示是溶液浓度为1 mol/L时合成的LiFePO4在不同放电倍率下的放电比容量和循环曲线。由图7可见:在0.1C和1.0C倍率下合成的LiFePO4其首次放电比容量分别为154.4 mA?h/g和137.7 mA?h/g,说明随着放电倍率的增大,首次放电比容量逐渐减小。从图7(b)可见:以1 mol/L条件下合成的LiFePO4在0.1C和1.0C倍率下经过30次循环后,容量保持率分别为99.7%和98.6%,循环性能优良。
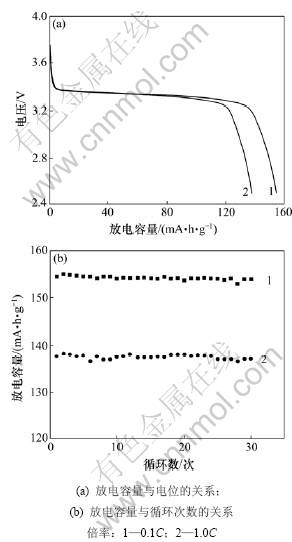
图7 当溶液浓度为1 mol/L时合成的LiFePO4在不同倍率下的放电曲线和循环曲线
Fig.7 Discharge curves(a) and cycle performance(b) of LiFePO4 at concentration of 1 mol/L
综上所述,溶液浓度在制备过程中对前驱体FePO4·xH2O以及LiFePO4的性能影响很大,经综合考虑,宜选取溶液浓度为1 mol/L左右。
3 结论
(1) 以NH4H2PO4和FeSO4·7H2O为原料,H2O2为氧化剂,研究了不同浓度的溶液对合成前驱体FePO4·xH2O的影响。当溶液浓度为0.1,0.3,0.5,1.0和1.5 mol/L时,合成的前驱体FePO4·xH2O均为纯相。
(2) 在溶液浓度为1.0 mol/L时合成的前驱体FePO4·xH2O含2个结晶水,即可以通过调节溶液浓度来控制结晶水的含量,为LiFePO4的制备确定Fe源、Li源和C源的物质的量比。
(3) 以浓度为1 mol/L时合成的FePO4·xH2O为原料制备的LiFePO4其电化学性能优于其他浓度下合成的LiFePO4的电化学性能,该样在0.1C倍率下的首次放电容量为154.4 mA?h/g,30次循环后的容量保持率为99.7%。
参考文献:
[1] Padhi A K, Nanjundaswamy K S, Goodenough J B. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. Electrochemical Society, 1997, 144(4): 1188-1194.
[2] Takahashi M, Tobishima S, et al. Characterization of LiFePO4 as the cathode material for rechargeable lithium batteries[J]. J Power Sources, 2001, 97(98): 508-511.
[3] LIAO
[4] Amine K, Liu J,
[5] Prosini P P, Zane D. Improved electrochemical performance of a LiFePO4-based composite cathode[J]. Electrochemical Acta, 2001, 46: 3517-3523.
[6] Masashi H, Katayama K, Azuma Y, et al. Synthesis of LiFePO4 cathode material by microwave processing[J]. J Power Sources, 2003, 119(121): 258-261.
[7] 郑绵平, 文衍宣. 一种制备磷酸铁锂的湿化学方法: 中国专利, 03102665.6[P]. 2003.
ZHENG Jin-ping, WEN Yan-xuan. A wet chemical method of preparation of lithium iron phosphate: China Patent, 03102665.6[P]. 2003.
[8] Arnold G, Garche J, Hemmer R, et al. Fine-particle iron phosphate LiFePO4 synthesized by a new low-cost aqueous precipitation technique[J]. J Power Sources, 2003, 119(121): 247-251.
[9] Park K S, Son J T, Chung H T, et a1. Surface modification by silver coating for improving electrochemical properties of LiFePO4[J]. Solid State Communications, 2004, 129: 311-314.
[10] HU Yao-qin, Doeff M M, Kostechi R, et al. Electrochemical performance of sol-gel synthesized LiFePO4[J]. J Electrochemical Soc, 2004, 151(12): 1279-1285.
[11] 丁燕怀, 苏光耀, 高德淑, 等. 合成温度对LiFePO4电化学性能的影响[J]. 电池工业, 2006, 11(1): 33-35.
DING Yan-huai, SU Guang-yao, GAO De-shu, et al. Effect of synthesis temperature on the electrochemical performance of LiFePO4[J]. Chinese Battery Industry, 2006, 11(1): 33-35.
[12] 郑俊超, 李新海, 王志兴, 等. 制备过程pH值对FePO4·xH2O及LiFePO4性能的影响[J]. 中国有色金属学报, 2008, 18(5): 867-872.
ZHENG Jun-chao, LI Xin-hai, WANG Zhi-xing, et al. Effect of pH value on performance of FePO4·xH2O and LiFePO4 in synthesis process[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(5): 867-872.
[13] YU Wen-li, ZHAO Ya-ping, RAO Qun-li. Rapid and continuous production of LiFePO4/C nanoparticles in super heated water[J]. Chinese Journal of Chemical Engineering, 2009, 17(1): 171-174.
[14] CHEN Zhao-yong, ZHU Hua-li, JI Shan, et al. Influence of carbon sources on electrochemical performances of LiFePO4/C composites[J]. Solid State Ionics, 2008, 179(27/32): 1810-1815.
[15] 张宝, 彭春丽, 王志兴, 等. 加碳方式对磷酸铁锂动力学及电化学性能的影响[J]. 中南大学学报: 自然科学版, 2007, 38(5): 863-866.
ZHANG Bao, PENG Chun-li, WANG Zhi-xing, et al. Electrochemical properties of LiFePO4/C for cathode materials of lithium ion batteries[J]. Journal of Central South University: Science and Technology, 2007, 38(5): 863-866.
(编辑 陈灿华)
收稿日期:2010-02-21;修回日期:2010-05-10
基金项目:国家自然科学基金资助项目(51072233);中南大学贵重仪器设备开放共享基金资助项目(ZKJ2009036)
通信作者:彭春丽(1971-),女,河南开封人,博士,副教授,从事电化学研究;电话:0731-82654596;E-mail: clpeng228@126.com


