文章编号:1004-0609(2010)05-1013-08
超声波辅助硫化镍矿氧化浸出动力学
薛娟琴,毛维博,卢 曦,李京仙,王玉洁,吴 明
(西安建筑科技大学 冶金工程学院,西安 710055)
摘 要:
选用过硫酸盐+银盐作氧化剂,在超声波作用下对硫化镍矿进行直接氧化浸出,研究搅拌速率、过硫酸钠浓度、浸出温度、银盐浓度及粒度对镍浸出率的影响规律,探讨氧化浸出反应机理。结果表明:在一定范围内,在超声波作用下搅拌速率或者粒度的变化对镍浸出率影响不显著;镍浸出率随Na2S2O8浓度的增大以及温度的升高而增加,但是当温度高于70 ℃后,浸出率的增加不明显;在浸出过程中起主导作用的是S2O82-,少量银盐的存在对浸出反应有促进作用。通过对该体系浸出过程动力学参数的考察,发现其符合缩核模型,过程总体反应速率受界面化学反应控制,表观活化能为39.67 kJ/mol,建立了浸出过程的宏观动力学方程。
关键词:
硫化镍矿;氧化浸出;动力学;表现活化能;超声波;缩核模型;界面化学反应;
中图分类号:TF811 文献标志码:A
Dynamics of ultrasound-assisted oxidation leaching of
nickel sulfide concentrate
XUE Juan-qin, MAO Wei-bo, LU Xi, LI Jing-xian, WANG Yu-jie, WU Ming
(School of Metallurgical Engineering, Xi’an University of Architecture and Technology, Xi’an 710055, China)
Abstract: The method of leaching nickel directly with oxidants of sulphate and silver salts with the assistance of ultrasonic was proposed. The influence of stirring speed, S2O82- concentration, leaching temperature, silver ion concentration and granularity on the leaching rate of nickel was investigated. The reaction mechanism of oxidizing leaching was explored. The results show that the influence of stirring speed or granularity on the leaching rate is not obvious in a certain range; with the increase of S2O82- concentration or leaching temperature, the leaching rate of nickel increases, whereas when the temperature is above 70 ℃, the increase of leaching rate is not obvious; S2O82- plays a dominant role in the oxidation action during the leaching process. The presence of a small amount of silver salt can promote the leaching reaction. Through investigating the dynamic parameters of the process, the dynamics in accordance with the shrinking core model is found. The overall reaction rate is controlled by interfacial chemical reaction with apparent activation energy of 39.67 kJ/mol. The macro-dynamic equations of the process are established.
Key words: nickel sulfide concentrate; oxidation leaching; dynamic; apparent activity energy; ultrasound; shrinking core model; interfacial chemical reaction
目前,世界各国开采的镍矿资源主要为铜镍硫化物矿床[1]。对于硫化镍矿的湿法处理,常用的方法主要有高压氨浸法、硫酸化焙烧浸出法、氧化焙烧还原氨浸法、氧压浸出法和氯化浸出法等[2-5]。这些方法 在同时满足经济效益和环境效益方面尚存在一些问 题[6-7]。作为一种新兴的湿法冶金技术,氧化浸出法在处理贵金属含量较低的硫化矿方面取得了效果[8-9]。蒋小辉等[10]对常温下强氧化剂浸出黄铜矿的过程进行了研究,对比了酸性条件下强氧化剂H2O2和NaClO以及弱氧化剂O2和Fe3+对黄铜矿的作用机理,发现在常温下依靠O2和Fe3+的氧化作用很难浸出黄铜矿中的铜离子,但加入H2O2和NaClO则能大幅度提高铜的浸出效果。范兴祥等[11]研究了在银离子催化下过硫酸铵氧化浸出黄铜矿的新工艺及机理,通过考察浸出温度、浸出时间、过硫酸铵浓度、粒度、银离子浓度和pH值等因素对浸出率的影响,得出氧化浸出法对黄铜矿具有较好的浸出效果的结果。常规湿法冶金中存在反应速度慢,浸出时间长等不足,因此,过程强化必不可少。目前已研究开发出一系列强化法,其中超声强化为重要方法之一。试验证明,对于许多稀有金属、贵金属、重金属矿石及精矿或滤渣,均可采用超声强化浸出过程并取得了较好效果[12]。KAR等[13]对比了在无超声波时,利用细菌浸出红土矿中镍,发现在其他条件相同时,有超声作用的浸出速率比无超声的提高了40%。PESIC和ZHOU[14]对镍的超声波辅助提取进行了研究,结果表明超声配合新溶剂的提取能使提取速率比常规法提高4~7倍。
本文作者提出采用氧化浸出法对硫化镍矿进行镍的直接浸出,并引入超声波对浸出过程进行强化,通过对浸出过程动力学参数的考察,探索镍的高效提取机理,探明不同因素对镍浸出率的影响规律,为高效提取硫化镍矿中的镍提供理论和技术指导。
1 实验
实验所用原料为硫化镍精矿,其XRD谱如图1 所示。精矿中的主要矿物为黄铜矿CuFeS2,镍黄铁矿(Fe, Ni)9S8,磁铁矿Fe3O4及黄铁矿FeS2等。
首先,将恒温水浴锅升温至预定温度,称取一定粒度的硫化镍精矿置于烧杯中,按预定的液固比加入浸出剂,然后将烧杯置于超声波反应器中,用恒流泵将水进行循环以控制浸出过程的温度,在预定功率的超声波发生器作用及机械搅拌下进行氧化浸出。实验结束后对浸出液和浸出渣进行镍含量和XRD分析,并由下式计算镍的浸出率:


图1 硫化镍精矿的XRD谱
Fig.1 XRD pattern of nickel sulfide concentrate
2 结果与讨论
由浸出渣的XRD谱(见图2)可以知道,渣中主要物相包括黄铁矿(FeS2),磁铁矿(Fe3O4),元素硫,二氧化硅等;其中黄铁矿和磁铁矿为主要组分。与原矿相比,浸出渣中镍黄铁矿((Fe,Ni)9S8)、硫酸镍(NiSO4·6H2O)等组分的相对含量大幅度减少,黄铁矿的含量变化不大;渣中有元素硫存在,其含量为矿渣的10%以上,说明浸出过程中有元素硫生成并稳定存在。浸取过程发生明显的电化学反应,具有较高电位的黄铁矿等由于被阴极保护在浸出过程中几乎不反应,它们的存在可以促进电位较低的镍黄铁矿的优先

图2 浸出渣的XRD谱
Fig.2 XRD pattern of slag leached
溶解。在浸出过程发生的主要化学反应如下:
![]()
![]() (2)
(2)
![]()
![]() (3)
(3)
![]() (4)
(4)
浸出过程属于液-固相反应过程,整个过程均可认为是在满足下述条件下进行的。
1) 反应物的浓度在反应过程中基本保持恒定。实验中过硫酸盐的用量远远大于理论所需消耗量。实验证明,与动力学实验相同条件下利用更少量的过硫酸盐在较长的时间也能把矿样中的镍完全浸出,因此,可以近似地认为过硫酸盐的浓度在镍被完全浸出的过程中是恒定的。浸出过程中银离子能不断再生,可以认为它的浓度在浸出过程中也是恒定的。
2) 参与反应的固体是单粒级的颗粒。实验过程只选取粒度为147~175 μm的致密的近似球形的颗粒矿样进行浸出。
3) 反应过程中温度与搅拌速率保持恒定,压力也保持恒定。
据此,该浸出过程动力学模型拟选用未反应收缩核模型来描述,至于浸出过程的模型及控制步骤符合哪种类型,还需要用实验数据利用尝试法证实[9, 15]。
在反应温度为70 ℃、浸出剂Na2S2O8浓度为0.8 mol/L、液固比为30?1、AgNO3浓度为1.0 mmol/L、超声功率为220 W、搅拌转速为250 r/min、粒径为147~175 μm的条件下,进行超声浸出与常规浸出对浸出率影响的对比实验,结果如图3所示。由图3可知,在超声波作用下镍浸出率高于常规搅拌下的。超声作用30 min,镍的浸出率比常规搅拌下提高6.79%;浸出150 min,就能达到常规搅拌300 min时的浸出率。
为了确定适合本体系的超声波功率,在其他条件与上面相同的情况下,考察不同超声功率对浸出率的影响,结果如图4所示。由图4看出,镍浸出率随着超声功率的增大而增大。产生上述现象的主要原因在于超声波的空化效应。伴随着超声空化产生的微射流、冲击波和声冲流等机械效应,会在浸出体系中引起液流的宏观湍动以及固体粒子间的高速碰撞,使涡流扩散得到加强,并对液-液界面和液-固界面产生冲击、剥离、侵蚀作用,进而使相界面得以更新;并且微射流和冲击波导致的多微孔介质内的微扰动作用,使微

图3 超声波强化浸出与常规浸出的结果比较
Fig.3 Comparison of leaching results by ultrasonic and traditional leaching
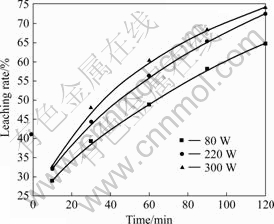
图4 不同超声功率下浸出率与时间的关系
Fig.4 Relationships between leaching rate and time at different ultrasonic powers
孔内物质扩散得到加强,这是采用普通机械搅拌难以实现的。当超声波功率较低时,超声空化一般表现为微弱的稳态空化过程,对传质过程影响不大。当超声功率为80 W时,镍浸出率相对较低。当超声波功率较高时,空化效应加强,一般表现为激烈的瞬态空化过程,对传质及界面反应有显著的促进作用,但是也不能无限制地提高超声波功率,因为最大的空化泡半径与使用的超声波功率有一定的关系,太高的超声波功率反而会抑制激烈的瞬态空化过程的发生;同时考虑到能耗的关系,应该选择适当的超声波功率[16-17],因此,在后续研究中一般选用超声波功率为220 W。
其他条件同2.2部分的,改变搅拌速度(分别为100、250、350、450、600 r/min),得到相应的镍浸出率。结果发现,搅拌速度对浸出率的影响不大,在上述转速下,镍浸出率都在70%左右,表明在超声波作用下,外扩散对浸出过程没有显著的限制作用。为了防止矿物沉于反应器底部,后续实验中采用的搅拌转速为100 r/min。
其他实验条件同2.2,考察不同Na2S2O8浓度对浸出率的影响,结果如图5所示。
采用尝试法将实验数据代入缩核模型的不同控制步骤表达式并作动力学关系图,结果发现界面化学反应动力学曲线均为直线(线性相关系数的绝对值均大于0.99),且大体通过y轴上同一点(见图6),说明该浸出过程属界面化学反应步骤控制类型[9],并可表示为
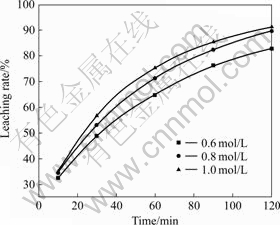
图5 不同浸出剂浓度下浸出率与时间的关系
Fig.5 Relationships between leaching rate and time in leacing with different concentrations
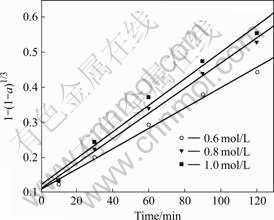
图6 不同S2O82-浓度下的浸出动力学曲线
Fig.6 Kinetics curves in leaching with different concentrations of S2O82-
![]() (5)
(5)

由图1可知:矿样中镍的主要存在形式为镍黄铁矿(Fe, Ni)9S8,占镍总含量的60%,其他存在形式有硫酸镍NiSO4·6H2O、(Ni,Mg)3Si4O18、Ni3Si2O5(OH)4及辉镍矿Ni3S4等。在浸出初期,由于镍黄铁矿与过硫酸盐的反应进行得比较缓慢,矿样中较容易被浸出的组分如硫酸镍[NiSO4·6H2O]等首先被浸出。实验结果显示,这些容易被浸出的组分反应速度极快。在上述反应条件下浸出15 min,镍浸出率可达到25%左右。显然,其动力学机理与镍黄铁矿与过硫酸盐的氧化浸出不一样。由此可推断出这就是造成界面化学反应动力学曲线没有经过原点的原因[18-19]。
根据图6所示的不同S2O82-浓度下的浸出动力学曲线,可求得其相应的表观速率常数k值,k0.6= 0.002 91,k0.8=0.003 59,k1.0=0.003 79。以lg k对lg c作图(c为过硫酸盐浓度),可得方程y=0.527 27x-2.411 43的直线,其线性相关系数为0.97,由此得到浸出过程中S2O82-的反应级数约为0.5。
其他实验条件同2.2部分的,分别研究25、35、40、55、70、85 ℃时,浸出率与时间的关系,结果如图7所示。
将实验数据代入缩核模型的各个控制步骤的特性函数进行模型及控制步骤判断,发现以t对1-(1-a)1/3作图,各温度下浸出的动力学曲线均为直线(线性相关系数的绝对值均大于0.99),且大体通过y轴上同一点,如图8所示,说明各温度下浸出过程属于化学反应控制类型。
对缩核模型进行线性回归,所得直线的斜率即为反应速率常数k。以lnk对1/T作图可得浸出过程的阿仑尼乌斯曲线(见图9),直线方程如下:y=8.157 46- 4 771.134 27x,线性相关系数为-0.997 48。
在浸出化学反应中,反应速率是温度的函数,温度对表观速率常数的影响可用阿仑尼乌斯(Arrhenius)公式表示[15, 20-21]:
![]()

图7 不同温度时浸出率与时间的关系
Fig.7 Relationships between leaching rate and time at different temperatures
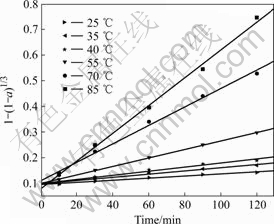
图8 不同温度下浸出动力学曲线
Fig.8 Kinetics curves at different temperatures
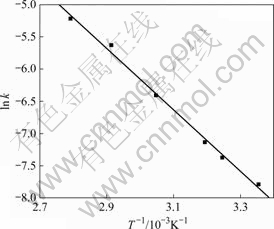
图9 lnk—1/T曲线
Fig.9 Curve of lnk—1/T
对式(6)两边取对数可得:
![]() (8)
(8)
式中:k为表观速率常数;K0为频率因子;Ea为表观活化能;R为摩尔气体常数;T为热力学温度。
结合式(8)和图9,可求得浸出过程的活化能Ea为39.67 kJ/mol,K0为3 487.71。对于多数浸出反应,由界面化学反应控制时其表观活化能在30~85 kJ/mol的范围内变化[9],这就进一步证明了镍浸出过程总体反应速率受界面化学反应控制。
将式(7)代入式(6),可以得到浸出过程的综合速率常数k1:
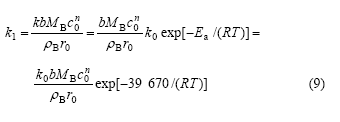
其他实验条件同2.2部分的,考察不同银离子浓度(硝酸银浓度分别为0、1.0、2.0、3.0 mol/L)下浸出率与时间的关系,结果如图10所示。以t对1-(1-a)1/3作图得图11。由图11可以看出,不同银离子浓度下浸出的动力学曲线均为直线(线性相关系数的绝对值均大于0.99),且有银离子存在时的曲线都大体通过y轴上同一点,说明不同银离子浓度下浸出过程的反应速率均属于界面化学反应步骤控制类型。以lnk对lnc(Ag+)作图(c(Ag+)为银离子浓度),得一拟合直线,其方程为y=0.196 5x-4.835 96,由此得到浸出过程中银离子的反应级数约为0.2。
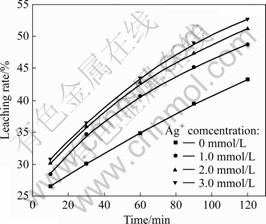
图10 不同银离子浓度下浸出率与时间的关系
Fig.10 Relationships between leaching rate and time at different concentrations of Ag+
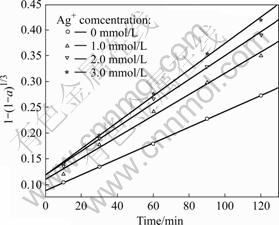
图11 不同银离子浓度下的浸出动力学曲线
Fig.11 Kinetics curves in leaching at different concentrations of Ag+
其他实验条件同2.2部分的,考察不同粒度下浸出率与时间的关系,以t对1-(1-a)1/3作图,结果如图12所示。由图12可以看出,在一定粒度范围(74~246 μm)内的浸出动力学曲线均为直线(各线的相关系数都大于0.99),且大体通过y轴上同一点,这说明各粒度下浸出过程的反应均速率属于界面化学反应步骤控制 类型。
由于浸出过程中引入超声波进行强化,而超声的空化作用产生的效应具有表面效应和破碎作用,因此在一定的粒度范围内,粒度的变化对浸出效果影响不大,式(9)中的1/r0可视为同一常数。
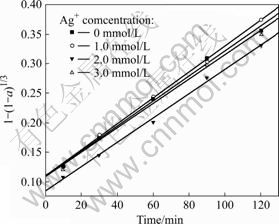
图12 不同粒度下浸出动力学曲线
Fig.12 Kinetics curves in leaching for different granularities
根据以上分析,可以确定浸出过程中各因素对浸出率的影响程度。将式(9)代入式(5),并代入各个参数,可以得到在超声波强化作用下,过硫酸盐+硝酸银体系浸出硫化镍精矿中镍的浸出过程的宏观动力学 方程:

式(10)主要是用来描述矿样中的镍的主要存在形式镍黄铁矿(Fe, Ni)9S8的浸出过程的,验证实验结果表明,该动力学方程能较好地描述实际的反应过程。
3 氧化浸出机理
该浸出过程属于液-固相反应过程。在反应初期,矿样中容易被浸出的组分如硫酸镍等首先被浸出,其反应速度很快,一般为溶解反应。但这些组分在矿样中含量较低,因此不对其过程进行详细分析,重点分析矿样的主要成分(镍黄铁矿)的浸出机理。
浸出过程中镍黄铁矿与过硫酸盐的反应如式(1)所示。过硫酸根离子进行的氧化过程比较慢,但当适当的催化剂存在时,反应就会变得较快。实验结果表明,浸出体系中加入少量硝酸银溶液能显著地提高镍的浸出速率和浸出率。分析认为浸出过程中银离子进行的反应如式(2)和式(3)所示:首先,银离子与镍黄铁矿反应生成Ag2S;由于浸出体系中存在足量的具有很强氧化性的S2O82-,其电极电位明显高于Ag2S的电极电位,因此,S2O82-可以氧化Ag2S生成银离子,从而实现催化剂再生。
在上述氧化还原反应过程中,Ag+与Ag2S之间不断发生转变,随着反应的进行,Ag2S微粒先均匀地夹杂在不断生成的元素硫产物层中,然后又被氧化成Ag+而进入溶液,这不仅可以在一定程度上蓬松元素硫层,而且能改变矿物表面的电化学性质,改善产物元素硫层的导电性能,促进S2O82-和镍黄铁矿间的电子“传递”,加速镍黄铁矿的氧化还原浸出反应和电化学溶解浸出反应的进行。由于浸出过程总体反应速率受界面化学反应控制,且存在具有表面效应和破碎作用等促进传质效应的超声场,因此,Ag+的存在对提高镍的浸出速率具有促进作用。同样,强氧化剂S2O82-也能把Fe2+氧化成Fe3+,而Fe3+也可以氧化镍黄铁矿和硫化银,Fe3+在氧化还原反应过程中,与Fe2+在不同的反应表面不断地相互转换,也促进了浸出过程中的电子“传递”,在一定程度上加速了镍的浸出。
根据以上分析和实验结果,可推断在浸出初期,浸出过程主要经历以下步骤:
1) S2O82-和Ag+向矿粒表面扩散;
2) S2O82-和Ag+被矿粒表面吸附;
3) 吸附的S2O82-和Ag+与矿粒发生反应分别生成Ni2+、Fe2+、SO42-、S和Ag2S、Ni2+、Fe2+;
4) 反应生成物Ni2+、Fe2+和SO42-从矿粒表面解吸,而Ag2S附着在矿粒表面不溶反应产物元素硫层间,然后与新扩散进来的S2O82-反应生成Ag+,并参加新一轮扩散;
5) Ni2+、Fe2+与SO42-通过扩散离开矿粒表面进入溶液主体。
浸出一段时间后,矿粒表面会积累一定量的不溶产物元素硫层,使内扩散过程相对更明显。因此,浸出一段时间后,浸出过程主要经历以下步骤:
6) S2O82-、Ag+与Fe3+穿过液膜及不溶产物元素硫层向矿粒表面扩散;
7) S2O82-、Ag+与Fe3+被矿粒表面吸附;
8) 吸附的S2O82-和Fe3+均与镍黄铁矿和浸出生成的Ag2S反应,分别生成Ni2+、Fe2+、SO42-、S、Ag+,同时,Ag+与镍黄铁矿反应生成Ag2S、Ni2+、Fe2+;
9) 反应生成物Ni2+、Fe2+、SO42-和Ag+从矿粒表面解吸,而Ag2S附着在矿粒表面不溶反应产物元素硫层间;
10) Ni2+、Fe2+、SO42-与Ag+通过扩散离开矿粒表面穿过产物元素硫层进入溶液。
在超声波的作用下,上述过程的扩散比常规条件下的明显加强。由于超声波的波长远大于分子尺寸,在溶液中超声波本身不能直接对分子起作用,而是通过对分子周围环境的物理作用影响分子[16, 22]。在浸出过程中超声波主要是通过空化效应促进过程的传质。超声空化产生的冲击波和微射流的运动,会在浸出体系中产生涡流扩散很强的湍动效应,使微孔内物质扩散得到加强的微扰效应以及剥离、侵蚀、更新界面的表面等效应,一方面改善了传质条件,加快了传质速率,促进S2O82-、Ag+和Fe3+向硫化镍精矿表面的扩散以及产物Ni2+、Fe2+和SO42-向外的扩散;另一方面,能使硫化镍精矿颗粒表面上的不溶产物元素硫层产生裂隙、震动脱落甚至能直接破碎矿粒,导致镍精矿颗粒不断裸露出新鲜的反应界面,从而增大与氧化剂S2O82-与催化剂Ag+的接触面积。由于未反应的硫化镍精矿颗粒表面的元素硫层被破坏甚至脱落、以及部分矿物本身被破碎,因此,S2O82-、Fe3+和Ag+等向矿粒表面扩散的路径以及Ni2+、Fe2+和SO42-等向外扩散的路径大大缩短,从而加速了镍的浸出反应,提高了镍的浸出率。
在浸出过程中,起主导作用的是S2O82-,镍黄铁矿被氧化浸出主要是S2O82-与其直接和间接混合作用的结果;少量银盐的存在主要起到改变矿物表面的电化学性质,催化镍黄铁矿氧化还原浸出反应进行的作用[23]。
4 结论
1) 在一定搅拌速度下内(100~600 r/min),在超声波作用下搅拌速度对镍浸出率影响不明显,即外扩散对浸出过程没有显著地限制作用。在一定粒度范围(74~246 μm)内,粒度的变化对镍浸出效果也不大。
2) 镍的浸出率随着Na2S2O8浓度的增加而增大。随着温度的升高,镍浸出率增大,但是当温度高于70 ℃后,浸出率的增加不明显。浸出过程反应速率受界面化学反应控制。
3) 在浸出过程中,起主导作用的是S2O82-。少量银盐的存在改变了矿物表面的电化学性质,对浸出反应有促进作用。
4) 通过对体系浸出过程动力学参数的考察,发现其符合缩核模型,过程总体反应速率受界面化学反应控制,表观活化能为39.67 kJ/mol,过程的宏观动力学方程可表达为
![]()
![]()
REFERENCES
[1] 张卫民, 谷士飞. 银离子对低品位原生硫化铜矿石细菌浸出的催化[J]. 金属矿山, 2006(8): 26-29.
ZHANG Wei-min, GU Shi-fei. Effect of silver ion on bioleaching of low-grade primary copper sulfide ores[J]. Metal Mine, 2006(8): 26-29.
[2] 何焕华, 蔡乔方. 中国镍钴冶金[M]. 北京: 冶金工业出版社, 2000: 541-557.
HE Huan-hua, CAI Qiao-fang. Nickel and cobalt metallurgy of China[M]. Beijing: Metallurgical Industry Press, 2000: 541-557.
[3] 黄其兴. 镍冶金学[M]. 北京: 中国科学技术出版社, 1990: 395-399.
HUANG Qi-xing. Nickel metallurgy[M]. Science and Technology of China Press, 1990: 395-399.
[4] 《有色金属提取冶金手册》编辑委员会. 有色金属提取冶金手册铜镍[M]. 北京: 冶金工业出版社, 2000: 433-441.
《Non-ferrous Metal Extraction Metallurgy Handbook》Edition Committee. Copper-nickel of non-ferrous metal extraction metallurgy handbook[M]. Beijing: Metallurgical Industry Press, 2000: 433-441.
[5] 李忠国. 硫化镍矿的湿法冶金应用基础研究[D]. 沈阳: 东北大学, 2006.
LI Zhong-guo. The basic research of nickel sulfide hydrometallurgical applications[D]. Beijing: Northeastern University, 2006.
[6] 赵由才, 牛冬杰. 湿法冶金污染控制技术[M]. 北京: 冶金工业出版社, 2003: 55-64.
ZHAO You-cai, NIU Dong-jie. Pollution control technology hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 2003: 55-64.
[7] 马荣骏. 湿法冶金新发展[J]. 湿法冶金, 2007, 26(1): 1-12.
MA Rong-jun. New development of hydrometallurgy[J]. Hydrometallurgy of China, 2007, 26(1): 1-12.
[8] ANDREY Z Z, SHEINDLIN A E. Use of low-cost aluminum in electric energy production[J]. Journal of Power Source, 2006, 157: 921-926.
[9] 李洪桂. 冶金原理[M]. 北京: 科学出版社, 2005: 291-316.
LI Hong-gui. Principles of metallurgy[M]. Beijing: Science Press, 2005: 291-316.
[10] 蒋小辉, 卢毅屏, 冯其明, 欧乐明, 张国范. 强氧化剂常温浸出黄铜矿及机理探讨[J]. 有色金属, 2008, 60(2): 62-65.
JIANG Xiao-hui, LU Yi-ping, FENG Qi-ming, OU Le-ming, ZHANG Guo-fan. Chalcopyrite leaching at ambient temperature with oxidants and mechanism investigation[J]. Nonferrous Metals, 2008, 60(2): 62-65.
[11] 范兴祥, 彭金辉, 黄孟阳, 张 敏, 张利波. 浸出黄铜矿的新工艺研究[J]. 矿冶工程, 2005, 25(3): 58-62.
FAN Xing-xiang, PENG Jin-hui, HUANG Meng-yang, ZHANG Shi-min, ZHANG Li-bo. Study on innovative process of leaching of chalcopyrite[J]. Mining and Metallurgical Engineering, 2005, 25(3): 58-62.
[12] 陈世琯. 超声波在湿法冶金中的应用[J]. 上海有色金属, 2003(3): 142-146.
CHEN Shi-guan. Application of ultrasound in hydrometallurgical processes[J]. Shanghai Nonferrous Metals, 2003(3): 142-146.
[13] KAR R N, SUKLA L B, SWAMY K M, PANCHANADIKAR V V, NARAYANA K L. Bioleaching of lateritic nickel ore by ultrasound[J]. Metallurgical and Materials Transactions B, 1996, 27: 351-354.
[14] PESIC B, ZHOU Tai-li. Application of ultrasound in extractive metallurgy: Sonochemical extraction of nickel[J]. Metallurgical and Materials Transactions B, 1992, 23: 13-22.
[15] 佟志芳, 毕诗文. 高炉铝酸钙炉渣浸出过程动力学[J]. 过程工程学报, 2005, 8(5): 399-402.
TONG Zhi-fang, BI Shi-wen. Leaching kinetics of calcium aluminate slag[J]. The Chinese Journal of Process Engineering, 2005, 8(5): 399-402.
[16] ONCEL M S, INCE M, BAYRAMOGLU M. Leaching of silver from solid waste using ultrasound assisted thiourea method[M]. Amsterdam: Elsevier, 2003.
[17] ONCEL M S, INCE M, BAYRAMOGLU M. Leaching of silver from solid waste using ultrasound assisted thiourea method[J]. Ultrasonics Sonochemistry, 2005, 12(3): 237-242.
[18] 夏志华, 唐谟堂. 锌焙砂中浸渣高温高酸浸出动力学研究[J]. 矿冶工程, 2005, 25(2): 53-57.
XIA Zhi-hua, TANG Mo-tang. A study on the kinetics of leaching the residues from the neutral leaching process with high concentration of sulfuric acid at high temperature[J]. Mining and Metallurgical Engineering, 2005, 25(2): 53-57.
[19] 林智信. 物理化学?动力学?电化学?表面及胶体化学[M]. 武汉:武汉大学出版社, 2003: 32-36.
LIN Zhi-xin. Physical chemistry-dynamics-electrochemical- surface and colloid chemistry[M]. Wuhan: Wuhan University Press, 2003: 32-36.
[20] 吴一峰, 刘峙嵘. 铝土矿渣浸取动力学研究[J]. 化工矿物与加工, 2008(5): 9-11.
WU Yi-feng, LIU Zhi-rong. Study on leaching kinetics of bauxite residue[J]. Industrial Minerals and Processing, 2008(5): 9-11.
[21] 郑雅杰, 彭春丽. 机械活化硫铁矿还原Fe3+反应动力学[J].中南大学学报: 自然科学版, 2006, 35(3): 376-380.
ZHENG Ya-jie, PENG Chun-li. Kinetics of Fe3+ reduction by mechanical activated pyrite[J]. Journal of Central South University of Technology: Natural Science, 2006, 35(3): 376-380.
[22] NIEMCZEWSKI B. Chemical activation of ultrasonic cavitation [J]. Ultrasonics Sonochemistry, 1999, 6: 211-216.
[23] 王康林, 韩效钊. 银离子在细菌浸出黄铜矿中的催化行为研究[J]. 矿冶工程, 2003, 23(5): 60-62.
WANG Kang-lin, HAN Xiao-zhao. The research of silver ions in the bacterial leaching of chalcopyrite in the catalytic behavior[J]. Mining and Metallurgical Engineering, 2003, 23(5): 60-62.
(编辑 杨 华)
基金项目:国家自然科学基金资助项目(50874087, 50978212)
收稿日期:2009-03-09;修订日期:2009-08-25
通信作者:薛娟琴,教授,博士;电话:13186038833;E-mail: huagong1985@163.com


