硫酸铵存在下碘化物-氯化十四烷基二甲基苄基铵-异丙醇体系萃取分离汞
河南师范大学化学与环境科学学院河南高等学校环境科学与工程重点开放实验室,河南师范大学化学与环境科学学院河南高等学校环境科学与工程重点开放实验室,河南师范大学化学与环境科学学院河南高等学校环境科学与工程重点开放实验室,河南师范大学化学与环境科学学院河南高等学校环境科学与工程重点开放实验室,河南师范大学化学与环境科学学院河南高等学校环境科学与工程重点开放实验室 河南新乡453002
平顶山工学院环境工程系,河南平顶山467001 ,河南新乡453002
洛阳师范学院化学系,河南洛阳471000 ,河南新乡453002 ,河南新乡453002 ,河南新乡453002
摘 要:
研究了硫酸铵存在下碘化物 氯化十四烷基二甲基苄基铵 异丙醇体系萃取分离汞的行为及其与常见离子的分离条件。实验表明 :当异丙醇的加入量为 3 0 0ml, Zeph ( 1 0× 10 - 2 mol·L- 1 ) 和KI ( 0 1mol·L- 1 ) 加入量均为 1 0ml, 溶液的总体积为 10 0ml , 硫酸铵的加入量为1 5 0g , 控制pH =1.0 , 能使Hg (Ⅱ ) 从Fe3+ , Co2 + , Ni2 + , Zn2 + , Mn2 + , Al3+ 等离子混合液中分离出来。
关键词:
中图分类号: O658.2
收稿日期:2002-12-17
基金:河南省创新人才工程项目 (教高〔2 0 0 1〕5 13号 );
Extraction Separation of Mercury (Ⅱ) by Iodide-Tetradecylbenzyldimethyl Ammonium Chloride-Iso-Propyl Alcohol System in the Presence of Ammonium Sulphate
Abstract:
A iodide tetradecylbenzyldimethyl ammonium chloride iso propyl alcohol extraction system for the separation of Hg 2+ , Fe 3+ , Co 2+ , Ni 2+ , Zn 2+ , Mn 2+ , Al 3+ in iso propyl alcohol and water phase containing salts was studied. It shows that the extraction mechanism of Hg (Ⅱ) is based on the association of metal anions (HgI 4 2- ) with protonated iso propanol molecules {as (AH +) 2·HgI 4 2- }, or with Zeph {as (R 4N +) 2·HgI 4 2- }. The optimum condition of extraction was found to be 30% ( V/V ) iso propanol, 1.00 ml of 1.0×10 -2 mol·L -1 Zeph, 1.00 ml of 0.1 mol·L -1 KI solution and 0 15 g·ml -1 (NH 4) 2SO 4 at pH1.0. It is concluded that this method can be applied to the separation of Hg 2+ from Fe 3+ , Co 2+ , Ni 2+ , Zn 2+ , Mn 2+ , Al 3+ . No toxic extractor is involved and the extraction efficiency is high.
Keyword:
extraction spectration; iso propanol; tetradecylbenzyldimethyl ammonium chloride (Zeph) ; mercury;
Received: 2002-12-17
在无机盐存在下, 利用乙醇、 丙醇、 异丙醇作为萃取溶剂的萃取体系已有报道
1 实验部分
1.1 主要试剂与仪器
异丙醇 (A.R., 新乡市化学试剂厂) ; 硫酸铵 (A.R., 北京化工厂) ; 0.1 mol·L-1碘化钾 (A.R., 山东省化学研究所) ; 1.0×10-2 mol·L-1十四烷基二甲基苄基铵水溶液 (Zeph) (A.R., 东京化成工业株式会社) ; 缓冲溶液 (pH=1~6) 按文献
1.2 实验方法
于25 ml磨口比色管中, 加入一定量的异丙醇及KI溶液、 Zeph溶液和被研究的金属离子溶液, 2.0 ml缓冲溶液并用水稀释至10 ml, 再加一定量固体 (NH4) 2SO4, 振摇1~2 min, 放置片刻, 使溶液分为异丙醇/水两相, 移取异丙醇相或下层盐水相测量金属离子浓度, 计算萃取率 (E%) 。
2 结果与讨论
2.1 异丙醇与水溶液分相条件选择
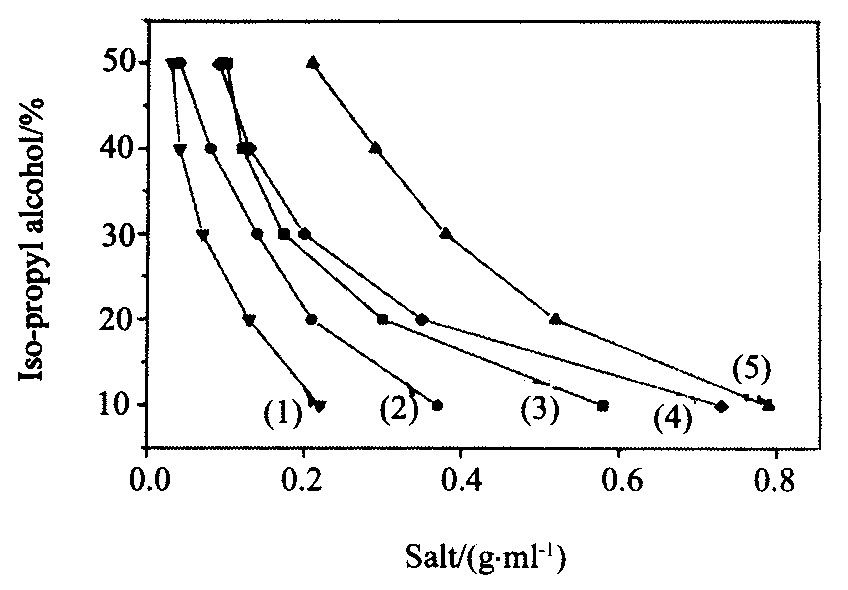
固定水溶液中异丙醇浓度, 分别加入不同量的NaCl, NaNO3, NaH2PO4, KH2PO4, Na2CO3, (NH4) 2SO4。 实验发现, 除了KH2PO4之外, 其余盐均能使异丙醇与水分相。 不同浓度的异丙醇水溶液, 其分相时所需盐用量见图1。 异丙醇的浓度越大, 分相时盐的用量相应减少。 原因可能是当溶液中的水用于盐的水合作用到一定程度时, 异丙醇与水才能分相。 在加入质量相同的盐中, 几种盐的分相能力按Na2CO3, (NH4) 2SO4, NaCl, NaH2PO4, NaNO3 的顺序递减。 这表明二价阴离子具有较强的盐析作用及分相能力。 Na2CO3的分相能力大于 (NH4) 2SO4, 这与CO32-的水合作用大于SO42-的情况相一致
图1 不同盐浓度对异丙醇与水分相时异丙醇浓度的影响
Fig.1 Effect of salt concentration on concentration of iso-propyl alcohol in phase separation
(1) Na2CO3; (2) (NH4) 2SO4; (3) NaCl; (4) NaH2PO4; (5) NaNO3 (总体积10 ml)
固定异丙醇加入量为3.0 ml, 溶液总体积为10 ml, 试验了溶液酸度变化至异丙醇与水刚好分相时 (NH4) 2SO4 的用量。 当pH=0和pH大于1.0时, 分析时所需 (NH4) 2SO4加入量分别为1.80, 1.40 g, 继续增加溶液的pH值, 相分离所需盐的用量不再改变。 酸度高时 (pH=1.0) , 分相所需盐的用量增加, 是由于高酸度下SO42-转化为HSO-4, 致使盐析作用减弱的缘故。
上述条件不变时, 相分离时析出异丙醇相体积与 (NH4) 2SO4用量有关。 当 (NH4) 2SO4用量为1.40 g, 析出异丙醇相体积为2.6 ml, 这表明相分离时, 部分异丙醇仍留在水相; 当 (NH4) 2SO4用量增至1.50 g 时, 测得异丙醇相体积为3.02 ml, 表明异丙醇与水分相程度趋于完全。 这与在实验过程中选择加入1.50 g (NH4) 2SO4 时能使Hg (Ⅱ) 定量萃取相一致。
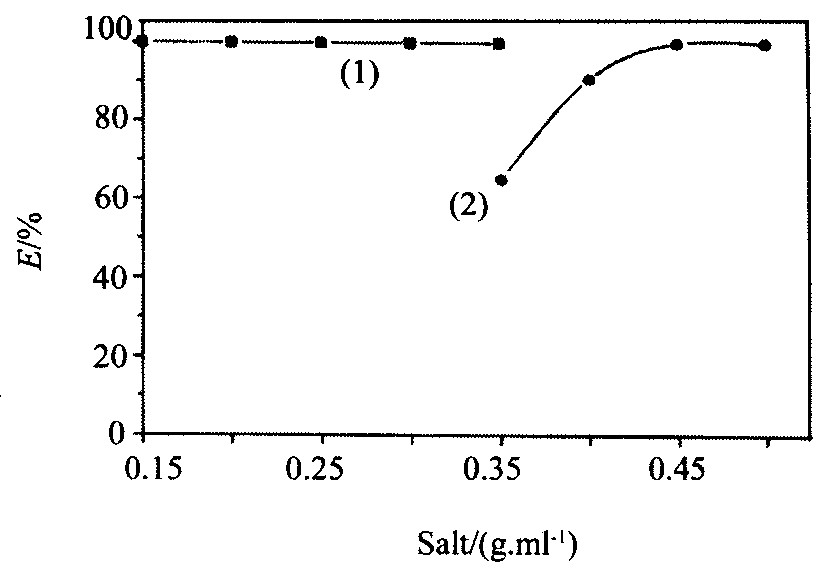
2.2 不同盐对Hg (Ⅱ) 萃取率的影响
在异丙醇与水分相条件下, 分别试验了NaCl, NaNO3, (NH4) 2SO4用量对Hg (Ⅱ) 萃取率的影响 (图2) 。 其中以 (NH4) 2SO4效果最好, 当其用量在1.5 g以上时, 均能使Hg (Ⅱ) 定量萃取。
2.3 Zeph用量对Hg (Ⅱ) 萃取率的影响及萃取机制
固定 (NH4) 2SO4用量为1.5 g, 0.1 mol·L-1的KI加入量为1.00 ml, 其他条件同图1。 无Zeph存在时, Hg (Ⅱ) 的萃取率只有75%左右; 当1.0×10-2 mol·L-1的Zeph水溶液加入量在0.50 ml以上时, Hg (Ⅱ) 的萃取率可达100%, 本实验中选择Zeph用量为1.00 ml。 如果分别用氯仿、甲苯代替异丙醇, 无Zeph存在时, Hg (Ⅱ) 不被萃取。 由此推测萃取Hg (Ⅱ) 的机制可能是:
图2 不同盐对Hg (Ⅱ) 萃取率的影响
Fig.2 Effect of different salt on E% of Hg (Ⅱ)
(Hg2+:50μg;Zeph (1.0×10-2 mol·L-1) ;KI (0.1 mol·L-1) ;1.00 ml;异丙醇3.00 ml;总体积10 ml) (1) (NH4) 2SO4 (1.5~3.0 g) ;NaCl (2.0~3.5 g) ; (2) NaNO3
(1) 有KI而无Zeph存在时, 质子化的异丙醇 (AH+) 与Hg (Ⅱ) 和I-形成的HgI42-缔合使部分Hg (Ⅱ) 进入异丙醇相。
2AH++HgI42-→ (AH+) 2·HgI42-
(异丙醇相)
由于HgI42-带电荷而不能被惰性溶剂氯仿、甲苯萃取。 如果无KI时, Hg (Ⅱ) 也不被异丙醇相萃取。
(2) Zeph (阳离子部分以R4N+表示) 能与络合阴离子形成多元络合物。 Zeph存在时能使Hg (Ⅱ) 的萃取率由75%提高到100%, 这表明R4N+也能与HgI42-缔合使Hg (Ⅱ) 进入异丙醇相。
2 R4N++HgI42-→ (R4N+) 2·HgI42-
(异丙醇相)
可见, 作为萃取溶剂的异丙醇, 既能萃取带电络合物HgI42-, 又能萃取电中性离子缔合物 (R4N+) 2·HgI42-, 而不能萃取简单金属离子。
2.4 酸度对不同金属离子萃取率的影响
当异丙醇用量为3.0 ml, Zeph (1.0×10-2 mol·L-1) 和KI (0.10 mol·L-1) 加入量均为1.0 ml, 溶液总体积为10.0 ml时, (NH4) 2SO4 加入量为1.50 g, 试验了酸度对不同金属离子的萃取率的影响见图3。 由图可见, 在 (NH4) 2SO4 存在下, KI-zeph-异丙醇体系中, Fe3+, Co2+, Ni2+, Zn2+, Mn2+, Al3+萃取率很低或根本不被萃取。 控制一定条件, 有可能使Hg (Ⅱ) 与这些离子得到分离。
图3 酸度对金属离子萃取率的影响
Fig.3 Effect of pH on E% of metal ions
各种离子加入量:50μg; (NH4) 2SO4:1.5 g;其他条件如图1
2.5 分离实验
在2.3节条件下, 分别试验了二元或多元合成样中Hg (Ⅱ) 与Fe3+, Co2+, Ni2+, Zn2+, Mn2+, Al3+的分离情况, 结果见表1和表2。
由表1和表2的分离实验表明, 硫酸铵存在下碘化物-氯化十四烷基二甲基苄基铵-异丙醇体系能使Hg2+从Fe3+, Co2+, Ni2+, Zn2+, Mn2+, Al3+的混合液中定量分离出来, 且各离子的分离情况与其单独存在时的的萃取行为相同, 因此对单个离子萃取行为的研究可以估计其在混合液中的萃取情况。 特别是Hg2+与Zn2+性质相同, 且汞又是有毒元素, 其测定又常受上述离子干扰。 故该体系的研究对分离测定Hg2+是一项很有意义的工作。
表1 两个离子之间的分离*
Table 1Separation and determination results of binary mixed ions*
混合离子 |
不同加入量金属离子的萃取率/E% |
|||||
Hg |
Mea | Hg | Meb | Hg | Mec | |
Hg2+~Zn2+ |
100 | 0 | 100 | 0.3 | 100 | 0 |
Hg2+~Fe3+ |
100 | 2.7 | 100 | 0 | 100 | 1.3 |
Hg2+~Co2+ |
100 | 0.3 | 100 | 1.0 | 100 | 0.5 |
Hg2+~Ni2+ |
100 | 1.8 | 100 | 0 | 100 | 0.2 |
Hg2+~Mn2+ |
100 | 0 | 100 | 0 | 100 | 0 |
Hg2+~Al3+ |
100 | 0 | 100 | 1.0 | 100 | 0 |
* (pH=1.0) ; Hg2+的加入量:50 μg; Me 表示除Hg2+以外的其他离子; a, b, c分别表示加入Me的量:50, 100, 500 μg
表2 多个离子混合液的分离*
Table 2 Separation of from multiple-mixed ions
混合 离子 |
Fe3+, Co2+, Ni2+, Zn2+, Mn2+, Al3+加入量:100 μg |
|
Hg2+ (10 μg) |
Hg2+ (50 μg) | |
E/% |
98.3 | 99 |
参考文献
[1] 李全民, 张青芬, 刘 奇.硫酸铵水杨基荧光酮乙醇体系萃取分离[J].分析化学, 1997, 25 (10) :1143.
[2] 李全民, 张青芬, 刘 奇. 液液萃取浮选分离Ni (Ⅱ) , Co (Ⅱ) , Fe (Ⅲ) 的研究[J].分析试验室, 1998, 17 (2) :30.
[3] 李全民, 申义阳, 张丽敏, 等. 硫酸铵存在下碘化物结晶紫丙醇萃取体系分离镉[J].分析化学, 1998, 26 (9) :1071.