新型Ni-Cu复合镀层的制备
楚 广,刘生长
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘 要:
摘 要:采用复合电镀方法,在镀镍液中加入粒径为5~10 ?m的铜微粒(晶粒粒径为52 nm)制备Ni-Cu复合镀层,探讨阴极电流密度、镀液的pH值与温度、搅拌速度、铜微粒含量和镍离子浓度对Ni-Cu复合镀层中铜微粒共析量的影响。结果表明,最佳镀液组成和工艺参数如下:七水合硫酸镍250~300 g/L,六水合氯化镍30~60 g/L,硼酸35~40 g/L,十二烷基硫酸钠0.05~0.1 g/L,pH值3.5~4.0,温度55~60 ℃,阴极电流密度2~3 A/dm2,搅拌速度为500~600 r/min,铜粉质量浓度8~9 g/L;镀层致密且铜微粒分布均匀; Ni-Cu复合镀层中铜的质量分数在5%~30%之间,其显微硬度HV0.2在450~750之间,且随镀层中铜含量的增大而增大,表现出高硬度的特点。
关键词:
中图分类号:TQ153.2 文献标识码:A 文章编号:1672-7207(2007)03-0474-06
Preparation of Ni-Cu composite coating by composite electroplating
CHU Guang, LIU Sheng-zhang
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The Ni-Cu composite electrodeposition was prepared by composite electroplating when the Cu particles with 5-10 μm in size(the grain size is 52 nm) were put into the solution of Ni electroplating. The effects of cathode current density, pH value, temperature of solution, stirring rate, Cu particle content and concentration of Ni2+ on the content of Cu in Ni-Cu composite deposits were investigated to obtain tight Ni-Cu composite coating. The experimental results show that the optimal technological condition is as follows: NiSO4?7H2O, 250-300 g/L; NiCl2?6H2O, 30-60 g/L; H3BO3, 35-40 g/L; C12H25SO4Na, 0.05-0.10 g/L; pH value, 3.5-4.0; temperature, 55-60 ℃; cathode current density, 2-3 A/dm2; stirring rate, 500-600 r/min; Cu content in solution, 8-9 g/L. The results of SEM and EDS analysis indicate that the Ni-Cu composite coating is dense and Cu particles in composite coating distribute uniformly; Cu content in the composite coating ranges from 5% to 30%. The microhardness (HV0.2) is between 450 and 750, increasing with the increase of Cu content in the composite coating. The composite coatings show the characteristic of high hardness.
Key words: copper; nickel; composite electrodeposition; preparation
复合电镀是指用电镀的方法,使金属与无机颗粒、有机颗粒或金属颗粒共同沉积,以形成复合镀层的方法。运用复合电镀,可以获得许多具有特殊功能的复合材料镀层,如耐磨镀层、耐高温镀层、减磨镀层、耐磨自润滑镀层、高温耐磨镀层、高温自润滑镀层、耐腐蚀镀层、分散强化镀层、特殊装饰性彩色镀层等,它们在机械工业、航空工业、汽车工业以及电子工业与航天工业中有着广阔的使用前景,可以胜任单金属镀层与合金镀层无法胜任的场合。同时,除在水溶液中沉积复合镀层外,还可以从非水溶液中沉积复合镀层[1-6]。我国于20世纪70年代开始研究复合电镀技术,天津大学进行了镍-金刚石复合镀层工艺的研究;哈尔滨工业大学开展了Ni-SiC、Fe-Al2O3、Fe-SiC等复合镀层的电镀工艺研究;武汉材料保护研究所于20世纪70年代末、80年代初开展了镍-氟化石墨和铜-氟化石墨复合电镀工艺的研究;天津大学开展了具有电接触功能复合镀电沉积工艺的研究[7]。
本实验所用具有纳米晶结构的铜粉粒径为5~10 ?m[8],具有较高的化学稳定性,较高的硬度,生产成本低。本文作者提出了在电镀镍溶液中加入铜微粒制备Ni-Cu复合沉积层的新方法,并就其影响因素进行研究。
1 实 验
1.1 镀液组成及工艺条件
镀液采用普通镀镍电解液(硫酸盐低氯化物型镀镍电解液),镀液组成及工艺条件如下:
NiSO4?6H2O,250~300 g/L; NiCl2?6H2O,30~60 g/L; H3BO3,35~40 g/L; C12H26SO4Na(十二烷基硫酸钠),0.05~0.10 g/L; pH值,3~4; 温度,45~60 ℃; 阴极电流密度,2~3 A/dm2;Cu粉,8 g/L;搅拌速度,500 r/min;电解时间,3~4 h。
其中,NiSO4?6H2O和NiCl2?6H2O均为分析纯试剂,而C12H26SO4Na(十二烷基硫酸钠)则为化学纯试剂。各试剂的作用如下:硫酸镍是镀镍电解液的主盐,为电解提供镍离子;氯化镍中的氯离子为阳极活化剂,防止阳极钝化,同时又为溶液提供镍离子,增加溶液的电导率;H3BO3是缓冲剂,用来调整电解液的pH值;C12H26SO4Na(十二烷基硫酸钠)为润湿剂或称针孔防止剂,能改善电解液对电极表面的润湿性能,使氢气不易吸附在电极表面上,从而减少或消除针孔的发生。
1.2 实验方法及装置
电镀槽为500 mL烧杯,内置搅拌磁子,外部配置有DF-101B集热式恒温磁力搅拌器,阴极片为0.2 mm×58 mm×40 mm的分析纯铜片,其背面用AB胶封住,阳极为镍块。电镀时,采用恒电流方法,搅拌方式为磁力搅拌。实验装置如图1所示。
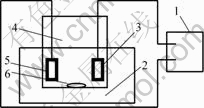
1—电源; 2—磁力搅拌器; 3—阳极; 4—电镀槽;
5—阴极; 6—磁力搅拌子
图1 复合电镀装置示意图
Fig.1 Sketch diagram of composite electroplating device
1.3 复合镀层中铜粉含量及镀层表面形貌的分析测试
扫描电子显微镜(SEM)是利用初级电子束轰击材料表面产生的二次电子和背散射电子进行成像观测微区表面形态,其附件——能量色散谱仪(EDS)可以探测样品某一微区的化学成分。
将镀层从阴极片上剥下,经洗涤、干燥、称量后,利用JSM-6360LV型扫描电镜观察复合镀层的表面形貌及X射线能谱分析仪测试出铜粉的含量。
采用日本岛津HMV-2型全自动显微硬度计(数显),按GB/T4342—91测试金属Ni-Cu复合镀层样品的显微硬度,载荷为200 g,保持30 s,每个样品测试4个点。
2 结果和讨论
2.1 阴极电流密度对镀层中铜含量的影响
图2所示为阴极电流密度与镀层中铜含量的关系。从图2可知,当阴极电流密度J小于2 A/dm2时,镀层中铜含量随着阴极电流密度的增加而增大;当阴极电流密度J接近2 A/dm2时,镀层中铜含量最大;当阴极电流密度J超过2 A/dm2时,镀层中铜含量基本上不随电流密度的变化而变化,反而稍微有点下降。
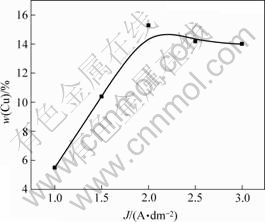
图2 阴极电流密度与镀层中铜含量的关系
Fig.2 Relationship between current density of cathode and Cu content in composite coatings
在复合电镀过程中,一方面,随着阴极电流密度增大,基质金属的沉积速度提高,极限时间缩短,表明单位时间内可能被嵌入的微粒数量越多;另一方面,阴极电流密度增大,阴极的过电位会相应地增高,电场力增强,阴极对吸附了正离子的固体微粒的静电引力增强,此时对微粒与基质金属的复合共沉积有一定的促进作用。然而,当阴极电流密度太大时(本实验中,大于2 A/dm2),微粒被输送到阴极附近并被嵌入沉积层的速度落后于基质金属的沉积速度。此外,由于镶嵌在阴极表面的微粒的导电能力较弱,遮盖了部分阴极表面,从而使阴极实际面积减小而真实电流密度增大,进一步提高了阴极过电位,导致H2析出量增加。这样,不仅会妨害微粒在电极上的吸附,同时,析氢还可能冲刷掉未在阴极上嵌牢的部分微粒,进而影响到与基质金属的共沉积行为,使沉积层内微粒的相对含量下降。
2.2 镀液温度对镀层中铜含量的影响
图3所示为镀液温度与镀层中铜含量的关系。从图3可知,当温度在40~45 ℃之间变化时,镀层中的铜含量略有增加,但增幅不大;而当温度从45 ℃上升至55 ℃时,镀层中的铜含量急剧增加,在55 ℃达到最大值;但当温度超过55 ℃后,镀层中的铜含量又急剧下降。这是由于随着温度的升高,镀液粘度下降,有利于颗粒的输送,镀液中离子的热运动也随温度的升高而加强,同时使铜微粒的平均动能增加,所以,铜微粒在复合镀层中的含量随温度上升而增加。但温度过高会导致阴极过电位减少,还会减少铜微粒对阳离子的吸附力,从而不利于铜微粒嵌入镀层。因此,铜微粒在复合镀层中的含量随温度的继续升高而下降。可见,55 ℃为本实验温度的最佳值。
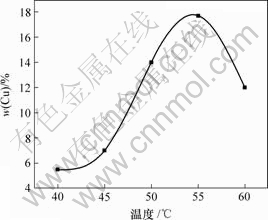
图3 镀液温度与镀层中铜含量的关系
Fig.3 Relationship between temperature of solution and Cu content in composite coatings
2.3 pH值对镀层中铜含量的影响
图4所示为pH值与镀层中铜含量的关系。从图4可知,镀层中铜含量先随着pH值的增大而增大。当pH值大于4时,镀层中铜含量随着pH值的增大而减小,这是因为:当镀液pH值较低时,氢离子吸附在铜微粒表面上,使其表面呈正电性,有利于铜微粒在电场力作用下向阴极移动,但此时在阴极表面上有大量氢气析出,反而不利于共沉积的进行;随着pH值的升高,镀液中氢离子浓度下降,电镀时氢气的析出量减少,降低了析氢对铜微粒在阴极表面吸附所产生的不利影响,有利于复合量和沉积速率的提高;但若pH值过高,有可能造成阴极表面局部碱化,产生高度分散的镍的氢氧化物,导致镍离子浓度降低,同时镀液中氢离子数量减少,使铜微粒吸附的正电荷数减少,导致在电场力的作用下到达阴极表面的铜微粒数量减少,并且镀层脆性增大。因此,pH值应控制在3.5~4.0之间为宜。
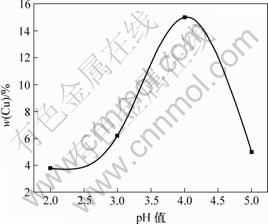
图4 pH值与镀层中铜含量的关系
Fig.4 Relationship between pH value and Cu content in composite coatings
2.4 搅拌速度对镀层中铜含量的影响
图5所示为搅拌速度与镀层中铜含量的关系。从图5可知,当镀液的搅拌速度低于600 r/min时,镀层中的铜含量随搅拌速度的增大而增加;当镀液的搅拌速度等于600 r/min时,镀层中铜含量达到最大值;当镀液的搅拌速度超过600 r/min时,镀层中铜含量随搅拌速度的增大而减少。这是因为:在其他条件不变的情况下,随着搅拌速度的提高,镀液中铜微粒的传输加快,使其撞击复合镀层的频率增大,搅拌还使镀液中微粒充分悬浮,有利于铜微粒沉积在阴极上;但当搅拌速度超过600 r/min后,铜微粒难以在阴极表面上吸附,同时还会使已经黏附在阴极表面但尚未被基质金属嵌牢的铜微粒在运动着的铜微粒和镀液切向力的冲击下,脱离阴极表面重新进入到镀液中,不利于共沉积过程的进行。因此,本实验中选取的最佳搅拌速度为500~600 r/min。
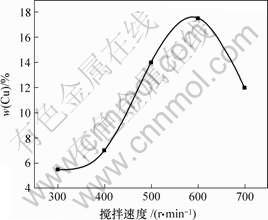
图5 搅拌速度与镀层中铜含量的关系
Fig.5 Relationship between stirring velocity and Cu content in composite coatings
2.5 镀液中铜粉质量浓度对镀层中铜含量的影响
图6所示为镀液中铜粉质量浓度与镀层中铜含量的关系。由图 6可见,出现了3种现象:a. 当镀液中铜粉质量浓度小于9 g/L左右时,随着镀液中铜微粒的增加,镀层中铜微粒的共析量显著上升;b. 当槽液中铜粉质量浓度达到9 g/L时,镀层中铜微粒的共析量达到最大值;c. 继续增大镀液中铜粉质量浓度时,复合镀层中铜微粒的共析量反而缓慢下降。 产生第1种现象的原因是:在相同的实验条件下,镀液中铜微粒数目越多,被输送到阴极附近并与阴极发生碰撞形成弱吸附的微粒也越多,由于铜微粒产生强吸附的形成速度和被嵌入阴极的几率与弱吸附覆盖度成正比,所以,镀层中铜微粒的共析量随着镀液中铜粉质量浓度的增加及弱吸附覆盖度的增大而相应增大。但当铜微粒数目达到一定程度后,弱吸附于阴极的铜微粒达到饱和,此时镀层中铜微粒的共析量达到峰值,因此产生第2种现象。不过,若继续增加铜粉质量浓度,反而会导致镀层中铜微粒的共析量下降。其原因在于:继续增加铜粉质量浓度会强化不利于共沉积的其他因素的作用,如铜微粒在镀液中相互碰撞产生团聚,铜微粒表面荷电程度降低以及因铜微粒吸附于电极表面,使电极表面提供电化学反应的面积减小,导致真实电流密度增大而引起电极表面析氢量增多,镍的沉积速度加快等因素,故会产生第3种现象[9-10]。
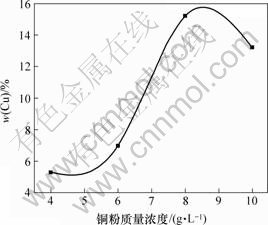
图6 铜粉质量浓度与镀层中铜含量的关系
Fig.6 Relationship between quantity of copper powders and Cu content in composite coatings
2.6 镍离子浓度对镀层中铜含量的影响
镀液中镍离子浓度过低时,易出现浓差极化,使镀液允许的电流密度上限降低,在高电流密度区镀层容易烧焦;镍离子浓度较高时,镀层沉积速度加快;镍离子浓度过高时,将降低镀液的分散能力和深镀 能力。
图7所示为镍离子质量浓度与镀层中铜含量的关系。从图中可以看出,当镀液中镍离子总质量浓度低于70 g/L时,镀层中铜含量与镀液中镍离子质量浓度几乎呈线性关系,且增幅比较大。但当镀液中镍离子质量浓度继续增加时,镀层中铜含量则不再变化,铜含量稳定在11%左右。这是由于溶液中的铜微粒对镍离子的有吸附作用,镍离子质量浓度越大,吸附了镍离子的铜微粒就越多,从而使更多的铜微粒能够沉积到阴极上;但当镍离子质量浓度超过一定值后,由于阴极表面积有限,接纳铜微粒的能力也有限,因此,铜含量基本不再变化。所以,本实验镀液中镍离子的最佳总质量浓度为70 g/L左右。
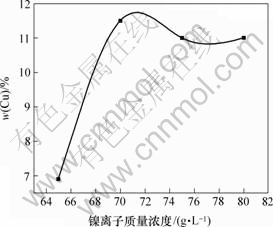
图7 镍离子浓度与镀层中铜含量的关系
Fig.7 Relationship between concentration of Ni2+ and Cu content in composite coating
2.7 SEM及X射线能谱(EDS)分析
图8所示为Ni-Cu复合镀层的EDS谱(工艺条件:镍离子浓度为300 g/L,pH值为4,电镀时间为4 h,温度为55 ℃,搅拌速度为400 r/min,铜粉含量为5 g/L,阴极电流密度为2.0 A/dm2),结果表明,镀层中铜的质量分数可达19.17%。
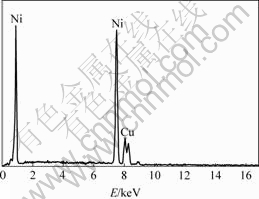
图8 Ni-Cu复合沉积层的EDS谱
Fig.8 EDS spectrum of Ni-Cu composite electrodeposition
电镀初期镀面较平整,基质镍中铜微粒含量较少, 随着沉积时间的增加,基质镍中铜微粒含量明显增多。以上现象与底材表面以及镀面的表面粗糙度有很大的关系。根据Guglielmi模型[10],在颗粒共沉积过程中,静电吸附与机械碰撞吸附同时存在。由于在沉积初 期,底材具有较低的粗糙度,会削弱底材表面俘获铜微粒的能力;随着沉积时间增加,铜微粒被包覆使得镀面的粗糙度逐渐升高,这增加了镀面机械俘获铜微粒的几率。图9所示为Ni-Cu复合镀层的SEM像。由图9可见,在沉积的基质金属镍中镶嵌着球状的铜微粒,结构致密、分布均匀,而且与镀前的铜微粒形状相似[8]。

图9 Ni-Cu复合镀层的SEM像(1000倍)
Fig.9 SEM image of Ni-Cu composite electrodeposition (×1000)
2.8 镀层显微硬度分析
分别选取实验中得到的铜含量不同的镀层进行显微硬度测试,得到不同铜含量镀层的显微硬度,如图10所示。从图10可以发现:当镀层中铜含量从10%增加到约15%时,镀层的显微硬度急剧增加(HV0.2达到750),与文献[7]中介绍的RE-Ni-W-9.5%P-15.2%SiC复合镀层在镀态时的显微硬度相当。当镀层中铜含量超过15%后,镀层的显微硬度增长很缓慢。其原因可能与本实验的微米铜粉具有纳米晶的结构和弥散强化作用有关,金属纳米材料具有很高的硬度[11-14]。从复合镀层的表面形貌可以看出,铜微粒的加入使得镀层晶粒细化,铜微粒与镀层结合紧密,粒子弥散分布在复合镀层内,对晶粒之间的滑移产生阻碍作用,使金属获得有效的强化,产生弥散强化效应。当镀层中铜微粒较少时,微粒间距较大,故强化作用较小,随镀层中铜微粒增多,微粒间距变小,强化作用增大。但当镀层中铜含量超过一定值后,镀层的晶格所受的强化影响逐渐减少直至消失,表现为显微硬度随铜含量的增加而趋于稳定。
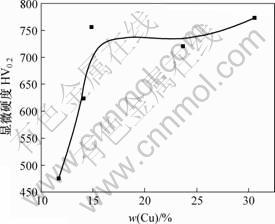
图10 显微硬度与镀层中铜含量的关系
Fig.10 Relationship between microhardness and Cu content in composite coating
3 结 论
a. 对Ni-Cu复合镀层的各因素影响进行研究,获到了致密、均匀的Ni-Cu复合镀层,其中铜含量(质量分数)在5%到30%之间,在镀态时的镀层的显微硬度(HV0.2)最高可达750,与RE-Ni-W-9.5%P-15.2%SiC复合镀层的显微硬度相当。
b. 最佳工艺条件如下:阴极电流密度,2~3 A/dm2;镀液温度,55~60 ℃;搅拌速度,500~600 r/min;镀液pH值,3.5~4.0;铜粉质量浓度,8~9 g/L;七水合硫酸镍,250~300 g/L;六水合氯化镍,30~60 g/L;硼酸,35~40 g/L;十二烷基硫酸钠,0.05~0.10 g/L。
c. Ni-Cu复合镀层可为具有纳米晶结构的铜粉的TEM测试提供试样,同时开辟一条新的制备纳米复合金属材料的新途径。
参考文献:
[1] LEE W H, Tang S C, Chung K C. Effects of direct current and pulse-plating on co-deposition of nickel and nanometer diamond powder[J]. Surface and Coatings Technology, 1999, 121(12): 607-611.
[2] GUO Zhong-cheng, LIU Hong-kang, YANG Xian-wan. Properties of electrodeposited amorphous Ni-W-P-SiC composite coatings[J]. Acta Metallurgica Sinica, 1996, 9(1): 44-48.
[3] Mandich N V, Dennis J K. Codeposition of nano-diamonds with chromium[J]. Metal Finishing, 2001, 99(6): 117-119.
[4] Benea L, Bonora P L, Borello A, et al. Wear corrosion properties of nano- structured SiC-nickel composite coatings obtained by electroplating[J]. Wear, 2001, 249(11): 995-1003.
[5] CHEN Xiao-hua, XIA Jin-tong, PENG Jing-cui, et al. Carbonnanotube metal-matrix composites prepared by electro less plating[J]. Composites Science and Technology, 2000, 60(2): 301-306.
[6] Gyttou P, Pavlato E A, Spyellis N, et al. Hardening modification of nickel matrix composite electrocoatings containing SiC nanoparticles[J]. Electroplating & Surface Treatment, 2001, 9(1): 23-28.
[7] 郭忠诚,杨显万. 电沉积多功能复合材料的理论与实践[M]. 北京: 冶金工业出版社, 2002: 81.
GUO Zhong-cheng, YANG Xian-wan. Theory and practice of multi-function composite materials electroplated[M]. Bejing: Metallurgical Industry Press, 2002: 81.
[8] CHU Guang, TANG Yong-jian, YANG Tian-zu. A new method to prepare big bulk-nanocrystalline Cu in large quantities[J]. Trans Nonferrous Met Soc China, 2006, 16(4): 873-877.
[9] PENG Qun-jia, MU Dao-bin, MA Ju-sheng, et al. Study on the mechanism of Ni/ZrO2 composite electrodeposition[J]. Electrochemistry, 1999, 5(1): 68-73.
[10] Gugliemi N. Kinetics of the deposition of inert particles from electrolyte baths[J]. Eletrochem Soc, 1972, 11(8): 1009-1012.
[11] 楚 广, 唐永建, 罗江山, 等. ICF物理实验用纳米Cu块体靶材的制备研究[J]. 强激光与粒子束, 2005, 17(12): 1829-1834.
CHU Guang, TANG Yong-jian, LUO Jiang-shan, et al. Research on synthesis of nanocrystalline copper target for ICF experiments[J]. High Powder Laser and Particle Beams, 2005, 17(12): 1829-1834.
[12] 张立德,牟季美. 纳米材料和纳米结构[M]. 科学出版社, 2002: 260-271.
ZHANG Li-de, MOU Ji-mei. Nanomaterials and nanostructure[M]. Beijing: The Science Press, 2002: 260-271.
[13] Nieman G W, Weertman J R. Mechanical behavior of nanocrystalline Cu and Pd[J]. J Mater Res, 1991, 6(5): 1012-1027.
[14] Sanders P G, Eastman J A, Weertman J R. Elastic and tensile behavior of nanocrystalline copper and palladium[J]. Acta Mater, 1997, 45(10): 4019-4025.
收稿日期:2006-09-30
作者简介:楚 广(1958-),男,湖南长沙人,高级工程师,从事纳米材料制备的研究
通讯作者:楚 广,男,高级工程师;电话: 0731-8836791,13507312949;E-mail: user12134@sina.com
[7] 郭忠诚,杨显万. 电沉积多功能复合材料的理论与实践[M]. 北京: 冶金工业出版社, 2002: 81.
[11] 楚 广, 唐永建, 罗江山, 等. ICF物理实验用纳米Cu块体靶材的制备研究[J]. 强激光与粒子束, 2005, 17(12): 1829-1834.
[12] 张立德,牟季美. 纳米材料和纳米结构[M]. 科学出版社, 2002: 260-271.
" target="blank">[14] Sanders P G, Eastman J A, Weertman J R. Elastic and tensile behavior of nanocrystalline copper and palladium[J]. Acta Mater, 1997, 45(10): 4019-4025.


