文章编号:1004-0609(2010)12-2357-09
锌电积用Pb/Pb-MnO2复合电催化阳极的制备及性能
李 渊1,蒋良兴1,倪恒发2,吕晓军1,赖延清1,李 劼1,刘业翔1
(1. 中南大学 冶金科学与工程学院,长沙 410083;2. 河南豫光锌业有限公司,济源 464530)
摘 要:
采用复合电镀技术制备Pb/Pb-MnO2复合电催化阳极,研究MnO2微粒晶型与粒径、电极构置、施镀时间和添加剂等对镀层中微粒含量的影响,利用正交实验确定阳极制备的最优条件,运用循环伏安和恒流极化等手段对复合阳极的析氧电催化性能进行评价。结果表明:通过工艺优化,可在氟硼酸盐镀铅体系中实现Pb基体上Pb-MnO2复合镀,获得MnO2微粒含量为1%~10%(质量分数)的复合镀层;模拟工业锌电积过程中,电解初始阶段复合阳极电位相比铅阳极降低约300 mV,经过24 h电解后,其稳定电位仍比铅阳极低100 mV,与工业Pb-Ag(0.6%,质量分数)阳极的稳定电位相当。
关键词:
锌电积;复合电镀;Pb/Pb-MnO2阳极;氟硼酸盐体系;析氧电催化;
中图分类号:O646 文献标志码:A
Preparation and properties of Pb/Pb-MnO2 composite anode for
zinc electrowinning
LI Yuan1, JIANG Liang-xing1, NI Heng-fa2, L? Xiao-jun1, LAI Yan-qing1, LI Jie1, LIU Ye-xiang1
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;
2. Henan Yuguang Zinc Industry Co., Ltd., Jiyuan 464530, China)
Abstract: A new type of Pb/Pb-MnO2 composite anode was prepared by composite electrodeposition, the effects of particle size and crystal of MnO2, electrodes configuration and electrodeposition time on the particles content in co-deposit were studied, and the optimum conditions of anode preparation were ascertained by orthogonal experiments. The electrocatalytic activity for oxygen evolution reaction (OER) of the composite anode was evaluated by cyclic voltammetry (CV) and galvanostatic polarization method. The results indicate that Pb/Pb-MnO2 composite deposit containing 1%~10% (mass fraction, %) MnO2 particles can be obtained in the fluoborate solution of lead plating. In the stimulant evaluation of industrial electrowinning, the composite anode prepared under the optimal conditions is about 300 mV, more active than the pure lead anode at the initial stage of electrolysis, and the stable potential after 24 h is 100 mV lower than that of pure lead anode, which is equal to that of Pb-Ag (0.6%) anode.
Key words: zinc electrowinning; composite electrodeposition; Pb/Pb-MnO2 anode; fluoborate system; oxygen evolution electrocatalysis
长期以来,湿法炼锌工业的电积过程一直采用Pb-Ag(0.6%~1.0%,质量分数)合金阳极[1-2],它虽然能满足锌电积的基本要求,但仍存在许多不足,如析氧过电位高(860 mV),铅的腐蚀产物会污染阴极锌,减短阳极寿命(尤其有Cl-存在时)。此外,铅密度大,机械强度低,易发生蠕变,挠曲造成阴阳极短路而降低电效。针对以上不足,人们研究了多种阳极材料力图改善或替代传统Pb-Ag阳极,主要集中在多元合金 化[3-8]和表面涂覆电催化性金属氧化物[9-14]两个方面,但这些工序或使阳极制作过程复杂,成本提高,或者
无法避免基底材料(如Ti)的阳极钝化,涂层容易被破坏,使用寿命不长,因而无法大规模地应用于工业生产中。部分学者[15-17]将复合电镀技术应用于湿法电沉积节能阳极的开发中,制备了Pb/Pb-Co3O4、Pb-Ca/Pb-CoTiO3、Al/Pb-Y(Y=WC、ZrO2、CeO2、Ag)等复合涂层阳极,发现此类阳极可在一定程度上降低析氧电位,减小腐蚀速率,使用寿命较长。因此,寻找有效的析氧催化剂,利用复合电镀技术制备出高电催化活性复合阳极是一个可行且有潜力的研究方向。
MnO2是最常用的析氧催化剂之一,电催化活性高且成本低廉。SCHMACHTEL和TOIMINEH[18]用冷喷涂技术(Cold spray technique)制备了Pb/Pb-MnO2复合阳极,发现其在电解初期析氧电位比Pb-Ag(0.6%)阳极的低250 mV,表现出优异的析氧电催化性能。但冷喷涂过程操作复杂,制备成本高,样品中颗粒之间靠塑性变形粘结在一起,未形成均相基质,各种缺陷多,阳极耐腐蚀性差。与此相比,复合电镀技术[19]工艺简单,操作条件易于控制,在样品制备过程中不会引起原料性质(如晶型和形貌等)的改变,形成均相基质具有较好的耐腐蚀性,避免了冷喷涂的不足。因此,本文作者采用复合电镀技术制备高催化活性的Pb/Pb-MnO2复合阳极,并对其复合电镀工艺和镀层的电化学性能进行研究。
1 实验
复合电镀体系中阳极和阴极均为20 mm× 20 mm×3 mm的纯铅块,并用绝缘胶密封,只保留20 mm×20 mm的工作面积。实验在250 mL烧杯中 进行,采用DF-101S集热式恒温磁力搅拌器,电源为固纬GPS1830D直流稳压电源。所用试剂均为分析纯,MnO2纯度大于99.5%(湖南汇通科技有限公司),镀液用去离子水配制。
复合电镀液的基本组成如下:Pb(BF4)2 120~150 g/L;HBF4 30~40 g/L;H3BO3 12~15 g/L;一定质量MnO2微粒;适量添加剂。
复合电镀的具体步骤如下。
1) 镀前处理:① 将被镀电极依次用220#、400#砂纸以及金相W28(01)砂纸打磨至光亮,然后用去离子水冲洗;② 在NaOH、Na2CO3、Na3PO4和Na2SiO3除油液中浸泡10~15 min,并用去离子水冲洗;③ 用30%醋酸溶液浸泡5~10 min,并用去离子水冲洗。
2) 复合电镀:① 反向电解。安装实验装置,反接阴阳极,以2 A/dm2电流处理电极3~5 min;② 预镀纯铅。正接电路,以4 A/dm2电流在阴极上电镀30 min;③ 复合电镀。加入微粒,并开动磁力搅拌,按预定条件复合电镀。
3) 镀后处理:① 将复合镀层在急水中冲洗3~5 min;② 在无水酒精中浸泡5~10 min,用冷风吹干后保存。
采用JSM-6360型扫描电镜(SEM)观察复合镀层的表面微观形貌,GENESIS60S型X射线能谱分析仪(EDX)测定其元素组成,并由式(1)计算镀层中MnO2微粒的质量分数:
![]() (1)
(1)
式中:MPb、MMn、MO分别为Pb、Mn、O的相对原子质量;n(Pb)/n(Mn)为EDX测定的Pb和Mn摩尔比。
采用三电极体系对纯Pb阳极、工业Pb-Ag(0.6%)阳极、Pb/Pb-MnO2阳极分别进行循环伏安和恒流极化测试,以比较其电催化性能。测试中工作电极为上述各种阳极,辅助电极采用铂片,参比电极采用饱和甘汞电极(SCE)。所用电解液组成为250 g/L ZnSO4+160 g/L H2SO4,体积200 mL。循环伏安测试在Parstat2273电化学综合测试仪上进行,扫描区间0~2.2 V,扫描速率10 mV/s。恒流极化的阳极电流密度为5 A/dm2,极化时间为24 h。温度采用DK-S24型电热恒温水浴锅控制在(35.0±0.5) ℃。
2 结果与讨论
2.1.1 电极构置形式的影响
复合电镀中电极的构置形式通常有两种:平置电极(Horizontal electrode)和竖置电极(Vertical electrode)。ZAHAVI和HAZAN[20]在Ni-金刚石复合电镀的研究中指出,在平置电极上微粒共沉积量明显大于竖置电极。本实验中也对这两种电极构置进行了研究,对应镀层的微观形貌如图1所示(黑色衬度:MnO2颗粒;灰白色衬度:Pb基质)。
图1所示为电极构置对镀层表面形貌和微粒含量的影响。图1(a)中MnO2微粒(含量为7.89%,质量分数)多分布在晶粒之间的沟渠中,而图1(b)中MnO2微

图1 电极构置对镀层表面形貌和微粒含量的影响
Fig.1 Influence of electrode configuration on surface morphologies and particle contents of deposits (Other experiment condition: γ-MnO2 (2-7 μm), particle suspension 80 g/L, current density 4 A/dm2, temperature 35 ℃): (a) Horizontal electrode (experiment agitation rate 550 r/min); (b) Vertical electrode (experiment agitation rate 400 r/min)
粒(含量为4.83%,质量分数)比较分散。这主要是由于2~7 μm的微粒在复合镀中已属较大微粒范畴,重力作用的影响不可忽略。研究表明[21],液体流过平板界面时,会产生几十到几百微米的流体边界层,在这个范围内流体流速(ν)相比本体流速(ν0)大大降低,微粒在其中的传质变差。另外,在电极表面附近,存在一层几十纳米厚的双电层,对微粒的有效吸附有重要的影响[22]。如图2所示,微粒在镀液中主要受重力(Fg),浮力(Fp)和流体冲击力(Fw)的作用,在双电层外,电场力很弱,可以忽略不计。电极平置时(图2(a)),由于边界层内流体流速降低,微粒所受冲击力减小,正好在重力作用下沉降到电极上。同时,平置电极表面的凹凸不平也有利于机械截留微粒,使其较容易地嵌入镀层中;反之,电极竖置时(图2(b)),边界层内微粒传质变差,重力作用使其迅速沉降,到达双电层的微粒量减少,而此时电极表面又不利于机械截留,因此,镀层中的微粒嵌入量较少。此外,在实际操作中,电极竖置时搅拌速率和电极极距等对微粒嵌入的影响较为复杂,电镀条件不易控制。 因此,本文作者采用平置电极进行复合电镀。
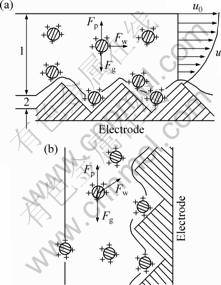
图2 不同构置下电极表面附近微粒的受力状态
Fig.2 Stress state of particles near electrode surface in different electrode configurations (1—Boundary layer; 2—Electrical double layer): (a) Horizontal electrode; (b) Vertical electrode
2.1.2 MnO2微粒晶型和粒径的影响
MnO2是常用的电池材料,也是有效的析氧催化剂,其矿物有多种晶型,最主要的是α、β、γ和δ型。研究表明[23],这些MnO2的普遍结构是[MnO6]八面体共用棱和共用顶,形成变化多端的复杂网络,其间可容纳各种不同的阳离子和配位物,因而锰的氧化物有多种多样的组成和晶体结构。单就催化活性而言,γ-MnO2中存在大量的Mn3+和空穴,使得其本体和表面都存在大量的“游离价电子”,这就决定了它具有相当好的催化活性[24]。本实验以常用的β和γ两种MnO2(粒径2~7μm)为分散相微粒进行研究,观察复合镀层的微观形貌(见图3),测定其中微粒含量,并分析两者共沉积机理。
图3所示为分别以β-MnO2和γ-MnO2为分数相时所获镀层的表面形貌。两镀层表面微观形貌相差不大,但γ-MnO2(含量为6.86%,质量分数)在镀层中的嵌入量远远大于β-MnO2(含量为1.69%,质量分数),这主要归因于它们晶体结构和表面状态的差异。CELIS等[25]五步沉积机理指出,悬浮在镀液中的微粒先吸附离子在表面形成溶剂化膜,而后迁移到电极表面发生共沉积。对MnO2而言,表面吸附和交换能力在很大程度上取决于其表面的—OH基,酸性—OH基中的H
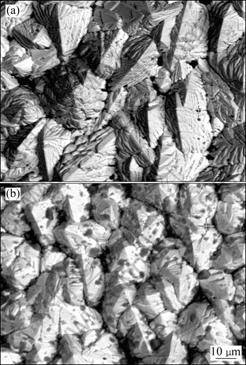
图3 分别以β-MnO2和γ-MnO2为分散相时所获镀层的表面形貌
Fig.3 Surface morphologies of deposits using β-MnO2 and γ-MnO2 as disperse phase (Experiment condition: particle suspension 80 g/L, current density 4 A/dm2, temperature 35 ℃, agitation rate 550 r/min, deposition time 60 min): (a) β-MnO2; (b) γ-MnO2
可被金属阳离子(如Ni2+、Zn2+和Co2+等)取代而使微粒带正电[26],这对共沉积是有利的。夏熙[23]指出,β-MnO2是标准的金红石型结构,具有理想的原子配比,结晶性良好,决定了它在本体和表面均不含—OH基,因而吸附性差,在复合电镀时难以嵌入镀层中;反之,γ-MnO2的晶体结构呈较大的[1×2]隧道,且表面存在大量的—OH基,在镀液中就可能吸附Pb2+和H+等阳离子而带正电,且其导电性又优于β-MnO2的,因此,γ-MnO2很容易吸附在阴极表面发生共沉积。
此外,本实验在控制电流密度(4 A/dm2)、温度(35 ℃)、施镀时间(60 min)等条件相同的前提下(搅拌速率调节至微粒刚好不堆积到电极表面),研究了γ-MnO2粒径(20~40 μm、2~7 μm、40 nm)对复合镀层中微粒含量的影响。结果表明,只有2~7 μm的γ-MnO2才能大量地嵌入到镀层中(含量为5.86%,质量分数),40 nm的次之(含量为1.49%,质量分数),而20~40 μm的微粒几乎不能进入镀层(含量为0.47%,质量分数)。可能的原因如下:纳米MnO2表面能很高,在溶液中极易团聚,镀液中微粒悬浮量一般不应超过10 g/L,这样获得的镀层微粒含量就比较小;而微米级微粒在镀液中稳定性好,团聚小,可以在很高的悬浮浓度(80~125 g/L)下进行复合镀,从而获得微粒含量高的镀层;但当粒径增至20~40 μm时,镀液对微粒的冲刷作用明显,微粒已经很难被镀层截留而形成有效的包覆,因而嵌入量很少。当然,纳米微粒在镀液中的悬浮状态可通过添加表面活性剂和加强搅拌等措施来改善,从而获得微粒含量高、催化活性好的复合镀层,有必要进行深入的探索。在本研究中,若无特殊说明,填充微粒均采用粒径为2~7 μm的γ-MnO2。
2.1.3 施镀时间的影响
在Pb/Pb-MnO2复合阳极上发生析氧反应时,实际上只有表层附近的分散微粒才起催化作用,镀层内部的微粒贡献甚少。同时,MnO2又是一种导电性比较差的材料,在镀层中会增加电极电阻,反而提高阳极电位。所以,阳极的析氧电催化效果实际上是MnO2电催化活性和导电性的综合结果。大量研究表明[22],在复合电镀的初始阶段,镀层中微粒含量特别高,但随施镀时间的增加,微粒含量逐渐减少,在本研究中也得出了相似的规律,结果如图4和5所示。这主要是因为:随施镀时间的增加,电化学整平作用使电极表面粗糙度逐渐降低,微粒捕获量减少;镀液中高浓度的MnO2微粒发生部分团聚,使进入镀层的微粒减少。因此,可通过合理控制施镀时间来控制镀层的厚度,使表层MnO2含量足够高,且电极电阻也比较低。
由图5可见,随着施镀时间增加,镀层变得平整,表层嵌入微粒粒径及数量逐渐减小,与上述论证一致。此外,当施镀时间为60~90 min时(见图4),曲线出现平台,这可能是经过一段时间浸泡后,微粒在镀液中的湿润性变好,能更好地吸附在电极表面,因而促进了共沉积。电化学测试发现,施镀60~90 min时,复合阳极的析氧电催化效果都比较好,因此本研究中复合电镀时间选择为60 min。
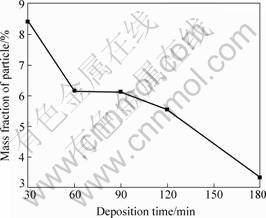
图4 施镀时间对复合镀层中微粒含量的影响
Fig.4 Influence of deposition time on particle contents in deposits

图5 不同施镀时间时复合镀层的表面形貌
Fig.5 Surface morphologies of deposits at different deposition time: (a) 30 min; (b) 90 min; (c) 180 min
2.1.4 正交实验确定最优化条件
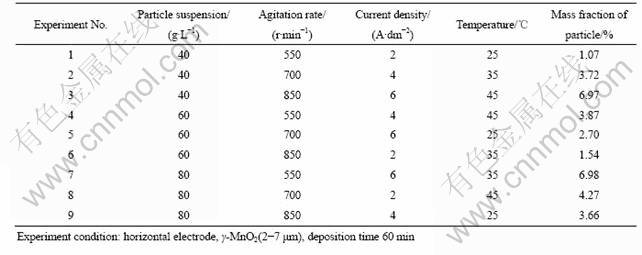
根据以上结论,本实验就复合电镀的其它操作条件(镀液中微粒悬浮量、电流密度、搅拌速率和温度等)对镀层中微粒含量的影响,开展正交实验,以获得复合阳极制备的最优条件。正交实验表及结果如表1所列。
实验研究发现,上述因素对复合镀层中微粒含量均有一定的影响,按影响程度由大到小依次为电流密度、温度、微粒浓度和搅拌速率。随着前三者数值的增大,微粒含量分别有明显的增加,原因分析如下:随着电流密度的增加,电沉积速率增大,微粒包覆作用也随之增强;随着温度的升高,镀液黏度降低,微粒沉降速度也随之增加;微粒含量增加则使更多的微粒接触到电极表面,这些都是对微粒共沉积有利的。相对而言,搅拌速率对镀层中微粒含量的影响较小,这可能是因为在电极表面流体边界层内,重力作用已经可以使足够多的微粒沉降到电极表面发生共沉积。正交实验得出,制备高微粒含量复合镀层的最优条件为:镀液中微粒悬浮量80 g/L,搅拌550~700 r/min(当搅拌速率小于550 r/min时MnO2微粒会堆积在电极表面而得不到镀层),电流密度6 A/dm2,温度45 ℃。
2.1.5 添加剂对镀层中微粒含量的影响
Pb2+电沉积过电位很低,电极反应速度快,在镀液中极易形成粗糙、树枝状或针状的沉积物,必须加入一定添加剂来阻化电沉积过程,以得到平整、致密、分散性好的镀层。此外,在复合电镀中,常向镀液中
表1 复合电镀正交试验设计及相应实验结果
Table 1 Orthogonal experiment design of composite electrodeposition and corresponding results
加入适量的表面活性剂,改变微粒的湿润性和表面荷电状态,使其更好地嵌入镀层中(微粒含量高,分布均匀,与基质结合好)。本文作者就明胶和阳离子表面活性剂A等添加剂对复合镀层中微粒含量及其表面形貌的影响进行了研究。如图6所示,随明胶含量的增加,镀层中微粒含量呈现出先增大后减小的趋势,在0.5g/L时最高;同时,向镀液中添加阳离子表面活性剂A与明胶(0.5 g/L)配合使用,可使镀层中微粒含量进一步增大(表面活性剂A的加入量需小于0.5 g/L,当加入量大于0.5 g/L时,镀层中微粒含量反而减小)。
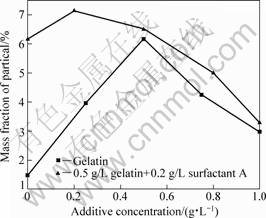
图6 明胶和阳离子表面活性剂A对镀层中微粒含量的 影响
Fig.6 Influence of gelatin and cationic surfactant A on particle content in deposit
明胶是一种由多种氨基酸组成的高分子胶原蛋白,兼有酸性和碱性。一方面,它可以吸附在微粒和电极表面,增强微粒与镀液,电极之间的润湿性,并在电沉积过程中阻化电化学反应,得到结晶细致,分散性好的镀层;另一方面,在酸性介质中,氨基可以吸收质子而形成NH3+—R—COOH,相当于一种阳离子型表面活性剂,吸附在微粒表面使其带正电,促进共沉积。镀液中不含明胶时得到的镀层粗糙,MnO2微粒含量很低,当其含量增至0.5 g/L时,得到的镀层总体比较平整,微粒含量达到最大值;明胶含量继续升高,镀层中微粒含量有所下降,这可能是镀液粘度增大、MnO2传质变差、到达电极表面的微粒量减小所致,如图7(a)、(b)、(c)所示。
明胶与阳离子表面活性剂A配合使用得到的复合镀层更加平整、致密,微粒含量也有所升高。这是因为阳离子表面活性剂在酸性溶液中以带正电的有机分子团存在,它可以吸附在MnO2微粒表面使其带正电,一方面促进微粒的电泳迁移和在电极表面的有效吸附,有利于共沉积;另一方面增加微粒与基质金属的润湿作用,使其结合性变好,如图7(d)所示。
此外,此类有机添加剂均为导电性较差的物质,夹杂在镀层中会明显增加电极电阻,使阳极电位升高。

图7 添加剂对镀层表面形貌的影响
Fig.7 Influence of additives on surface morphologies of deposits: (a) 0 g/L gelatin; (b) 0.5 g/L gelatin; (c) 1.0 g/L gelatin; (d) 0.5 g/L gelatin+0.2 g/L surfactant A
因此,只有控制恰当的加入量,才能获得电催化活性最好的复合电极。
2.2.1 循环伏安特性
图8所示为Pb、Pb-Ag(0.6%)和Pb/Pb-MnO2阳极新鲜电极表面在前述ZnSO4+H2SO4溶液中测得的循环伏安曲线。由图7可见,Pb/Pb-MnO2与Pb、Pb-Ag阳极的电化学行为总体上一致,但差异也较为明显。
由图8可见,正向扫描时,首先,由于Pb基阳极在H2SO4体系中形成了较为致密的PbSO4钝化膜,在0~1.2 V的电压区间内3种阳极的电流密度基本为0。之后,Pb和Pb-Ag阳极首先分别在1.85 V和1.76 V处出现阳极氧化峰(Anodic peak),根据其位置推测[27],该峰对应反应PbO→α-PbO2;其次,3种阳极分别在1.95~2.2 V、1.8~2.2 V和1.8~2.2 V区域出现氧化枝(Anodic branch),这是PbSO4→β-PbO2和H2O→O2两个反应叠加的结果[28],Pb-Ag和Pb/Pb-MnO2阳极对应该峰明显负移,说明在相同电流密度下,它们均能有效降低析氧电位,而以Pb/Pb-MnO2阳极效果最好。此外,Pb/Pb-MnO2复合阳极没有 PbO→α-PbO2氧化峰,可推测Pb和Pb-Ag阳极在极化初期相对倾向于生成α-PbO2,而复合阳极则倾向于生成导电性好的β-PbO2,这是其析氧活性较高的原因之一。负向扫描时,在氧化枝左侧,Pb/Pb-MnO2和Pb-Ag阳极首先分别在1.44 V和1.48 V出现一个氧化峰,其机理是电解液中的SO42-通过电极表面形成的PbO2微孔渗入到Pb基底上发生反应Pb,PbO2→PbSO4[28],而Pb阳极却观测不到此峰,可能的原因如下:纯铅阳极表面反应活性低,电化学反应微弱,基本上观测不到该反应峰;Ag的加入提供了大量的反应活性点,在很大程度上促进了该反应的发生,峰形明显增加;而复合阳极出现该反应峰是因为MnO2的加入使镀层变得粗糙,表面积大大增加,电化学反应量增加。其次,3种阳极在1.35 V左右都可以检测到PbO2→PbSO4的还原峰(Cathodic peak),Pb/Pb-MnO2与Pb阳极的还原峰高相近,而Pb-Ag阳极的还原峰高较大,说明Ag的加入使阳极在氧化区(1.7~2.2 V)生成了较多量的PbO2,这也是其析氧活性较高的原因之一,同时也可以印证Pb/Pb-MnO2较高的析氧活性来源于MnO2的催化作用。还须指出的是,图8中观测不到MnO2的相关反应峰,这说明它在极化过程中自身并不会发生化学变化,只对析氧反应起到催化作用。
2.2.2 恒流极化特性
工业锌电积是在恒定电流下进行的,阳极电位是衡量该过程能耗的一个重要指标。图9所示为Pb、Pb-Ag(0.6%)和最优条件下制得Pb/Pb-MnO2复合阳极24 h恒流极化的阳极电位曲线。由图9可以看出,在电解初始阶段,Pb/Pb-MnO2阳极的析氧电位迅速降低(相比Pb阳极可降低约300 mV),电催化活性明显好于Pb和工业Pb-Ag(0.6%)阳极,这与循环伏安曲线测定的结果一致;但随后电位有一定程度的回升,最后稳定电位低于Pb阳极100 mV,与Pb-Ag(0.6%)阳极相当。
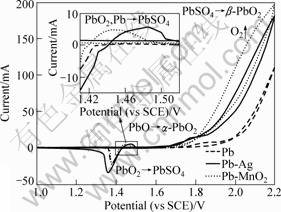
图8 Pb、Pb-Ag及Pb/Pb-MnO2阳极的循环伏安曲线
Fig.8 Cyclic voltammograms of Pb, Pb-Ag and Pb/Pb-MnO2 anodes
对恒流极化初始阶段的阳极电位曲线进行放大,发现Pb/Pb-MnO2阳极的极化曲线有一明显的谷形,这可归因于Pb电极在H2SO4体系中电解时,表面状态发生的变化:即阳极表面会逐渐生成一层疏松,多孔的PbO2膜。一方面,这层氧化膜可能覆盖部分MnO2
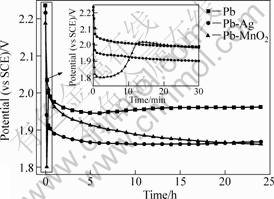
图9 Pb、Pb-Ag和Pb/Pb-MnO2阳极经24 h恒流极化的阳极电位曲线
Fig.9 Galvanostatic polarization curves of Pb, Pb-Ag and Pb/Pb-MnO2 anodes for 24 h
微粒,使其不能与电解液接触而无法参与电化学反应;另一方面,氧化膜的生成使镶嵌在电极表面的MnO2微粒变得松动,很容易脱落进入电解液,而氧气的冲刷作用更加剧了这一过程。所以,由于表面催化性微粒的减少,Pb/Pb-MnO2阳极的催化活性会在一段时间后大大减弱。图10所示为Pb/Pb-MnO2阳极恒流极化12 h前后的表面微观形貌,EDX测试发现其中MnO2含量从初始的6.24%降低到1.02%,可见极化后阳极表面微粒含量大大减小。尽管如此,复合电极在恒流极化24 h后达到的稳定电位极比纯铅电极低约100 mV,这说明Pb在氧化的同时与镀层中残留的MnO2形成了PbO2-MnO2复合层,仍具有较好的析氧电催化效果。

图10 同一电极恒流极化12 h前后的表面形貌
Fig.10 Surface morphologies of same anode before (a) and after (b) galvanostatic polarization for 12 h
3 结论
1) 循环伏安测试结果表明,Pb/Pb-MnO2复合阳极较好的析氧电催化活性可能来源于MnO2微粒的析氧催化作用,复合镀层较大的真实表面积以及复合阳极表面有利于生成析氧活性高的β-PbO2。同时,MnO2的加入并未参与或改变阳极电化学反应和Pb氧化过程,只是使阳极的析氧活性显著提高,起到催化剂的作用。
2) 恒流极化结果表明,复合阳极具有较高的析氧活性,在电解初始阶段其阳极电位相比铅电极降低约300 mV,24 h后,其稳定电位仍比铅阳极低100 mV,与Pb-Ag(0.6%,质量分数)阳极的相当。但是,复合阳极的电催化性能会受到Pb基底表面状态变化的影响,PbO2的生成致使表层MnO2脱落,析氧活性减弱。后续实验可从加强基质Pb与MnO2的结合性入手,尽量减少MnO2脱落量,最终形成稳定且MnO2含量较高的PbO2-MnO2复合层,这样进一步降低复合阳极的稳定阳极电位。
REFERENCES
[1] 彭荣秋. 锌冶金[M]. 长沙: 中南大学出版社, 2005: 103-118.
[2] PENG Rong-qiu. Zinc metallurgy[M]. Changsha: Central South University Press, 2005: 103-118.
[3] 李松瑞. 铅及铅合金[M]. 长沙: 中南工业大学出版社, 1996: 329-330.
[4] LI Song-rui. Lead and lead alloys[M]. Changsha: Central South University of Technology Press, 1996: 329-330.
[5] FELDER A, PRENGAMAN R D. Lead alloys for permanent anodes in the nonferrous metals industry[J]. JOM, 2006, 58(10): 28-31.
[6] MOATS M S.Will lead-based anodes ever be replaced in aqueous electrowinning?[J]. JOM, 2008, 60(10): 46-49.
[7] LI W S, CHEN H Y, LONG X M. Oxygen evolution reaction on lead-bismuth alloys in sulfuric acid solution[J]. Journal of Power Sources, 2006, 158: 902–907.
[8] 衷水平, 赖延清, 蒋良兴, 田忠良, 李 劼, 刘业翔. 锌电积用 Pb-Ag-Ca-Sr 四元合金阳极的阳极极化行为[J]. 中国有色金属学报, 2008, 18(7): 1342–1346.
[9] ZHONG Shui-ping, LAI Yan-qing, JIANG Liang-xing, TIAN Zhong-liang, LI Jie, LIU Ye-xiang. Anodization behavior on Pb-Ag-Ca-Sr alloy during zinc electrowinning[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(7): 1342–1346.
[10] IVANOV I, STEFANOV Y, NONCHEVA Z, PETROVA M. Insoluble anodes used in hydrometallurgy. Part Ⅰ. Corrosion resistance of lead and lead alloy anodes[J]. Hydrometallurgy, 2000, 57: 109-124.
[11] IVANOV I, STEFANOV Y, NONCHEVA Z, PETROVA M. Insoluble anodes used in hydrometallurgy. Part II. Anodic behavior of lead and lead-alloy anodes[J]. Hydrometallurgy, 2000, 57: 125-139.
[12] CATTARIN S, MUSIANI M. Electrosynthesis of nanocomposite materials for electrocatalysis[J]. Electrochimica Acta, 2007, 52: 2796-2805.
[13] MARSHALL A, BORRESEN B, GAGENM G, TSYPKIN M, TUNOLD R. Electrochemical characterisation of IrxSn1-xO2 powders as oxygen evolution electrocatalysts[J]. Electrochimica Acta, 2006, 51: 3161-3167.
[14] JIRKOVSKY J, MAKAROVA M, KRTIL P. Particle size dependence of oxygen evolution reaction on nanocrystalline RuO2 and Ru0.8Co0.2O2-x[J]. Electrochemistry Communications, 2006, 8: 1417-1422.
[15] LI Bao-song, LIN An, GAN Fu-xing. Preparation and electrocatalytic properties of Ti/IrO2-Ta2O5 anodes for oxygen evolution[J]. Transactions of Nonferrous Metals Society of China, 2006, 16: 1193-1199.
[16] YE Z G, MENG H M, SUN D B. Electrochemical impedance spectroscopic (EIS) investigation of the oxygen evolution reaction mechanism of Ti/IrO2+MnO2 electrodes in 0.5 M H2SO4 solution[J]. Journal of Electroanalytical Chemistry, 2008, 621: 49-54.
[17] SHRIVASTAVA P, MOATS M S. Ruthenium palladium oxide-coated titanium anodes for low-current-density oxygen evolution[J]. Journal of the Electrochemical Society, 2008, 155(7): E101-E107.
[18] HRUSSANOVA A, MIRKOVA L, DOBREV T. Anodic behaviour of the Pb-Co3O4 composite coating in copper electrowinning[J]. Hydrometallurgy, 2001(60): 199-213.
[19] DOBREV T, VALCHANOVA I, STEFANOV Y, MAGAEVA S. Investigations of new anodic materials for zinc electrowinning[J]. Transactions of the Institute of Metal Finishing, 2009, 87(3): 136-140.
[20] 常志文, 郭忠诚, 潘君益, 徐瑞东. Al/Pb-WC-ZrO2-Ag和Al/Pb-WC-ZrO2-CeO2复合电极材料的性能研究[J]. 昆明理工大学学报: 理工版, 2007, 32(3): 13-18.
[21] CHANG Zhi-wen, GUO Zhong-cheng, PAN Jun-yi, XU Rui-dong. Property studies on electrodeposited Al/Pb-WC-ZrO2- Ag and Al/Pb-WC-ZrO2-CeO2 composite electrode materials[J]. Journal of Kunming University of Science and Technology: Science and Technology, 2007, 32(3): 13-18.
[22] SCHMACHTEL S, TOIMINEN M. New oxygen evolution anodes for metal electrowinning: MnO2 composite electrodes[J]. J Appl Electrochem, 2009, 39(10): 1835-1848.
[23] 郭鹤桐, 张三元. 复合电镀技术[M]. 北京: 化学工业出版社, 2007.
[24] GUO He-tong, ZHANG San-yuan. Composite plating technology[M]. Beijing: Chemical Industry Press, 2007.
[25] ZAHAVI J, HAZAN J. Electrodeposited nickel composites containing diamond particles[J]. Plating and Surface Finishing, 1983, 70(2): 57-61.
[26] 唐谟堂. 冶金设备基础—传递原理及物料输送[M]. 长沙: 中南大学出版社, 2006: 6-18.
[27] TANG Mo-tang. Metallurgical equipment basic-transfer principle and material transport[M]. Changsha: Central South University Press, 2006: 6-18.
[28] 郭鹤桐, 覃奇贤. 电化学教程[M]. 天津: 天津大学出版社, 2005: 115-148.
[29] GUO He-tong, QIN Qi-xian. Electrochemistry tutorial[M]. Tianjin: Tianjin University Press, 2005: 115-148.
[30] 夏 熙. 二氧化锰及相关锰氧化物的晶体结构、制备及放电性能(1)[J]. 电池, 2004, 34(6): 411-414.
[31] XIA Xi. Crystal structure, preparation and discharge performance for manganese dioxides and related manganese oxides(1)[J]. Battery, 2004, 34(6): 411-414.
[32] FERNANDES J B, DESAI B D, KAMAT V N. Studies on chemically precipitated Mn (Ⅳ) oxides-Ⅲ. Correlation among physical, chemical and electrochemical characteristics of manganese dioxides[J]. Electrochemica Acta, 1984, 29(2): 187-931.
[33] CELIS J P, ROOS J R, BUELENS C. A mathematical model for the electrolytic codeposition of particles with a metallic matrix[J]. J Electrochem Soc, 1987, 1346(6): 1402-1408.
[34] 夏 熙. 二氧化锰的物理、化学性质与其电化学活性的相关(4)[J].电池, 2006, 36(3): 195-198.
[35] XIA Xi. The relation between chemical, physical properties and electrochemical activity for manganese dioxides(4)[J]. Battery, 2006, 36(3): 195-198.
[36] YAMANOTO Y, FUMINO K, UEDA T. A potentiodynamic study of the lead electrode in sulphuric acid solution[J]. Electrochimica Acta, 1992, 37(2): 199-203.
[37] CZEERWINSKI A, ZELAZOWSKA M, GRDEN M. Electrochemical behavior of lead in sulfuric acid solutions[J]. Journal of Power Sources, 2000, 85: 49-55.
(编辑 李艳红)
基金项目:湖南省院士基金资助项目(06FJ4059)
收稿日期:2010-06-18;修订日期:2010-09-13
通信作者:吕晓军,讲师,博士;电话:0731-88830474,E-mail:csulightmetals07@163.com
[1] 彭荣秋. 锌冶金[M]. 长沙: 中南大学出版社, 2005: 103-118.
[2] PENG Rong-qiu. Zinc metallurgy[M]. Changsha: Central South University Press, 2005: 103-118.
[3] 李松瑞. 铅及铅合金[M]. 长沙: 中南工业大学出版社, 1996: 329-330.
[23] 郭鹤桐, 张三元. 复合电镀技术[M]. 北京: 化学工业出版社, 2007.
[26] 唐谟堂. 冶金设备基础—传递原理及物料输送[M]. 长沙: 中南大学出版社, 2006: 6-18.
[28] 郭鹤桐, 覃奇贤. 电化学教程[M]. 天津: 天津大学出版社, 2005: 115-148.
[30] 夏 熙. 二氧化锰及相关锰氧化物的晶体结构、制备及放电性能(1)[J]. 电池, 2004, 34(6): 411-414.
[34] 夏 熙. 二氧化锰的物理、化学性质与其电化学活性的相关(4)[J].电池, 2006, 36(3): 195-198.


