文章编号:1004-0609(2009)12-2230-07
Pannonibacter phragmitetus对Cr(Ⅵ)污染土壤的修复效应
柴立元1, 2 ,许友泽 1, 2,王海鹰1 ,向仁军1, 2,杨志辉1,苏长青1,王 兵1
(1. 中南大学 冶金科学与工程学院,长沙 410083;
2. 中南大学 水污染控制技术湖南省重点实验室,长沙 410004)
摘 要:
在前期从铬渣污染土壤中分离筛选出高效还原Cr(Ⅵ)的土著微生物(Pannonibacter phragmitetus)的基 础上,通过单因素实验对所筛选的土著微生物修复模拟铬污染土壤效应及其影响因素进行研究。结果表明: 土著微生物对土壤中Cr(Ⅵ)的修复受pH值、微生物接种量和初始Cr(Ⅵ)浓度的影响;pH值越高、微生物接种量越大而初始Cr(Ⅵ)浓度越低时,Cr(Ⅵ)的修复速率越快;所筛选的土著微生物在316 h内就能够完全还原污染土壤中浓度为360 mg/kg的Cr(Ⅵ);Cr(Ⅵ)的修复是土著微生物(Pannonibacter phragmitetus)通过酶促反应对Cr(Ⅵ)的直接还原所致。
关键词:
铬(Ⅵ)污染土壤;铬(Ⅵ)污染修复;Pannonibacter phragmitetus;
中图分类号:X131.3 文献标识码: A
Cr(Ⅵ) remediation by Pannonibacter phragmitetus in
contaminated soils
CHAI Li-yuan1, 2, XU You-ze1, 2, WANG Hai-ying1, XIANG Ren-jun1, 2, YANG Zhi-hui1, SU Chang-qing1, WANG Bing1
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;
2. Hunan Key Laboratory of Water Pollution Control Technology, Central South University, Changsha 410004, China)
Abstract: Based on the isolation and screening of chromium-reduction bacterium (Pannonibacter phragmitetus) in the previous research, this strain was used to remediate Cr(Ⅵ) in the contaminated soils. The Cr(Ⅵ) reduction effectiveness by Pannonibacter phragmitetus and its factors were investigated using single factor experiment. The results show that the Cr(Ⅵ) remediation is affected by pH value, inoculation amount of Pannonibacter phragmitetus and initial Cr(Ⅵ) concentration. The remediation rate increases with increasing pH value and inoculation amount of mircrobes, and increases with decreasing initial Cr(Ⅵ) concentration. Pannonibacter phragmitetus can completely reduce 360 mg/kg of Cr(Ⅵ) in the contaminated soil within 316 h. Cr(Ⅵ) remediation in soils is attributed to the direct reduction of Cr(Ⅵ) via enzymatic reaction of Pannonibacter phragmitetus.
Key words: Cr(Ⅵ)-contaminated soil; Cr(Ⅵ) remediation; Pannonibacter phragmitet
在土壤/地下水的重金属污染中,近年来发现Cr(Ⅵ)具有潜在的致癌性和基因的诱变性而变得倍受关注,而且Cr(Ⅵ)占重金属污染的比例与范围都较大。陈传宏和田保国[1]研究报道,在全国范围内,20%以上的受污染土壤/地下水是由含Cr(Ⅵ)废物长期堆 放而防范措施不力造成的。Cr(Ⅵ)具有高迁移性[2],因此,Cr(Ⅵ)的治理至关重要。修复土壤中Cr(Ⅵ)的有效方法是将Cr(Ⅵ)转化为Cr(Ⅲ)[3-5]。早期对含铬废物治理主要有物理法、化学法,但这些方法因化学氧化还原反应的不彻底性,以及投加反应剂量大,使得渣的处理总费用上升,而且在化学修复过程中易产生新的二次污染[6-7]。而微生物修复方法具有高效、成本低的特点,因此,国内外对微生物修复铬污染土壤的研究越来越多。研究发现,埃希氏菌属[8-9]、肠细菌[10] 、杆状菌[11]、Shewanella菌[12]能够把Cr(Ⅵ)转化为Cr(Ⅲ),进而达到修复Cr(Ⅵ)的效果,但这些细菌还原Cr(Ⅵ)的浓度比较低、还原率不高或修复时间较长。本文作者在前期的研究工作中,从铬渣堆场土壤中分离出一种高效还原Cr(Ⅵ)的细菌—Pannonibacter phragmitetus,该细菌能较快还原铬渣堆场污染土壤中的Cr(Ⅵ)。由于细菌是从该污染土壤中分离得到,而铬水溶性渣堆场土壤的pH值高达10以上,土壤中的水溶性Cr(Ⅵ)高达360 mg/kg,因此,菌株 Pannonibacter phragmitetus 已适应于高pH、高Cr(Ⅵ)含量污染土壤中的生长。 但该菌株是否能应用于异地土壤中Cr(Ⅵ)的修复中还未见研究,因此,本文作者利用Pannonibacter phragmitetus修复模拟铬污染土壤,研究该菌株对Cr(Ⅵ)的修复效果及修复机理。
1 实验
1.1 试验材料
1) 模拟Cr(Ⅵ)污染土壤的制备
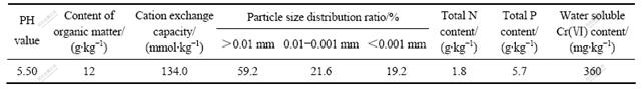
供试土壤采自于湖南省湘乡市岭南村第四纪红土母质发育的旱地土壤,取样地点距中国五矿(湖南)铁合金集团2 km。 土壤取回后经自然风干、粉碎、过孔径1 mm 的筛。过筛后的土壤加入重铬酸钾溶液,使土壤中的Cr(Ⅵ)含量接近中国五矿(湖南)铁合金集团铬渣堆场中Cr(Ⅵ)含量,土壤充分搅匀,风干得到模拟Cr(Ⅵ)污染土壤。所模拟土壤的基本理化性质见表1。
2) 还原Cr(Ⅵ)的土著微生物
在前期的工作中[13],本文作者从中国五矿(湖南)铁合金集团铬渣堆场土壤中分离出一种高效还原Cr(Ⅵ)的细菌,通过采用16S rDNA基因测序和 Genbank数据库中的数据对比,发现该菌和Pannonibacter phragmitetus 有很高的同源性。将分离出的Pannonibacter phragmitetus接种到无菌LB培养基中培养,并应用到模拟土壤中进行Cr(Ⅵ)的修复。
1.2 模拟土壤中Cr(Ⅵ)的微生物修复试验
采用恒温培养实验研究土著微生物对土壤中Cr(Ⅵ)的修复效果:取25 g土样置于100 mL塑料瓶中,按照土液比为1?2分别加入超纯水、培养基、Pannonibacter phragmitetus菌液培养基,调节体系pH值为8.5,将土壤样品置于30 ℃的培养箱中静置培养,每隔6 h取样,在800 r/min的速率下离心分离8 min,测定土壤中水溶性Cr(Ⅵ)的含量。
采用单因素实验,分别研究体系中不同pH值、菌液浓度和Cr(Ⅵ)初始浓度对Cr(Ⅵ)修复的影响:取25g模拟土样,按土液比为1?2(W/V)加入菌液培养基,用NaOH和盐酸调节体系的pH值分别为5.5、6.5、7.5、8.5、9.5、10.5和11.5,土壤样品置于30 ℃的培养箱中培养,定期测定土壤中水溶性Cr(Ⅵ)的浓度,考察不同pH对修复效果的影响。取25 g模拟土样,按土液比为1?2(W/V)加入接种量分别为5%、10%、20%、30%和50%的Pannonibacter phragmitetus菌液培养基,土壤样品置于30 ℃的培养箱中培养,定期测定土壤中的水溶性Cr(Ⅵ)含量。在原始土壤中加入不同Cr(Ⅵ)浓度的重铬酸钾溶液,分成制成含210、360、410、610和1 010 mg/kg的污染土壤,取20 g 上述土壤,按土液比为1?2(W/V)加入菌液培养基,置于30 ℃的培养箱中培养,定期测定土壤中水溶性Cr(Ⅵ)的浓度。以上试验均重复3次。
分别采用高浓度的氨水、蛋白酶K,紫外线照射,以及超声波对细菌细胞悬液进行酶变性处理,测量修复之后土样中Cr(Ⅵ)的含量。以探讨微生物修复Cr(Ⅵ)的机理。分别向体系中加入FeCl3,调节加入的FeCl3含量分别为50、100、200、400和800 mg/L,考察Fe3+ 含量对微生物还原Cr(Ⅵ)的影响。
表1 试验土壤的物理化学性质
Table 1 Physical and chemical characteristic of soils studied
1.3 土壤中水溶性Cr(Ⅵ)的测定
土壤中水溶性Cr(Ⅵ)用二苯碳酰二肼法测定:在不同的培养阶段,土壤样品从培养箱中取出,0.5 mL取0.2 mL上清液,分别加入1?1(体积比)H2SO4、1?1(体积比) H3PO4各0.5 mL,二苯碳酰二肼2 mL,摇匀、静置10 min后在722分光光度计上测定吸光度。
2 结果与讨论
2.1 Pannonibacter phragmitetus 对土壤中Cr(Ⅵ)的修复效果
模拟铬污染土壤与细菌培养基及菌液培养基分别处理后的土壤定期测定Cr(Ⅵ)含量,其结果如图1和表2所示。由图1可知,未加培养基或菌液培养基的土壤,Cr(Ⅵ)含量在整个实验过程中变化很小,维持在355 mg/kg 不变。加入培养基的土样在316 h后,Cr(Ⅵ)浓度由初始浓度355 mg/kg下降到289 mg/kg,表明培养基的加入能降低土壤中的Cr(Ⅵ)浓度。在本实验中,培养基中以乳酸钠作为微生物的电子供体,土壤中存在大量微生物,可能利用乳酸钠电子供体,将土壤中Cr(Ⅵ)还原,从而降低土壤中Cr(Ⅵ)的含量。不过,未被铬污染的土壤,加入Cr(Ⅵ)的时间不长,没有形成大量的铬还原菌,因此,原始土壤中微生物的存在对Cr(Ⅵ)的修复效果很小。另一方面,乳酸钠是一种有机酸,不排除其对Cr(Ⅵ)的还原作用。据 PERLMUTTER等[14]报道,土壤中有机酸对Cr(Ⅵ)具有不同程度的还原作用。然而,将含Pannonibacter phragmitetus 菌液的培养基加入到模拟铬污染的土壤中,Cr(Ⅵ)的含量急剧降低,在316 h内由355 mg/kg左右降低到0.5 mg/kg,达到当地土壤水溶性Cr(Ⅵ)的背景值含量。由此可见,通过Pannonibacter phragmitetus的作用,污染土壤中的有效Cr显著降低,这将大大减缓Cr对周围环境的危害。
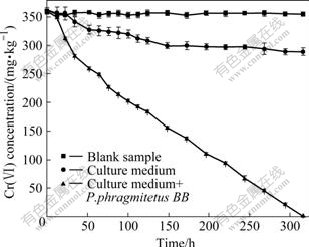
图1 Pannonibacter phragmitetus及培养基对污染土壤中Cr(Ⅵ)浓度的影响
Fig.1 Effect of Pannonibacter phragmitetus and culture medium on Cr(Ⅵ) concentration in contaminated soils
表2 Pannonibacter phragmitetus及培养基对Cr(Ⅵ)的还原速率
Table 2 Removal rate of Cr(Ⅵ) by Pannonibacter phragmitetus and culture medium in contaminated soils (mg?kg-1?d-1)

从表2可以看出,加入培养基后,土样中Cr(Ⅵ)的还原速率仅为5.394 mg/(kg·d);加入Pannonibacter phragmitetus后,明显提高了土壤中Cr(Ⅵ)的还原速率,其数值高达32.24 mg/(kg·d)。
2.2 体系pH值对Cr(Ⅵ)修复的影响
pH值能够影响微生物的生长和Cr(Ⅵ)的还原效 果[2, 15]。图2所示为pH值对污染土壤中Cr(Ⅵ)浓度的影响。由图2可知,微生物修复Cr(Ⅵ)的pH值范围比较宽,随着pH值的升高,Cr(Ⅵ)的还原效果逐渐提高。培养基pH值分别为5.5、6.5和7.5时,污染土壤与菌液培养基共培养316 h后,Cr(Ⅵ)浓度分别为95.78、96.04和14.45 mg/kg。当pH值继续升高,培养316 h后,土壤中Cr(Ⅵ)得以完全还原。不过,pH值分别为8.5、9.5、10.5和11.5时,土壤中Cr(Ⅵ)完全消失所需要的时间分别为316、172、100和64 h。由此可见,pH值越高,Cr(Ⅵ)的还原速度越快,这主要是由于菌株Pannonibacter phragmitetus从碱性铬渣堆场土壤分离得到,对高pH值环境具有良好的适应性,所以pH值的升高有助于提高细菌的活性,增加细菌的繁殖,从而提高Cr(Ⅵ)的还原效果。
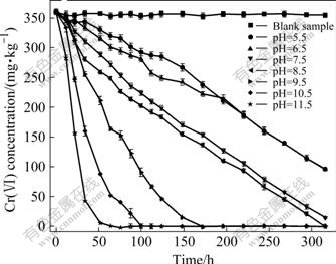
图2 pH值对污染土壤中Cr(Ⅵ)浓度的影响
Fig.2 Effect of pH value on Cr(Ⅵ) concentration in contaminated soils
从Cr(Ⅵ)的还原速度来看,随着pH值的升高,Cr(Ⅵ)的还原速率加快(见图3)。由图3可看出,当pH值为5.5时,Cr(Ⅵ)的还原速率为20.07 mg/(kg·d);当pH为11.5时,Cr(Ⅵ)的还原速率增加至134.7 mg/(kg·d)。
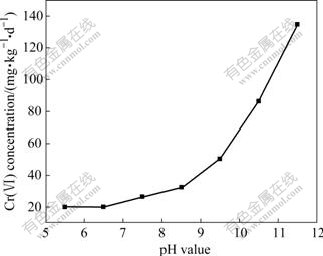
图3 pH值对Cr(Ⅵ) 还原速率的影响
Fig.3 Effect of pH value on Cr(Ⅵ) reduction rate
2.3 微生物接种量对Cr(Ⅵ)修复的影响
菌液占整个液体培养基的百分比称为细菌的接种量。在实验中,模拟污染土壤中Cr(Ⅵ)的含量为355 mg/kg,未接种Pannonibacter phragmitetus时,土壤中Cr(Ⅵ)含量基本维持不变(见图4),这表明土壤中未存在其他Cr(Ⅵ)还原菌。一旦接种Pannonibacter phragmitetus,土壤中的Cr(Ⅵ)随培养时间的延长而 迅速减少。随Pannonibacter phragmitetus接种量的增加,Cr(Ⅵ)还原所需要的时间越短。例如,接种量为5%、10%、20%、30%和50%时,土壤中Cr(Ⅵ)彻底还原所需的时间分别为316、220、172、100和12 h。这一结果与铬渣中Cr(Ⅵ)的微生物还原效应较为一 致[16]。
根据不同培养阶段土壤中Cr(Ⅵ)的含量变化,计算出Cr(Ⅵ)的还原速率,其结果如图5所示。由图5可看出,当接种量为5%时,Cr(Ⅵ)的还原速率为32.24 mg/(kg·d);当接种量为10%、20%和30%时,Cr(Ⅵ)的还原速率分别为39.24、50.20和98.11 mg/(kg·d);当接种量为50%时,土壤中Cr(Ⅵ)的还原速率最大,可达718.9 mg/(kg·d)。由此可见,接种量越大,Cr(Ⅵ)还原速率越快。
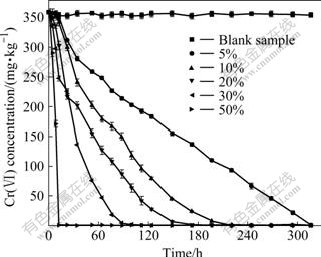
图4 Pannonibacter phragmitetus接种量对污染土壤中Cr(Ⅵ)浓度的影响
Fig.4 Effect of inoculation amount of Pannonibacter phragmitetus on Cr(Ⅵ) concentration in contaminated soils
2.4 初始Cr(Ⅵ)浓度对Cr(Ⅵ)还原的影响
微生物对污染土壤中Cr(Ⅵ)的还原受初始浓度影响[15]。图6所示为不同初始Cr(Ⅵ)浓度对Cr(Ⅵ)还原的影响。由图6可知,当初始Cr(Ⅵ)浓度为1010 mg/kg,微生物的接种量为5%时,经过316 h的细菌还原作用,Cr(Ⅵ)浓度仍然维持在614.5 mg/kg;初始Cr(Ⅵ)浓度为610和410 mg/kg时,316 h后Cr(Ⅵ)浓度分别为227.7和16.59 mg/kg;初始Cr(Ⅵ)浓度为360 mg/kg,土壤中的Cr(Ⅵ)在316 h内被完全还原;当初始浓度降低至210 mg/kg时,土壤中的Cr(Ⅵ)在112 h内被完全还原。可见,土壤中初始Cr(Ⅵ)浓度越高,Cr(Ⅵ)还原所需要时间越长。
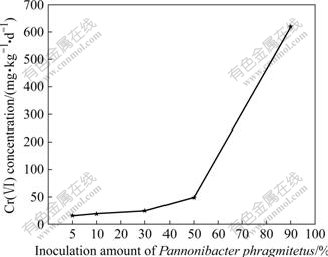
图5 Pannonibacter phragmitetus接种量对Cr(Ⅵ) 还原速率的影响
Fig.5 Effect of inoculation amount of Pannonibacter phragmitetus on Cr(Ⅵ) reduction rate
图7所示为不同初始Cr(Ⅵ)浓度对Cr(Ⅵ)还原速率的影响。由图7可知,初始Cr(Ⅵ)浓度增加,Cr(Ⅵ) 的还原速率降低。这是由于细菌的生长和繁殖受 Cr(Ⅵ)的抑制,Cr(Ⅵ)浓度越高,抑制性就越强。初始Cr(Ⅵ)浓度为210 mg/kg时,Cr(Ⅵ)的还原速率为45 mg/(kg·d);初始浓度为360 mg/kg时,Cr(Ⅵ)还原速率为32.24 mg/(kg·d);当初始Cr(Ⅵ)浓度为410~1 010 mg/kg时,Cr(Ⅵ)还原速率基本维持在30 mg/(kg·d)。
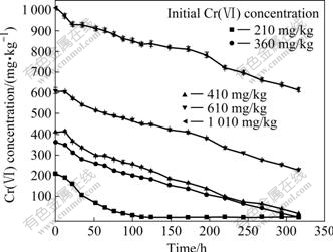
图6 不同初始Cr(Ⅵ)浓度对Cr(Ⅵ)还原的影响
Fig.6 Effect of initial Cr(Ⅵ) concentration on Cr(Ⅵ) reduction
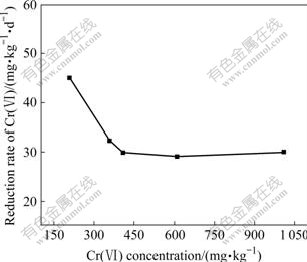
图7 不同初始Cr(Ⅵ)浓度对Cr(Ⅵ) 还原速率的影响
Fig.7 Effect of initial Cr(Ⅵ) concentration on reduction rate of Cr(Ⅵ)
2.5 酶变处理对Cr(Ⅵ)修复的影响
Pannonibacter phragmitetus菌是一种化能异养菌,在生长代谢以及Cr(VI)的还原过程中需要消耗有机物质作为营养源,这和脱硫弧菌、氧化亚铁硫杆菌等间接还原作用的化能自养菌明显不同。在细菌的培养过程中,细菌生长过程中没有 S和H2S等还原性物质的产生。因此,Pannonibacter phragmitetus的铬还原不是间接还原。用各种酶变性手段分别对细菌细胞悬液进行预处理,包括高浓度的氨水、蛋白酶K、紫外线照射以及超声波处理等,然后在最适条件下对Cr(Ⅵ)进行还原。图8所示为酶变处理对Cr(Ⅵ)还原的影响。由图8可知,经过酶变处理之后的细胞悬液还原结束之后,Cr(Ⅵ)的浓度都在360 mg/kg左右不变,而对照组Cr(VI)的浓度在检出限以下通过酶变性处理的细胞悬液与未经处理的对照样相比,Pannonibacter phragmitetus菌基本上没有还原Cr(Ⅵ)的能力,说明该菌的Cr(Ⅵ)还原是由一种铬还原酶所催化的直接还原反应。
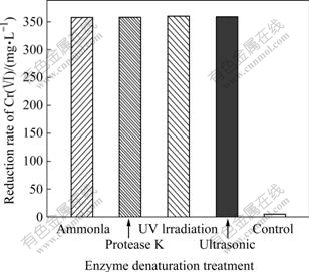
图8 酶变处理对Cr(Ⅵ)还原的影响
Fig.8 Effect of enzyme denaturation treatments on reduction rate of Cr(VI)
2.6 Pannonibacter phragmitetus菌修复土壤中Cr(Ⅵ)的机理探讨
金属离子影响Cr(Ⅵ)生物还原的研究由来已久,在铬还原菌Cellulomonas flavigena 的研究中发现,Fe3+(FeCl3)的加入可以将Cr(Ⅵ)还原率从 56.9% 提高到90%,并且铁离子的浓度变化可以影响Cr(Ⅵ)的还原率。研究还发现不同形态的铁离子对还原的影响不同,纤铁矿可以将还原率提高到80%,而赤铁矿则没有明显的促进作用[17],Fe3+能够促进还原的主要原因是有些微生物能够还原土壤中的Fe3+,而生成Fe2+又能够还原Cr(Ⅵ)。图9所示为FeCl3对Cr(Ⅵ)还原速率的影响。由图9可知,随着体系中FeCl3的量从50 mg/L增加到800 mg/L,Pannonibacter phragmitetus对土壤中Cr(Ⅵ)的修复速率并没有增加,基本保持在50 mg/(kg·d)左右。同时还发现当FeCl3量增加至800 mg/L时,修复速率反而下降到41.2 mg/(kg·d),这主要是FeCl3量增大到一定程度能够抑制微生物的生长,从而降低修复速率。由以上分析可知,Pannonibacter phragmitetus不是以间接还原的方式修复土壤中的Cr(Ⅵ),而是通过直接还原的方式修复土壤中的Cr(Ⅵ)。
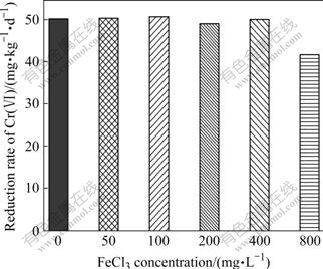
图9 FeCl3对Cr(Ⅵ)还原速率的影响
Fig.9 Effect of FeCl3 on reduction rate of Cr(VI)
3 结论
1) 铬渣堆场污染土壤中分离筛选出的铬还原细菌Pannonibacter phragmitetus对Cr(Ⅵ)具有很好的还原效果,在316 h内,将土壤中Cr(Ⅵ)含量由360 mg/kg降低到0.5 mg/kg,达到当地土壤Cr(Ⅵ)的背景值含量范围。
2) 污染土壤中Cr(Ⅵ)的微生物还原效果受pH值、细菌接种量及Cr(Ⅵ)初始浓度的影响。pH值越高,Cr(Ⅵ)的还原效果越好;Pannonibacter phragmitetus的接种量越大,Cr(Ⅵ)的还原效果越好;Cr(Ⅵ)的初始浓度越小,还原效果越好,且彻底消除Cr(Ⅵ)所需的时间越短。
3) Pannonibacter phragmitetus对Cr(Ⅵ)的还原机理是由一种Cr(Ⅵ)还原酶所催化的直接还原作用。
REFERENCES
[1] 陈传宏, 田保国. 21世纪初期中国环境保护与生态建设科技发展战略研究[M]. 北京: 中国环境科学出版社, 2001: 86-89.
CHEN Chuan-hong, TIAN Bao-guo. Technology development strategy of the early 21st century for environmental protection and ecological construction[M]. Beijing: China Environment Science Press, 2001: 86-89.
[2] JEYASINGH J, PHILIP L. Bioremediation of chromium contaminated soil: optimization of operating parameters under laboratory conditions[J]. Journal of Hazardous Materials, 2005, B118(1/3): 113-120.
[3] 王新新, 张 颖, 李 慧, 王元芬, 徐 慧, 姜世英. 零价铁对铬污染底泥的修复及其对微生物群落结构的影响[J]. 环境科学学报, 2009, 29(2): 297-304.
WANG Xin-xin, ZHANG Ying, LI Hui, WANG Yuan-fen, XU Hui, JIANG Shi-ying. Remediation of chromium-contaminated sediments by zero-valent iron and its effects on microbial community structure[J]. Acta Scientiae Circumstantiae, 2009, 29(2): 297-304.
[4] 孟庆恒, 刘文静, 赵东风. 土著微生物-玉米对Cr污染的联 合修复初步研究[J]. 农业环境科学学报, 2007, 26(5): 1870-1873.
MENG Qing-heng, LIU Wen-jing, ZHAO Dong-feng. Preliminary study on union remediation of chromium by endemic microbe and maize[J]. Journal of Agro-Environment Science, 2007, 26(5): 1870-1873.
[5] SHAILI S, INDU S T. Evaluation of bioremediation and detoxification potentiality of Aspergillus niger for removal of hexavalent chromium in soil microcosm[J]. Soil Biology & Biochemistry, 2006, 38(7): 1904-1911.
[6] 常文越, 陈晓东, 王 磊. 土著微生物修复铬(Ⅵ)污染土壤的条件实验研究[J].环境保护科学, 2007, 33(1): 42-44.
CHANG Wen-yue, CHENG Xiao-dong, WANG Lei. Experimental study on conditions of chromium(Ⅵ)- contaminated soil remediation by aboriginal microbe[J]. Environmental Protection Science, 2007, 33(1): 42-44.
[7] 孟庆恒, 傅 珊, 张海江, 彭 博. 微生物在铬污染土壤中的分布及铬累积菌株的初步筛选[J]. 农业环境科学学报, 2007, 26(2): 472-475.
MENG Qing-heng, FU Shan, ZHANG Hai-jiang, PENG Bo. Preliminary assaying on distribution of microbes in Cr polluted soil and selection of Cr accumulative strains[J]. Journal of Agro-Environment Science, 2007, 26(2): 472-475.
[8] SHEN H, WANG Y T. Characterization of enzymatic reduction of hexavalent chromium by Escherichia coli ATCC 33456[J]. Applied and Environmental Microbiology, 1993, 59(11): 3771-3776.
[9] ACKERLEY D F, GONZALEZ C F, KEYHAN M, BLAKE R, MATIN A. Mechanism of chromate reduction by the Escherichia coli protein, NfsA, and the role of different chromate reductases in minimizing oxidative stress during chromate reduction[J]. Environ Microbiol, 2004, 6(8): 851-858.
[10] OHTAKE H, FUJII E, TODA K. Reduction of toxic chromate in an industrial effluent by use of a chromate reducing strain of Enterobacter cloacae[J]. Environment Science Technology, 1990, 11(7): 663-668.
[11] PHILIP L, IYENGAR L, VENKOBACHAR C. Cr(Ⅵ) reduction by Bacillus coagulans isolated from contaminated soils[J]. Journal of Environment Engineering, 1998, 124(12): 1165-1170.
[12] GUHA H, JAYACHANDRAN K, MAURRASSE F. Kinetics of chromium (Ⅵ) reduction by a type strain Shewanella alga under different growth conditions[J]. Environmental Pollution, 2001, 115(2): 209-218.
[13] CHAI L Y, HUANG S H, YANG Z H, PENG B, HUANG Y, CHEN Y H. Hexavalent chromium reduction by Pannonibacter phragmitetus BB isolated from soils under chromium-containing slag heap[J]. Journal of Environmental Science and Health Part A, 2009, 44(6): 615-622.
[14] PERLMUTTER M W, BRITTO R, COWAN J D, JACOBS A K. In situ biotreatment of perchlorate and chromium in groundwater [C]// MAGAR V S. Proceedings of the 6th International In Situ and On-Site Bioremediation Symposium, San Diego, California, 2001, 6(9): 315-322.
[15] LIU Yun-guo, XU Wei-hua, ZENG Guang-ming, LI Xin, GAO Hui. Cr(VI) reduction by Bacillus sp. isolated from chromium landfill[J]. Process Biochemistry, 2006, 41(9): 1981-1986.
[16] 朱文杰, 龙怀中, 杨志辉, 柴立元. Leucobacter对Cr(Ⅵ)的还原及其产物成分分析[J]. 中南大学学报: 自然科学版, 2008, 39(3): 443-447.
ZHU Wen-jie, LONG Huai-zhong, YANG Zhi-hui, CHAI Li-yuan. Bio-reduction of Cr(Ⅵ) by Leucobacter and element analysis of reduction products[J]. Journal of Central South University: Science and Technology, 2008, 39(3): 443-447.
[17] XU W, LIU Y, ZENG G, LI X, TANG C, YUAN X. Enhancing effect of iron on chromate reduction by Cellulomonas flavigena [J]. Journal of Hazardous Materials B, 2005, 126(1/3): 17-22.
基金项目:国家高技术研究发展计划资助项目(2006AA06Z374; 2007AA021304);湖南省科技重大专项资助项目(2009FJ1009-2)
收稿日期:2008-11-25;修订日期:2009-07-03
通信作者:王海鹰,讲师,博士;电话:0731-88830875;E-mail: haiyw25@163.com
摘 要:在前期从铬渣污染土壤中分离筛选出高效还原Cr(Ⅵ)的土著微生物(Pannonibacter phragmitetus)的基 础上,通过单因素实验对所筛选的土著微生物修复模拟铬污染土壤效应及其影响因素进行研究。结果表明: 土著微生物对土壤中Cr(Ⅵ)的修复受pH值、微生物接种量和初始Cr(Ⅵ)浓度的影响;pH值越高、微生物接种量越大而初始Cr(Ⅵ)浓度越低时,Cr(Ⅵ)的修复速率越快;所筛选的土著微生物在316 h内就能够完全还原污染土壤中浓度为360 mg/kg的Cr(Ⅵ);Cr(Ⅵ)的修复是土著微生物(Pannonibacter phragmitetus)通过酶促反应对Cr(Ⅵ)的直接还原所致。


